대부분의 경골어류는 어체 내부와 외부 환경 사이의 삼투압 차이가 있거나 동일한 환경에서 서식하는데, 이들은 효과적인 삼투압조절(해산어: 저삼투압조절, 담수어: 고삼투압조절)을 함으로써 이온의 항상성 유지 및 생존이 가능하다(McCormick et al., 1989). 아가미는 이러한 삼투압조절을 담당하는 가장 중요한 외부 기관으로 해수 및 담수에서 아가미의 염류세포는 염분을 각각 배출 및 흡수하는 기능을 한다(Payan et al., 1984). 이 세포는 주로 2차새변의 기저에 위치하고 있으며, 특히 미토콘드리아와 Na+/K+-ATPase (NKA)가 풍부한데, 이것은 능동적 이온 수송과 관련이 있다(Hirose et al., 2003). 경골어류에서 삼투압조절과 관련하여 해수에서 NKA는 Na+를 염류세포 밖(혈액)으로 배출시키며, 배출된 Na+는 염류세포와 인접한 부세포(accessory cell) 사이에 밀착연접을 통해 해수로 나간다. 담수에서 NKA는 염류세포 선단에 위치한 Na+/H+-교환체 또는 Na+채널을 통해 담수의 Na+를 염류세포로 흡수하는데 에너지를 공급하며, 또한 흡수된 Na+를 혈액으로 보낸다(McCormick, 2001; Hirose et al., 2003). 따라서 경골어류는 외부 염분변화에 적응하기 위해서는 아가미 NKA 활성의 변조는 반드시 필요하다(Marshall, 2002). 광염성 경골어류의 아가미 NKA 활성은 외부 염분농도와 관련이 있는데, 연어과 어류의 경우 NKA 활성은 염분농도와 정상관계로 나타나지만(McCormick, 1995), 숭어류, 농어류, 망둥어류 등의 다른 어류에서는 이 두 요인의 관계가 U 형태의 관계(염분농도가 높거나 낮을 때 NKA가 증가하며, 이 중간의 염분농도에서 NKA가 감소)보고되고 있다(Jensen et al., 1998; Laiz-Carrión et al., 2005; Sangiao-Alvarellos et al., 2005). 또한, 어체가 다른 염분농도로 노출되었을 때, 시간에 따른 아가미 NKA의 변화는 종에 따라 다르게 나타나고 있는데, 일반적으로 광염성 어종은 다른 염분으로의 이동후 주로 2-3일 이내에 아가미 NKA 활성의 변화가 나타나는 (Laiz-Carrión et al., 2005; Sangiao-Alvarellos et al., 2005) 반면 소하성 어류의 경우에는 3-7일 후에 활성의 변화가 나타난다고 알려져 있다(McCormick and Naiman, 1985; Madsen and Naamansen, 1989; Berge et al., 1995).
감성돔(
국립수산과학원(부산시 기장군)에서 자연해수(33 psu)로 500 L FRP 원형수조에서 사육중인 감성돔(평균 전장: 17.6±1.4 cm, 체중: 92.7±21.4 g) 64마리를 실험어로 사용하였다. 실험어의 저염분 노출은 해수 사육수조(대조구)에서 동일한 크기의 5 psu 수조(실험구)로 즉시 옮겨 48시간 동안 수용하였다. 실험구의 염분은 해수와 담수를 조절하여 유수식으로 유지하였으며, 수온은 15±0.4℃였다. 실험어는 실험 24시간전부터 종료시까지 절식하였다. 실험기간 동안 모든 실험어는 생존하였다.
저염분 노출에 따른 혈액 및 조직 샘플링은 해수(33 psu) 및 5 psu-3, 6, 12, 24, 48시간째에 각각 8마리를 무작위로 잡아 실시하였다. 해수 또는 5 psu가 수용된 40 L 플라스틱 수조에 각각 tricaine methan sulphonate (MS-222, Sigma, USA)를 150 ppm의 농도가 되도록 첨가한 다음 실험어를 옮겨 마취하였다. heparin sodium 처리된 주사기(3 mL)로 실험어의 미부혈관으로부터 혈액을 채취한 후, 혈장을 분리(4℃, 7,000 rpm, 15분)하여 이온 및 삼투질농도 분석전까지 -80℃에 보관하였다. 아가미 NKA 활성 및 발현을 조사하기 위하여 실험어 아가미의 새변(왼쪽, 2번째)을 절취하여 액체질소에서 급속 냉동시킨 다음 -80℃에 보관하였다. 또한 아가미 조직내 NKA 위치 및 발현 정도를 관찰하기 위하여 새변의 일부를 10% 중성포르말린에 고정하였다.
아가미 NKA 활성은 Hwang et al. (1989)의 방법을 변형하여 측정하였으며, 간략히 설명하자면 다음과 같다: 냉동된 새변 절편(약 20-25 mg)을 SEI 용액(200 mM Sucrose, 5 mM Na2EDTA, 100 mM Imidazole-Hcl buffer, pH 7.6)으로 녹여 washing한 후, SEID 용액(SEI+0.1% sodium deoxycholate) 1 mL에 조직을 넣어 homogenizer (Pro 200, Pro Scientific Co., USA)로 균질화하였다. 원심분리(4℃, 6,000 rpm, 5분)하여 얻은 상층액의 10 μL를 각각 Reaction mixture A (125 mM NaCl, 75 mM KCl, 7.5 mM MgCl2, 5 mM Na2ATP, 100 mM Imidazole-Hcl buffer, pH 7.6)와 Reaction mixture B (mixture A+10 mM ouabain)의 200 μL 와 혼합하여 37℃에서 30분간 반응시킨 후, 30% trichloroacetic acid 50 μL를 넣어 반응을 중지시켰다. NKA 측정을 위한 모든 시약은 Sigma (USA) 제품을 사용하였다. Ouabain 유무에 따른 무기인 함량은 Phosphate Colorimetric Assay Kit (BioVision, USA)를 사용하여 650 nm에서 측정하였으며, 조직내 단백질 함량은 Pierce BCA Protein kit (Thermo, USA)로 측정하였다. 최종 NKA 활성은 μmol Pi−1 mg protein−1 h−1로 나타내었다.
10% 포르말린에 고정된 아가미 조직을 파라핀으로 포매하여 5 μm 두께로 절편한 후, 탈 파라핀하여 다음과 같이 염색하였다: 조직을 Blocking solution (DIG Wash and Block Buffer Set, Roche, Germany)으로 4℃에서 1시간 동안 Blocking 한 다음 1차 항체로 mouse anti-Na+/K+-ATPase α-subunit (α5) (Hybridoma Bank, USA)를 Washing buffer (DIG Wash and Block Buffer Set, Roche, Germany)와 1:100로 희석하여 반응시켰다(4℃, overnight). 실험에 사용된 항체 α5는 조류, 포유류, 개구리, 양서류 및 어류의 항원과 특이적으로 결합하며, 어류의 경우 연어류에서 이미 검증된 바 있다(Tipsmark et al., 2002).
다음날 Washing buffer로 1차 항체를 제거한 다음, 2차 항체인 anti-mouse IgG (Alexa Fluor 488, Cell Signaling, USA)를 1:200로 희석하여 반응(실온, 1시간)시킨 후, washing 하였다. 봉인한 후, 형광현미경(Axio Scope A1, CarlZeiss, Germany)으로 관찰하였다. 또한, NKA의 조직발현 정도는 화상분석시스템(i series, InnerView, Korea)을 이용하여 관찰한 아가미 면적에 대한 염색된 염류세포의 면적을 %로 나타내었다. 이에 관찰된 아가미 조직상은 9-12개의 전체 조직표본 슬라이드에서 현미경 관찰시 염류세포의 수가 많으며, 그 크기가 가장 큰 것으로 보이는 1개의 슬라이드를 선택하였으며, 이 슬라이드에서 10개의 새변에 포함된 염류세포를 관찰하였다.
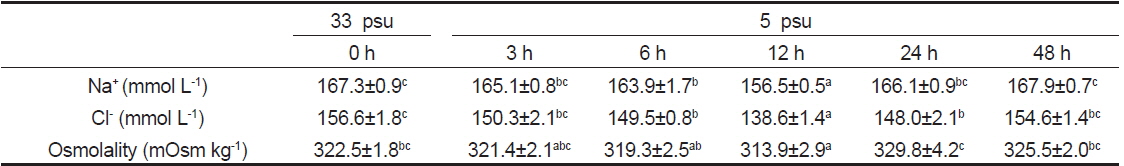
혈장의 Na+, Cl− 농도는 생화학자동분석기(Dry-chem 4000i, Fujifilm, Japan)로, 삼투질농도는 삼투압측정기(Vapro 5520, WESCOR, USA)로 측정하였다.
실험결과의 자료값은 평균±표준오차로 나타내었으며, SPSS 통계프로그램(ver. 17.0)을 사용하여 one way-ANOVA 및 Duncan's multiple range test로 유의성을 검정하였다(
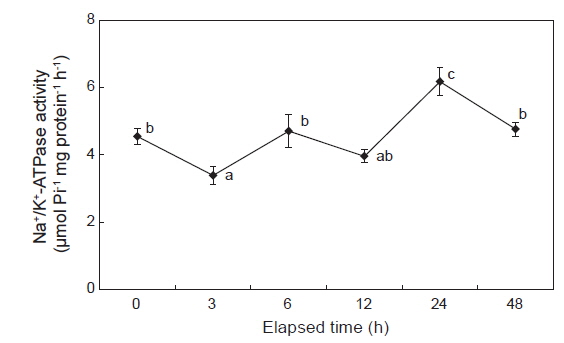
감성돔을 해수에서 5 psu로 옮겼을 때, 3시간째 아가미의 NKA 활성은 해수에서 보다 유의하게 감소하였다가, 6시간째에는 개시시(해수) 수준으로 나타났다. 12시간째에는 개시시와 유의한 차이는 없었지만 다소 감소하는 경향을 보였다. 5 psu 노출 24시간째에 아가미의 NKA 활성은 개시시보다 1.4배정도 높았다. 그러나 48시간째에는 다시 개시시 수준으로 감소하였다(Fig. 1).
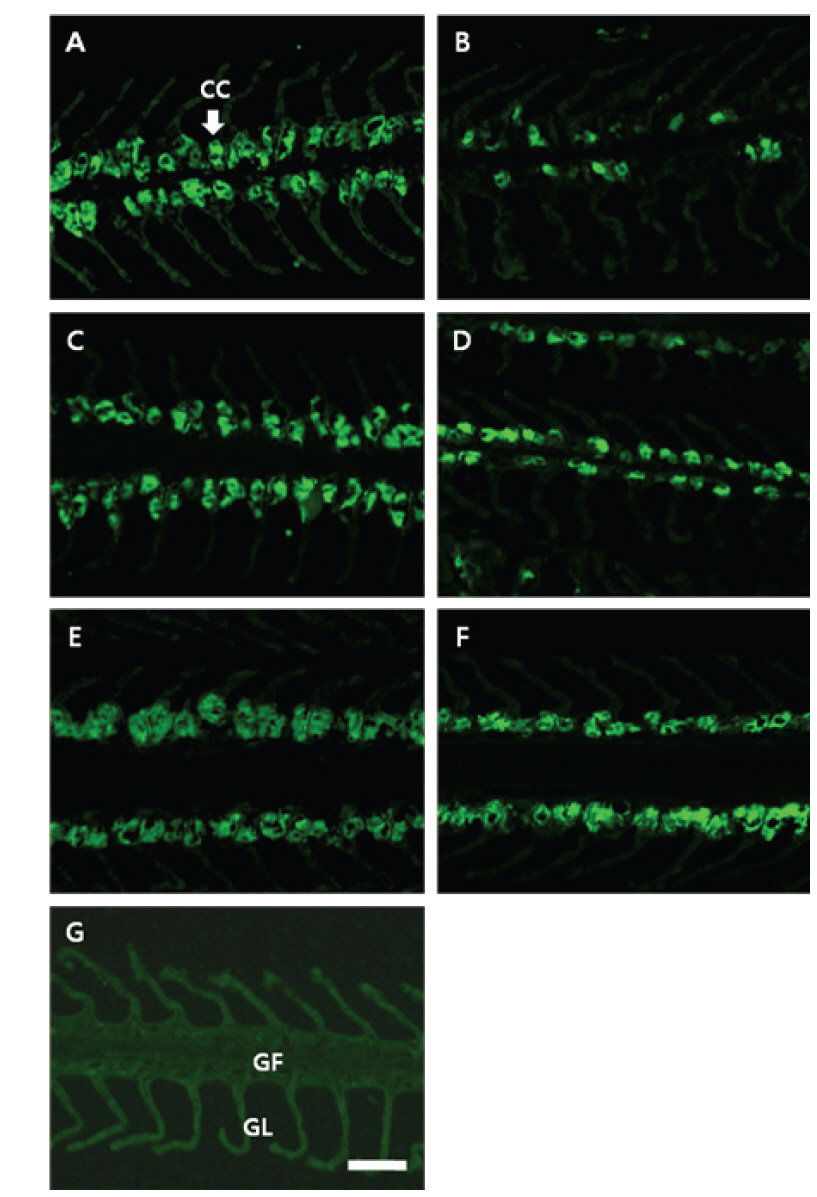
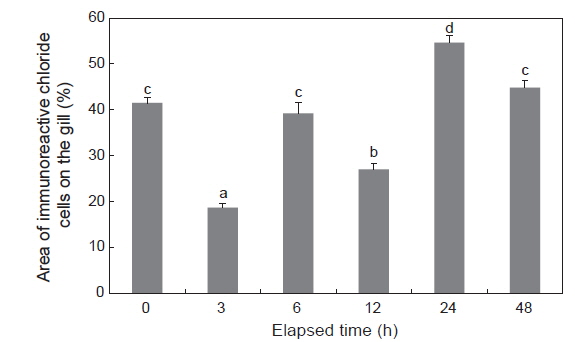
NKA 면역조직화학적 염색에 따른 감성돔 아가미 염류세포의 변화는 결과는 Fig. 2 및 Table 1에 나타내었다. 1차 항체(α5) 및 2차 항체(anti-mouse IgG)에 반응한 NKA는 뚜렷한 밝은 푸른색으로 나타났다(Fig. 2A-2F). 이러한 반응색이 α5의 항원 결합 때문임을 검증하기 위하여 Negative control을 두어α5 없이 anti-mouse IgG만을 반응시켰으며, 이때에는 아가미 전체에 걸쳐 매우 연한 푸른색이 관찰되었다(Fig. 2G). 5 psu에서 3시간째 염류세포의 수는 해수에서 보다 유의하게 감소하는 것으로 확인되었으며, 6시간째 다시 해수 수준으로 회복하였다. 12시간째 염류세포 수는 다시 감소하였으나, 24시간째부터 증가한 후 48시간째 해수 수준으로 감소하였다.
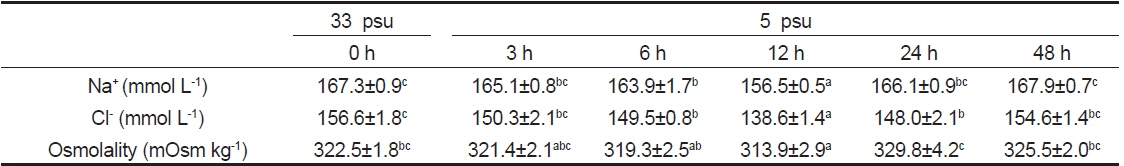
Time course of changes in plasma Na+, Cl? and osmolality of black sea bream Acanthopagrus schlegelii after transfer from 33 to 5 psu
5 psu 노출 3시간째까지 감성돔의 혈장 Na+는 해수와 차이가 없었으나 6시간째부터 감소하기 시작하여 12시간째에 최저 농도를 나타내었으나 24시간째부터는 해수수준으로 회복하였다. 혈장 Cl− 또한 Na+와 마찬가지로 저염분 노출 6시간째부터 감소하여 12시간째에 최저 농도를 나타내었으며, 24시간째부터 증가하기 시작하여 48시간째에는 해수수준과 차이가 없었다. 저염분 노출에 따른 삼투질농도는 12시간째 유의하게 감소하였으나 이후로는 해수수준과 차이를 보이지 않았다(Table 1).
광염성 어류는 다양한 염분농도에 적응하기 위하여 어체의 삼투압조절 시스템을 활성화하는데, 본 연구에서는 감성돔 저염분 노출에 따른 고삼투압조절 작용 메커니즘을 이해하기 위하여 시간경과에 따른 아가미 Na+/K+-ATPase 활성 및 발현과, 혈장 이온 및 삼투질농도를 조사하였다.
Na+ pump로도 불리는 Na+/K+-ATPase (NKA)는 2개의 α-subunit과 이에 수반하는 2개의 β-subunit으로 구성 되어져있다. α-subunit은 효소적 기능을 위한 촉매역할을 담당하는 것으로 밝혀져 있으며(Lingrel and Kuntzweiler, 1994), 이에 반에 β-subunit은 아직 그 역할이 잘 알려져 있지는 않지만 NKA의 안정성 유지와 막 방향(membrane orientation)을 바로 잡는데 필요한 요소이다(Noguchi et al., 1990). 따라서 본 연구에서는 효소의 기능을 하는 NKA의 α-subunit의 발현만을 조사하였다. 일반적으로 경골어류의 삼투압과 관련하여 NKA는 ATP 가 수분해로 3 Na+ 및 2 K+ 를 각각 염류세포 외부와 내부로 펌핑하며, 이로 인해 이온 농도의 전기화학적 경사가 형성되어 이온수송의 에너지원을 제공한다(Hirose et al., 2003). 아가미 NKA는 어체보다 고농도의 환경에서는 Na+와 Cl−를 배출하며, 저농도의 환경에서는 Na+를 흡수하는데 에너지를 공급한다(Marshall, 2002; Evans et al., 2005). 따라서 NKA의 활성은 염류 세포의 이온수송 능력을 나타내는 좋은 지표로 이용할 수 있다. 이전의 다른 연구에서는 감성돔을 대상으로 염분 변화에 따른 NKA 활성의 결과들이 서로 비슷하게 보고되고 있다. Choi and An (2008)은 해수 사육한 감성돔을 단계적으로 염분을 낮추어 96시간 만에 담수로 옮겼을 때, 아가미 NKA mRNA 발현이 4배정도 증가하였다고 하였으며, 또한 Tomy et al. (2009)은 감성돔을 다양한 염분농도(0-45 psu)에서 72시간째 노출하였을 때 5 psu 이하에서는 아가미 NKA 활성이 유의하게 증가한다고 보고하였다. 그러나 이들 결과는 저염분 노출이 시간이 3일 이후에 대한 것으로, 그 이전 시간에서는 감성돔의 아가미 NKA 활성 변화가 아직 밝혀져 있지 않았으나, 본 연구에서 3-48시간까지 조사한 결과, 5 psu 노출 3시간째에 효소 활성이 유의하게 감소하는 것으로 나타났다. 6시간째에는 변화가 없었으며, 24시간째에 증가하였다 48시간째에 다시 해수수준으로 감소하는 것으로 관찰되었으며, 이와 더불어 염류세포내 NKA 발현도 효소 활성과 비슷한 패턴을 보였다. 이러한 결과를 통해 감성돔의 저염분 노출에 따른 삼투압조절은 다음과 같이 해석해 볼 수 있다. 5 psu의 3시간째에는 아직 염류세포가 고삼투압조절시스템으로 전환되지 않아 아가미 NKA 활성을 감소시켜 체내의 이온 방출을 차단한 것으로 보이며, 6시간째에는 저삼투압조절에서 고삼투압조절시템으로 전환되어 외부로부터 이온을 흡수하기 위하여 NKA가 다시 활성화 된 것으로 여겨진다. 이때까지 Na+ 및 Cl−은 경미하게 감소하였으나, 삼투질농도는 해수수준과 차이를 보이지 않아 정상적인 삼투압조절이 이루어지고 있음을 알 수 있다. 5 psu의 12시간째에 NKA활성이 해수수준과 유의한 차이는 없었지만 다소 감소하였으며, 또한 조직학적 발현에서도 감소하는 것으로 나타났는데, 이로 인하여 이온 및 삼투질 농도가 감소한 것으로 판단된다. 감성돔은 이온 및 삼투질농도에 대한 항상성 유지를 위해 24시간째부터는 아가미 NKA 활성을 증가시켜 감소한 이온 및 삼투질농도를 해수수준으로 회복시키는 것으로 확인되었다.
Kelly et al. (1999)는 감성돔을 3주 동안 저염분 노출하였을 때, 아가미 NKA 활성이 6 psu에서는 해수에 비해 2배 정도 감소한 반면, 담수에서는 3배 정도 증가하는 것으로 보고하였다. 또한 감성돔과 유사종인
아가미 NKA는 염류세포의 체내측 세포막(basolateral membrane)과 세포질내 광범위하게 분포하고 tubular system에 존재하므로(Pisam and Rambourg 1991: Dang et al., 2000), NKA의 면역조직화학 염색시에는 염류세포의 핵을 제외한 부분에 염색이 이루어 지는데(Lee et al., 2006), 본 연구에서도 이러한 염색상을 관찰할 수 있었다. 따라서 아가미의 NKA 활성 및 발현은 염류세포의 수와 크기에 따라 달라질 수 있다. 본 연구에서는 1 및 2차 항체에 의해 면역반응을 보이는 염류세포의 면적만을 계산한 결과, 저염분 노출시 시간경과에 따른 NKA 활성과 유사한 변화를 보였다. 염류세포의 수와 크기를 각각 측정하지는 않았지만, 조직상에 의하면 3시간째 NKA 발현 감소는 염류세포의 수와 크기가 모두 감소하였기 때문이며, 24시간째 NKA 발현 증가는 염류세포의 크기가 증가하였기 때문인 것으로 추정된다.
이상의 결과를 종합해 보면 감성돔은 6시간째부터 외부로부터 이온을 흡수하는 고삼투압조절을 하며, 24시간째부터는 원래의 삼투질농도를 유지하기 위하여 아가미 NKA 활성을 증가시키는 것으로 나타났다.