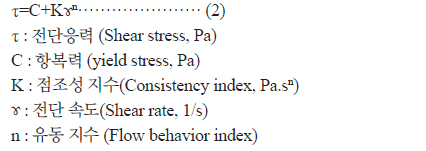국내에서 생산되는 해조류 중 주요 홍조류인 김(
본 연구에서는 저분자 포피란을 이용한 기능성 소재를 개발하기 위한 기초 자료를 얻기 위해 포피란을 β-agarase로 가수분해한 후 한외여과로 분자량 별로 분획하여 저분자 포피란의 화학적 및 물성학적 특성을 조사하였다.
실험에 사용한 김(
포피란 제조
포피란은 Koo et al. (2007)의 방법에 준하여 제조하였다. 즉 마른 김에 50배(v/w)의 증류수를 넣고 pH가 약산성(pH 4.0)이 되게 조절한 후 80℃에서 3시간 동안 추출, 여과, 농축하였다. 농축액에 3배(v/v)량의 에탄올을 첨가하고 원심분리(4,000
포피란 효소가수분해 분획물 제조
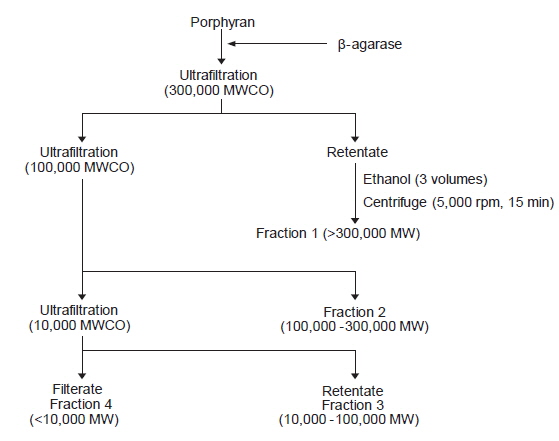
포피란에 β-agarase (Sigma-Aldrich Co., USA)를 가하여 실온에서 24시간 효소 가수분해하였다. 효소가수분해물을 분자량에 따라 분획하기 위해 molecular weight cut-off 10, 100, 300 KDa인 한외여과막(DIAFlO ultrafiltration membrane, Amicon, Division)을 사용하여 여과하여 분획한 후 동결 건조하여 분자량 별 분획물을 제조하였다(Fig. 1).
일반성분 분석
회분, 조단백질, 조지방은 AOAC법 (1990)에 따라 측정하였다. 수분은 105℃ 상압 건조법, 회분은 550℃ 회화법, 조단백질은 Kjeldhal법으로 측정하였다. 조지방은 Soxhlet법으로 측정하였고 탄수화물은 100-(수분+회분+조단백질+조지방)으로 나타내었다.
구성당 분석
구성당 분석은 Furneaux et al. (1990)의 방법에 따라 표준시약(rhamnose, fucose, arabinose, ribose, galactose, 6-O-methyl-D-galactose, 3,6-anhydro galactose, xylose, mannose, glucose)과 시료에 내부 표준물질(myo-inositol)을 넣어 각각 acetylation 유도체화 한 후 GC로 분석하였다. 구성당 GC 분석은 Hewlett Packard GC Model 6890과 FID (flame ionization detecter) 검출기, 칼럼은 SP-2330 (0.25 mm I.D × 30 m, film thickness; 0.2 μm)을 사용하였다. 칼럼온도는 230℃이며 주입구와 검출기 온도는 모두 240℃로 하였다. 이동상은 He을 0.1 mL/min의 유속으로 하여 분석하였다. 시료의 구성당 함량은 표준시약의 검량선을 이용하여 산출하였다.
FT-IR 분석
FT-IR 분광분석은 6300FV+IRT5000 (Jasco, Japan)으로 포피란과 포피란 효소가수분해 분획물(Fraction 1, 2, 3, 4)을 ATR법(attenuated total reflection absorption spectroscopy, 감쇠 전 반사 흡수 분광법)으로 분석하였다.
점도 및 유동특성 측정
포피란과 포피란 효소가수분해 분획물의 점도는 점도계(HAAKE RotoVisco 1, Thermo Electron, Germany)를 이용하여 20℃에서 sensor PP60Ti (Radius 30 mm, Gap 1 mm)를 사용하여 측정하였다. 전단속도는 0-1500 1/s까지 변화시켰고, 측정온도는 22.5℃에서 측정하였다. 농도 변화에 따른 포피란과 포피란 효소가수분해 분획물의 유동 특성 값을 구하기 위해 포피란과 효소가수분해 분획물을 각각 3%, 5%, 7%, 10%로 제조하여 측정한 후 power law model 식(1)과 Herschel-Bulkley model 식(2)을 사용하여 점조성지수 K와 유동성지수 n을 구하였다.
활성화에너지 측정
포피란과 포피란 효소가수분해 분획물(Fraction 1)의 온도변화(20, 30, 40, 50℃)에 따른 활성화 에너지값을 Arrhenius model (3)을 이용하여 구하였다(Rao and Anantheswaran , 1982).
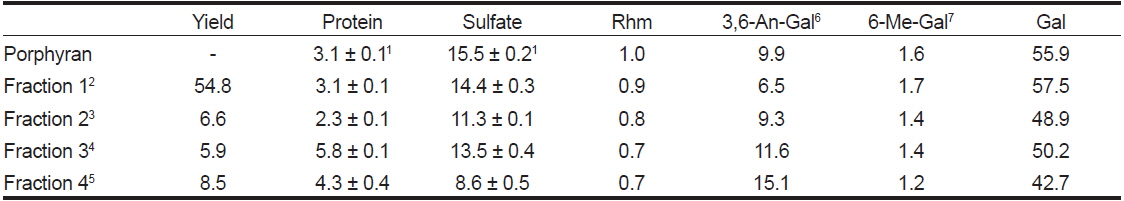
포피란과 포피란을 β-agarase로 가수분해한 효소가수분해물의 수율 및 구성성분은 Table 1과 같다. 포피란의 조성은 단백질 3.1%, 황산기 15.5%, rhamnose 1.0%, 6-O-methyl-galactose 1.6%, 3,6-anhydro galactose 9.9%, galactose 55.9%로 galactose, 3,6-anhydro galactose와 황산기를 합한 값이 81.3%를 차지하였다. Park and Koo (2008)는 조포피란을 cetylpyridinium chloride로 분리한 산성 분획물의 경우 galactose, 3,6-anhydro galactose, 황산기의 함량이 각각 47.1%, 12.7%, 14.3%로 이들 3종을 합한 값이 74.1%로 대부분을 차지한다고 보고하였는데 본 연구 결과와 유사함을 알 수 있다. 효소가수분해 분획물의 구성 성분도 galactose (42.7-57.5%), 3,6-anhydro galactose (6.5-15.1%), ester sulfate (8.6-14.1%)가 대부분을 차지하였다. 수율과 황산기 함량은 분자량 300 KDa 이상인 fraction 1이 각각 54.8%와 14.4%로 가장 높았다. 반면에 3,6-anhydro galactose 함량은 fraction 1이 6.5%로 가장 낮고, fraction 4가 15.1%로 가장 높았다. 즉, 분자량이 큰 분획물일수록 6-sulfate galactose 함량이 높고, 3,6-anhydro galactose 함량은 낮아졌다. 이는 포피란에 함유되어 있는 주요 구성 성분인 6-sulfate galactose가 β-agarase의 활성을 저해하기 때문으로 여겨진다.
[Table 1.] Chemical composition of porphyran and enzymatic hydrolysate fractions (%)
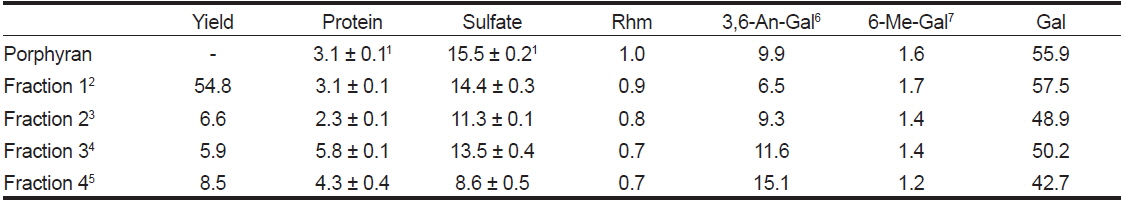
Chemical composition of porphyran and enzymatic hydrolysate fractions (%)
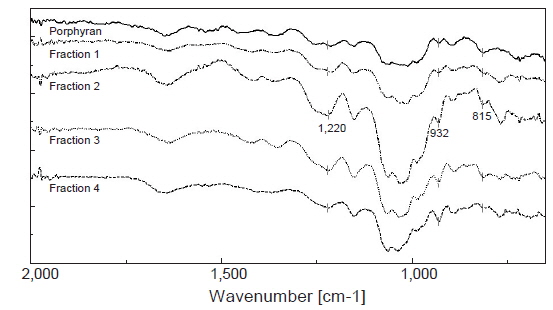
포피란과 포피란 효소가수분해 분획물의 FT-IR spectrum은 Fig. 2와 같다. 포피란 및 분획물 모두 3,6-anhydro galactose (932 cm−1)와 6-sulfate galactose (815 cm−1) peak가 검출되었다. 또한 포피란의 주요 성분인 황산기는 1,210-1,260 cm−1 (황산기의 O=S=O에 의한 진동 밴드) 파장에서 나타나는데 포피란 및 분획물 모두 1,220 cm−1 부근에서 peak가 검출되어 황산기가 존재함을 확인하였다.
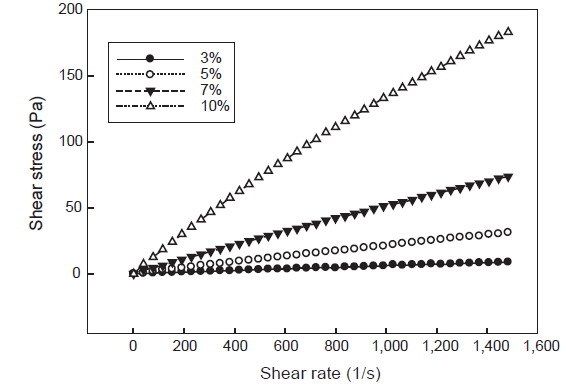
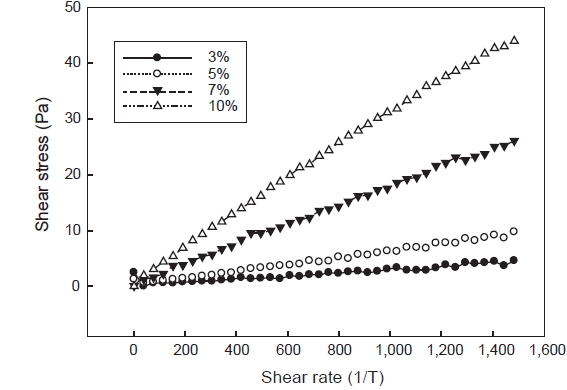
포피란과 효소가수분해 분획물의 전단속도에 따른 전단응력 변화는 각각 Fig. 3, 4와 같다. 전단속도 800 1/s일 때 3%, 5%, 7%, 10%의 포피란 용액의 전단응력은 각각 4.46, 17.27, 42.08, 110.80 Pa로 농도 증가에 따라 증가하였으며 고농도인 10%에서 급격히 증가하였다. 효소가수분해 분획물인 fraction 1도 3%, 5%, 7%, 10% 용액의 전단응력이 각각 2.30, 5.26, 14.31, 25.80 Pa로 분획물의 농도 증가에 따라 전단응력이 증가하였으나 전체적으로 fraction 1의 전단응력이 포피란에 비해 낮았다. Koo et al. (1997)은 국내산 다시마, 미역포자엽, 톳, 모자반에서 추출한 fucoidan의 농도에 따른 유동 특성을 측정한 결과 전 시료 모두 농도가 증가함에 따라 겉보기 점도가 급격히 증가한다고 보고하였는데 본 실험에서 포피란과 효소가수분해 분획물 모두 농도 증가에 따라 점도가 증가되는 동일한 경향을 나타내었다.
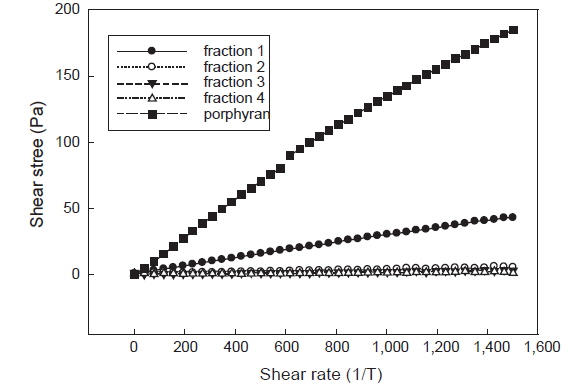
효소가수분해 분획물의 분자량 크기에 따른 전단응력 변화는 Fig. 5와 같다. 전단속도 800 1/s에서 fraction 1은 25.80 Pa, fraction 2는 3.35 Pa, fraction 3은 1.59 Pa 그리고 fraction 4는 0.96 Pa로 분자량 감소에 따라 점도도 감소하였다. Koo et al. (2007)은 제단백 포피란의 점도 측정을 통해 포피란의 점도는 저분자화 될수록 점도가 저하하며 분자량 크기에 영향을 많이 받는다고 보고하였다. 또한 Song et al. (2007)도 알긴산과 카라기난에 감마선을 조사한 결과 조사선량이 증가할수록 분자량과 점도가 유의성 있게 감소한다고 보고하였는데 본 실험에서도 분자량 감소에 따라 점도가 저하하는 동일한 경향을 나타내었다.
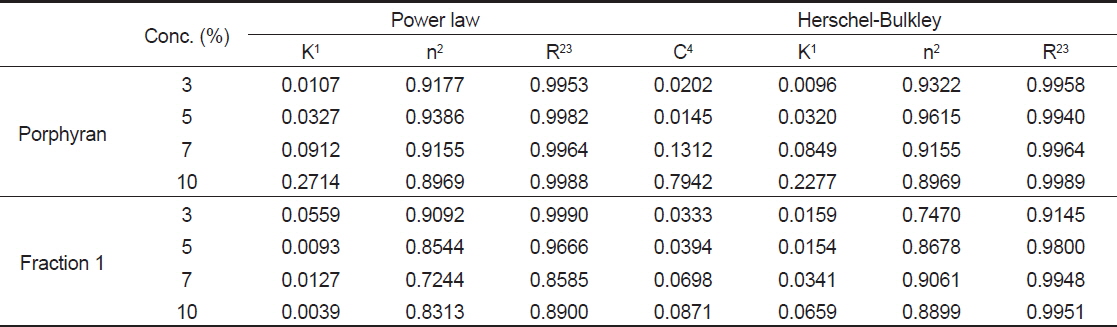
포피란과 효소가수분해 분획물 fraction 1의 농도에 따른 유동 특성을 조사하기 위해 Power law model과 Herschel-Bulkley model을 이용하여 유동지수, 점조도 지수, 항복력를 구한 결과를 Table 2에 나타내었다. 결정계수(r2)값의 경우 Herschel-Bulkley model은 포피란과 효소가수분해 분획물 모두 0.91-0.99로 높은 상관성을 나타내었다. 반면에 power law model은 포피란은 모든 농도에서 0.99로 높은 상관성을 나타내었으나 fraction 1은 0.85-0.99로 7-10%의 고농도에서는 상대적으로 낮은 값을 나타내었다. 따라서 효소가수분해물의 유동 특성 값 분석에는 Herschel-Bulkley model이 적합하다고 생각된다. Herschel-Bulkley model로 구한 유동지수는 포피란과 fraction 모두 1 이하이며 항복력을 가지는 의가소성 유체 특성을 나타내었다. 점조도 지수는 포피란과 fraction 1은 각각 0.009-0.227과 0.0159-0.0659로 농도가 증가할수록 점조도 지수값이 증가하였다. 항복력은 3%와 5%의 낮은 농도에서는 포피란과 효소가 수분해물인 fraction 1 모두 0.0145-0.0394로 거의 차이가 없었으나 7%와 10%의 농도에서는 포피란은 각각 0.1312와 0.7942이고, fraction 1은 각각 0.0698과 0.0871로 포피란이 fraction 1에 비해 높은 값을 나타내었으며, 특히 10% 포피란이 높은 값을 나타내었다. 위의 결과로 미루어 볼 때 포피란과 효수가수분 해물의 점조도 지수와 항복력 모두 농도가 높을수록 영향을 많이 받음을 알 수 있다.
[Table 2.] Rheological parameters for porphyran and its enzymatic hydrolysate fraction 1
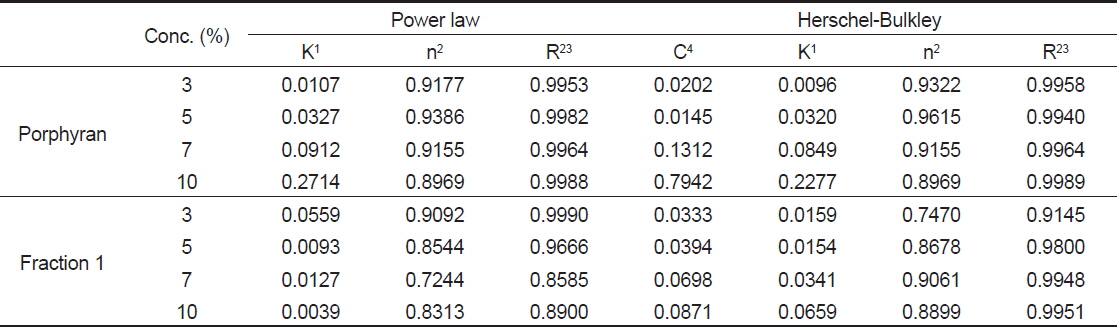
Rheological parameters for porphyran and its enzymatic hydrolysate fraction 1
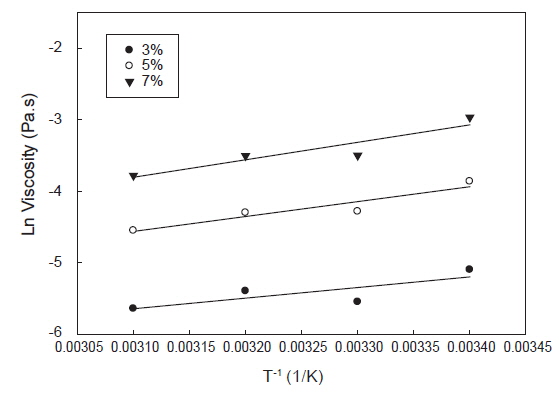
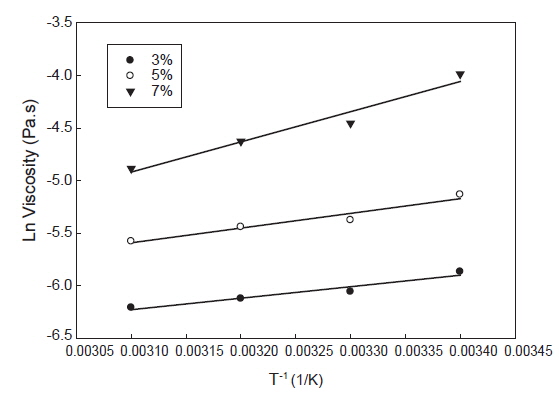
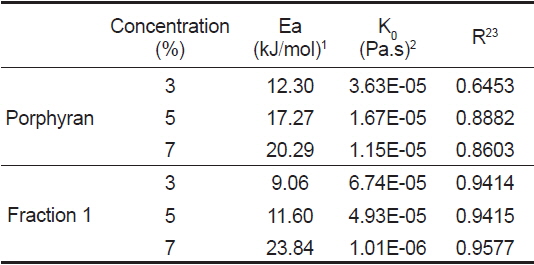
활성화 에너지는 유체가 흐르기 위해 극복해야 할 장애 에너지를 의미하며 일반적으로 시료의 농도, 이온강도, 이화학적 특성 및 전단 응력에 따라 달라진다(Rincon et al., 2014). 포피란과 포피란 효소 가수분해 분획물(fraction 1)의 농도 별 온도에 대한 활성화 에너지의 영향을 알아보기 위해 전단속도 1,000 1/s에서 온도를 변화시키면서 농도(3, 5, 7%) 별로 겉보기 점도를 측정하였다(Fig. 6, 7). 포피란과 fraction 1 모두 직선성을 나타내었다. 겉보기 점도변화와 온도변화(1/T)에 따라 Arrhenius 식을 통해 구한 활성화 에너지는 Table 3과 같다. 결정계수(r2)값은 포피란은 0.64-0.88, fraction 1은 0.94-0.95로 농도가 높을수록 높았고, 전체적으로 포피란에 비해 fraction 1이 높았다. 농도에 따른 활성화 에너지값은 포피란의 농도가 3, 5, 7%로 증가함에 따라 각각 12.30, 17.27, 20.29 kJ/mole로 증가하였고 효소가 수분해 분획물인 fraction 1도 각각 9.06, 11,60, 23.84 kJ/mole로 증가하였다. Paual et al. (2001)은
[Table 3.] Constants for Arrhenius model for porphyran and enzymatic hydrolysate fraction 1
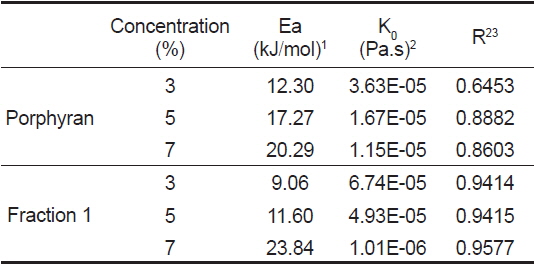
Constants for Arrhenius model for porphyran and enzymatic hydrolysate fraction 1