The purpose of this study is to evaluate the characteristic of the iron oxide carrier for removing arsenic contained in the groundwater. 4 types of iron oxide carrier used in the study is iron oxide coated sand carrier (IOCSC), iron oxide coated zeolite carrier (IOCZC), iron oxide plasticity carrier (IOPC) and platinum iron oxide plasticity carrier (PIOPC). The results of this study, IOPC is showed high arsenic adsorption strength and the maximum amount of adsorption than the IOCC. Based on the results of the arsenic adsorption characteristic, by using IOCC was conducted to column test. As a result, PIOPC is showed a high arsenic adsorption amount than IOPC, it was found that the time required to reach the breakthrough point is also extended. Therefore it is determined that stably compliance with water quality standards enhanced drinking water when using the PIOPC.
비소는 발암성 물질로 알려져 있으며 음용수를 통해 비소에 노출될 경우 암 발생뿐만이 아니라 심혈관 질환 등 다양한 만성 질환을 유발하는 것으로 보고되고 있다. 최근 국내·외에서 지하수 및 지반오염에 대한 관심이 고조되고 있는 가운데 광산 등의 지역에서 비소를 포함한 중금속 농도가 오염 기준치를 초과하는 사례들이 보고되고 있다 (Kim et al., 2009). 수계 내의 비소는 광범위하게 분포하며 일반적으로 약 0.005~0.05 mg/L 정도의 농도를 나타낸다고 보고되고 있다. 또한 pH 및 암질에 따라 국부적으로 0.1~2.0 mg/L까지 고농도로 나타나기 때문에 생태계와 인간에게 직접적인 영향을 줄 수 있다(Bang et al., 2003). 비소는 염색체 변이 유발, 위장, 혈관, 신경계 질환 및 폐암과 피부암 등을 유발하며, 이에 따라 2001년 미국 환경청에서는 비소의 음용수 법적 기준을 0.05 mg/L에서 0.01 mg/L로 강화하였고 유럽 등 선진 국가에서는 비소의 법적 기준을 0.01 mg/L로 규제하고 있다. 국내 지하수법의 경우 비소의 먹는 물 수질 기준을 0.05 mg/L에서 0.01 mg/L로 강화하여 관리하고 있다. 국내 지하수 오염 사례를 조사한 결과 135개 시료 중 71개 시료에서 비소가 검출되었으며, 이 중 먹는 물 수질 기준을 초과하는 시료는 49개로 나타났다 (Lee, 2002). 특히 수도법 개정으로 간이상수도를 일반수도로 인정하는 가운데 대형 정수처리시설의 경우 모니터링을 통하여 비소오염에 대처가 가능하지만 소규모 정수처리시설에서는 비소의 관리가 매우 미흡한 실정이다(Abdallah and Gannon, 2013). 또한 현재 국내 · 외에서 사용되는 비소제거 기술은 응집 · 침전 및 막 여과 기술 등이 제시되고 있으나 기존의 기술들은 고가의 처리비용과 슬러지 처리에 대한 문제가 발생하여 소규모 정수처리시설에 적용하기 어려운 문제점을 가지고 있다. 소규모 정수처리시설에서 적용 가능한 비소제거 기술로는 흡착기술이 많이 적용되고 있는 실정이다(Bang et al., 2003). 또한 산화철의 경우 기존 연구에서 큰 비표면적을 가지고 있어 중금속 흡착에 많이 활용된 사례가 보고되고 있다. 수용액 상 비소는 As(III)와 As(V)로 존재하며 대부분 산화음이온 또는 중성상태를 나타낸다. 이러한 비소는 흡착제 표면의 OH 혹은 OH2와의 리간드 교환반응에 의해 제거 되는 것으로 알려져 있다. 산화철을 이용한 흡착은 처리수질에 큰 영향을 받지 않기 때문에 지하수를 음용수로 이용하는 경우에 많이 적용되고 있다. 담체의 경우 세부 메커니즘에 관한 고찰이나 흡착제 표면 미세구조와 흡착능 사이의 상관관계에 관한 연구는 미비한 실정이다. 따라서 본 연구에서는 비소제거를 위한 산화철 담체특성을 통해 소규모 정수처리시설에 적용 가능한 비소제거용 산화철 담체의 적용성을 평가하고자 한다.
본 연구는 분말 산화철(Fe3O4, Particle size < 50 nm)을 이용하여 코팅 및 소성방법에 따라 담체를 구분하여 실험조건에 따른 비소 흡착효율을 평가하였다. 산화철 코팅담체는 지지체로 모래(비중 : 2.5~2.6 kg/m3, 유효경 : 0.45~0.7 mm)와 제올라이트(음이온 계열, size : 1.0~1.7μm3)를 사용하였으며, 산화철 소성담체는 산화철 분말과 제올라이트 분말을 혼합 후 백금을 첨가한 담체를 사용하였다. 이에 따라 담체별 물리 · 화학적 특성 및 비소 흡착효율과 컬럼 실험을 통한 파과점 및 비소 흡착능력을 도출하였다.
산화철 코팅담체의 제조는 지지체와 3가철 용액(30%)을 진공회전증발기에 함께 넣고 70°C 온도에서 30 rpm 속도로 회전시켜 3가철 용액 및 지지체에 함유된 수분을 증발시켰다. 또한 슬러리 중 철의 농축에 따른 지지체 표면으로 철의 부착이 쉽게 일어날 수 있도록 수분을 증발시켜 100°C로 유지된 가열로에 넣고 건조하였다. 건조가 끝난 다음 담체는 600°C 가열로에서 약 5시간 소성하고 냉각 후 증류수로 세척하여 다시 105°C에서 건조하였다. 산화철 담체 제조를 위해 지지체는 주문진 여과사와 국내산 천연 제올라이트를 사용하였다. 지지체는 일정한 사이즈로 구분하여 사용하기 위해 표준 입도 분리체를 사용하여 1.0~1.2 mm 크기로 분류하였다.
산화철 소성담체는 분말 제올라이트를 분말 산화철과 2:8 비율로 혼합하고 증류수를 이용하여 반죽 후 담체형태로 성형하였다. 또한 성형된 담체는 600°C에서 소성하여 사용하였으며, 백금촉매를 첨가한 산화철 소성담체는 담체 제조단계에서 액상 백금용액(16%)을 추가로 혼합하여 담체를 제조하였다. 철 산화물을 이용한 흡착이 가장 보편적인 비소 흡착제거에 사용되는 방법이며, 이러한 기법은 전기적 중성을 띠는 As(III)보다는 음이온 형태로 거동하는 As(V)에 더 좋은 효율을 보인다는 연구결과(Viraraghavan et al., 1999; Zouboulis et al., 1993)에 따라 소성담체에 강력한 산화제인 백금을 주입하여 촉매로 이용하였다.
제조된 담체의 표면구조 및 기공 형태 등 물리 · 화학적 특성을 확인하기 위해 주사전자현미경(Scanning electron microscope, SEM)을 이용하였으며, 담체를 구성하고 있는 담체상의 원소의 정량 분석을 알아보기 위해 EDX(Energy Dispersive X-ray Spectroscopy)를 이용하여 확인하였다.
본 연구에서는 담체의 비소 흡착효율을 평가하기 위해 등온흡착실험을 진행하였다. 실험에 사용된 원수는 비소 표준물질인 아비산나트륨(KH2AsO4, 99.9%, Sigma Aldrich)을 이용하여 0.25 mg/L 표준용액을 제조하여 사용하였으며, 각각의 담체무게를 0, 0.125, 0.25, 0.5, 0.75, 1, 1.5 g씩 구분하여 Shaking incubator에서 72시간 동안 반응시켰다. 시료의 용량은 200 ml로 일정하게 하였으며, 반응 온도는 20°C 조건을 유지하였다. 등온흡착실험 결과는 Langmuir와 Freundlich 흡착식을 이용하여 평가하였다.
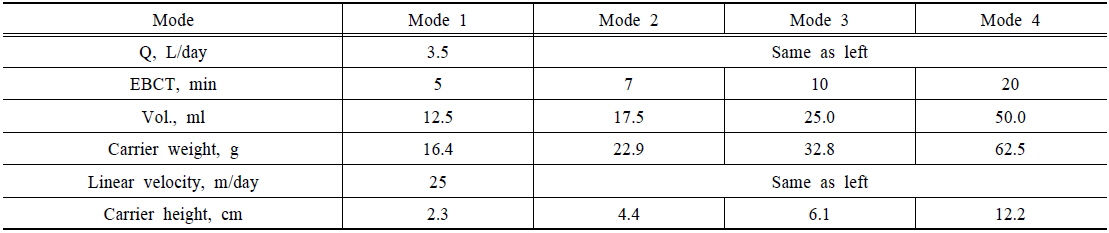
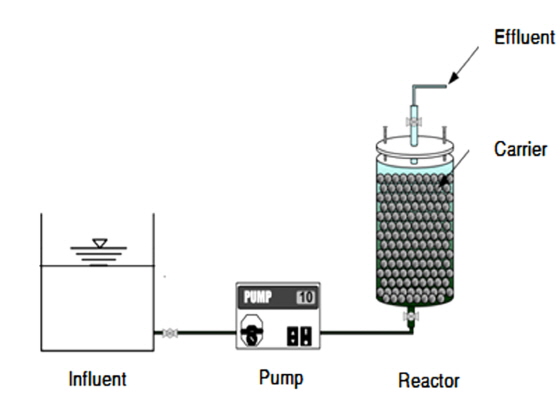
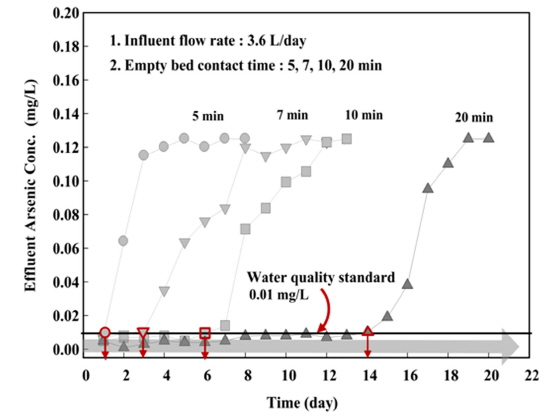
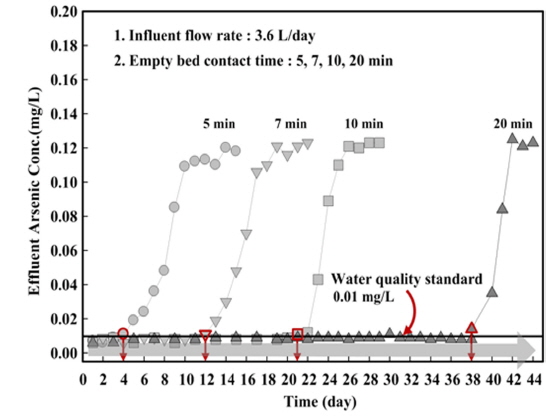
담체의 파과점 및 비소 제거능력은 컬럼 실험을 통해 평가하였다. 컬럼의 제원은 두께 5 mm, 길이 500 mm, 지름 10 mm의 아크릴을 이용하여 총 4개의 컬럼을 제작하였다. 컬럼 상하부에는 밸브를 설치하여 유입과 유출이 원활하게 이루어지도록 구성하였으며, 원수 공급은 정량펌프를 이용하여 상향류식으로 주입하였다. 또한 운전조건에 따라 공상체류시간(Empty bed contact time, EBCT)을 구분하여 24시간 간격으로 비소농도를 측정하였다. Table 1에는 컬럼 실험을 위한 운전조건을 제시하였으며, Fig. 1에는 컬럼 실험장치의 모식도를 나타내었다.
[Table 1.] Operation conditions of column test
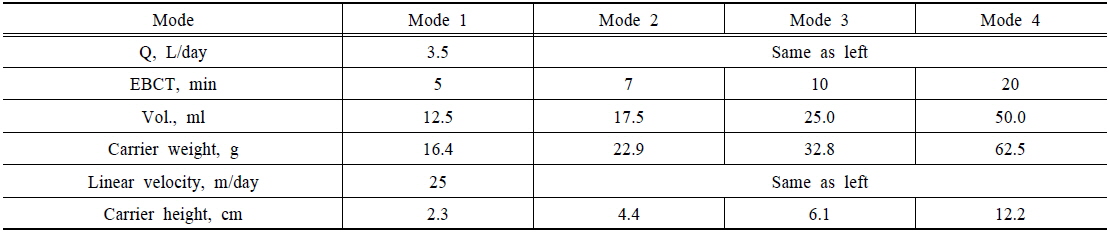
Operation conditions of column test
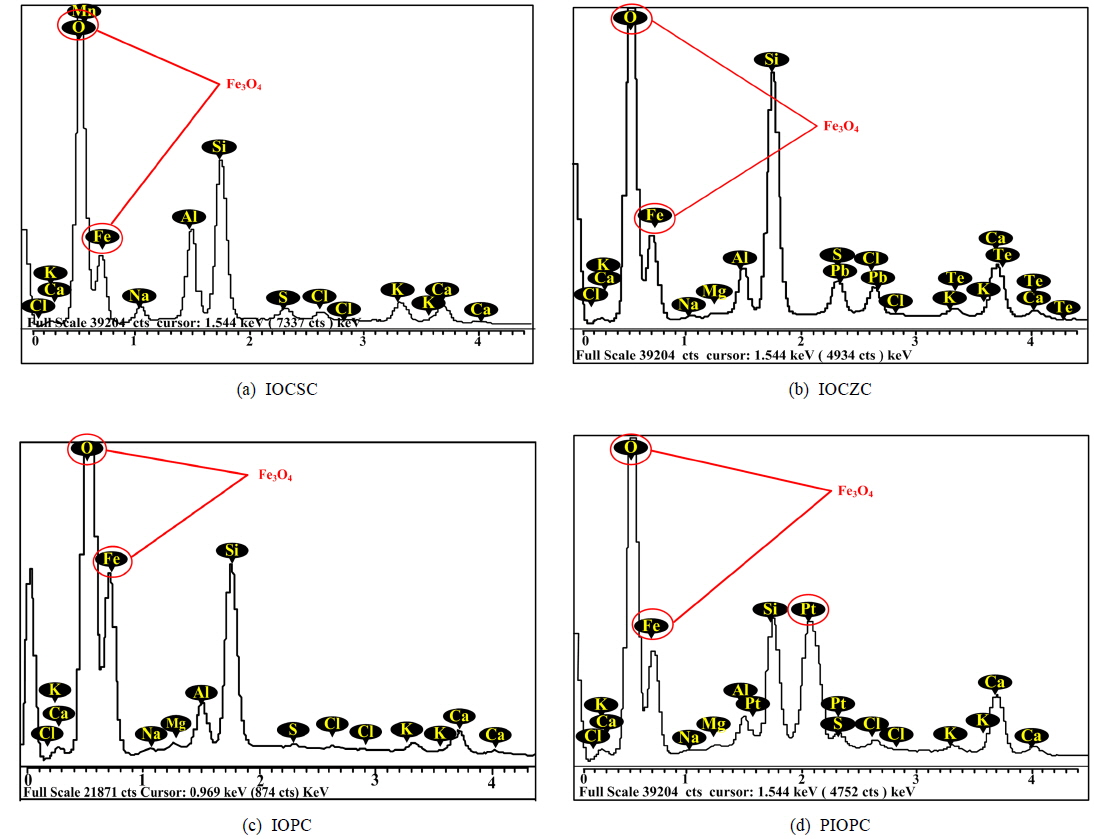
본 연구에 사용된 담체의 표면구조, 기공 및 화학구조를 알아보기 위하여 SEM과 EDX의 분석을 실시하였다. SEM 측정결과 산화철 코팅 모래담체(Iron oxidized coated sand carrier, IOCSC)와 산화철 코팅 제올라이트담체(Iron oxidized coated zeolite carrier, IOCZC)의 표면에 산화철 입자들이 코팅되어 있는 것으로 나타났으며, 지지체로 모래보다 제올라이트를 사용한 경우 상대적으로 많은 산화철이 관찰되었다. 이는 제올라이트가 모래보다 다공성이 큰 지지체로써 표면적 증가에 따라 산화철이 더 많이 흡착된 것으로 판단된다. Tufano et al. (2008)의 연구에서 제올라이트는 미세한 세공을 가지고 있는 결정성 알루미나로써 사면체의 구조물이 산소를 공유하며 연속적으로 이어지는 구조를 가지고 있다고 보고하고 있다. 산화철 소성담체(Iron oxidized plasticity carrier, IOPC)와 백금촉매가 첨가된 산화철 소성담체 (Platinum iron oxidized plasticity carrier, PIOPC)표면은 산화철 고유의 구형입자들이 나타났으며, 산화철의 입자분포가 일정하게 유지되는 것을 확인할 수 있었다. 또한 산화철 사이의 미세한 공극이 관찰되는 것으로 보아 다공성 구조로 인해 표면적이 증가된 것으로 나타났다. Yoo (2014)의 연구에서 소성을 통한 굴 폐각의 표면개질을 연구한 결과 고온조건에서 소성을 가했을 경우 비표면적이 증가한다고 하였으며, Leupin and Hug (2005)은 산화철의 미세세공들이 마주하고 있는 벽돌에 의해 발생된 흡착력의 포개짐 때문에 내부 흡착 potential이 더 많이 증가한다고 주장하고 있다. 담체의 화학적 구성성분 파악을 위해 EDX를 분석한 결과 담체의 표면에 다량의 철(Fe)과 산소(O) 성분이 측정되었으며, 이는 담체에 Fe3O4 형태의 산화철이 다량 함유된 것으로 판단되며 또한 석영 성분인 SiO2가 혼재되어 있는 것으로 나타났다. Fig. 2 및 Fig. 3에 담체의 SEM과 EDX 분석결과를 나타내었다.
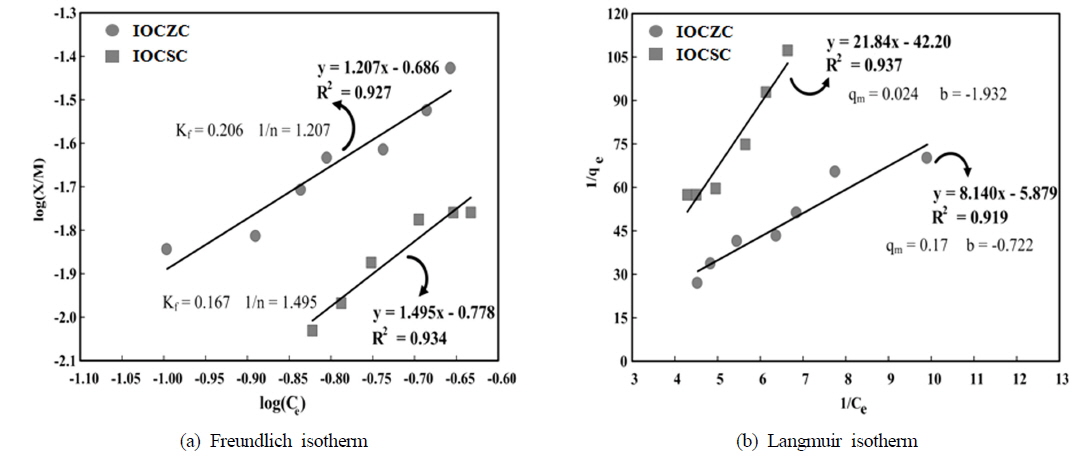
[Table 2.] Results of arsenic adsorption with IOCSC and IOCZC
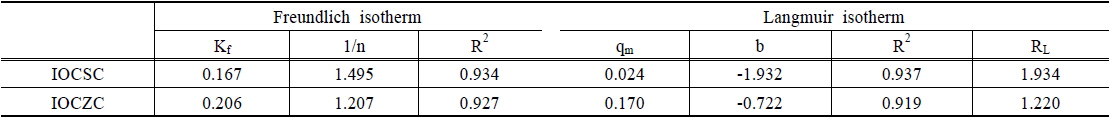
Results of arsenic adsorption with IOCSC and IOCZC
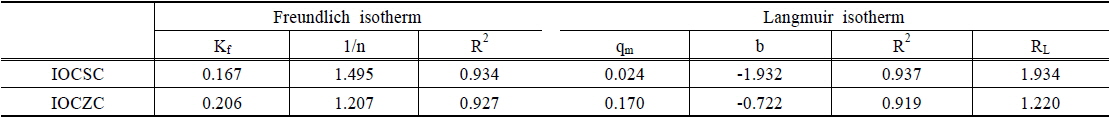
IOCSC와 IOCZC의 등온흡착실험 결과, Freundlich 흡착모델과 Langmuir 흡착모델 모두 높은 상관관계를 가지는 것으로 분석되었다. Yang et al. (2003)의 연구에서 Freundlich 흡착모델 적용결과 최대 흡착량은 각각 0.167 mg/g, 0.206 mg/g 분석되어 산화철 코팅 모래 kg당 90 mg의 비소가 제거되었다는 연구결과와 유사한 흡착량을 나타내었다. 이온결합 강도를 나타내는 1/n값은 1.495, 1.207로 양호한 이온결합 강도(1/n : 0.1~0.5) 범위를 초과하여 이온결합 강도가 불량한 것으로 나타났다. Langmuir 흡착모델의 적합성 여부를 알아보기 위하여 분리인자 RL값을 분석한 결과 RL값이 1.934 및 1.224로 IOCSC와 IOCZC는 Langmuir 흡착모델적용이 적합하지 않은 것으로 나타났다. RL값의 경우 RL > 1, RL = 0은 부적합, 0 < RL < 1은 적합하다고 알려져 있다(Weber and Chakravorti, 1974).
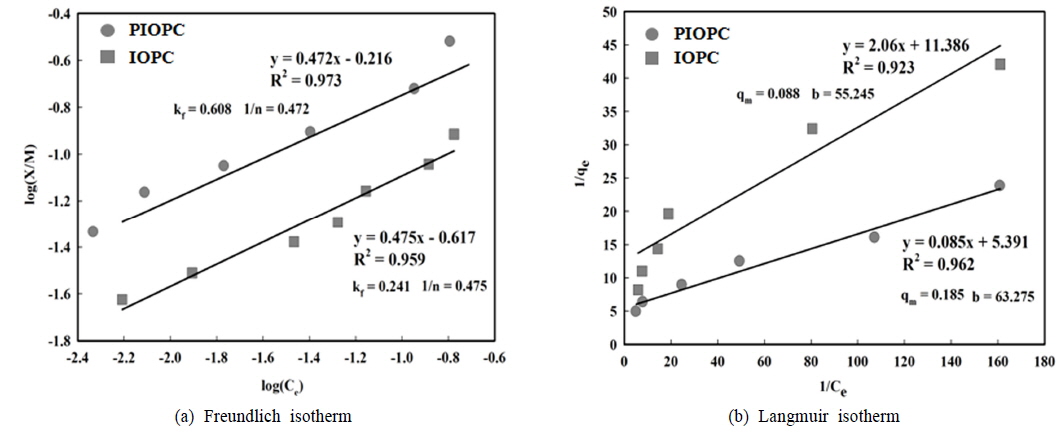
IOPC와 PIOPC의 등온흡착실험 결과, Freundlich 흡착모델이 Langmuir 흡착모델보다 상관관계가 높게 나타났으며, 이는 표면 단층 흡착을 가정한 Langmuir 모델보다 화학적 흡착과 함께 표면침전을 설명하는데 유용한 Freundlich 모델이 기본 가정에 더 적합하다는 기존 연구결과 (Oh et al., 2010)에 부합되는 결과를 보였다. 또한 IOPC와 PIOPC의 Freundlich 흡착모델에서의 최대 흡착량은 각각 0.241 및 0.608 mg/g으로 분석되어 촉매로 백금이 주입에 따라 비소 흡착효율이 개선되는 것을 확인할 수 있었다. Korngold et al. (2001)은 백금촉매를 이용한 지하수 내 TCE 제거에 관한 연구에서 백금을 주입하였을 경우 TCE 제거율이 급격히 증가한다고 보고하였다. IOPC와 PIOPC의 이온결합 강도를 나타내는 상수 1/n값은 각각 0.475와 0.472로 결합강도가 우수한 것으로 나타나 흡착공정에 적용할 경우 효과적인 비소제거가 가능한 수준임을 알 수 있었다.
[Table 3.] Results of arsenic adsorption with IOPC and PIOPC

Results of arsenic adsorption with IOPC and PIOPC
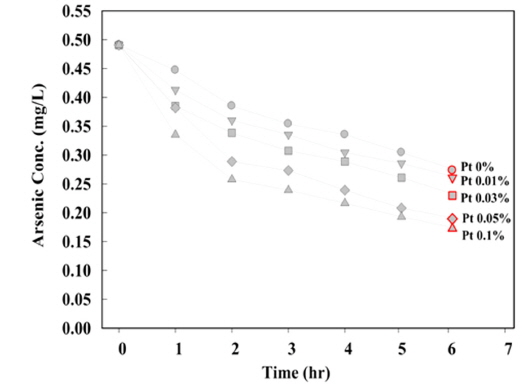
등온흡착실험에 사용된 PIOPC의 백금촉매 함량은 0.05%였으며, 백금촉매 함량이 증가할수록 흡착속도가 증가하는 것으로 나타났다. 아래 Fig. 6에 담체 내 백금 함량에 따른 비소 흡착속도 변화를 나타내었다. 독성물질로 알려진 비소를 제거하는 효과적인 방법은 As(III)를 As(V)로 산화시키는 것으로, 담체 내 백금은 산화반응을 촉진시켜 As(III)를 As(V)로 전환을 유도하기 때문에 백금 함량이 증가할수록 비소 제거속도가 증가한 것으로 판단된다. Oscarson et al. (1981)은 cryptomelane, pyrolusite, birnessite의 세 가지 형태의 MnO2가 용액 중의 As(III)를 As(V)로 산화시켜 흡착에 의해 효율적으로 제거시킬 수 있다고 보고하였으며, As(V)는 pH 4~10 범위에서 주로 음이온형으로 존재하고, As(III)는 중성형으로 존재하여 철 표면과 반응성이 As(V)가 더 높다고 보고하고 있다(Huang and Liu, 1997). 촉매로서의 효율이 우수한 백금이 함유된 담체를 이용할 경우 비소의 산화 및 흡착에 의해 비소 제거효율이 증가될 것으로 판단된다.
3.4. 산화철 소성담체를 이용한 column test 결과
등온흡착실험 결과를 바탕으로 비소 흡착능력은 산화철 코팅담체보다 산화철 소성담체가 우수한 것으로 나타났으며, 이에 따른 컬럼 실험은 산화철 소성담체인 IOPC와 PIOPC를 이용하였다. 담체의 파과점은 먹는 물 수질기준인 0.01 mg/L를 초과하는 지점으로 설정하였으며, 비소 흡착량을 도출하기 위해 column식 흡착법을 적용하여 비소 흡착능력을 평가하였다.
U = {(CIn - CEff1) + (CIn - CEff2) + (CIn - CEff3) ⋯ (CIn - CEffn)} / M
U : 비소의 증가 시점까지의 흡착, mg/g CIn : 컬럼 통과 전 농도, mg/L CEff : 컬럼 통과 후 농도, mg/L M : 산화철 담체의 양, g
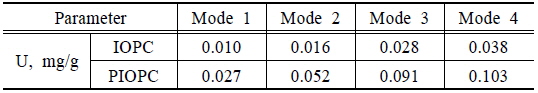
Column식 흡착법을 적용한 비소 흡착량 및 파과점 도출결과를 Table 4 및 Fig. 7~8에 나타내었다. 실험결과 비소 흡착량은 PIOPC가 IOPC에 비해 더 높은 흡착량을 나타내는 것으로 나타났으며, PIOPC가 약 2.5배정도 흡착량이 증가한 것으로 분석되었다. Banergeea et al. (2008)의 연구에서도 GFH를 이용한 비소 흡착실험 결과 control보다 약 2배의 비소가 흡착되었다고 보고하고 있다. 백금을 첨가한 산화철 소성담체의 컬럼 실험을 통해 도출한 흡착량은 등온흡착실험에 의해 도출된 최대 흡착량의 45%정도로 분석되었다.
[Table 4.] Results of arsenic adsorption amount for column test
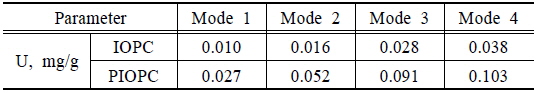
Results of arsenic adsorption amount for column test
산화철 담체의 물리화학적 특성과 관련지어 볼 때 PIOPC 표면의 다공성 구조에 의해 미세한 공극이 다량 관찰되어 표면적이 증가함으로써 비소의 흡착이 상대적으로 많이 이루어진 것으로 판단된다.
파과점은 EBCT 5 min에서 IOPC와 PIOPC의 파과점이 가장 빠르게 발생하였으며, EBCT가 길어짐에 따라 파과점 발생시간이 연장되는 것으로 나타났다. 파과점 도달 후 비소의 농도가 점차 증가하는 경향을 나타냈으며, 이는 담체층에서 비소의 파과가 발생된 것으로 판단된다(Jung, 2005). 이에 따라 비소제거를 위한 흡착탑 용량 결정시 EBCT가 흡착탑 설계의 중요한 인자로 작용하는 것을 알 수 있었다.
산화철 소성담체의 비소 흡착실험 결과와 컬럼 실험결과를 토대로 연구결과를 평가하였을 때 백금촉매를 주입한 소성담체를 적용하였을 경우 우수한 비소 처리효율과 파과점 연장에 따른 유지관리 측면에서 현장 적용이 용이할 것으로 판단된다.
본 연구에서는 지하수를 음용수로 사용하는 소규모 정수시설에 적용 가능한 비소제거용 담체개발에 관한 연구로 산화철 코팅 모래담체(IOCSC), 산화철 코팅 제올라이트담체(IOCZC), 산화철 소성담체(IOPC), 백금촉매가 첨가된 산화철 소성담체(PIOPC)를 제작하여 등온이온교환실험 및 컬럼 실험을 통해 담체 흡착특성을 평가하였으며, 다음과 같이 결론을 도출하였다.
1) 등온이온교환 실험결과 산화철 코팅 담체(IOCSC, IOCZC)보다 산화철 소성 담체(IOPC, PIOPC)의 비소 흡착강도와 최대 흡착량이 더 우수한 것으로 나타났으며, 이에 따라 지하수를 음용수로 사용하는 소규모 정수시설에 적용할 경우 산화철 소성 담체가 적합할 것으로 판단된다.
2) 담체에 백금을 산화촉매로 첨가함에 따라 3가 비소를 빠른 속도로 5가 비소로 산화시킴으로써 비소 제거효율이 향상되었으며, 효율적인 지하수 내 비소제거를 위해서는 백금촉매가 적용된 담체를 적용하는 것이 필요할 것으로 판단된다.
3) 산화철 소성담체에 백금촉매를 주입함에 따라 비소의 최대 흡착량이 증가하였으며, 파과점 도달은 EBCT가 증가할수록 늘어나는 것으로 나타났다. 백금촉매를 첨가한 산화철 소성담체를 이용하였을 경우 강화된 먹는 물 수질기준을 안정적으로 준수할 수 있을 것으로 판단된다.