과일과 채소는 비타민 C와 E (vitamin C and E), 미네랄(minerals), 페놀화합물(phenolics)과 카로티노이드(carotenoids)를 포함하고 있으며, 이를 섭취함으로써 많은 영양소를 공급받을 수 있다(Burns
세계적으로 토마토(
토마토에 가장 많이 함유된 것으로 알려진 라이코펜은 지금까지 발견된 600여종의 카로티노이드 중 하나로, 1910년에 처음으로 보고되었다(Yang
일반적으로, 라이코펜 분석 시에 컬럼 크기는 주로 150 4.6 mm인 것을 사용하고, 검출 파장은 대부분 450~485 nm 범위 내에서 설정한다(Burns
토마토에는 다양한 카로티노이드 성분 중, 베타카로틴(56.1), 파이토엔(234.2), 라이코펜(522.5 mg/kg dry wt.)이 함유되어 있다(Burns
본 실험에서는 라이코펜을 포함한 카로티노이드 5성분(루테인, 제아크산틴, 알파카로틴, 베타카로틴, 라이코펜)의 동시 분석법을 확립하고, 토마토 4종류(일반토마토, 방울토마토, 빨간색 및 주황색 대추방울토마토) 내 라이코펜의 함량을 정량화하였다.
Ethanol (C2H5OH)과 methanol (CH3OH)은 J.T Baker Chemical Co.(Phillipsburg, NJ, USA)를 사용하였고, ethyl acetate (CH3COOC2H5)는 Burdick&Jackson (Ulsan, Korea)을 사용하였다. Hexane (C6H14)은 Fluka Chemika(Buchs, Switzerland) 것을 사용하였으며, dichloromethane (CH2Cl2)은 LiChrosolv (New Jersey, USA) 제품을 사용하였다. Potassium hydroxide (KOH)는 Junsei Chemical Co. (Tokyo, Japan) 제품을 사용하였다.
토마토(
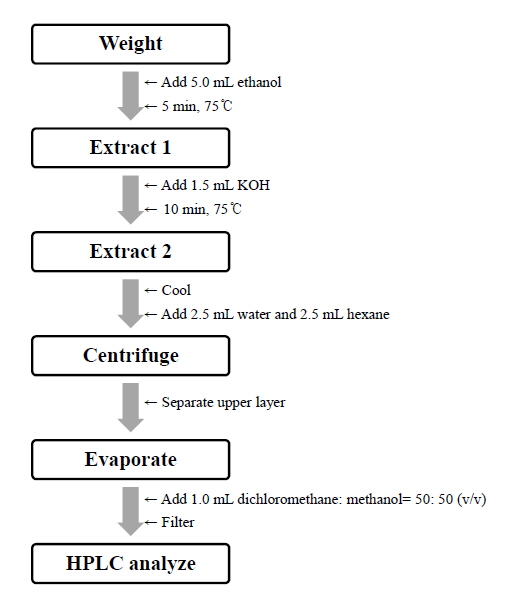
건조된 분말 시료 500 mg을 칭량하여 5.0 mL-Falcon tube에 넣고 EtOH (5.0 mL)를 넣은 후, 항온수조(75℃)에서 5분간 진탕하였다. 80% KOH (1.5 mL)를 넣고 다시 항온수조(75℃)에서 10분간 진탕하였다. 진탕한 후에는 5분간 얼음에 넣어 반응을 정지시키고, 초순수(2.5 mL)와 hexane(2.5 mL)을 넣고 진동혼합(vortex)을 하였다. 원심분리(3,000 rpm, 3 min)하고 상층액(hexane층)을 수거하여 농축플라스크에 담았다. 나머지는 동일한 과정으로 총 3회 추출하여 각 상층액을 모두 합하였다. 합한 상층액을 감압 농축기(40℃)로 농축한 후에, dichloromethane: methanol [50:50(v/v)] 1.0 mL를 넣고 sonicator를 이용하여 완전히 녹였다. 녹인 용액은 0.45 μm hydrophilic PTFE syringe filter(직경 13 mm)로 필터한 후, HPLC용 vial병에 넣어 HPLC로 분석하였다(Fig. 2).
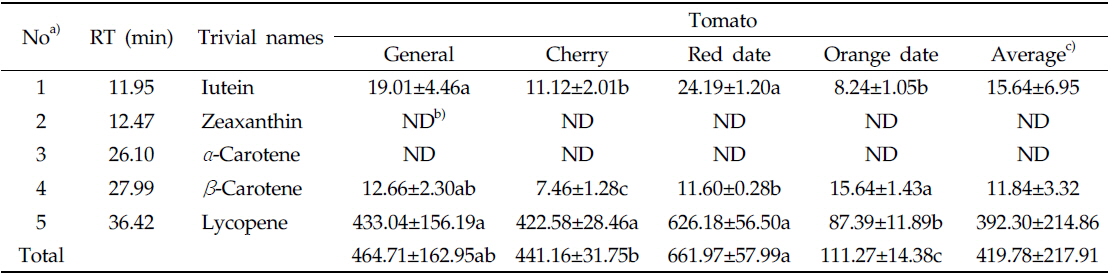
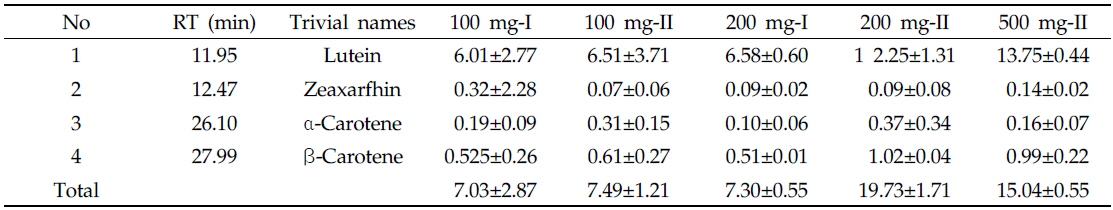
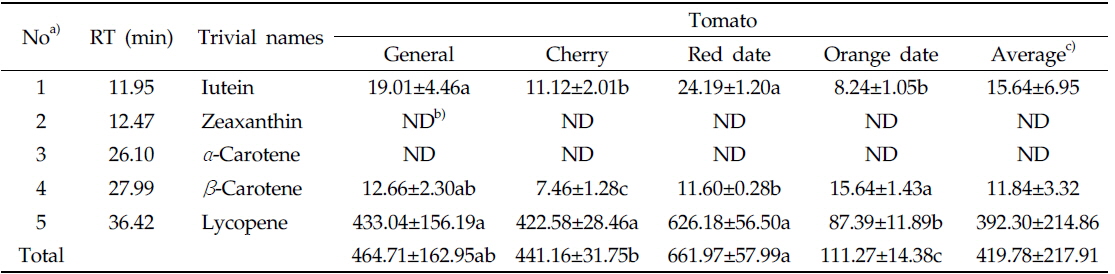
라이코펜을 포함한 카로티노이드 분석은 YMC carotenoid C30 column (250 × 4.6 mm i.d., particle size 3.0 μm)을 장착한 HPLC (Perkin Elmer Flexar, Inc, USA)를 사용하였다. 분석조건으로 칼럼 온도(column temperature)는 40℃, 검출 파장(detection wavelength)은 454 nm, 유량 (flow rate)은 1.0 mL/min, 주입량은(injection volume)은 20.0 μL로 설정하였다. 이동상 용매는 A [water: methanol=25: 75 (v/v)]과 B[ethyl acetate]를 사용하였다. 용매 B는 처음에 60%로 시작하여 4분에 70%까지 증가시키고, 9분에 75%로 증가시킨 후 20분까지 유지시켰다. 23분에는 100%까지 증가시켜 28분까지 유지시키고, 28.1분에 60%로 급격히 감소시켜 38분까지 10분간 칼럼을 세척하였다. 각 카로티노이드 5성분은 대응하는 외부표준물질의 HPLC 피크 면적(area)과 각 성분의 면적을 비교하여 정량하였다(Table 3).
[Table 3.] Carotenoid contents (mg/kg dry wt.) in tomatoes (n=3)
Carotenoid contents (mg/kg dry wt.) in tomatoes (n=3)
모든 토마토 시료는 3반복으로 분석하였고, 분석 결과를 Microsoft Ofiice Excel 2010으로 평균값(average)과 표준편차(SD, standard deviation)를 구하였다. 통계프로그램은 IBM SPSS® version 21을 사용하여 일원배치 분산분석을 실시하였고(
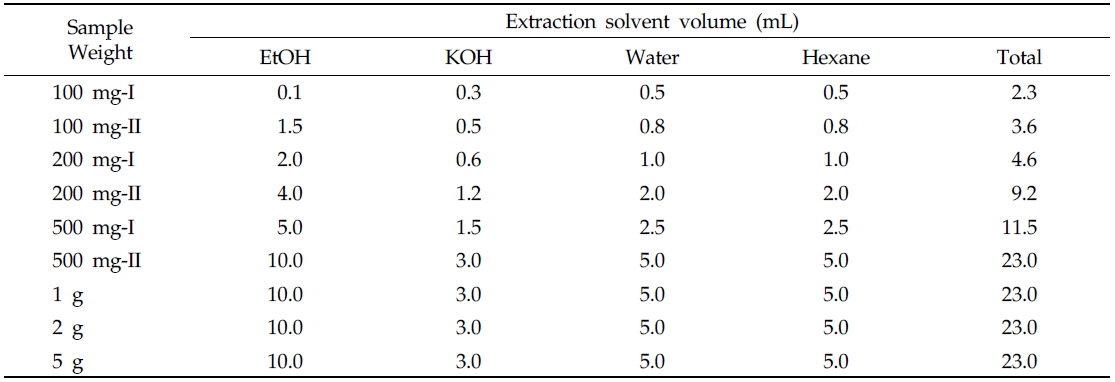
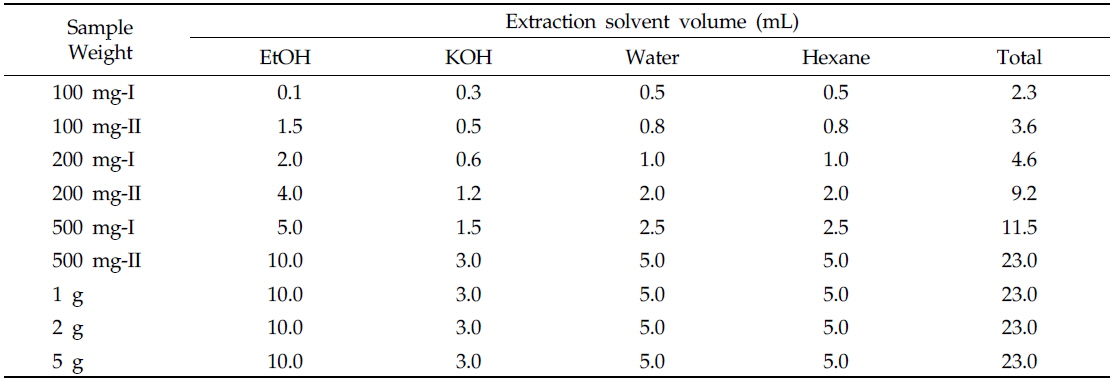
본 실험실에서는 배추 내 카로티노이드 고함유 계통 선발을 위하여 라이코펜을 제외한 카로티노이드 4성분(루테인, 제아크산틴, 알파카로틴, 베타카로틴)의 HPLC 분석법을 이미 개발하였다(slightly modified from Tuan, 2012). 분석법 개발 시, HPLC 분석 조건을 최적화하기 위해 배추의 시료량, 추출 용매(4종류)의 첨가량, 에탄올과 KOH 용매의 추출온도 및 시간을 달리하여 추출실험을 진행하였다. 상기 카로티노이드 추출과정을 간단하게 설명하면, 배추 시료를 각각 100, 200, 500 mg, 1, 2, 5 g씩 6가지로 칭량하고, 에탄올, KOH, water, 헥산 등 추출 용매 첨가량(시료량별 2가지)을 다르게 하였다(Table 1). 그 결과, 1 g 이상의 시료에서는 시료량이 많아 시료와 용매가 충분하게 혼합되지 않았다. 따라서 추출이 잘 되지 않는 1 g 이상의 시료를 추출방법에서 제외하였다. 또한, 500 mg-II는 hexane의 양(5 mL)이 많아 농축 시 시간이 오래 걸려 다량 추출방법으로 적당하지 않아 제외하였다.
[Table 1.] Extraction conditions of carotenoid analysis from Chinese cabbage
Extraction conditions of carotenoid analysis from Chinese cabbage
최적 추출 조건은 HPLC 분석 정량결과(Table 2)를 바탕으로 500 mg의 시료를 에탄올(5.0), KOH(1.5), 물(2.5), 헥산(2.5 mL)으로 추출한 것이 다른 시료에 비해 오차가 적고 추출 및 농축 시 조작이 용이하므로 이 방법으로 결정하였다. 특히 200 mg-II 시료를 사용한 분석 결과가 더 좋았으나 감압농축 시 조작 편이성 때문에, 헥산 양을 충분히 첨가할 수 있는 500 mg 시료를 사용하기로 결정하였다.
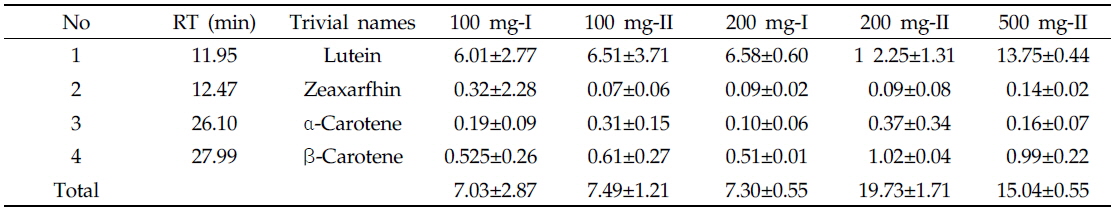
Carotenoid contents (mg/kg dry wt.) in Chinese cabbage at various extraction solvent volume and sample amounts (n=3)
토마토 내 카로티노이드 분리를 위한 HPLC 분석조건은 Tuan 등(2012)으로부터 검출 파장과 이동상 용매 구배조건을 변형하였다. 분석 컬럼은 carotenoid 전용 컬럼인 YMC carotenoid C30 column (250 × 4.6 mm i.d., particle size 3.0 μm)을 장착하였고, 이동상 용매는 A [water: methanol=25: 75 (v/v)]과 B[ethyl acetate]를 사용하였다. 검출 파장은 454 nm, 온도는 40℃, 유량은 1.0 mL/min으로 설정하였다. 이동상 용매 B는 0분에 0%로 시작하여 20분에 70%로 증가시켰다. 24분에는 100%로 증가시킨 후, 24.1분에 0%로 급격히 감소시켜 30분까지 유지시켰다. 배추 시료를 분석한 결과, 라이코펜을 제외한 카로티노이드 4성분(루테인, 제아크산틴, 알파카로틴, 베타카로틴)의 피크가 모두 분리되어이 방법을 카로티노이드 분석법으로 선택하였다.
그렇지만 토마토는 카로티노이드 중 라이코펜을 다량 함유하고 있으므로
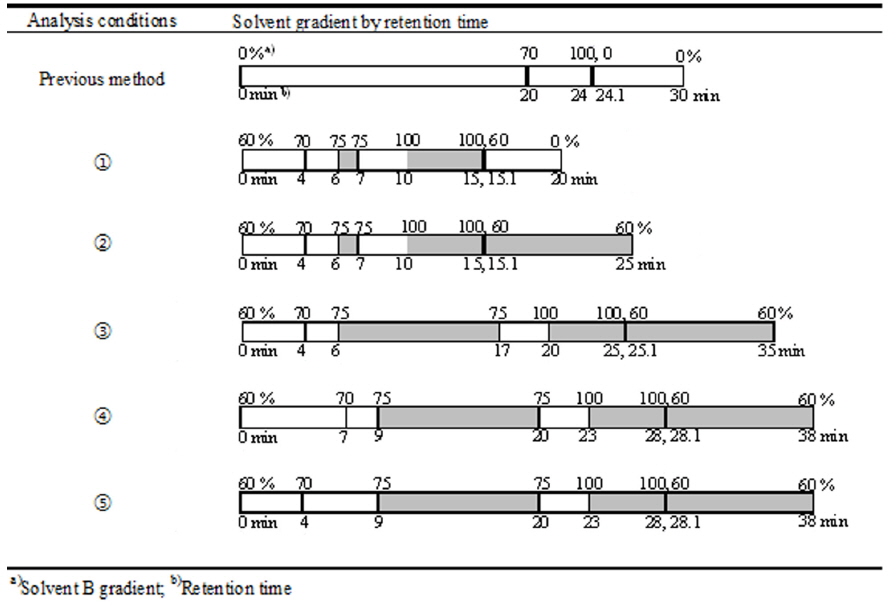
향후 토마토 기능성 성분을 평가하기 위해서는 카로티노이드 4성분(루테인, 제아크산틴, 알파카로틴, 베타카로틴) 뿐만 아니라 라이코펜 성분을 동시에 분석할 수 있는 분석법 개발이 절실하다. 따라서 본 실험에서는 확립한 상기 배추 내 카로티노이드의 HPLC 분석 방법을 바탕으로 토마토의 카로티노이드 5성분을 동시에 분석할 수 있는 HPLC 분석법을 확립하였다. 이를 위하여 다음과 같이 이동상 용매의 구배조건과 HPLC 분석시간을 조절에 따라 단계별[분석조건 ①-⑤]로 분석법을 검토하였다(Fig. 3).
가. [분석조건 ①] : 기존에 선택한 분석법에서 라이코펜을 제외한 카로티노이드 4가지 성분의 피크가 모두 20분 이후에 분리되므로, 이동상 용매 B[ethyl acetate]에 변화를 주어 총분석 시간을 단축시켰다. 이동상 용매 B를 60%로 시작하여 4분에 70%로 증가시킨 후, 6분에 75%로 증가시켜 7분까지 유지시켰다. 10분에는 100%까지 증가시켜 15분까지 유지시킨 후, 15.1분에 60%로 급격히 감소시키고 20분에는 0%로 감소시켜 주었다. 그 결과 라이코펜의 피크가 19.7분에 나타났다.
나. [분석조건 ②] : [분석조건 ①]로 분석한 결과, 분석 시간이 충분히 길지 않아 라이코펜의 피크가 분석 도중 끊겨 분석 시간을 증가시켰다. 이동상 용매 B를 60%에서 4분에 70%로 증가시키고, 6분에 75%로 증가시켜 7분까지 유지시켰다. 10분에는 100%까지 증가시켜 15분까지 유지시킨 후, 15.1분에 60%까지 급격하게 감소시키고 25분까지 유지시켜 주었다. 그 결과 라이코펜이 19.7분에 분리되었다.
다. [분석조건 ③] : [분석조건 ②]에서 완전히 분리되지 않은 루테인과 제아크산틴의 피크를 분리시키기 위해, 이동상 용매 구배조건을 변화시킴과 동시에 총 분석 시간을 증가시켰다. 이동상 용매 B를 60%로 시작하여 4분에 70%로 증가시키고, 6분에 75%로 증가시켜 17분까지 유지시켜주었다. 그 후에 20분에 100%까지 증가시켜 25분까지 유지한 후, 25.1분에 60%로 감소시켜 35분까지 유지하였다.
라. [분석조건 ④] : [분석조건 ③]에서도 분리되지 않은 루테인과 제아크산틴 피크를 분리하기 위해, 이동상 용매 B를 60%에서 7분에 70%로 증가시키고, 9분에 75%까지 증가시킨 후, 20분까지 유지시켰다. 23분에는 100%까지 증가시켜 28분까지 유지하고, 28.1분에 60%로 감소시켜 38분까지 유지시켰으나, 루테인과 제아크산틴 피크는 완전히 분리되지 않았다.
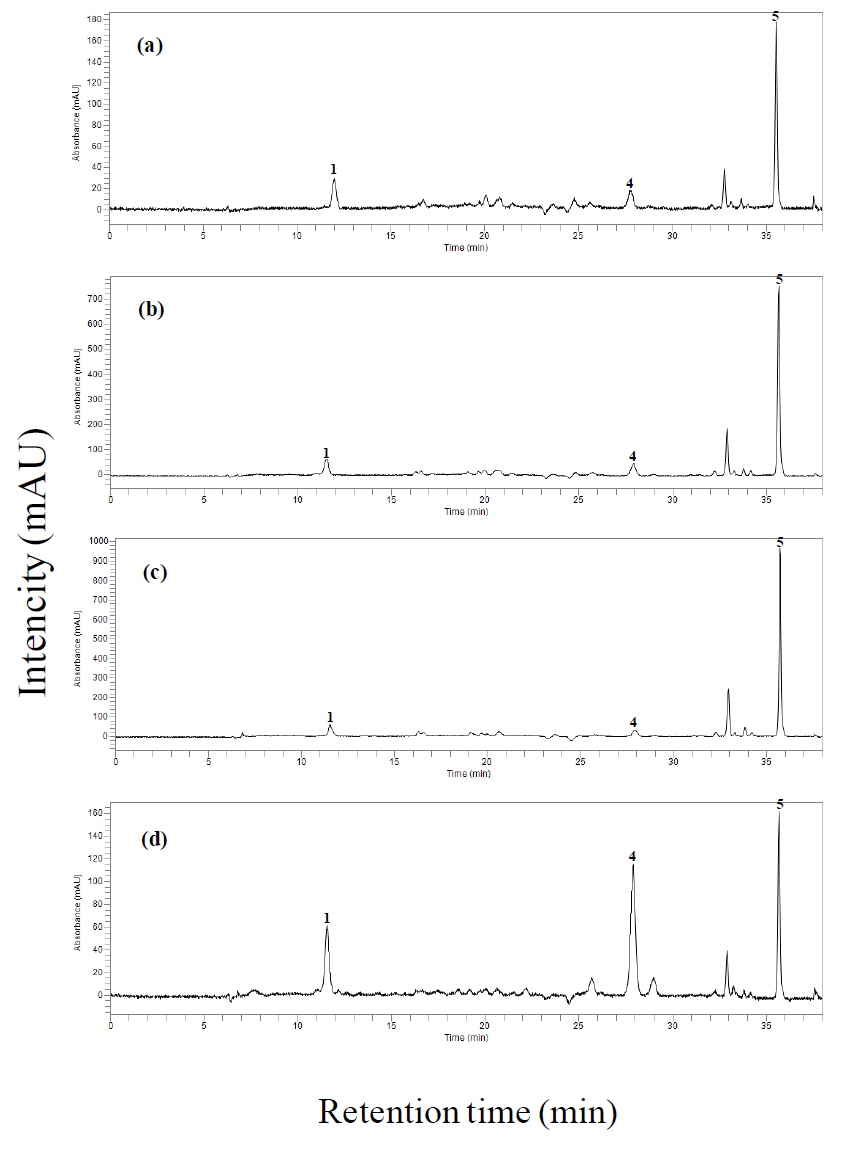
마. [분석조건 ⑤] : 이동상 용매 B를 60%로 시작하여 4분에 70%까지 증가시키고, 9분에 75%로 증가시켰다. 20분까지 유지시킨 후, 23분에 100%로 증가시켜 28분까지 유지시켰다. 28.1분에는 60%로 급격히 감소시켜 38분까지 유지하였다. 그 결과, 루테인은 11.6분, 제아크산틴은 12.2분, 알파카로틴은 26.2분, 베타카로틴은 27.9분, 라이코펜은 36.4분에서 분리되었다.
이동상 용매 B의 구배조건에 변화(60 → 100%)를 주어 분석한 결과, 카로티노이드 5성분 표준품의 피크가 모두 잘 분리된 [분석조건 ⑤]로 분석법을 확립하였다. 기 보고된 다른 분석법들은 여러 가지 용매를 혼합하여 제조하는 불편함이 있는 반면(Burns
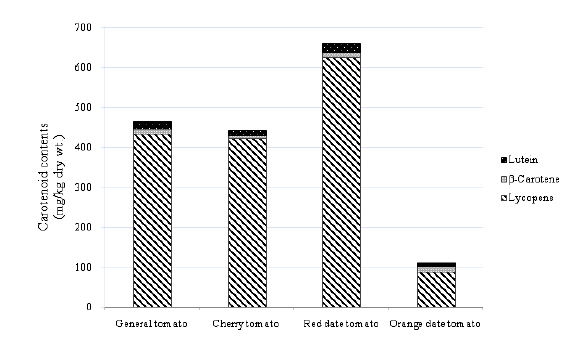
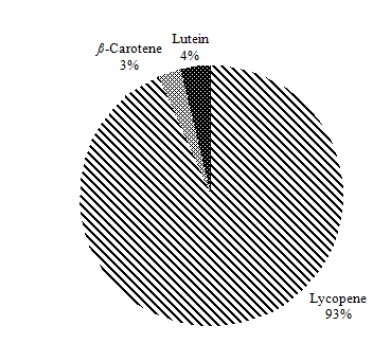
토마토 4종류(일반토마토, 방울토마토, 빨간색 및 주황색 대추방울토마토) 내 라이코펜을 분리하여 정량화하였다. 토마토에서는 라이코펜을 포함한 카로티노이드 5가지 성분(루테인, 제아크산틴, 알파카로틴, 베타카로틴, 라이코펜) 중 루테인, 베타카로틴, 라이코펜 3종류만 검출되었다(Fig. 4). 총 카로티노이드 함량은 빨간색 대추방울토마토(729.9) > 일반토마토(464.7) > 방울토마토(441.2) >주황색 대추방울토마토(111.3 mg/kg dry wt.) 순으로 높았고, 각 카로티노이드 성분별 함량은 라이코펜(4종류 토마토 평균값(392.3) > 루테인(15.6) > 베타카로틴(11.8 mg/kg dry wt.) 순으로 높게 나타났다(Table 3, Fig. 5). 4종류의 토마토 내의 총 카로티노이드 함량 중 평균적으로 라이코펜이 93%로 대부분을 차지하였고, 루테인은 4%, 베타카로틴은 3%를 차지하였다(Fig. 6).
루테인 함량은 일반토마토와 빨간색 대추방울토마토에서 다른 두 종류보다 조금 높은 것으로 나타났다. 베타카로틴은 주황색 대추방울토마토에서 15.6 mg/kg dry wt.로 다른 토마토 보다 다소 높았다. 라이코펜의 함량은 빨간색 대추방울토마토(626.2) > 일반토마토(433.0) > 방울토마토(422.6) > 주황색 대추방울토마토(87.4 mg/kg dry wt.) 순으로 높게 나타났고, 빨간색 대추방울토마토는 주황색 대추방울토마토보다 약 7.2배 높았다. 가장 짙은 붉은색을 띈 빨간색 대추방울토마토(626.2)에서 라이코펜 함량이 다른 세 종류의 토마토보다 상대적으로 높게 나타났고, 주황색 대추방울토마토(87.4 mg/kg dry wt.)에서 가장 낮게 나타났다. 이러한 결과는 라이코펜이 짙은 붉은색을 띄게 하는 색소이므로, 상대적으로 붉은색 색소를 적게 가지고 있는 주황색 대추방울토마토에서 함량이 다른 토마토에 비해 낮게 나타난 것으로 생각된다(Gomez-Prieto
본 실험에서 일반토마토 내 라이코펜 함량이 Markovic 등(2006) 보다 높게 나타났고(50.3 mg/kg wet wt.), 방울토마토 내 라이코펜 함량은 Toma 등(2008) 보다 낮게 나타났다(1,240 mg/kg dry wt.). Burns 등(2003)에서는 일반토마토 내 라이코펜 함량이 522.5 mg/kg dry wt.로 본 실험보다 조금 높게 나타났으나, 총 카로티노이드 함량 중 차지하는 비율은 58%에 불과했다. 이는 본 실험에서는 포함하지 않은 카로티노이드 성분 phytoene이 다량 포함되어 있어 총 카로티노이드 함량 대비 라이코펜의 함량은 낮아진 것으로 보인다. Sun 등(2012)에서는 토마토가 성숙함에 따라 라이코펜 함량은 0 → 250 mg/kg fresh wt.까지 증가했으며, 총 카로티노이드 함량 또한 0 → 300 mg/kg fresh wt.까지 증가하였다. 이와 같은 결과는 과실의 성숙 정도에 따라 카로티노이드 함량이 증가하기 때문에, 토마토 내 라이코펜 함량이 차이를 보이는 것으로 생각된다.