In korea, sweet persimmon(Diospyros kaki) cultivation is front to abiotic stresses such as frost damage at fruit maturing stage. The cold and rapid freezing stresses are most damaging to fruit production which is most actively progressed in late fall. This study was performed to evaluate the validity of chlorophyll fluorescence imaging(CFI) technology to determine the degree of frost damage in sweet persimmon fruits.
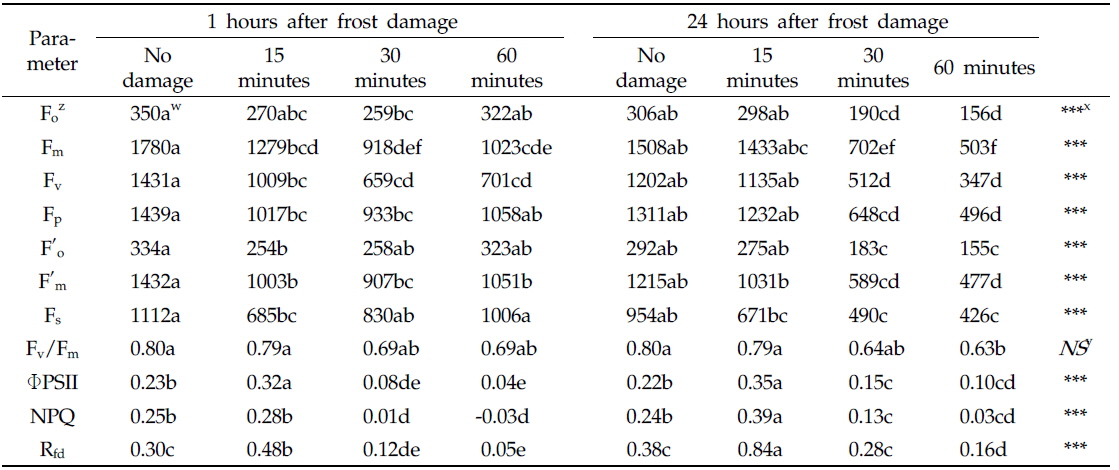
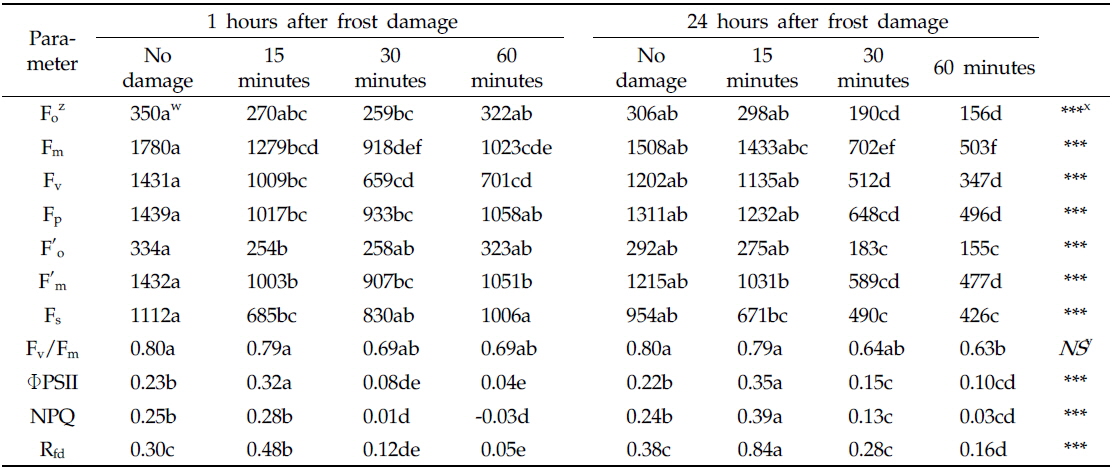
The sweet persimmon fruits were measured separately for each treatment(15, 30, 60 minutes) at 24 hours after treatment(HAT) rapid freezing. A CFI FluorCam (FC 1000-H, PSI, Czech Republic) was used to measure the fluorescence images of the fruits. In rapid freezing for 15 minutes, photochemical parameters were not changed. However, in rapid freezing for 30 and 60 minutes, photochemical parameters were lowered. Especially, Fm, Fv, Fv/Fm and ΦPSII values were declined under rapid freezing.
In our study, it was clearly indicated that the rapid freezing could be a stress in sweet persimmon fruits. The CFI analysis and its related parameters are applicable as a rapid assessing technique for the determination of frost damage.
지구 온난화로 인해 평균 기온의 뚜렷한 상승 경향이 보이고 있으나, 이러한 현상은 지역별로 일관되지 않고 기온의 상승폭이 다양하게 나타나고 있으며, 기후변화에 따른 이상기상 현상이 보다 빈번히 발생하고 있다(Lee
최저 기온의 상승으로 우리나라 대부분의 지역에서 서리현상일수가 감소하는 추세에 있으나 몇몇 지역의 경우 오히려 증가(Kwon, 2006)하는 것으로 보고되었으며, 국지적으로 발생하는 이상저온으로 인한 농작물의 피해가 우려되고 있는 실정이다.
과수의 경우 개화기 및 수확기를 전후한 서리나 저온 등 동상해로 인해 과실의 품질저하가 발생한다. 단감 재배는 수확시기의 첫서리 피해가 문제되고 있으며, 과육이 물러지며 과실의 저장성 및 상품성이 저하 되는 등의 문제가 발생한다(Hwang
최근에는 기후변화에 따른 한발, 동상해 등 기상이변으로 인한 농작물 피해를 예측, 평가하는데 기상자료(Kwon, 2006; Lee
엽록소 형광 현상은 Kautsky와 Hirsch(1931)의 광합성 과정 중 빛의 섬광에 의한 CO2 흡수동화의 변화원인에 대한 연구에서 비롯되었으며, 비파괴적 방법을 통한 식물체의 비생물학적 스트레스(abiotic stress) 지표 및 건전생장에 관한 정량적인 평가를 할 수 있는 분석법이다. 지금까지 chlorophyll a의 형광현상을 응용하여 광합성 기구의 일련반응을 해석하려는 연구가 많이 시도되어 왔다(Govindjee, 1995; Strasser
엽록소 형광 이미지(Chlorophyll fluorescence imaging) 분석법을 이용해 비생물학적 스트레스에 대한 광화학적 생리지표 연구가 활발히 이루어 졌으며, 현재 광합성계 II(PSII) 광화학반응에서의 최대 양자수득률을 나타내는 변수(Fv/ Fm Ratio)가 보편적으로 활용되고 있다(Govindjee, 1995, 2004).
엽록소 형광 이미지 분석 기술은 식물의 잎뿐만 아니라 과일 색소(Pigment)의 광화학 반응 측정 및 광합성 능력 평가가 가능한 것으로 보고되었다(Nedbal and Whitmarsh, 2004; Zushi
지금까지 저온 및 고온 스트레스에 의한 엽록소 형광 반응 연구는 주로 식물의 잎(Wahid and Gelani, 2007; Ogweno
본 연구에서는 엽록소 형광 이미지 분석 기술을 이용하여 단감의 급속 냉각에 따른 광화학 반응 해석 및 동상해 평가에 활용하기 위해 실시하였다.
동상해가 과실에 미치는 영향을 측정하기 위해 시중에 유통되는 단감 ‘부유’를 경기도 안성의 마트에서 구매 후 1일간 냉장(4℃) 보관하였다.
동상해 처리는 드라이아이스(Dry ice)를 단감 상단 중앙에 올려놓은 후 15분, 30분 및 60분간 급속 냉각하였다. 이때, 드라이아이스가 완전히 승화되기 전 5분 간격으로 교체하여 냉각 처리가 유지되도록 하였다.
>
엽록소 형광 이미지(Chlorophyll Fluorescence Imaging) 측정
단감의 동상해 처리 전, 처리 후 1시간, 처리 후 24시간 간격으로 엽록소 형광 이미지 측정기(FC 1000-H, PSI, Czech Republic)을 이용하여 암적응(엽록소 형광분석기 챔버에서 30분간 암처리) 상태에서 Quenching kinetics analysis 방법으로 측정하였다(Genty
측정된 엽록소 형광 매개 변수는 FluorCam version 7.0(PSI, CZ)을 이용해 Gorbe 등 (2012)이 제시한 방법에 의해 분석하였다(Table 1).

Summary of the Chlorophyll fluorescence parameters (modified from Gorbe et al’s data, 2012)
통계분석은 SAS package version 9.02(SAS Institute Inc., USA)을 이용하여 동상해 처리별 광화학 반응 비교를 실시하였다.
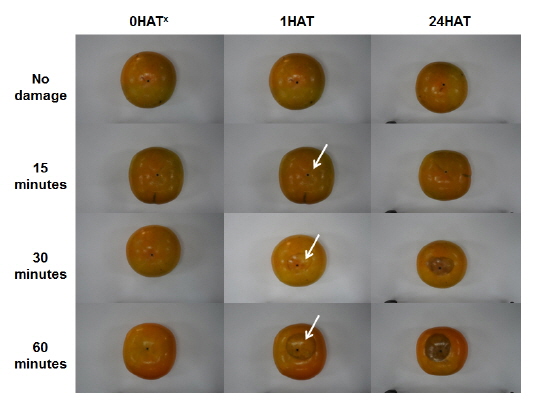
단감‘부유’의 동상피해 평가를 위해 급속 냉각 처리 30분 및 60분 처리하여 상온 보관한 과실의 외형 변화를 조사한 결과 1시간 후 수침상이 나타났으며, 24시간 후 짙은 갈색으로 변하는 것으로 나타났다(Fig. 1).
그러나 본 연구의 15분 냉각 처리한 과실에서는 뚜렷한 변화가 없었으며, 수침상 및 변색은 60분 처리구 과실에서 더 큰 변화가 일어남을 확인하였다.
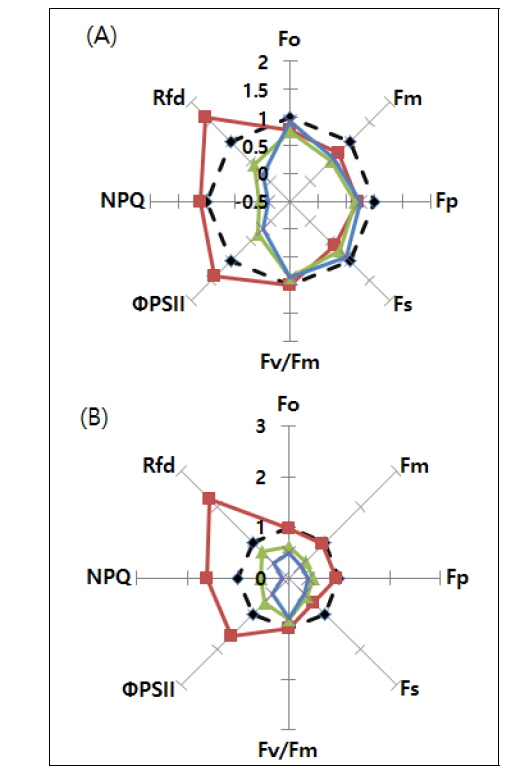
엽록소 형광 이미지(CFI)는 각각의 매개변수(Parameter) 형광 강도에 의한 색의 변화를 근거로 하여 분석 하였다(Fig. 2). 이때, 각 처리구 단감의 형광 강도 범위 내에서 파란색은 형광 강도가 가장 낮고 붉은색의 형광 강도가 가장 높음을 나타낸다.
본 연구에서 냉각 처리한 단감의 암적응 최소 형광량(Fo)는 0~500, 암적응 최대 형광량(Fm), 암적응 광계II 최대 양자수율(Fv/Fm), 명적응 광계II 광화학 에너지 전환 효율(ΦPSII) 및 비광화학적 소광(NPQ)는 0~1.0, 그리고 엽록소 형광 감소율(Rfd)는 0~3.0의 범위에서 분포하였다.
냉각 처리 1시간 후 Fo는 모든 처리구에서 변화가 없었으나, 30분 냉각 처리구의 엽록소 형광 이미지(Fm, Fv/Fm, ΦPSII, NPQ, Rfd)에서 과실 상단 중앙에 타원형의 형태로 파란색으로 변해 동상피해를 받았음을 확인했다.
그러나 60분 냉각 처리구에서는 1시간 후 Fv/Fm ratio를 제외한 형광 매개변수에서는 뚜렷한 변화가 나타나지 않았으며, 24시간 후 피해 유무를 확인할 수 있었다. 이는 60분 냉각 처리한 부분은 물론이고, 그 주변까지 냉기 피해를 받아 모든 부위가 광화학적 활성이 낮아진 결과 이미지상 확인이 어려운 것으로 판단된다.
무피해과(no damage)와 냉각 피해과의 암적응 최소(Fo), 최대(Fm) 및 변동(Fv) 형광량을 비교 분석하였다(Fig. 3A, B). 15분 냉각 처리한 단감은 엽록소 형광 이미지에서 냉각 피해 확인이 어려웠으나 형광량을 정량화한 분석에서 처리 1시간 후의 Fo, Fm, Fv 형광량에서 각각 23~29% 감소했고, 24시간 후 무피해과 수준으로 회복하였다. 그리고 30분과 60분 냉각처리한 단감의 1시간 후 Fo, Fm, Fv 형광량은 동일한 감소 경향을 보였으며, Fm과 Fv 형광량이 크게 감소(43~54%)하는 것으로 나타났다.
냉각 피해과의 Fo, Fm 및 Fv 형광량은 무피해과에 비해 크게 감소(
Comparison of photochemical parameters in the sweet persimmon fruits under different frost damage conditions
광계II 암적응 최대 양자수득률(Fv/Fm ratio)은 15분 냉각 처리구에서는 0.79 범위에서 변화가 없었다. 그러나 30분 및 60분 처리구에서 24시간 후 각각 19%, 21% 감소하며, 매우 낮은(0.63~0.64) Fv/Fm ratio를 보였다(Table 2).
일반적으로 건전한 식물의 광계II 암적응 최대 양자수득률(Fv/Fm ratio)은 0.8 내외로 알려져 있다(Baker, 2008). 그러나 0℃ 이하의 온도 조건에서 Fv/Fm ratio가 감소한다는 연구 결과도 보고되었다(Devisscher and Malek, 1993; Adams and Perkins, 1993). 대부분의 식물에서 Fv/Fm ratio는 비생물학적 스트레스에 대한 광억제 현상 등의 스트레스 생리지표로 활용되고 있으며(Bjorkman and Demmig, 1987; Johnson
명적응 단계의 광계II 광화학 에너지 전환 효율(ΦPSII)에서도 30분 및 60분 처리구의 Fv/Fm ratio와 유사한 감소(32~54%) 경향을 보였으며, 15분 처리구에서 무피해과(0.22)에 비해 오히려 40% 증가(0.35)하였다.
일반적으로, 비광화학적 소광(NPQ)는 광화학 에너지 전환 과정 중 발생하는 광합성 기구의 에너지 손실을 의미하며, 스트레스 조건에서 증가하는 것으로 알려져 있다(Genty
그러나 본 연구에서 냉각 처리한 단감의 비광화학적 소광(NPQ)은 15분 냉각 처리구에서 무피해과(0.24)에 비해 60% 증가했고, 30분 및 60분 동안 냉각 처리한 단감은 각각 46%, 87% 감소하는 것으로 나타났다(
엽록소 형광 감소율(Rfd ratio)은 온도, 광, 산소 및 수분 등 환경변화에 의한 광화학 기구의 소광 및 전자전달 속도 등과 관련하여 식물의 건전성을 평가할 수 있는 매개변수(Lichtenthaler and Rinderle, 1988; Bolhar-Nordenkampt and lechner, 1988)로서 무처리구 및 15분 냉각 처리한 과실에서는 증가했으며, 30분 이상의 냉각 처리에 의해 급격히 감소하며 이후 회복되지 않았다(
본 연구는 엽록소 형광 이미지(CFI) 분석 기술을 활용해 단감‘부유’의 동상피해 평가의 적용 가능성을 알아보기 위해 실시하였다. 동상 피해과의 엽록소 형광 이미지 측정한 결과 15분 냉각 처리한 단감에서는 뚜렷한 피해 현상을 확인할 수 없었으며, 30분 및 60분 냉각 처리한 단감에서 동상 피해 부위에서 광화학 에너지 감소로 인한 색의 변화가 나타났다. 또한, 광화학적 매개변수(Parameter) 분석 결과 냉각 처리구 (15분, 30분, 60분)에서 공통적으로 Fo, Fm, Fv가 감소했으며, Fv/Fm ratio, NPQ 및 Rfd는 30분과 60분 냉각 처리구에서 감소하는 것으로 나타났다. 따라서 Fo, Fm, Fv, Fv/Fm ratio, NPQ 및 Rfd 등 6개의 매개변수가 단감의 동상해에 대한 광화학 생리지표로 활용 가능한 것으로 판단된다.
또한 Fo, Fm 및 Fv는 동상해에 대해 민감하게 반응하며 약한 수준의 동상해에도 적용 가능할 것으로 사료되었다.