Digital microfluidic electroporation system was used for the transformation of microalgae and we have obtained higher transformation efficiency and viability than that of conventional method. Key parameters of electroporation such as pulse voltage, number, and duration time were systematically investigated for two different microalgal strains with and without cell wall. We have found that cell wall does not always have negative effects on the gene transformation of microalgae. Parallel processing of proposed digital microfluidic electroporation was demonstrated together with on chip culture of microalgae.
최근 청정 기술로써 미세조류를(microalgae) 활용한 연구가 많은 주목을 받고 있다. 미세조류는 복잡한 재조합 단백질 합성 등 대장균 등의 하등 세포로는 만들기 어려운 생체 물질을 생산할 수 있는 능력이 있어 새로운 생물공학 균주로서 가능성이 높다[1]. 또한 미세조류는 식물세포이기 때문에 온실 가스로 문제가 되고 있는 이산화탄소를 소모하여 석유를 대체할 수 있는 오일을 생산할 수 있는 뛰어난 능력이 있다[2,3]. 하지만 이러한 미세조류의 청정 기술로써의 가능성을 높이기 위해서는 자연 상태의 미세조류 종을 그대로 사용하기보다 대사공학적 접근을 통한 형질전환 등을 통해 보다 생산성이 높은 우량형 미세조류를 확보하는 것이 매우 중요하다[3].
미세조류는 다른 세포 종에 비해 형질전환 관점에서 어려운 점이 많다. 우선 미세조류는 단세포 생물이면서 부유 세포(suspension cell)이기 때문에 일반적인 부착형 세포(adherent cell) 대비 형질전환 효율이 낮다[4]. 또한 미세조류는 모든 식물 세포들과 마찬가지로 세포벽이 존재하기 때문에 외부 DNA를 전달하는 데 있어 세포벽이 없는 세포 종 대비 매우 불리하다. 더욱이 수억 년 이상 유전 정보를 유지해 왔던 생물학적 특성 때문에 DNA가 세포핵 내부로 전달되어 형질전환이 일어나더라도 이전에 가지고 있던 유전정보를 복원하는 능력이 뛰어나 형질전환이 실패하는 세포적 특징도 보이는 세포종이다. 최근 많은 연구자들이 유전자총(gene gun), 전기천공 등 다양한 형질전환 방법을 시도하고 있으나 위에 언급된 어려움들 때문에 만족할 만한 결과를 얻고 있지 못한 실정이다[5]. 따라서 미세조류 형질전환을 위해 보다 효율적인 유전자 전달 및 형질전환 방법론을 개발하는 것이 필요하다.
미세조류의 형질전환 방법 중 전기천공 방법이 많이 사용되고 있다[5]. 전기천공은 전기 펼스를 이용해 세포막에 일시적인 천공을 만든 후 전기장을 이용해 음전하를 띄는 외부 DNA를 세포 내로 전달하는 방법이다. 생물학 분야에서는 이미 20년 넘게 사용되어 온 방법으로 상용화된 전기천공 장치가 많이 사용되고 있다. 하지만 기존 상용화 전기천공 장치의 경우 높은 전압의 사용으로 수 암페어에 이르는 많은 전류가 세포 배양액을 통해 흐르기 때문에 세포 생존율이 낮고 상대적으로 DNA 전달 효율도 높지 않은 단점들이 있다. 최근 이러한 상용화 전기천공 장치의 단점들을 극복하기 위해 미세유체를 활용한 연구가 진행되고 있다[6]. 미세유체의 경우 시스템의 크기가 매우 작기 때문에 작동 전압과 전류를 획기적으로 낮추어 기존 문제점들을 근본적으로 해결할 수 있는 장점이 있다. 하지만 지금까지의 미세유체 전기천공 시스템은 매우 적은 수의 세포를 다루기 때문에 수천만에서 수 억 개에 이르는 세포 수를 요구하는 생물 실험에는 적용하기 어려운 한계가 있어 실제 활용되는 예는 극히 드문 실정이다.
최근 액적 접촉충전 기반의 디지털 미세유체 기술은[7-14] 기존의 상용화 장치와 미세유체 전기천공 문제점들을 모두 해결할 수 있는 가능성이 있다. 액적 접촉충전 기반 디지털 미세유체에서는 1 mm 크기의 수용액적을 전극에 직접 접촉 충전 시켜 액적을 구동하기 때문에 상용화 장치 대비 인가 전압과 전류를 크게 줄일 수 있다. 또한 하나의 액적 내에 최대 백만 개의 세포를 담아 실험하는 것이 가능하기 때문에 기존 미세유체 전기천공의 한계인 낮은 수율 문제를 해결하는 것 또한 가능하다.
따라서 본 연구에서는 액적 접촉충전 기반의 새로운 디지털 미세유체 기술을 세포벽이 있는 미세조류 형질전환에 활용해 보고자 한다. 특히 본 연구에서는 기존 방법론 대비 높은 효율성을 확인하기 위해 세포벽이 있는 와일드 타입의 미세조류를 활용한 형질전환 연구를 세포벽이 없는 돌연변이종과 비교함으로써 미세조류 형질전환에 있어 세포벽의 역할 및 영향 분석을 통해 관련 분야에 가이드를 제시하고자 한다. 이를 위해 전기천공의 주요 조건인 인가전압의 세기, 전기 펄스의 수 및 지속 시간 등 전기천공 변수에 따른 변화를 고찰하여 체계적인 분석을 수행하였다. 또한 충분한 수율 확보를 위한 병렬화 및 온 칩 상에서의 배양을 통한 집적화 시스템 가능성을 확인하고 향후 기술의 개발 방향에 대해서도 논의하고자 한다.
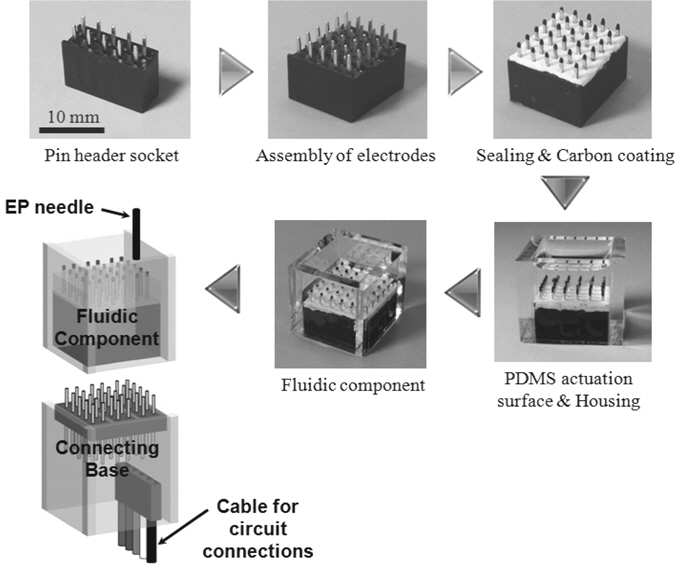
액적 접촉충전 기반 디지털 전기천공 시스템을 구성하는 미세유체 장치의 제작은 Figure 1에 나타난 바와 같다. 액적 구동을 위한 장치의 제작 및 구성은 기본적으로 이전 디지털 전기영동 시스템과 동일하다[11]. 하지만 전기천공을 위해서는 액적이 두 전극 사이에 연결된 상태로 전류가 흘러야 하기 때문에 Figure 1에 나타낸 바와 같이 전기천공 용 전극(EP needle)이 추가된 것이 이전 시스템과의 차이점이다.
미세조류 형질전환 실험에 사용된 세포는 미세녹조류 분야에서 유전자 정보가 잘 알려져 있고 많은 사람들에 의해 연구되어 온 모델 세포종인 Chlamydomonas reinhardtii가 사용되었다. 세포벽의 영향을 살펴보기 위해 본 연구에서는 Chlamydomonas reinhardtii 중 세포벽이 존재하는 야생종(cc-125)과 형질전환을 통해 세포벽이 없는 돌연변이 종(cc-503) 두 종에 대해 형질전환 실험을 수행하였다. 형질전환 실험에 사용된 DNA는 노란색 형광 단백질(yellow fluorescence protein, YFP)을 합성할 수 있는 gene을 미세녹조류 안에서 발현 가능하도록 고안된 벡터에 삽입해 제작한 plasmid DNA를 사용하였으며 형질전환 효율은 각 세포에서 발현된 YFP의 양을 유세포 분석기(fluorescence activated cell sorter, FACS)를 통해 정량화한 값을 바탕으로 계측하였다.
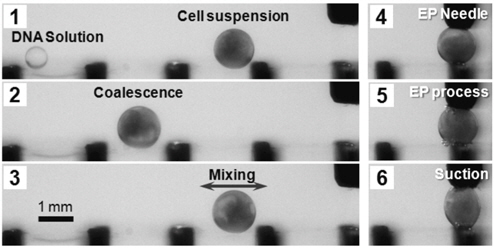
전기천공 실험 한 번에 사용된 세포의 양은 1 × 106개로 디지털 전기천공의 경우 세포 배양액을 10 µL로 하고 상용화 전기천공 장치의 경우 배양액은 500 µL를 사용하여 두 실험에서 사용되는 총 세포의 수를 동일하게 유지하였다. 실험에 사용된 DNA의 양은 1 µg으로 해당 plasmid DNA 약 1.37 × 1011개에 해당하는 양을 한 번의 전기천공 실험에 사용하였다(세포 하나 당 DNA 대략 10만개 사용). Figure 2에는 디지털 전기천공 실험 과정이 예시되어 있다. 준비된 세포와 DNA를 액적의 형태로 공급 후 병합/혼합을 한 뒤 전기천공 용 전극(EP needle)에 위치시키고 일정 크기의 전압 펄스를 인가하여(자세한 천공조건은 결과에서 논의) 전기천공을 수행하였다. 전기천공이 완료된 액적은 EP needle에 연결된 주사기를 통해 수집 후 분석을 위한 세포 배양 과정을 수행하였다. 디지털 전기천공 방법의 효율성 비교를 위해 상용화 전기천공 실험도 수행하였으며(Bio-Rad gene pulser xcell) 디지털 전기천공 조건에 해당하는 (동일 전기장) 조건 하에서 실험을 수행하였다.
각각의 조건들 하에서 전기천공 실험된 세포들은 각각 1 mL 배양액에 담겨 하루 동안 식물생장기(plant growth chamber) 내에서 배양되었다. 각 실험 조건 하에서의 형질전환 결과는 FACS를 통해 계측하였으며 세포의 생존도(viability)는 Trypan blue 염색을 이용해 측정하였다.
3.1. Confocal microscope를 통한 형질전환 확인
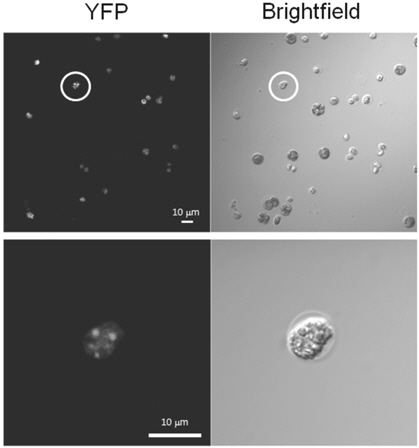
전기천공을 통한 형질전환 결과는 FACS를 이용해 계측하였으나 죽은 세포에서의 형광 발현문제 등 광학적 분석 방법의 한계로 개별 세포 내에서의 단백질 발현 유무를 확인하는 것이 필요하다. 따라서 본 연구에서는 Figure 3에 나타난 바와 같이 공초점 현미경(confocal microscope)을 이용해 살아있는 세포 내에서 YFP 형광 단백질의 발현을 확인하였다.
일반적으로 세포벽이 존재하는 cc-125 종의 경우, 형질전환을 위해 세포벽을 제거하는 공정을 거치는 것이 보통이다. 하지만 본 연구의 방법론이 전달 효율이 높기 때문에 이러한 과정을 생략하였으며 Figure 3에 나타난 바와 같이 성공적으로 세포벽의 제거 없이 전기천공을 통한 YFP gene의 전달 및 YFP 단백질 발현을 확인할 수 있었다.
3.2. 전기천공 조건에 따른 형질전환 효율 결과 비교
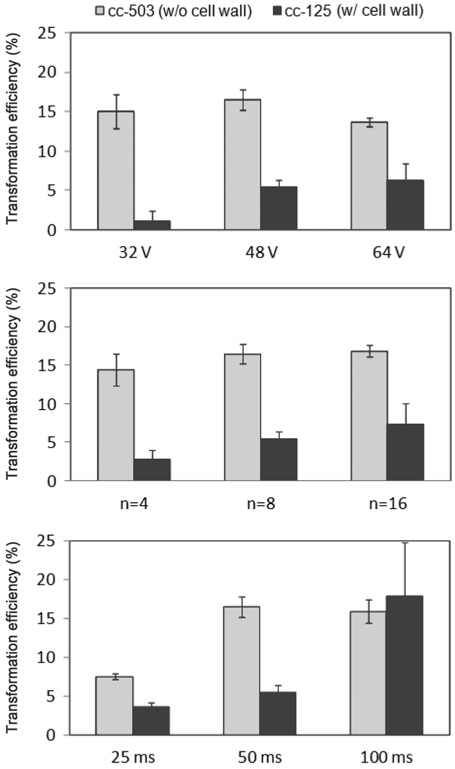
전기천공 파라미터 중 가장 주요한 요인은 인가전기장의 크기와 전기펄스의 인가 시간이다. 따라서 본 연구에서는 가해준 전압의 세기(32, 48, 64 V), 전기펄스의 횟수(n=4, 8, 16), 그리고 전기펄스의 지속시간(25, 50, 100 ms) 들을 변화시키며 두 종류의 미세녹조류에 대한 전기천공 실험을 수행하였다. Figure 4에는 각각의 조건들 하에서의 FACS를 이용한 형질전환 계측 결과들이 나타나 있다.
전체적으로 인가전압이 높을수록 그리고 전압인가 시간(횟수, 지속시간)이 길수록 높은 형질전환 경향을 나타내었다. 하지만 세포벽의 유무에 따라 다소 다른 경향도 나타났다. 세포벽이 없는 cc-503의 경우 인가전압 48 V에서 형질전환 효율이 최고치를 나타낸데 비해 세포벽이 있는 cc-125는 인가전압에 비례해 형질전환 효율이 증가하는 경향을 나타냈다. 인가시간(횟수, 지속시간)의 경우 세포벽이 없는 cc-503의 경우 기준 조건(n = 8, 50 ms) 이상에서는 형질전환 효율이 횟수나 지속 시간을 늘려도 정체되는 경향을 보이는 반면 세포벽이 있는 cc-125의 경우 횟수나 지속시간에 비례해 형질전환 효율이 증가되는 경향을 나타냈다. 특히 지속시간 조건 100 ms에서 획기적으로 전환 효율이 증가되어 인가시간 중 횟수의 증가보다는 펄스의 지속시간의 증가가 더 효율적인 것으로 나타났다.
위 결과에 나타난 바와 같이 미세조류의 형질전환 실험에서 세포벽의 유무가 전기천공 조건에 따른 다른 경향을 나타냄을 확인할 수 있었다. 세포벽은 DNA 전달에 있어 방해물로 작용하기 때문에 Figure 4에 나타난 바와 같이 세포벽이 없는 cc-503의 형질전환 효율이 세포벽이 있는 cc-125의 결과보다 높게 나타난다. 하지만 펄스의 지속시간 100 ms 조건에서는 cc-125의 효율 결과가 cc-503보다 높게 나타나 전기천공 조건에 따라서는 세포벽이 있는 세포종에의 DNA 전달 효율이 더 높게 나타날 수도 있음을 확인할 수 있었다.
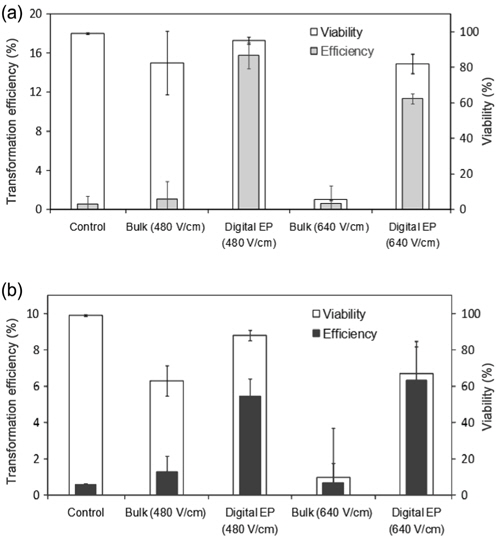
전기천공 형질전환에서 세포벽의 영향을 비교 분석하기 위해 Figure 5에는 두 미세녹조류 세포종에 대한 형질전환 결과와 생존도(viability) 결과를 도시하였다. 대조군 실험 결과는 YFP gene을 포함한 plasmid DNA를 추가한 세포 배양액 내에서 전기천공 과정을 거치지 않고 하루 동안 배양한 결과로 인위적인 방법이 아닌 자연적인 DNA 전달에 의한 발현 결과에 해당한다. 상용화 장치를 이용한 실험에서는 디지털 미세유체 실험과 동일한 전기장 하에서 전기천공을 수행하였다. 디지털 미세유체 시스템의 형질전환 결과는 상용화 장치 대비 최대 10배에 달하는 높은 효율을 보였으며 세포의 생존도 역시 높게 나타나 형질전환 방법으로 매우 뛰어난 성능을 확인할 수 있었다. 이는 본 디지털 미세유체 시스템이 상용화 장치 대비 크기가 작아 인가전압이 낮아지고 전극과 접촉하는 세포 배양액의 면적이 줄어 든 덕분으로 낮은 전류가 흘러 전기 천공의 부작용인 과도한 전류에 의한 문제가 최소화되었기 때문인 것으로 판단된다.
인가된 전기장의 세기가 480 V/cm에서 640 V/cm로 높아짐에 따라 세포벽이 없는 cc-503의 경우 상용화 벌크 시스템에서 세포 생존율과 형질전환 효율이 급격하게 낮아진 반면 디지털 미세유체 시스템에서는 생존율과 전환 효율 모두 감소하기는 하였으나 일정 수준 이상을 유지하였다. 세포벽이 있는 cc-125의 경우 벌크 시스템에서의 경향은 다소 유사하였으나 디지털 미세유체 시스템에서는 형질전환 효율이 오히려 증가하는 경향을 나타냈다. 이는 앞선 Figure 4 결과 중 100 ms 펄스 지속시간의 경우와 유사한 경향으로 판단된다.
흥미로운 것은 상용화 벌크 시스템의 640 V/cm 조건에서 cc-125의 생존율과 전환 효율이 동일 조건 하에서 세포벽 없는 cc-503 대비 높게 나타난 것이다. 이는 Figure 4 100 ms 펄스 지속시간의 경우에서도 비슷하게 확인 되는 사실로 전기천공 조건에 따라서는 세포벽이 있는 세포종에서의 생존율과 형질 전환 효율이 더 높게 나타날 수도 있음을 시사하는 결과이다. 따라서 세포벽이 있는 식물세포의 형질전환에서 세포벽의 존재가 항상 부정적으로만 작용하는 것이 아니라 경우에 따라서는 형질전환에 긍정적으로 작용할 수 있음을 시사 하는 결과로 판단된다. 물론 이러한 해석은 사용되는 유전자 전달 방법이 두꺼운 세포벽을 뚫을 수 있을 만큼 충분한 전달 효율을 가진다는 전제 조건이 있을 경우에 한한다.
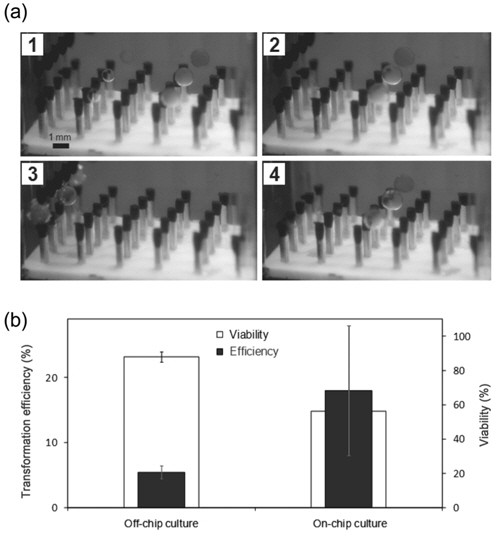
Figure 2에 예시된 실험에 사용된 액적의 크기는 2 µL로 FACS와 생존율 분석 등 세포 분석에 필요한 수의 세포를 얻기 위해서는 다섯 번의 반복 실험을 수행하여야 한다. 또한 많은 생물공학 실험들에서 Western blotting과 같은 분석을 위해서는 한 번에 수 억 개 이상의 세포 수 확보가 필요하다. 본 연구에서 시연한 디지털 미세유체 시스템의 경우, 하나의 액적 내에 담을 수 있는 최대 세포 수는 대략 백만 개 정도로 여러 생물학적 분석에 활용하기 위해서는 최소 다섯 번에서 많게는 수십 번의 실험을 반복해야 하는 문제가 있다. 따라서 이러한 문제를 해결하기 위해 본 연구에서는 디지털 미세유체 전기천공 시스템의 병렬화를 시도해 보았다.
Figure 6에는 한 번에 3개의 액적을 제어하여 동시에 전기천공을 수행한 실험 결과가 나타나 있다. 사진에 나타난 시스템의 생산성은 비록 기존 싱글 시스템 대비 세 배 밖에 증가되지 않았지만 액적 접촉충전 시스템은 구동 원리가 단순하기 때문에 전극의 개수를 늘림으로써 10배 혹은 그 이상 생산성이 높은 시스템을 구성하는 것이 가능하다. 본 디지털 미세유체 전기천공 시스템의 또 다른 장점은 세포들을 액적 단위로 다루기 때문에 전기천공 후 배양 과정을 칩 위에서 수행하는 것이 가능하다는 것이다. Figure 6(b)에는 이러한 아이디어를 실험을 통해 확인 한 결과로 Figure 6(a) 4번 사진에 보이는 상태로 칩 전체를 배양기 내에서 하루 동안 배양 후 형질전환 결과를 확인 한 결과, 세포의 생존율은 다소 낮아 진 반면 형질전환 효율이 전통적인 방법으로 배양한 세포 대비 높아지는 흥미로운 결과를 얻을 수 있어 향후 본 방법론의 새로운 세포 배양법으로의 응용 가능성을 확인할 수 있었다.
새로운 디지털 미세유체 전기천공 시스템을 활용하여 미세 녹조류 두 종에 대한 형질전환을 수행하였다. 제안된 디지털 전기천공 방법론은 기존 상용화 장치 대비 높은 유전자 전달 효율과 세포 생존도를 나타냄을 확인하여 향후 미세조류 형질전환에 유용하게 활용될 수 있음을 확인하였다. 특히 세포벽이 존재하는 세포종과 세포벽이 없는 세포종에 대한 비교 실험을 통해 식물 세포의 전기천공에서 세포벽의 역할은 단순히 유전체의 전달을 방해하기만 하는 부정적으로만 작용하는 것이 아니라 경우에 따라서는 세포의 활성도를 유지할 수 있는 보호막 역할을 수행하여 동일 조건 하에서 세포벽이 없는 세포종 대비 높은 세포 생존율과 유전체 전달 효율이 나타날 수 있음도 확인하였다. 이는 식물세포 형질전환 시 세포벽의 제거가 꼭 필요한 것은 아니며 세포벽을 뚫을 수 있는 충분한 전달 방법이 사용된다면 세포벽을 제거를 하지 않는 것이 더 효율적일 수도 있음을 시사하였다. 마지막으로 병렬화 및 온 칩 세포 배양 등을 통해 제안된 디지털 전기천공 기술이 적은 시료와 자원만으로도 형질전환이 가능한 새로운 청정 형질전환 방법으로써의 가능성도 확인하였다.