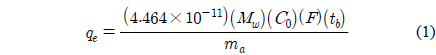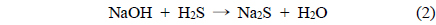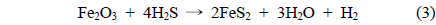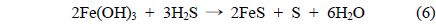Hydrogen sulfide and ammonia are one of the common malodorous compounds that can be found in emissions from many sewages treatment plants and industrial plants. Therefore, removing these harmful gases from emissions is of significance in both life and industry because they can cause health problems to human and detrimental effects on the catalysts. In this work, pyrolytic carbon blacks from waste tires were used to develop adsorbent with good adsorption capacity for removal of hydrogen and ammonia. Pellet-type adsorbents were prepared by a mixture of carbon black, metal oxide and sodium hydroxide or hydrochloric acid, and their adsorption capacities were estimated by using breakthrough curve of a continuous fixed bed adsorption column at ambient condition. The adsorbent manufactured with a mixture of carbon black, iron oxide(III) and sodium hydroxide showed the maximum working capacity of hydrogen sulfide. For ammonia, maximum working capacity was obtained by the adsorbent manufactured with a mixture of carbon black, copper oxide(II) and hydrochloric acid.
악취방지법 제2조에서 악취란 “황화수소, 메르캅탄류, 아민류, 그 밖에 자극성이 있는 물질이 사람의 후각을 자극하여 불쾌감과 혐오감을 주는 냄새”라고 규정하고 있다. 일반적으로 악취는 한 가지 물질의 냄새라기보다는 여러 물질이 섞여나는 냄새인 경우가 대부분이며, 악취는 대기오염의 기본적인 단서로서 사람들을 감정적으로 자극한다. 따라서 악취는 여러 가지 성분이 혼합된 상태로 존재하면서 사람의 후각을 자극하여 사람의 쾌적한 정서생활과 건강에 피해를 주는 감각오염의 한 형태이다. 악취의 원인 물질은 하수, 공장폐수, 분뇨, 음식물 찌꺼기 등의 유기성 폐자원물에서 미생물이 단백질 분해효소 작용에 의해 단백질을 분해할 때 주로 생성되는 물질이다. 악취물질들은 무기화합물과 유기화합물로 구별할 수 있는데, 무기화합물로는 황화수소(H2S)와 암모니아(NH3)이며 유기화합물로는 메르캅탄, 황화물, 아민류, 인돌(Indole), 스카톨(Skatole), 유기산, 알데히드류, 케톤류 등이 있다[1]. 일반적으로 악취물질은 오폐수처리시설, 하수관거 및 개인하수처리시설 등 하수도시설에서 발생하여 생활환경으로 확산하는데, 이들 중 주요 악취물질은 황화수소와 암모니아이다. 황화수소는 환경기초시설 및 공공시설 대부분의 환경에서 발생하며, 암모니아는 반도체 공장, 비료공장, 인쇄시설, 축산시설 등에서 주로 발생한다. 최근 악취로 인하여 건겅상 및 감각적인 피해를 호소하는 민원이 발생하는 등 생활환경상의 다양한 문제를 야기하고 있다. 특히 개인 하수처리시설인 정화조와 우리나라 하수관거의 현재 시스템은 악취의 대량 발생이 불가피한 실정이다. 소득의 증가로 삶의 질이 향상되어 쾌적한 환경에 대한 욕구가 증가되어 악취에 대한 민원이 증가하고 있어 이에 대한 해결책이 요구되고 있다[2].
이들 악취물질을 제거 또는 감소시키는 방법은 발생시설 개조, 악취물질의 사용/발생을 억제, 물리적, 화학적 및 생물학적 방법을 이용하여 악취 제거, 마스킹 등이 있다[2]. 일반적으로 처리하고자 하는 악취성분을 함유한 기체는 저농도의 복합성분인 경우가 많으며, 함유하고 있는 성질도 다양하다. 악취물질 제거방법 중 흡착제에 악취물질을 통과시켜 흡착시켜 제거하는 흡착 제거방법은 주로 저농도의 악취물질 제거에 효과적인 것으로 알려져 있다. 이 때 흡착제는 비표면적이 매우 높은 고체를 사용하며 악취물질을 분자 인력과 정전력으로 그의 표면에 흡착 고정하며, 주로 표면적이 매우 큰 활성탄이 분말, 구상, 입상, 섬유상 등의 형상으로 성형되어 사용되어 진다. 흡착 제거방법은 조작이 간단하고 설치 비용이 저렴할 뿐만 아니라 역사가 오래되어 운전실적이 매우 많다. 때로는 불연성으로 안전성을 향상시키기 위해 제올라이트를 사용하기도 한다. 흡착제거 후 흡착제를 처리방법은 교환탈취 방식, 용제 회수 방식, 농축탈취 방식 등이 있으며 조건과 목적에 따라 선택할 수 있다. 교환식은 흡착제 충진 흡착탑으로 악취를 통과시켜 활성탄이 파과점(break point)에 다다르면 새로운 흡착제로 교체 또는 재생 대체하여 사용하는 방식으로 현재 가장 널리 이용되고 있는 방식이다. 흡착 제거방법은 고농도의 물질 처리에는 신품 또는 재생 흡착체 교환에 비용이 많이 발생하게 되는 단점이 있다. 최근에는 고성능 첨착(impregnated) 활성탄이 개발되어 다양한 가스를 처리할 수 있을 뿐만 아니라 교체 주기도 크게 연장되었다. 따라서 악취물질의 흡착 제거방법의 적용의 핵심은 흡착성능이 우수한 흡착제의 개발에 있다[3-12].
국내외에서 많은 폐기물로써 폐타이어, 폐플라스틱 등의 유기고분자 폐기물이 발생한다. 특히 폐타이어는 2010년에 전세계적으로 약 15억개가 발생하였고 무게로는 330만톤에 해당한다[13]. 우리나라의 경우도 2012년 약 30만톤의 폐타이어가 발생하였다[14]. 이들 폐기물의 처리는 매립, 소각 및 재활용으로 구분되며, 매립은 폐타이어와 폐플라스틱이 잘 썩지않는 성질이 있어 적당한 매립지를 지속적으로 개발해야 하는 문제를 가지고 있고, 토양오염 문제가 심각하게 대두되면서 폐기물 처리 방법 중 비중이 작아지고 있다. 한편 소각은 단시간에 부피를 최소화할 수 있으며 소각시 발생하는 열을 이용할 수 있는 장점이 있어 매립 다음의 비중을 차지하고 있으나, 소각시 발생하는 다이옥신 등 대기 오염물질의 배출이 문제가 되면서 대체 기술개발이 요구되고 있다. 따라서 재활용은 폐기물의 발생량을 감소시키고 매립이나 소각 등으로 인해 발생할 수 있는 환경오염 문제를 해결할 수 있는 다른 대안으로 기대된다. 재활용 방법 중 가장 많이 사용되는 열분해법은 진공 또는 질소 분위기, 즉 무산소 상태에서 유기 폐기물을 500~800 ℃의 온도에서 열적으로 분해하는 것을 말하며, 열분해의 에너지는 지속적으로 반응기에 직 · 간접으로 공급되고, 열분해에 의해 생성된 분해물이 가스, 액상, 고상의 형태로 얻어진다. 이때 생성된 액상은 증류에 의해 정제하여 연료유로 사용하나, 고상물질인 촤(char) 또는 카본블랙(carbon black)은 주로 연료 또는 다른 재료의 충진물질로의 재활용한다. 그러나 폐타이어의 경우는 타이어의 제조과정에 사용된 황이 상당량 고상물질에 존재하여 재활용에 제약 요소가 된다[15-19].
이에 본 연구에서는 폐타이어의 재활용성을 높이기 위하여 폐타이어 열분해시 발생하는 카본블랙을 이용하여 황화수소와 암모니아 제거 효율이 우수한 흡착제를 개발하고자 한다. 이를 위해 카본블랙에 금속산화물과 산성 또는 염기성 용액을 혼합하여 황화수소와 암모니아 제거용 흡착제를 제조하고, 이들의 흡착성능을 고정층 흡착탑의 파과곡선을 통하여 평가하였다.
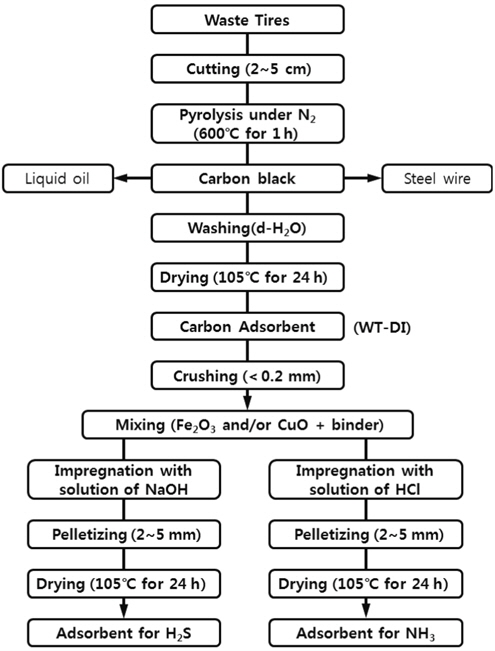
황화수소와 암모니아의 흡착을 위한 흡착제를 제조하기 위하여 폐타이어를 2~5 cm의 크기로 절단하고 열분해로에 주입하였다. 질소를 100 sccm (standard ml/min)의 유량으로 충분한 시간 동안 흘려서 열분해로를 질소분위기로 만든 후 열분해로의 온도가 600 ℃가 될 때까지 20 ℃/min의 속도로 승온하였다. 열분해의 온도가 600 ℃에 도달한 후 온도를 일정하게 유지하면서 열분해로 출구의 냉각기에서 액체 방울이 생성되지 않는 1시간 동안 폐타이어를 열분해하였다. 1시간의 열분해가 이루어진 후 계속 질소를 흘려주면서 열분해로의 온도를 상온까지 냉각하였다. 열분해로에 남아 있는 고상 물질을 꺼내어 자석 등을 이용하여 철심 등의 이물질을 분리하여 카본블랙을 얻었다. 회수된 카본블랙을 증류수로 충분히 세척하고 건조기에서 105 ℃에서 24시간 건조하여 탄소계 흡착제(WT-DI)로 사용하였다.
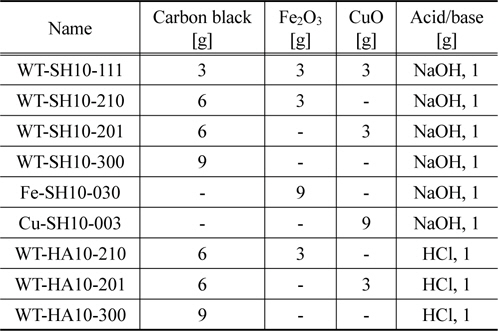
카본블랙을 0.2 mm 이하의 크기로 분쇄하고, 전이금속산화물(Fe2O3, CuO 등)과 결합제(벤토나이트 등)를 적당량을 균일하게 혼합하였다. 황화수소 제거용 흡차제를 제조하기 위하여 NaOH를 주입하고 메탄올과 증류수의 비가 1:1인 메탄올 수용액을 이용하여 잘 혼합하였다. 암모니아 제거용 흡착제를 제조하기 위하여 HCl을 주입하고 역시 메탄올 수용액을 이용하여 충분히 혼합하였다. 이들 혼합물을 상온에서 2시간이상 방치하였다. 혼합물을 2~4 mm 크기의 펠렛(pellet)으로 성형하고, 건조기를 이용하여 105 ℃에서 24시간 건조하여 황화수소와 암모니아 제거용 흡착제를 각각 제조하였다. 이들 흡착제의 제조과정을 Figure 1에 나타내었다. Table 1에 본 연구에서 제조한 산 또는 염기 및 금속산화물을 첨착한 흡착제의 제조 조건을 나타내었다.
[Table 1.] Impregnated conditions of various adsorbents
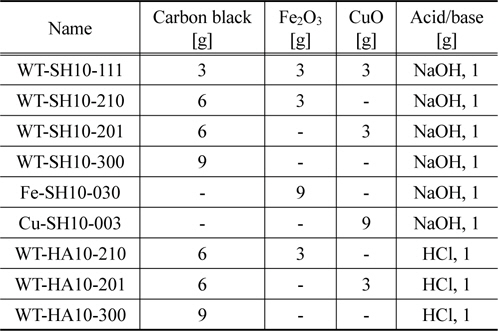
Impregnated conditions of various adsorbents
상업용으로 사용되는 흡착제의 황화수소와 암모니아에 대한 흡착성능을 비교하기 위하여 하수관거 에어벤트 탈취장치에 사용되고 있는 중성 가스용, 산성 가스용 및 염기성 가스용 흡착제를 선정하였다. 이들 흡착제에 대한 자세한 조성은 알려져 있지 않으나, 중성 가스용 흡착제는 4×8 mesh의 무정형 입자의 활성탄이고, 이를 증류수로 세척하고 105 ℃에서 24시간 이상 건조하여 DT-Neural로 사용하였다. 산성 가스용 흡착제는 활성탄에 NaOH와 Na2CO3를 5~18% 첨착한 DT-Acid1과 산화제이철에 제올라이트를 혼합한 흡착제인 DT-Acid2를 선정하였다. 한편 염기성 가스용 흡착제는 활성탄에 H2SO4와 H3PO4를 8~12% 첨착한 DT-Base를 선정하였다. 이들 흡착제는 모두 4×8 mesh의 펠렛형이고, 추가의 정제 과정 없이 사용하였다. 한편 비교군으로 RB4 (Norit사, 네들란드)와 BPL 4×10 (Calgon사, 미국) 활성탄을 선정하였다. 이들 흡착제는 약 5 mm 크기의 펠렛형이었으며, 증류수로 세척하고 105 ℃에서 24시간 이상 건조하여 각각 RB4-DI와 BPL-DI로 사용하였다.
본 연구에서 금속산화물로는 산화철(III) (Fe2O3, 대정화금(주), 한국)와 산화구리(II)(CuO, 대정화금(주), 한국)를, 결합제로는 벤토나이트(대정화금(주), 한국)를 사용하였다. 흡착제에 첨착을 위한 산은 HCl 또는 H2SO4 (삼천화학, 한국), 염기는 NaOH 또는 Na2CO3 (삼천화학, 한국)을 사용하였다. 카본 블랙에 대한 수용액의 원활한 혼합을 돕기 위하여 메탄올(덕산약품(주), 한국)을 선정하였다. 모든 시약은 CP (chemical pure)급의 시약을 추가의 정제과정 없이 사용하였다. 한편 악취물질로 사용한 황화수소와 암모니아는 리가스(한국)에서 1,000 ppm (N2 balance)의 농도로 구입하였다.
흡착제의 기공특성은 Micrometrics사의 ASAP 2020을 사용하여 -196 ℃에서 BET (Brunauer-Emmet-Teller) 법을 이용하여 흡착제의 비표면적(SBET), 미세 세공부피(Vmic), 총 세공부피(Vt) 그리고 평균 세공직경(Dp)을 측정하여 비교하였다. 흡착제의 표면은 주사전자현미경(scanning electron microscopy, SEM, JSM-6380LV, JEOL, Japan)을 이용하여 관찰하였다.
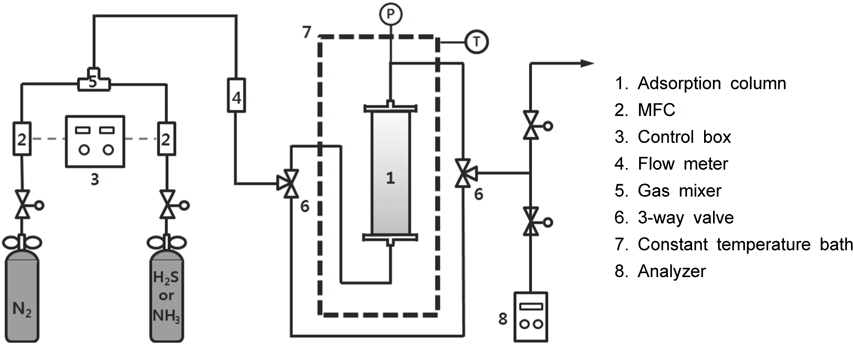
흡착제에 대한 황화수소와 암모니아의 흡착성능을 평가하기 위한 실험장치는 상압유통식으로 구성하였고, Figure 2에 실험장치에 대한 개략도를 나타내었다. 실험장치는 악취물질인 황화수소 또는 암모니아를 질소와 혼합하여 일정한 농도 및 일정 유량으로 공급해 주는 장치와 시료가스를 이용하여 흡착제에 대한 흡착실험을 수행하는 고정층 흡착탑으로 구성하였다. 황화수소와 암모니아에 의한 장치의 부식을 막기 위해 고정층 흡착탑, 모든 관 그리고 모든 장치는 스테인레스 스틸(stainless steel)로 제작하였다. 먼저 고정층 흡착탑은 내경이 4 cm, 길이 30 cm의 칼럼을 제작하여 공기를 이용하여 온도가 일정하게 유지될 수 있는 항온조내에 설치하였다. 고정층 흡착탑 하부에 직경이 1 mm인 유리구슬을 약 10 cm 높이로 채우고 그 위에 흡착제를 5 g을 충진하였다. 본 연구에서는 항 온조의 온도를 25±1 ℃ 이내로 조절하였다. 고정층 흡착탑을 설치한 후 질소로 충분히 흘려주어서 고정층 흡착탑과 모든 관을 질소 분위기 조건을 형성(conditioning)하였다.
본 연구에서 산성 악취가스는 1,000 ppm으로 제조된 황화수소와 순수한 질소를 질량유량조절기(mass flow controller, MFC)를 이용하여 일정한 농도와 일정한 유량으로 조절하고 스테텍믹서(static mixer)를 이용하여 잘 혼합한 다음 고정층 흡착탑으로 주입하였다. 염기성 악취가스는 역시 1,000 ppm의 암모니아와 순수한 질소를 이용하여 같은 방법으로 일정한 농도와 일정한 유량으로 조절하여 고정층 흡착탑에 주입하였다. 각각의 악취성분을 포함한 혼합가스는 고정층 흡착탑의 하부에서 상부로 흐르게 하였고, 고정층 흡착탑을 빠져 나온 기체는 매 5분마다 가스분석기(graywolf sensing solution model TG-501, USA)를 이용하여 황화수소와 암모니아의 유출 농도를 각각 측정하였다.
Figure 3에 본 연구에서 사용한 흡착제 일부의 SEM 사진을 나타내었다. Figure 3(a)와 (b)는 상업용으로 판매되는 중성 가스용 활성탄을 증류수로 충분히 세척한 후 건조시킨 흡착제(DT-Neutral)와 DT-Neutral을 10%의 HCl로 60 ℃에서 5시간 처리한 후 증류수로 세척하고 건조시킨 활성탄(DT-HA10)의 SEM 사진을 각각 나타내었다. 그림에서 보는 바와 같이 DT-Neutral의 경우에는 표면에 일부 탄소 덩어리가 관찰되었으나 산으로 처리한 경우는 표면에 존재하던 탄소덩어리가 사라지면서 보다 선명하게 표면을 관찰할 수 있었다. 중성 가스용 활성탄의 경우 전구체로 목재계의 재료를 사용하여 제조한 활성탄이었고 큰 기공을 중심으로 관찰되며 미세 기공은 잘 발달하지 않았음을 알 수 있다. Figure 3(c)와 (d)에는 산성 가스용과 염기성 가스용 활성탄의 SEM 사진을 나타내었고, 또한 Figure 3(e)와 (f)에는 Calgon사의 BPL과 Norit사의 RB4에 대한 SEM 사진을 각각 나타내었다. BPL은 역청탄(bituminous coal)을 전구체로, RB4는 이탄(peat)을 전구체로 각각 활성탄을 제조한 것으로 알려져 있다. Figure 3(g)에는 폐타이어의 열분해에 의해 얻어진 카본블랙을 증류수로 세척하여 건조한 흡착제(WT-DI)의 SEM 사진을 나타내었다.
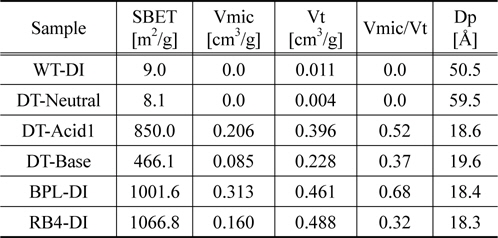
Table 2에는 일부 흡착제에 대한 기공 특성을 BET로 분석하여 나타내었다. DT-Neutral은 표면적이 매우 작아 8.1 m2/g이었지만 BPL과 RB4는 표면적이 매우 큰 1,000 m2/g 이상이었다. DT-Acid1은 850 m2/g을, DT-Base는 466 m2/g을 각각 나타내었다. 한편 WT-DI는 표면적이 9 m2/g으로 DT-Neutral과 유사한 값을 나타내었다. 흡착제 마다 총 기공부피 대 미세기공의 부피비는 달라서 BPL이 가장 높은 0.68을 나타낸 반면 RB4는 0.32를 나타내었고, DT-Neutral과 WT-DI의 경우는 미세기공이 관찰되지 않았다. 평균기공의 크기는 석탄계 활성탄은 모두 18~20 Å으로 관찰되었고, DT-Neutral과 WT-DI는 50~60 Å으로 관찰되었다.
[Table 2.] Structural parameters of adsorbents
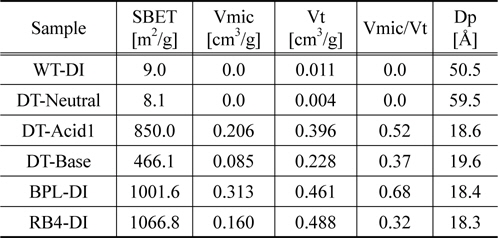
Structural parameters of adsorbents
일반적으로 흡착공정에서 일정한 시간이 지나면 흡착질의 거동은 유체에서 흡착질의 농도와 흡착제에서 흡착질의 농도간에 평형에 도달하게 되고, 이때 흡착제의 단위 질량 당 흡착된 흡착질의 질량은 평형흡착량(equilibrium adsorption capacity)이 된다. 흡착제의 최대 흡착량은 내부 표면적, 세공 구조, 표면 화학 등의 흡착제 특성과 분자의 화학적 성질, 분자의 크기, 친수성, 극성 등의 흡착질의 특성에 의해 결정된다. 회분식 저장조에서 온도를 일정하게 유지하면서 흡착질의 농도 변화에 따라 흡착량을 측정하면 흡착등온선(equilibrium isotherm)을 얻을 수 있다. 이 얻어진 값은 흡착제의 정적 흡착능력(static adsorption capacity)이라 할 수 있다. 이 때 흡착제에 흡착된 흡착질은 유체상의 흡착질의 농도와 평형상태에 있게 된다. 그러나 실제 현장의 흡착탑 운전에서는 동적 흡착능력(dynamic adsorption capacity)이 보다 중요한데, 이것은 고정층 흡착탑 내의 흡착제의 질량 당 흡착된 흡착질의 질량으로 나타낸다. 이 값은 흡착탑의 설계 조건에 따라 의존하기 때문에 흡착탑마다 다르다. 일반적으로 고정층 흡착탑에서 흡착은 유체 흐름에서 흡착질의 축방향 확산과 유체 흐름으로부터 흡착제의 표면까지의 물질전달 속도에 영향을 받는다. 유체의 흐름이 아주 느리다면 유체의 흐름은 층류흐름이 되어 흡착제 표면에 경계층(boundary layer)이 존재하지 않게 된다. 따라서 실험 수행에 있어서 흡착탑 내의 흐름을 층류의 영역에서 수행하는 것이 매우 중요하다. 이 경우 흡착탑 출구에서 유체에서의 흡착질의 농도를 측정하였을 때, s자형(sigmoid)의 파과곡선(breakthrough curve)을 얻을 수 있다. 동적 흡착능력은 고정층 흡착탑의 출구 농도가 포과 농도에 도달할 때까지의 파과곡선의 상부 면적을 구함으로 계산이 가능하다.
오염물질 제거를 위한 흡착탑을 설계하기 위해서는 오염물질을 포함한 유체를 흡착탑에 통과시킨 후 유출 유체에서 오염물질의 농도가 어느 시점에서 설계 기준 또는 허용 기준치를 초과할 것이냐에 대한 정보가 필요하다. 실제 흡착탑 운전에서는 흡착탑 출구의 오염물질의 농도가 파과점(break point)에 도달하면 새로운 흡착제로 바꾸고 먼저 사용한 흡착제는 재생과정을 거친다. 따라서 파과점에 도달하는 파과시간(break time)은 흡착제의 흡착능력을 나타내는 중요한 인자 중 하나이다. 본 연구에서 파과점은 원료 속의 흡착질 농도에 대한 기체 속의 흡착질 농도 비, 즉 (c/co)가 0.05인 경우로 택하였다. 이 분기점은 처리된 악취가스의 마지막 부분의 농도이기 때문에 시작점에서 분기점까지 제거된 오염물질의 평균 분율은 0.99 이상일 때가 많다[20].
본 연구에서 악취물질에 대한 흡착제의 흡착능력은 식 (1)에 의하여 정의되었다[21].
여기서 qe = 흡착 능력(g/kg) Mw = 악취가스의 분자량(g/mol) C0 = 악취가스의 흡착탑으로 유입 농도(ppm) F = 악취가스가 포함된 기체의 총 유량(cm3/min) tb = 5% 파과점까지의 시간(min) ma = 흡착탑 내의 흡착제 질량(kg)
이는 흡착탑의 작업용량(working capacity)이며, 이는 흡착제가 오염물질을 허용기준치 내에서 효과적으로 제거할 수 있는 흡착능력으로 정의된다. 식 (1)은 ASTM D 6646-01에 따라 활성탄을 이용하여 1% 황화수소를 이용하여 50 ppm (0.5%) 파과점에 도달하는 시간으로부터 황화수소의 흡착 능력을 구할 때 유도된 식이지만 일반적으로 다른 파과점과 다른 기체의 흡착에도 사용되어 질 수 있다. 식 (1)에 따라 흡착능력은 파과시간에 비례한다고 할 수 있다.
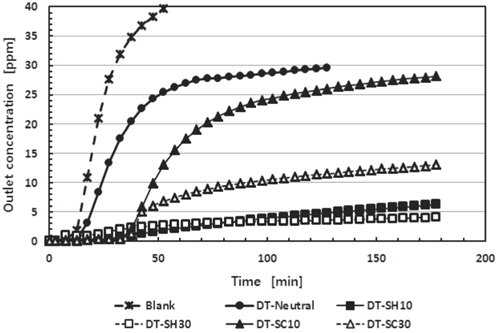
본 연구에서 산성 악취가스의 대표적인 예인 황화수소에 대한 흡착제의 흡착능력을 알아보기 위해 고정층 흡착탑에 일정한 농도의 황화수소를 주입한 후 흡착탑을 나가는 황화수소의 농도 대 시간의 곡선인 파과곡선에 구하였다. 먼저 활성탄에 대한 황화수소의 흡착능력과 염기 첨착에 의한 흡착능력의 증가를 알아보기 위하여 DT-Neutral과 이 활성탄에 탄산나트륨 또는 수산화나트륨을 무게 비로 각각 10%와 30%로 적당한 증류수를 이용하여 60 ℃에서 5시간 동안 진탕한 후 이를 건조하여 황화수소 제거용 흡착제를 제조하였다. Figure 4에 이들 흡착제 10 g과 황화수소 유입농도 50 ppm과 유입유량 50 sccm에 대한 파과곡선을 나타내었다. 그림의 범례에서 SH는 수산화나트륨(sodium hydroxide)을, SC는 탄산나트륨(sodium carbonate)을 각각 의미하며, 숫자는 활성탄에 첨착한 염기의 무게 %를 의미한다. 그림에서 보는 바와 같이 바탕시험(blank test)의 경우 유입 황화수소의 농도에 대한 유출 황화수소의 농도가 0.05 파과점(2.5 ppm)에 도달하는 파과시간은 13분이었다. 본 연구에서 주어진 흡착제에 대한 파과시간은 바탕시험에서의 파과시간을 뺀 시간으로 정의하였다. 즉 DT-Neutral의 경우 파과곡선에 의한 파과시간이 16분이었으므로 흡착제의 실제 파과시간은 3분이었다. 탄산나트륨 10%와 30%를 첨착한 경우 파과시간은 25분으로 비슷하였으나 포화흡착량에서 30%를 첨착한 경우가 10% 보다 2배의 능력을 나타내었다. 한편 수산화나트륨 10%와 30%를 첨착한 경우에는 파과시간은 10%가 55분, 30%가 35분이었고, 포화흡착량에서 큰 차이를 나타내지 않았다. 따라서 수산화나트륨을 첨착한 흡착제가 탄산나트륨을 첨착한 흡착제 보다 더 높은 흡착능력을 나타내었다. 본 연구에서 황화수소 처리용 흡착제 제조에는 수산화나트륨 10%를 첨착한 경우가 최적 상태를 나타내었다.
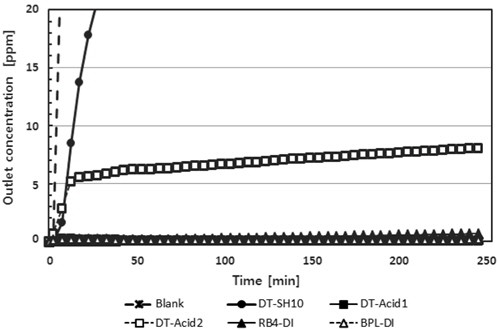
Figure 5에 중성가스용 활성탄에 수산화나트륨을 10% 첨착한 DT-SH10과 비교를 위해 상업용으로 사용되는 산성가스용 흡착제(DT-Acid1, DT-Acid2)와 외국에서 상업용으로 생산된 활성탄(RB4-DI, BPL-DI)을 이용한 황화수소에 대한 파과곡선을 나타내었다. 본 실험에서는 흡착제를 5 g, 황화수소 유입농도를 100 ppm 그리고 유입유량을 100 sccm로 하여 수행하였다. 이는 Figure 4에 나타낸 실험에 비해 흡착제 단위 질량 당 황화수소 8배의 부하량에 해당한다. 바탕시험에서 유출 농도가 5 pmm에 도달하는 파과시간은 3분이었다. DT-SH10의 파과시간은 10분이었다. DT-Acid2의 경우 파과시간은 12분으로 DT-SH10과 파과시간은 매우 유사하였으나, 실제 파과곡선의 형태의 차이에 의한 포화흡착능력에는 차이를 나타내었다. DT-Acid2의 경우는 산화철과 제올라이트를 혼합하여 제조한 산성가스용 흡착제로 알려져 있다. DT-Acid2의 경우 초기 흡착제 내부로의 확산저항에 의해 황화수소의 제거율이 낮아 많은 양의 황화수소가 제거되지 않고 유출되었으나, 시간이 지남에 따라 흡착제 내부로 황화수소가 확산하면서 황화수소가 반응을 통해 제거되어 지는 것으로 생각된다. 실제 악취제거용 흡착제로 채택한다면 경우에 따라서 두 흡착제의 교체주기가 차이가 나지 않을 수 있다는 것을 의미한다. 한편 DT-Acid1는 석탄계를 전구체로 제조된 활성탄에 수산화나트륨과 탄산나트륨을 첨착하였고 BPL-DI와 RB4-DI는 석탄계를 전구체로 제조된 활성탄이며, 이들 흡착제는 황화수소에 대한 흡착능력이 매우 높아서 4시간 동안 운전 후에도 흡착탑으로부터 유출농도가 1 ppm 미만이었다.
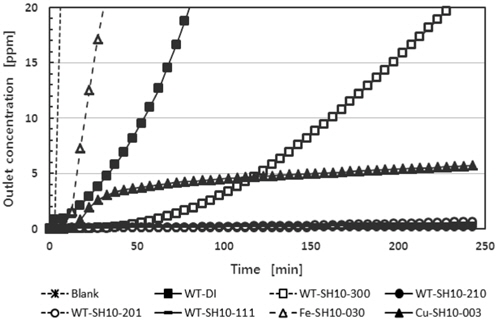
폐타이어의 열분해로부터 얻어진 카본블랙에 금속산화물과 염기를 첨착한 흡착제를 사용한 황화수소에 대한 파과곡선을 Figure 6에 나타내었고, 흡착제에 대한 이름과 조성은 Table 1에 나타내었다. 그림에서 보는 바와 같이 카본블랙을 포함하지 않고 산화철(III)과 산화구리(II)로 각각 제조된 Fe-SH10-030과 Cu-SH10-003 흡착제는 DT-Acid2 흡착제에서 언급한 바와 같이 흡착제 내부로의 확산 저항에 의해 황화수소의 초기 유출 농도가 높았다. 이들의 흡착제는 황화수소의 제거에 물리적 흡착보다 화학적 흡착 또는 반응에 의존하기 때문에 본 연구에서의 25 ℃에서의 낮은 반응 속도와 이들 물질의 높은 충진 밀도에 의한 확산저항 등에 의해 황화수소의 제거가 흡 착탑 운전 초기에 낮은 효율을 나타내었다. 본 연구에서 사용 한 산화철(III)과 산화구리(II)는 밀도가 각각 5.3 g/cm3과 6.3 g/cm3이고, 이들을 펠렛으로 제조한 흡착제의 충진 밀도는 각각 1.6 g/cm3과 1.4 g/cm3이었다. 한편 카본블랙의 밀도는 1.9 g/cm3이고 이를 이용하여 제조한 펠렛의 충진 밀도는 0.45 g/cm3이었다.
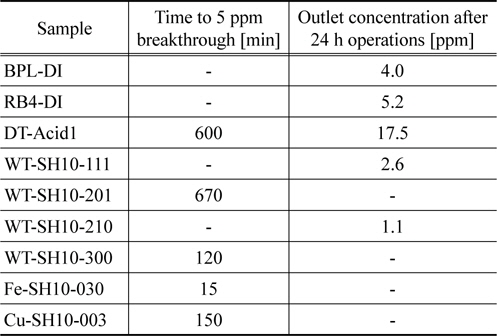
폐타이어 열분해 카본블랙 만으로 제조된 WT-DI의 경우 파과시간은 35분이었다. 비슷한 표면적을 가지는 중성 가스용 활성탄에 10% 수산화나트륨을 첨착한 DT-SH10에 비해 비교적 높은 흡착능력을 보였다. 이는 카본블랙의 표면에 수산기들이 있어 표면화학적 특징에 의한 것으로 생각된다. 본 연구에서 황화수소에 대한 탄소계 흡착제의 흡착능력은 대체로 비표면적에 따라 증가하는 경향을 보였고, 미세기공의 비율이 높은 BPL이 보다 높은 흡착능력을 보였다. 한편 카본블랙과 수산화나트륨의 혼합물로 구성된 WT-SH10-300의 경우 파과시간은 120분이었다. 그리고 카본블랙에 산화철(III) 또는 산화구리(II)를 혼합하여 제조한 흡착제의 경우 4시간 운전 후에도 유출농도가 역시 1 ppm 미만으로 BPL과 RB4와 유사한 흡착 능력을 나타내었다. 황화수소에 대한 우수한 흡착능력을 나타내는 흡착제에 대해 보다 자세한 파과시간을 Table 3에 나타내었다. 표에서 보는 바와 같이 BPL과 RB4는 24시간 운전 후 출구의 농도가 4~5 ppm으로 거의 파과점에 도달하였으나 WT-SH10-210과 WT-SH10-111은 1~2 ppm으로 24시간이 지난 후에도 파과점에 도달하지 않았다. 따라서 카본블랙에 염기와 금속산화물을 첨삭함으로 보다 흡착제의 흡착능력을 높일 수 있었다. 본 연구에서는 산화철(II)을 첨삭한 WT-SH10-210이 황화수소에 대한 가장 우수한 흡착 능력을 나타내었고, 20.3 g/kg의 작업 용량을 보였다.
[Table 3.] Adsorption capacities of various adsorbents for H2S
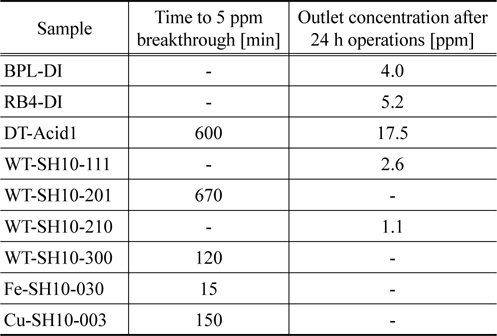
Adsorption capacities of various adsorbents for H2S
산화철(III)과 수산화나트륨에 의한 황화수소 제거는 다음과 같은 주요 반응에 의해 제거되어 지는 것으로 생각된다[7, 22-24].
본 연구에서 황화수소의 제거는 25 ℃에서 실험이 수행되었기 때문에 상기의 반응이 진행되는데 어느 정도 시간이 필요하며 산화철(III)과 수산화나트륨로 구성된 흡착제는 밀도가 높아서 황화수소가 흡착제로 확산 속도가 느려서 반응이 원활히 진행되지 않아 초기 황화수소의 제거율이 높지 않았을 것으로 생각된다. 그러나 카본블랙이 포함된 흡착제의 경우 낮은 온도에서도 카본블랙이 황화수소를 물리적으로 흡착하여, 상기의 반응이 진행되는데 필요한 시간을 제공함으로 높은 제거율을 나타내는 것으로 생각된다.
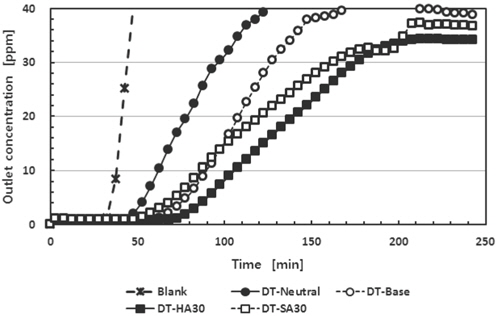
흡착제에 대한 암모니아의 파과곡선을 얻기 위해 암모니아를 포함하는 혼합가스를 유입농도 200 ppm과 유입유량 200 sccm으로 조절하여 고정층 흡착탑에 주입하였는데, 이는 황화수소보다 4배의 부하량을 해당한다. 이는 암모니아의 취기 강도가 황화수소보다 낮으며, 생활환경에서는 황화수소보다 암모니아의 발생량이 많기 때문이다. 한편 식 (1)에 의하면 암모니아의 경우 흡착탑에 주입하는 부하량은 4배이지만 암모니아의 분자량은 황화수소의 분자량의 1/2이기 때문에, 만일 파과시간이 동일하다면 흡착제에 대한 암모니아의 흡착량은 황화수소에 비해 2배에 해당한다. Figure 7에 중성가스용 활성탄과 이를 산으로 첨착한 흡착제에 대한 암모니아의 파과곡선을 나타내었다. 바탕시험에서 파과시간은 40분으로 높은 부하량에도 불구하고 황화수소의 3분에 비해 현저히 높은 수준을 나타내었다. 이는 분위기 기체인 질소는 사중극자(quadrupole)를 가지고 있고, 암모니아는 쌍극자(dipole)를 가지며 낮은 분자량에 의한 상승운동 등의 복합적인 요인에 의해 나타나는 본 실험장치의 특성으로 생각된다. 중성 가스용인 DT-Neutral의 파과시간은 20분이었고, 상업용 염기 가스용 활성탄 DT-Base의 파과시간은 55분이었다. 그리고 DT-Neutral에 염산 30%를 첨착한 DT-HA30의 파과시간은 75분, 황산 30%를 첨착한 DT-SH30의 파과시간은 45분이었다. DT-Base의 표면적이 466 m2/g, DT-Neutral의 표면적이 8 m2/g인 점을 고려한다면, 활성탄의 표면적보다 산첨착에 의한 암모니아 제거효과가 더 효율적임을 알 수 있다.
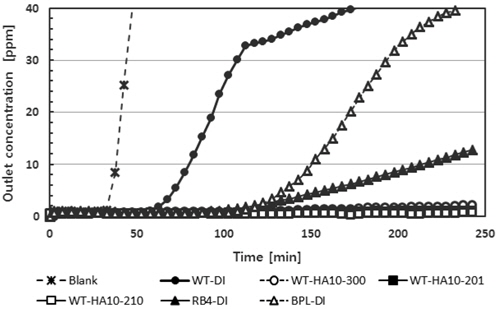
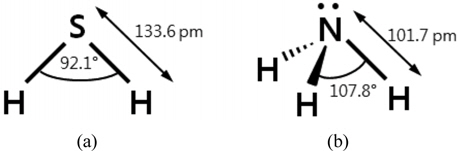
Figure 8에 폐타이어로부터 회수한 카본블랙에 금속산화물과 산을 첨착한 흡착제, RB4와 BPL에 대한 암모니아의 파과곡선을 나타내었다. 그림에서 보는바와 같이 RB4의 파과시간은 175분이었고, BPL은 110분이었다. 특히 폐타이어로부터 회수한 카본블랙만으로 제조한 흡착제 WT-DI의 파과시간이 40분으로 다른 흡착제와 비교하여 상대적으로 큰 차이를 나타내지 않았다. 일반적으로 활성탄은 sp2 혼성구조의 흑연층으로 되어 있으며, slit 형태의 기공 구조를 갖는 흡착제로 알려져 있다. 이는 700 ℃에서 탄화된 polyvinyliden chloride (PVDC)가 벤젠이나 사이클로헥산과 같은 납작한 분자들은 잘 흡착하지만 네오펜탄과 같은 구형 분자는 잘 흡착하지 않기 때문이다[25]. 한편 황화수소의 분자는 Figure 9(a)에서 나타낸 바와 같이 이등변삼각형 모양을 하고 있다. S-H 결합의 길이(원자핵 사이의 거리)는 1.345Å이며 H-S-H 결합각은 92.1°이다[26]. 암모니아의 분자 구조는 Figure 9(b)에서 나타낸 바와 같이 한 변이 1.63 Å인 정삼각형을 이루고 있는 3개의 수소 원자가 있고, 정삼각형의 중심으로부터 질소 원자가 0.38 Å만큼 떠 있는 모양으로 삼각뿔형의 구조를 하고 있다. 암모니아를 이루고 있는 질소 원자에는 비공유 전자쌍이 한 쌍 존재하는데, 이것으로 인해 암모니아는 양성자 받개, 즉 염기로 작용할 수 있다. 분자 구조로 말미암아 암모니아의 쌍극자 모멘트는 0이 아니게 되며, 따라서 암모니아는 극성 물질이 된다. N-H 결합의 길이는 1.017 Å이며 H-N-H의 결합각은 107.8°이다[27]. 따라서 납작한 구조를 가지는 황화수소의 경우 특히 미세기공을 많이 가지는 표면적이 높은 활성탄에 대한 흡착능력이 높게 나타나고 있으나, 삼각뿔 구조를 가지는 암모니아의 경우 상대적으로 활성탄에 대한 표면적 의존성이 낮아지게 된다. 한편 카본블랙은 일부 구형 입자가 융착되면서 복잡한 구조를 가지고 있고, 하이드록실 또는 카복실 기 등의 다양한 관능기가 카본 블랙의 표면에 존재한다[28]. 이런 이유로 카본블랙이 비슷한 표면적을 가지는 활성탄에 비해 표면화학적 특징으로 인하여 암모니아에 대해 상대적으로 높은 흡착능력을 나타내었다. 카본블랙에 염산 10%를 첨착한 흡착제 WT-HA10-300의 경우 8시간 운전 후 유출 농도가 5.7 ppm으로 단순히 10%의 산을 첨착함으로도 상당한 흡착능력 향상이 가능하였다. 산화철을 첨착한 WT-HA10-210은 유출 농도가 4.0 ppm이었고, 산화철을 첨착한 WT-HA10-201은 2.4 ppm이었다. 따라서 산화철을 첨착한 경우보다 산화구리(II)를 첨착한 경우가 우수한 흡착능력을 나타내었고, 12.2 g/kg의 작업 용량을 나타내었다. 한편 카본블랙, 산화철(III) 그리고 염산을 6:3:1로 혼합한 흡착제는 암모니아에 대한 작업용량이 7.3 g/kg이었지만, 카본블랙, 산화철(III) 그리고 산 또는 염기를 이용한 흡착제의 제조공정이 공정의 단순화로 인해 최적의 흡착제 제조공정이 될 것으로 생각된다.
악취성분의 일종인 황화수소와 암모니아를 효율적으로 제거하기 위한 흡착제를 개발하기 위하여 폐타이어 열분해 생성물인 카본블랙을 사용하였다. 본 연구에서 폐타이어 열분해 생성물인 카본블랙에 산화철 그리고/또는 산화구리를 첨착하고 황화수소용으로 수산화나트륨으로 처리하고, 암모니아용으로 염산을 처리함으로 우수한 흡착능력을 가지는 흡착제의 제조가 가능하였다. 카본블랙, 산화철 그리고 수산화나트륨을 각각 무게비로 6:3:1로 혼합하여 제조한 흡착제가 황화수소에 대해 20.3 g/kg의 작업용량으로 가장 우수한 흡착능력을 나타내었다. 또한 카본블랙, 산화구리 그리고 염산을 각각 무게비로 6:3:1로 혼합하여 제조한 흡착제가 암모니아에 대해 12.2 g/kg의 작업용량으로 가장 우수한 흡착능력을 보였다. 본 연구에서 폐타이어 열분해 생성물인 카본블랙에 산화철(III) 그리고/또는 산화구리(II)를 첨착하고 황화수소용으로 수산화나트륨으로 처리하고, 암모니아용으로 염산을 처리함으로 우수한 흡착능력을 가지는 흡착제의 제조가 가능하였다.