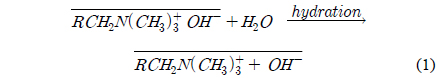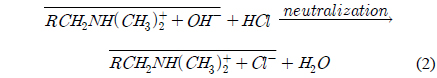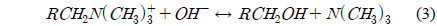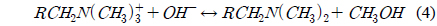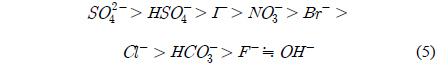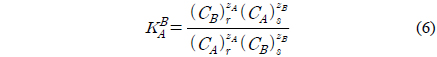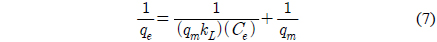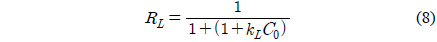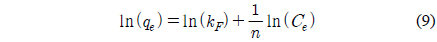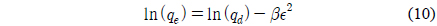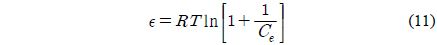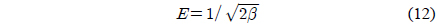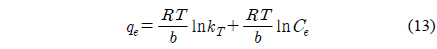본 연구에서는 CO2를 흡수하는 아민용액에서 성능 저하의 원인이 되는 HSS를 제거하기 위해 음이온교환수지를 이용한 HSS의 처리특성을 제시하고자 한다. 최적 HSS 제거효율은 수지 SAR10을 0.05 g/mL 사용할 때 316 K, pH 12에서 96.1%로 나타났다. 또한 최적 수지 재생효율은 NaOH 농도 3 M, 316 K에서 78.8%로 나타났다. HSS의 흡착은 Freundlich 모델에 가장 잘 부합하였으며 흡착 동력 크기를 보았을 때 수지를 이용한 HSS의 제거가 용이한 것으로 나타났다. 흡착 선택계수의 경우 전자가, 원자가가 클수록 높게 나타났고 탈착 선택계수는 이와 반대의 경향을 나타냈다. 연속식 HSS 처리시 오염시료 13.3 BV를 최적으로 처리할 수 있었으며, 5.2 BV가 최적 NaOH 소모량으로 나타났다.
In this study, we studied the characteristics of ion exchange for treatment of HSS (heat stable salts) which cause performance reduction in CO2 gas capture amine solution using anion exchange resins. The optimum HSS removal efficiency, 96.1% was obtained when using strong base anion exchange resin SAR10 at dosage 0.05 g/mL, 316 K, pH 12 and the best resin regeneration efficiency, 78.8% was obtained using NaOH solution of 3 M at 316 K. The adsorption data were described well by the Freundlich model and the sorption intensity(n) was 2.0951 lying within the range of favorable adsorption. The adsorption selectivity coefficients were increased by increasing valences and size of ion and desorption selectivity coefficients showed a contradictory tendency to adsorption selectivity coefficients. By continuous HSS removal experiments, 13.3 BV of HSS contaminated solution was effectively treated and the optimum NaOH solution consumption was 5.2 BV to regenerate resins.
전세계의 공업화에 따른 피해로 지구온난화의 문제가 범지구적 문제로 인식되면서 각국에서 CO2, CH4, N2O, PFC, HFC, SF6 등 여섯 가지의 온실가스 감축을 현실화시키고 있다. 특히 CO2는 인간 활동으로 배출되는 가장 주요한 온실가스로 꼽히며[1] 현재 개발되고 있는 CO2 분리 회수 공정은 흡수법, 흡착법, 심냉법, 산소부하연소법, 막 분리법 등으로 구분할 수 있다. 이 중 상용화되어 대량의 연소 배가스에 적용시킬 수 있는 방법으로 주로 흡수법이 사용된다. 흡수제로는 주로 알카놀아민 계열의 흡수제를 사용하며 CO2와 같은 산성가스와 발열, 가역적으로 반응한다. 알카놀아민 중 MEA는 넓은 범위의 분압에서 CO2 제거에 매우 효과적이며 빠른 반응 속도 때문에 널리 사용되고 있다[2].
아민 흡수 공정에서 주로 4가지 문제가 발생할 수 있으며 주로 거품 형성, 부식/침식, 아민 손실, 가스의 처리 효율 감소 등이다. 이러한 문제들에 대하여 대부분의 원인은 간단하게 해결되지만, 아민 용액과 산가스가 반응하여 형성하는 열안정성염, HSS (heat stable salts)의 경우 처리가 쉽지 않다[3]. HSS는 아민용액에서 주로 음이온 형태로 발생하며 glycolate (C2H3O3−), acetate (C2H3O2−), formate (CHOO−), oxalate (C2O42−) 등의 유기산 음이온과 chloride (Cl−), nitrite (NO2−), nitrate (NO3−), sulfate (SO42−) 등의 무기산 음이온으로 구성된다. HSS는 비가역적이고 비점이 높아 아민 공정의 탈거 부분에서 재생되지않기 때문에 지속적으로 축적되어 문제를 일으키게 된다[4,5]. HSS는 아민의 일부가 전환하여 발생하므로 산 가스 제거 용량이 감소하며[4] 용액의 pH를 낮추고 전도도를 증가시키며 킬레이트제와 같이 부식성을 증가시킨다[6]. 이러한 문제점을 일으키는 HSS 제어 기술로는 증류법(distillation), 전기투석법(electrodialysis)과 이온교환법(ion exchange)이 주로 사용되며 이 중 진공으로 150 ℃까지 가열하는 증류법의 경우 높은 비용, 흡수제 손실, 고온으로 인한 열화현상 등의 문제가 있고 전기투석법은 전기장을 이용하여 음이온과 양이온을 선택적으로 투과시킨다. 이는 멤브레인의 막힘 현상과 전체적으로 높은 비용 문제가 있다. 이온교환법은 낮은 수준으로 HSS 처리(0.5 wt%)를 가능하게 하고 공정 중 아민회복률 99%로 아민 손실량이 작기 때문에 에너지 소비가 낮고 비용적인 면에서 경쟁성이 있다[4,7]. 또한 화학적으로 깨끗하고 재생 폐기물이 생물학적 분해가 가능하므로 아민 시스템에서 친환경적으로 HSS를 제거할 수 있다.
CO2 흡수 공정에서 아민용액은 흡수탑에서 CO2를 흡수하고 CO2 탈착을 위해 탈거탑으로 이동하여 가열된다. 이온교환수지는 주로 탈거탑 뒤에 적용되며 에탄올아민과 물의 혼합용액에서 유기성 음이온이나 sulfate, nitrate 등의 이온성 오염물질을 제거하기 위해 사용된다. 하지만 이온교환법은 공정 내 화학약품의 소모량 및 폐기물 발생량이 높다는 문제점이 있고 수지의 주기적인 교체가 필요하여 효과적인 설계가 필요하다. 이온교환을 이용한 HSS 제거 기술 MPR 서비스에 의해 1991년부터 세계에 제공되었으며 이후로 한 단계 더 연구가 진행되어 HSSX, DOWEX, Amipur CCS 등의 공정이 개발되었다. Cumming et al.[5]은 2007년, 아민 리클레이밍 시스템에 대한 동향을 연구하였으며 HSS의 제거 기술로 새로운 용액 주입, 중화, 이온교환, 증류, 전기투석법 등을 제시하였다. Ludovic et al.[8]은 2012년에 HSS를 포함한 열화물질의 생성 경로와 그 영향을 줄이기 위한 문헌상으로 보고된 주요 기술에 대하여 발표하였다. 몇몇 연구자들은 아민 재생에 사용되는 상용화된 이온교환수지에 대한 정보를 제공하였으며 음이온교환수지의 경우 308~333 K의 온도 조건에서 적용되었다[9-11]. Pal et al.[7]은 2013년에 Gasco Habshan에서 사용하는 MDEA에서 HSS를 이온교환수지로 제거하는 연구를 수행하여 HSS 제거에 적합한 수지를 선정하고 흡착 모델에 적용하여 향후 공정에 기여하고자 하였으며 306~326 K 온도 조건에서 실험을 수행하였다. 현재까지 이온교환수지를 이용한 CO2 흡수 공정시 HSS 제거 공정은 국내 적용 사례가 전무하며 처리공정의 최적 운전 조건과 같은 기초자료뿐만 아니라 HSS 종류에 따른 처리특성에 관한 연구가 거의 이루어지지 않은 실정이므로 공정이 일반적으로 상용화되기 위해서는 많은 연구가 필요하다.
따라서 본 연구에서는 HSS의 효율적 처리를 위해 CO2 흡수 공정시 발생하는 HSS의 제거에 관하여 이온교환수지의 종류와 주입량, 온도에 대한 영향을 확인하고 이온교환수지의 재생에 관하여 재생용액 농도 및 온도에 대한 영향을 분석하였다. 연속식 HSS 처리 실험을 통해 파과특성을 파악하였으며 등온흡착모델 적용, 친밀도 분석을 통해 이온교환 특성을 파악하였다.
이온교환수지의 종류에 따른 HSS 제거효율의 변화는 이온교환수지의 해리 특성으로 설명될 수 있으며 이를 근거로 하여 이온교환수지의 종류를 선정할 수 있다. 이온교환수지는 4급 암모늄을 포함한 강염기성 음이온교환수지와 2, 3급 암모늄을 포함한 약염기성 음이온교환수지로 구분할 수 있으며 아래 식 (1)과 (2)는 각각 4급 암모늄 강염기성 음이온교환수지인 RCH2N(CH3)3+OH−, 약염기성 음이온교환수지인 RCH2N(CH3)2의 해리 특성을 나타낸 것으로 식에서 윗줄은 수지를, R은 공중합체 구조를 나타낸다. 강염기성 음이온교환수지는 수용액 상에서 강한 해리가 일어나 교환 이온(OH−)과 외부 음이온 물질이 교환되며, 모든 pH(0~14)의 범위에서 음이온 물질의 제거에 효과적으로 사용될 수 있다. 반면, 약염기성 음이온교환수지는 물에서 용매화되면 이온화된 수산화물 형태를 내놓지만 즉시 유리 염기 형태로 다시 전환되기 때문에 수산화이온의 해리가 매우 약해 강알칼리 용액에서의 이온교환이 전적으로 불리하다. 약염기성 음이온교환수지와 산성 용액은 반응하여 식 (2)과 같이 중화에 의해 산성 염 형태를 내놓으며 강한 해리 특성을 가지게 된다. 따라서 유리 염기 형태의 약염기성 이온교환수지는 수소 이온 농도가 충분히 높아 수지를 양성자화하는 낮은 pH에서만 유용하다[12].
이온교환수지의 열화 특성은 온도가 이온교환수지에 미치는 영향을 설명할 수 있다. 공정 운전 온도의 증가는 이온교환수지 내 기능기 열화와 이온교환 용량 감소를 야기한다[13]. 강염기성 음이온교환수지에서 탈아민화(deamination)와 약염기성 기능기(group) 형성으로 인한 수지 용량의 손실을 설명하기 위해 식 (3), (4)에서 호프만 열화 메커니즘(Hofmann degradation mechanism)이 제안되었다[14].
강염기성 음이온 수지에서 가장 열적으로 민감한 결합은 질소 원자에 붙어있는 알콜기(-OH)의 결합으로 이 결합이 갈라지는 반응은 호프만 열화 반응이라고 불린다. 알콜기를 손실한 기능기는 약염기 교환 특성을 가지는 삼차 아민으로 바뀌므로 기능기는 더 이상 염을 분리하지 못하고 오염 물질을 흡착하지 못하게 된다.
수용액상에서 이온교환수지와 음이온 물질의 친밀도는 음이온의 전자가, 원자가, 수지의 염기 강도 등에 따라 달라진다. 일반적으로 식 (5)와 같은 순서를 가지며 전자가와 원자가가 높은 음이온에 대하여 친밀도가 높다. 수지의 재생공정시 친밀도가 높은 음이온일수록 탈착이 어려우며 친밀도 식(5)의 역순으로 탈착 정도가 크다.
수지에 대한 음이온의 친밀도는 선택계수(selectivity coefficient)를 통하여 정량적으로 나타낼 수 있다. 선택계수는 평형상태에서 용액과 수지에 존재하는 이온의 비율을 기반으로 정의된다. 선택계수가 높을수록 이온에 대한 높은 선호도를 나타내며 질량 작용 관계에 따라 다음과 같이 나타난다[15].
위 식에서 C는 농도를 의미하며 몰랄 농도, 몰 농도, 상대적인 이온 분율 농도에 따라 나타낼 수 있다. 이 식으로 구한 선택계수는 흡착제, 흡착질의 전자가와 농도에 따라 달라진다. 따라서 본 연구에서는 흡·탈착 선택계수를 구하여 음이온교환수지에 대한 HSS의 친밀도를 비교하고자 하였다.
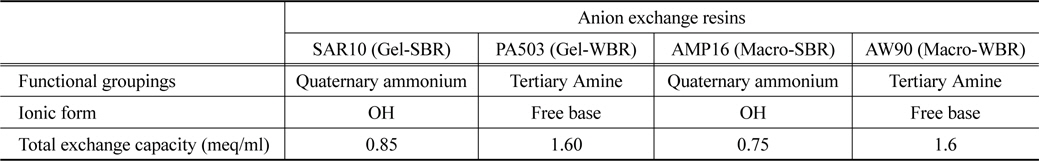
본 연구에 사용된 음이온교환수지는 4종류로 AMP16, SAR10, AW90 (Trilite, Yiryoong Chemical, KOR), PA503 (Pure resin Co., CHN)이 사용되었다. 수지들의 물리·화학적 특성은 Table 1에 나타내었다. 강염기성 음이온교환수지인 SAR10과 AMP16은 사차 암모늄기를 가지며 OH−를 교환이온으로 가진다. 약 염기성 음이온교환수지인 AW90과 PA503은 삼차 암모늄기를 가지고 유리 아민 형태로 존재한다.
[Table 1.] Physico-chemical properties of anion exchange resins
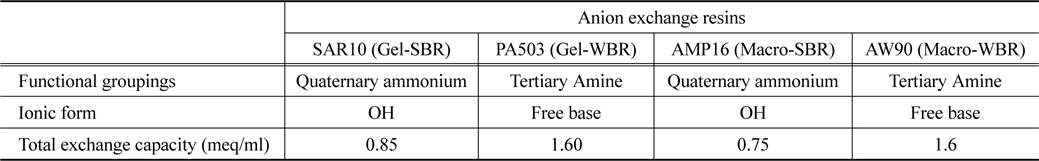
Physico-chemical properties of anion exchange resins
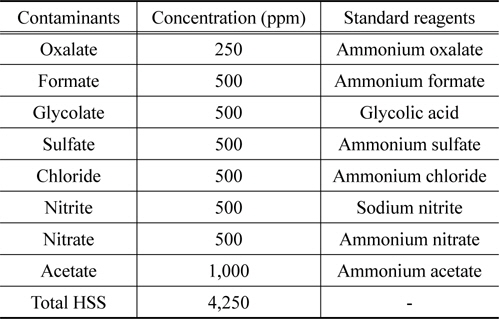
대상 HSS는 Haws[16]와 Rooney et al.[6]의 이전 연구를 참고하여 glycolate, formate, oxalate, chloride, acetate, sulfate, nitrate, nitrite를 대상으로 하였고 습식아민 공정에서 장치의 부식을 제한하기 위해 제시된 최대 농도[8,17]를 기준으로 하였다. 오염시료의 제조는 30 wt%의 MEA 용액에 HSS로 옥살산 암모늄, 포름산 암모늄, 염화 암모늄(Kanto Chemical, JPN)과 황산 암모늄, 아질산나트륨, 질산암모늄, 아세트산암모늄(Junsei Chemical, JPN) 등의 시약들을 Table 2와 같이 녹여 사용하였다. 재생 용액은 NaOH (Daejung Chemical, KOR)를 증류수에 녹여 제조하였다.
[Table 2.] Concentration of the major HSS contaminants in 30 wt.% MEA absorbent
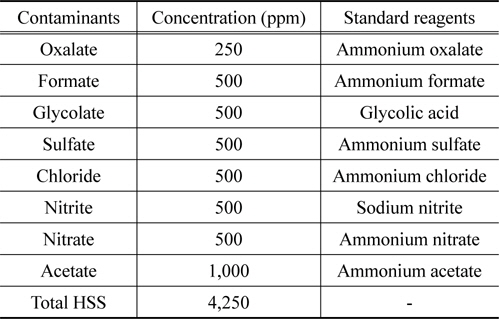
Concentration of the major HSS contaminants in 30 wt.% MEA absorbent
회분식 HSS 제거 실험은 회분식 교반기(Shaking Incubator, SH-802F. Seyoung Scientific)를 사용하였으며 오염시료에 이온교환수지를 주입하여 48 hr 동안 평형상태에 도달하게 하였다. 이온교환수지는 SAR10, AMP16, AW90, PA503을 대상으로 선정하였다. 시료의 pH는 CO2 가스를 주입하여 조절하였으며 pH 8~12까지의 범위로 하였다. 수지 주입량을 결정하기 위해 0.01~0.07 g/mL 수지를 주입하였으며 온도 변화에 따른 영향을 파악하기 위해 306~326 K 범위로 변화시켰다. HSS 제거가 끝난 후 수지의 재생용액은 NaOH 용액을 사용하였다. 수지의 재생실험은 NaOH의 농도 1~5 M, 온도 306~326 K로 각 변수에 대한 영향을 분석하였다.
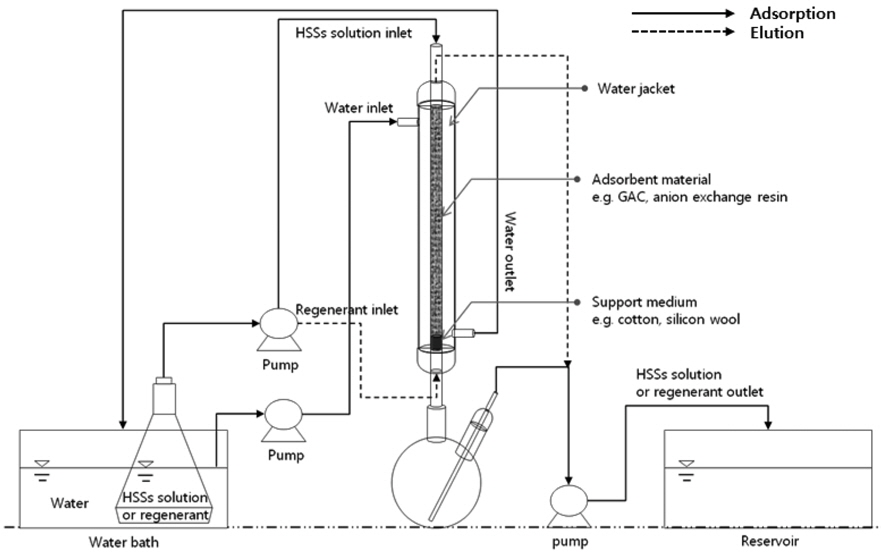
연속식 실험은 회분식 실험을 통해 결정한 조건을 바탕으로 실험하였으며 Figure 1과 같이 실험 장치를 설치하였다. 실험 장치로 워터재킷이 설치된 층 높이 300 mm, 내경 10 mm의 유리 칼럼, 항온조(WB-R203B, Dooyoung, KOR), 정량펌프(7524-55, Masterflex, USA)를 사용하였다. 연속식 HSS 처리 실험은 유량 6 mL/min, 온도 316 K 조건에서 수행하였다. 실험 후 HSS 농도를 측정하기 위해 이온 크로마토그래피(Thermo-Fisher Dionex, IonPac A815-5 µm Analytical Column 3 × 150 mm, IonPac AG15-5 µm Guard Column 3 × 30 mm)로 샘플을 분석하였다.
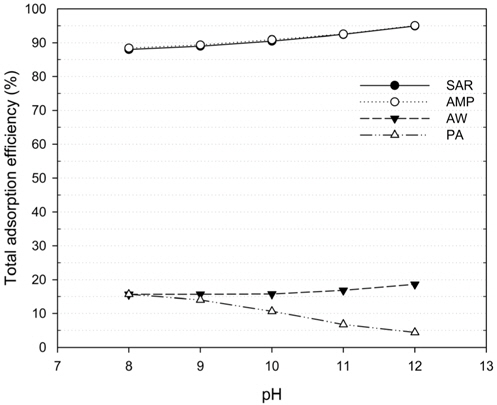
HSS 제거에 가장 적합한 음이온교환수지를 선정하기 위해 각 수지의 종류에 따른 제거효율을 분석하였다. 실제 공정에서 CO2를 흡수한 아민 용액의 pH가 변동되는 것을 고려하여 실험에 사용된 아민 용액은 pH 12로 CO2를 주입하여 pH를 조절하였으며 최대 pH 8까지 감소하였으므로 pH 범위를 pH 8~12로 하였다. Figure 2에서와 같이 각 수지 종류의 pH에 따른 HSS 제거 효율을 분석한 결과, 강염기성 음이온교환수지 중 SAR10의 총 제거효율은 pH 12 (94.9%) > pH 11 (92.5%) > pH 10 (90.5%) > pH 9 (89.0%) > pH 8 (88.0%)으로 나타났으며 AMP16의 경우 pH 12 (95.9%) > pH 11 (92.6%) > pH 10 (90.9%) > pH 9 (89.4%) > pH 8 (88.4%)로 SAR10과 유사하게 나타났다. 약염기성 음이온교환수지인 AW90과 PA503은 각각 pH 12에서 18.6%, pH 8에서 15.7%의 제거효율로 매우 낮게 나타났다. 이는 2.1절의 설명과 같이 강염기성 음이온교환수지는 모든 pH 범위에서 강한 해리가 일어나는 반면, 약염기성 음이온교환수지는 산성조건에서 해리가 일어나는 유리염기 형태를 가지기 때문인 것으로 판단된다. 또한 본 실험 조건에 적합한 강염기성 음이온교환수지는 pH가 증가할수록 HSS 제거효율이 높아지는 경향을 보인다. 이는 pH가 낮아져 양성자가 부가(protonation)되면 흡착질의 (−)가 중화되어 음이온의 성질이 사라지게 되므로 OH−와 교환되지 않기 때문에 제거 효율이 감소하는 것으로 판단된다[18]. 결론적으로 강염기성 음이온교환수지인 SAR10과 AMP16가 적절하다고 판단되었으며 상대적으로 구매비용이 낮은 SAR10을 최적 수지로 선정하였다.
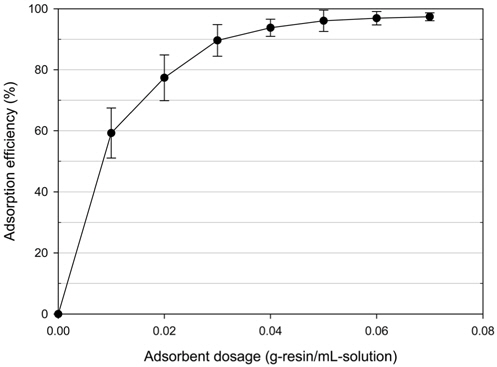
이온교환수지의 주입량 결정을 위해 주입량 0.01~0.07 g/mL의 범위로 실험을 수행하였다. 이온교환수지, SAR10의 주입량 변화에 따른 HSS 제거효율을 Figure 3에 나타낸 결과, 0.07 g/mL (97.4%) > 0.06 g/mL (96.9%) > 0.05 g/mL (96.1%) > 0.04 g/mL (93.8%) > 0.03 g/mL (89.6%) > 0.02 g/mL (77.4%) > 0.01 g/mL (59.2%) 순으로 높게 나타났다. 수지의 주입량이 늘어날수록 수지가 제공하는 교환기가 증가하여 흡착효율도 증가하는 경향을 보인다. 주입량이 0.01 g/mL에서 0.05 g/mL으로 증가할 때 HSS 흡착효율이 급격하게 증가하였으나 약 0.05 g/mL부터 증가율이 미미하며 거의 일정하게 나타났다. 따라서 본 실험을 통해 HSS 제거에 필요한 최소 주입량은 0.05 g/mL로 판단되었으며, 이를 최적 주입량으로 결정하였다.
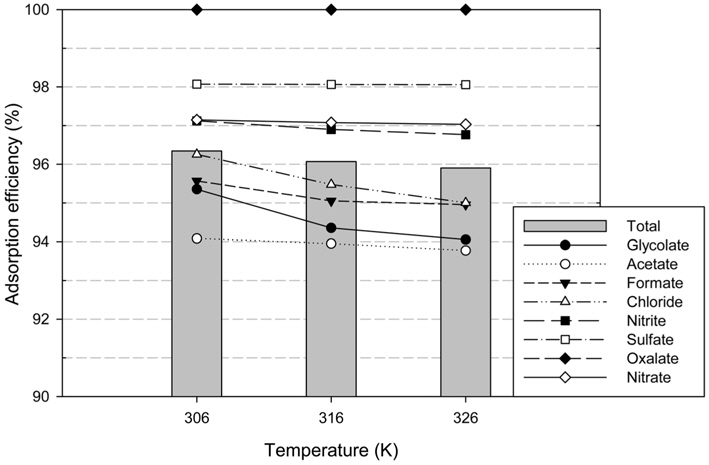
음이온교환수지가 HSS를 제거하기 위해 이용될 때 공정의 온도 범위 내에서 온도 변동에 따른 영향을 파악하기 위해 일반적인 아민 용액의 운전 온도 범위[19-20]를 고려하여 306, 316, 326 K 조건에서 48 hr 동안 교반하였다. Figure 4에서 보듯이 실험결과는 306 K (96.3%) > 316 K (96.1%) > 326 K (95.9%)로 온도 증가에 따라 효율이 떨어지는 경향으로 나타났다. 이러한 실험 결과는 온도가 증가함에 따라 수지가 열화하기 때문인 것으로 판단된다. SAR10과 같은 강염기성 음이온교환 수지에서 가장 열적으로 민감한 결합은 질소원자와 알콜기(−OH)의 결합으로, 온도의 증가에 따라 알콜기를 손실한 수지는 염기가 약해져 흡착 효율이 감소한다. 하지만 각 온도에 따른 효율간의 차이가 1% 이내로 나타나 모든 온도 범위에서 높은 효율을 나타내므로 온도 변화가 공정의 효율에 미치는 영향은 적을 것으로 예상된다.
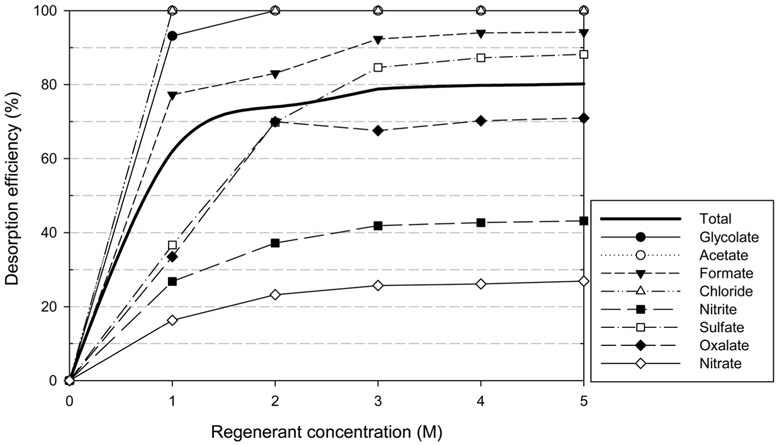
수지 재생 시 최적 재생용액 농도를 결정하기 위해 앞서 최적조건으로 HSS를 흡착시킨 이온교환수지를 사용하였으며, 일반적으로 사용되는 재생용액 중 OH− 교환기를 제공할 수 있는 NaOH 용액[21]을 사용하였다. 재생용액 농도 범위는 1~5 M로 하였으며 NaOH 용액으로 탈착실험을 수행한 결과를 Figure 5에 나타내었다. 실험 결과 5 M (80.2%) > 4 M (79.8%) > 3 M (78.8%) > 2 M (74.0%) > 1 M (62.0%) 순으로 높은 탈착효율이 나타났으며, 수지의 재생은 NaOH의 농도가 높아질수록 증가하였다. 3 M 이상의 농도에서는 탈착효율의 증가가 거의 없고 일정하게 나타나 재생용액 농도를 높이는 것이 효과가 미미한 것으로 판단된다. 따라서 HSS를 이온교환수지에서 탈착하기 위해서 NaOH 용액 3 M을 최적 농도로 결정하였다.
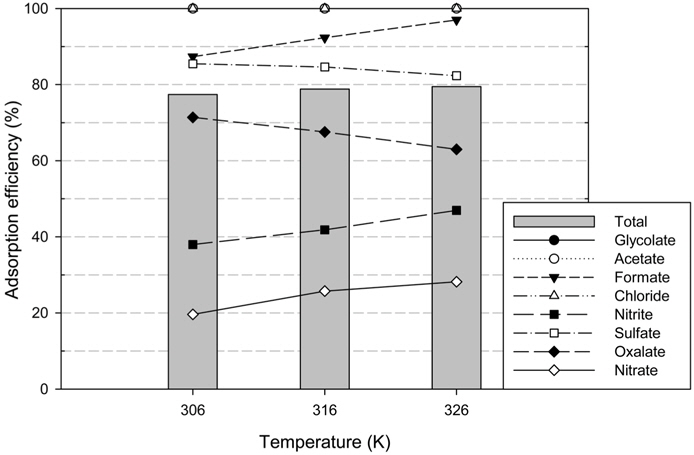
이온교환수지를 재생 공정의 운전 온도에서 온도의 변화에 따른 영향을 파악하기 위해 HSS의 탈착효율을 분석하였다. 최적조건으로 HSS를 제거한 후, 306, 316, 326 K 조건에서 탈착을 수행한 결과, Figure 6과 같이 총 HSS의 탈착효율은 326 K (79.5%) > 316 K (78.8%) > 306 K (77.4%)로 온도가 높아질수록 증가하며 개별적인 HSS 물질들도 대체적으로 같은 경향을 나타내었다. 이는 재생용액에 존재하는 OH− 이온과 흡착되었던 HSS 물질의 운동성이 커지며 확산운동이 증가한 결과로 보인다. 또한 온도가 증가함에 따라 호프만 열화가 발생하므로 수지가 HSS를 흡착하고자 하는 힘이 약해지기 때문에 탈착률이 증가하는 것으로 판단된다. 하지만 탈착효율의 차이는 약 2% 정도로 비슷하게 나타났기 때문에 공정의 온도 범위 내에서 온도변화가 수지 재생공정에 미치는 영향은 매우 작은 것으로 판단된다.
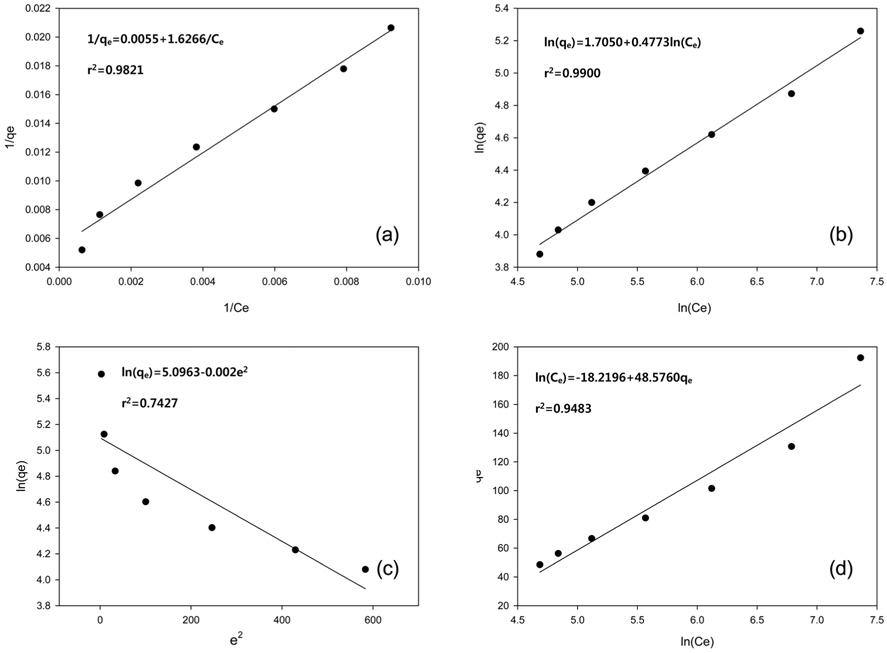
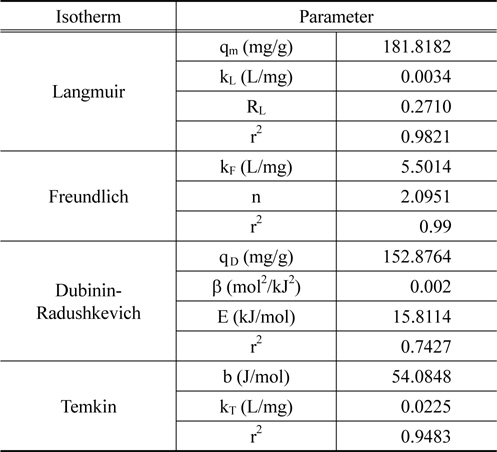
등온흡착실험을 통해 실험값을 Langmuir, Freundlich, Dubinin-Radushkevich, Temkin 등온흡착식에 적용한 결과는 Figure 7와 같고 Table 3에 계산 결과 등온흡착 파라미터를 나타내었다. Langmuir 등온흡착식은 식 (7)로 나타내며 Ce는 평형흡착농도(mg/L), qe는 평형흡착량(mg/g), kL은 Langmuir 상수(L/mg), qm은 최대 흡착량(mg/g)을 의미한다[22,23]. Lagnmuir 등온흡착식에서 구해진 qm은 181.8182 mg/g, kL은 0.0034으로 나타났다. kL을 이용하여 분리계수 또는 평형계수로 부르는 무차원 상수 RL을 식 (8)을 통해서 구할 수 있다. RL은 0.2710으로 0 < RL < 1의 범위 안에 포함되어 흡착처리공정에 적합하다는 것을 알 수 있다[24].
[Table 3.] Isotherm parameters for the adsorption of HSS on SAR10
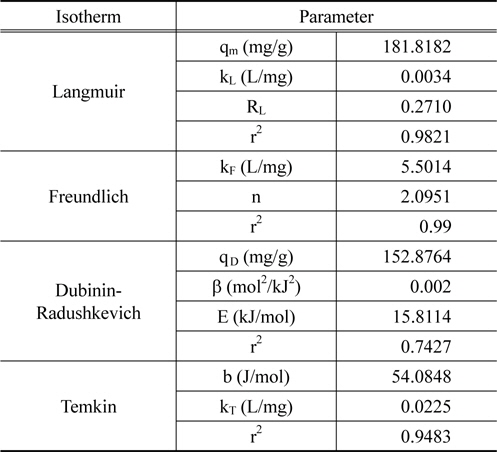
Isotherm parameters for the adsorption of HSS on SAR10
Freundlich 등온흡착식[25]은 식 (9)와 같이 나타낼 수 있으며 kF은 Freundlich 상수(L/mg), n은 흡착 동력의 크기를 나타내는 상수이다. Freundlich 등온흡착식으로부터 kF는 5.5014, n은 2.0951이며 이 때 n이 2보다 큰 값을 가지므로 양호한 흡착(favorable adsorption) 특성을 가진다고 판단된다[7,26].
Dubinin-Radushkevich 식[27]은 식 (10)와 같이 선형으로 나타낼 수 있다. qd는 최대흡착량(mg/g), β는 흡착에너지 상수(mol2/kJ2), ε는 potential 에너지를 나타내며, ε는 식 (11)와 같다. 흡착에너지, E(kJ/mol)는 β를 이용하여 식 (12)을 통해 구할 수 있다. Dubinin-Radushkevich 식을 통하여 qd는 152.8764 mg/g, β는 0.002, E는 15.8114 kJ/mol로 나타났다. E는 8에서 16 kJ/mol 범위에 포함될 때 화학적 흡착 특성을 가지며[28] 특히 이온교환에 해당하므로[12] 본 연구를 설명할 수 있는 것으로 판단된다.
Temkin 식[29]은 식 (13)와 같이
각 등온흡착식의 결정계수(r2) 값을 비교하였을 때, Freundlich (0.9900) > Langmuir (0.9821) > Temkin (0.9483) > Dubinin-Radushkevich (0.7427) 순서로 높게 나타났으며 Freundlich 등온흡착모델이 HSS 흡착에 가장 적합한 모델로 나타났다. Freundlich 등온흡착모델의 경우 불균일한 표면의 기상 및 액상 흡착 현상 설명에 유용하며 실제 액상 흡착은 불균일한 다분자층에 의해 이루어지므로 이온교환수지에서의 HSS 흡착을 잘 설명할 수 있는 것으로 판단된다.
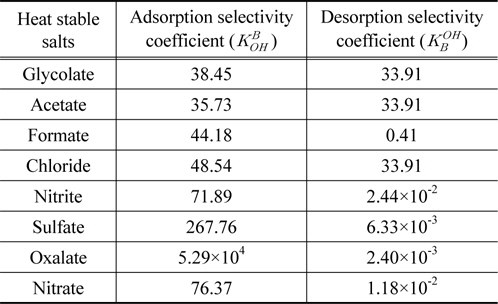
HSS를 수지로 처리할 때 HSS와 수지의 친밀도를 분석하기 위해 최적조건에서의 흡·탈착 평형 데이터를 사용하여 흡·탈착 선택계수를 계산하였다. 각 실험에서 완전히 흡착되거나 탈착된 경우 효율을 99.99%라고 하였다. 흡착 선택계수 계산시 총 계에 존재하는 OH− 이온의 농도는 SAR10 이온교환수지의 교환 용량인 0.85 meq/mL를 바탕으로 계산하였으며 NaOH는 수용액에서 완전히 해리한다고 가정하였다. 계산결과는 Table 4에 나타내었으며 흡착 선택계수의 경우, oxalate > sulfate > nitrate > nitrite > chloride > formate > glycolate > acetate로 나타났으며 흡착효율의 순서와 동일한 경향을 보였다. 이는 2.2절에서 설명하였던 바와 같이 전자가 및 원자가가 높을수록 수지와의 친밀도가 높기 때문이다. 전자가 수가 가장 큰 영향을 미치는 것으로 판단되며 formate, glycolate, acetate 등 유기산의 1가 음이온 HSS는 소수성을 띠므로 친수성인 수지와 친밀도가 낮은 것으로 나타났다. 탈착 선택계수는 glycolate ≒ chloride ≒ acetate > formate > nitrite > nitrate > sulfate > oxalate 순으로 나타나며 탈착 선택계수가 높을수록 수지의 재생효율이 높은 것을 의미한다. 흡착효율이 높은 물질은 수지와의 친밀도가 높아 탈착이 어렵기 때문에 흡·탈착 선택계수는 서로 반대의 경향을 나타낸다. 유기산 종류의 HSS는 모두 3 M에서 완전히 용출되었기 때문에 탈착 선택계수의 값이 거의 같게 나타났다. 유기산 HSS의 탈착 선택계수가 높았으며 2가 음이온의 값은 낮게 나타났으므로 2가 음이온의 탈착효율을 높이기 위한 연구가 필요한 것으로 판단된다. 실제 이온교환 공정에서 선택계수는 공정에서 각 이온의 유출 속도 등을 예상하기 위해 사용되고 있으며 이와 같이 본 연구를 통해 각 CO2 흡수제에서 발생하는 HSS 물질에 따라 선택계수를 계산하여 HSS 제거 및 수지 재생 공정의 조건을 조절할 수 있다.
[Table 4.] Selectivity coefficients of HSS from SAR10 anion exchange resins
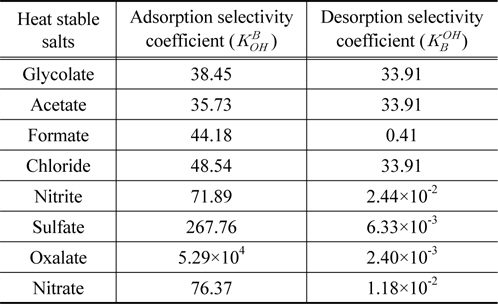
Selectivity coefficients of HSS from SAR10 anion exchange resins
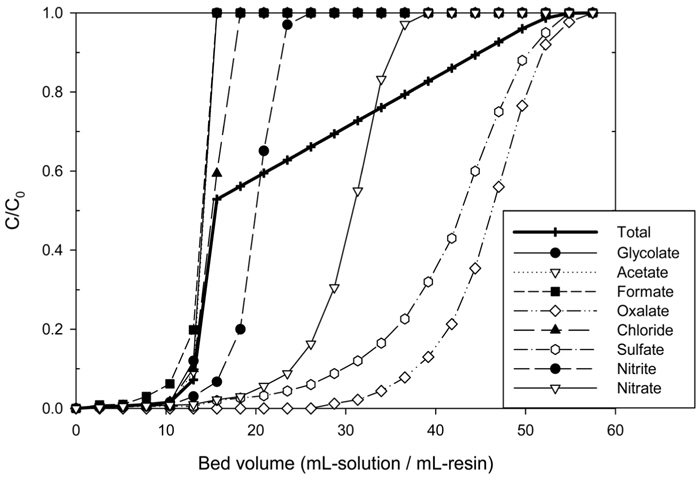
회분식 실험을 바탕으로 결정한 조건 하에서 HSS의 연속식 제거에 대한 파과곡선을 Figure 8에 나타내었다. 오염시료는 유량 6 mL/min로 칼럼에 주입하였다. 실험결과, 수지에 각 HSS 물질이 포화되는 순서는 oxalate > sulfate > nitrate > nitrite > chloride > formate ≒ glycolate ≒ acetate로 나타났다. 이는 전자가와 원자가가 높을수록 수지와의 친밀도가 더 높으며, 유기산염(formate, glycolate, acetate)은 친수성인 수지와 달리 소수성을 가지기 때문에 따라 상대적으로 낮은 친밀도를 가지는 것으로 판단된다. 일반적으로 파과점은 파과곡선에서 상대농도(C/C0)가 0.05~0.1을 나타내기 시작하는 점을 말하며[30] 본 실험에서는 0.1로 하였다. 각 물질들의 농도를 합한 총 HSS의 파과곡선은 약 13.3 BV에서 파과점에 도달하였으며 57.46 BV에서 수지가 포화되는 것으로 나타났다. 따라서 수지의 HSS 제거 성능을 일정하게 유지하기 위한 최적 처리 용량은 13.3 BV인 것으로 판단된다.
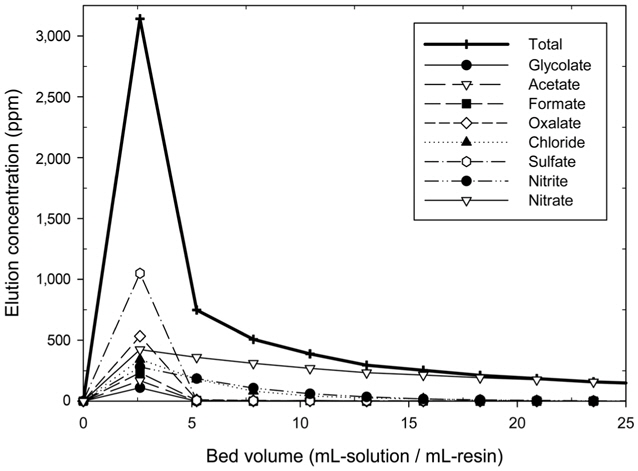
HSS로 포화된 이온교환수지를 재생하기 위하여 6 mL/min의 재생용액을 주입하였으며 수지로부터 HSS 용리곡선을 Figure 9에 나타내었다. 용출되는 최고 농도는 sulfate > oxalate > acetate > glycolate > formate > nitrate > nitrite > chloride 순으로 탈착되었다. 대부분의 HSS는 NaOH 용액 2.61 BV이 소모되었을 때 최고 농도를 나타냈으며 5.22 BV까지 대부분이 탈착되었지만 nitrate, nitrite, chloride는 5.22 BV 이후에도 탈착되며 더 많은 NaOH가 필요한 것으로 나타났다. 용리곡선 아래의 면적은 탈착량을 나타내며 총 HSS의 용리곡선을 볼 때 5.22 BV까지의 구간에서 대부분의 HSS가 용출되는 것을 알 수 있다. 따라서 HSS가 포화된 수지의 재생시 NaOH 소모량은 5.2 BV이 가장 효율적이라고 판단된다.
본 연구에서는 아민용액에서 공정의 효율을 저하시키는 HSS를 처리하기 위한 이온교환공정의 특성을 분석한 결과 다음과 같은 결론을 얻을 수 있었다.
1) 회분식 HSS 제거 공정에서 최적의 제거 효율은 강염기성 음이온교환수지인 SAR10을 사용하였을 때 주입량 0.05 g/mL, pH 12, 온도 316 K일 때 96.07%로 나타났으며, 수지의 재생시 NaOH 3 M로 316 K에서 탈착하였을 때 최적의 효율 78.80%을 얻을 수 있었다.
2) 등온흡착실험 결과로 Langmuir, Frendlich, Dubinin-Radushkevich, Temkin 등온흡착모델에 적용한 결과 Freundlich 모델에 가장 잘 적용되었으며 이는 수용액상에서 HSS의 제거를 잘 나타내는 것으로 판단된다. 최대흡착량은 152.88~181.82 mg/g이며 흡착 동력을 나타내는 계수 n의 값은 2.10으로 흡착이 쉽게 일어날 수 있음을 알 수 있었다.
3) HSS의 수지와의 친밀도에 대하여 선택계수를 계산한 결과 흡착 선택계수는 전자가, 원자가가 클수록 높게 나타났으며 소수성을 띠는 유기산 HSS가 친밀도가 낮은 것으로 나났다. 흡·탈착 선택계수는 흡착효율 및 탈착효율의 순서와 유사한 경향으로 나타났으며 2가 음이온의 흡착률이 높고 탈착이 어려운 것으로 나타났다. 2가 음이온의 탈착 효율이 낮으므로 이를 해결하기 위한 연구가 필요한 것으로 판단된다.
4) 회분식 HSS 처리 실험으로 구한 운전조건을 통해 연속식 HSS 제거의 파과곡선을 분석한 결과 파과점에 이르는 순서는 oxalate > sulfate > nitrate > nitrite > chloride > formate ≒ glycolate ≒ acetate로 나타났으며 이온교환수지의 성능 유지를 위한 최적 처리용량은 13.3 BV로 나타났다. 연속식 수지 재생 시 용출되는 최고 농도는 sulfate > oxalate > acetate > glycolate > formate > nitrate > nitrite > chloride 순으로 탈착되었으며 NaOH 소모량은 5.2 BV이 가장 적합하였다.
본 연구에서는 음이온교환수지를 이용한 HSS의 처리에 관하여 공정을 최적화하였고 음이온교환수지에 대한 HSS의 선택계수를 산정하여 흡·탈착 친밀도를 정량적인 값으로 나타낼 수 있었다. 본 연구를 통해 아민 용액에서 발생하는 HSS의 농도를 낮은 수준으로 유지하여 공정 효율을 높일 수 있을 것으로 판단된다.