The aim of this study was to evaluate influences of titanium dioxide (TiO2) concentrations and irradiation times on growth of
통성 혐기성이며 그람 양성균인
빛은 다양한 파장으로 구별되고 이에 따라 에너지를 갖는다. 이러한 빛 에너지를 이용한 광촉매(photocatalyst)는 빛(photo)과 촉매(catalyst)의 합성어로 빛을 에너지원으로 이용하여 산화, 환원반응을 촉진시키는 반도체 물질을 의미한다5). 광촉매 반응으로 일어난 산화, 환원 반응은 유기물을 이산화탄소와 물로 분해시키며 미생물의 생장을 억제하거나 사멸하는 능력을 가지고 있다6).
광촉매로서 이용될 수 있는 물질 중 이산화 티타늄(TiO2)은 인체에 적용하기 좋은 광촉매 소재로 알려져 있다7). 지구상에 많이 존재하는 원소인 티타늄이 산화된 형태로 존재하는 이산화 티타늄은 자원적으로 풍부하고 가격이 저렴하다. 또한 이산화 티타늄은 내마모성, 내구성이 좋고, 물질 자체가 안전하고 쉽게 변하지 않으며, 인체에 독성을 나타내지 않는다. 이와 같이 이산화 티타늄은 촉매제로 사용하기에 많은 장점을 가지고 있어 광촉매로 가장 많이 사용된다8). 이산화 티타늄 광촉매는 380 nm 이하의 빛에 의해 수산화 라디칼(hydroxyl radical: ˙HO)과 초과산화 이온(superoxide ion: O2−)을 생성하여 강력한 산화반응을 일으킨다. 이러한 활성 산소들은 유기물을 효과적으로 분해하기 때문에 항균, 탈취, 유해물 제거 등에 활용이 가능하다9). 이산화 티타늄의 광활성화(photoactivity) 연구는 20세기부터 시작되었고 1956년 Mashio 등이 이산화 티타늄의 자기산화(auto oxidation) 반응을 보고한 이후10) 전세계적으로 빛을 이용한 광촉매에 관한 연구가 활발히 진행되고 있다. 대부분의 연구에서 물이나 공기 중의 유독 물질을 정화하는 데 사용되었으며 조명 기구 및 주방용기, 건축자재 등의 자정작용에 사용되며, 거울이나 창 내벽 등의 유리의 김서림 방지에도 유용하게 사용되고 있다. 또한 수질, 토지 오염물과 같은 환경 유해물질, DNA, 내독소, 바이러스, 미생물을 분해하는 등 현재까지 광범위하게 연구되고 있다9,11).
치의학 분야에서는 교정용 와이어에 이산화 티타늄을 합성하거나 코팅하여 항균작용을 할 수 있게 하는 연구가 진행되고 있으며 각종 구강병을 야기하는 세균을 대상으로 항균효과를 평가하는 연구가 진행되었다5). 하지만 지금까지 이산화 티타늄을 이용하여 세균에 대한 항균효과를 조사한 연구는 대부분 ultraviolet (UV) 영역의 빛(100∼400 nm)을 사용하였으며,
최근 구강 내 미세변화를 탐지하기 위해 가시광선 영역의 빛을 사용하는 QLF-D Biluminator (QLF-D; Inspektor Research System BV, Amsterdam, Netherlands)라는 장비가 소개되었다. QLF-D는 405 nm의 가시광선을 이용하여 치아 또는 치면세균막을 구성하는 세균의 대사산물 중 하나인 포피린(porphyrin) 계열 물질의 형광(fluorescence) 현상을 유도하여 육안으로 쉽게 탐지할 수 있도록 도와주는 탐지기구이다17,18). 하지만 아직 QLF-D 시스템의 광원을 활용하여 구강의 미세변화 탐지 이외의 작용을 탐색한 연구는 전혀 없는 실정이다.
이에 본 연구에서는 인체에 유해성 없이 광촉매를 이용한 치면세균막 관리를 하기 위해 현재 임상현장에서 사용하고 있는 QLF-D의 405 nm light emitting diode (LED)를 활용해 보고자 하였다. 이를 위해 다양한 농도의 이산화 티타늄을 적용하고 파장별 광조사 시간을 달리하여
본 연구에서는
이산화 티타늄의 농도에 따른 항균력을 비교하기 위해 분말형태인 이산화 티타늄(titanium dioxide anatase type; Sigma-Aldrich)을 멸균된 증류수에 혼합하여 0.01, 0.1, 1.0, 10.0 mg/ml의 농도가 되도록 제조하였다. 각 농도별로 제조한 이산화 티타늄 용액 4.95 ml에 세균의 최종농도가 104 colony-forming unit (CFU)/ml로 조절된 배양액 50
[Table 1.] Discriptions of Light Sources Used in This Study

Discriptions of Light Sources Used in This Study
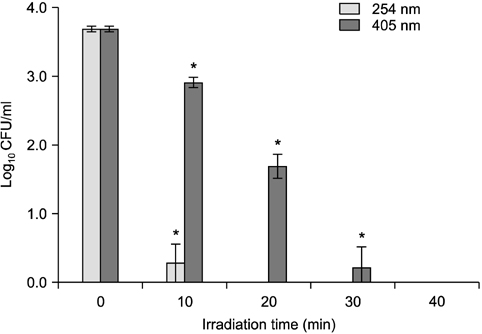
각 광원별 조사시간에 따른 항균력을 확인하기 위해 분말형태인 이산화 티타늄을 멸균된 증류수에 혼합하여 0.1 mg/ml의 농도로 이산화 티타늄 용액을 제조하였다. 해당 용액 4.95 ml에 세균의 최종농도가 104 CFU/ml가 되도록
이산화 티타늄 농도 및 광조사 시간에 따른 항균력의 유의성을 검증하기 위해 일원분산분석(one-way ANOVA)을 수행하였다. 모든 자료의 분석은 PASW Statistics 18.0(IBM Co., Armonk, NY, USA)을 사용하여 유의수준 0.05에서 수행하였다.
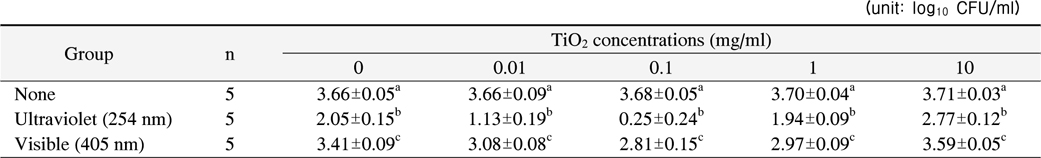
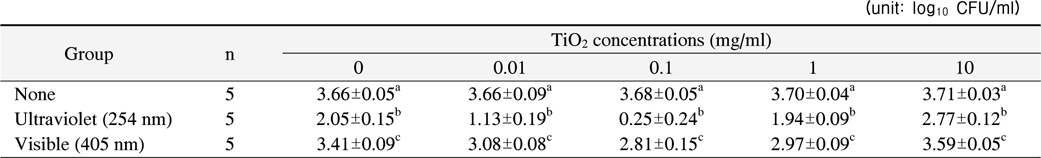
1. 이산화 티타늄 농도에 따른 S. mutans 항균 효과
광조사를 하지 않은 경우 이산화 티타늄의 농도에 따른 항균력의 차이는 보이지 않았다(p>0.05). 하지만 이산화 티타늄 없이 254 nm 또는 405 nm의 빛을 10분간 조사한 경우 각각 44%, 7%의 생균수 감소를 나타냈고 이는 광조사하지 않은 대조군과 통계적으로 유의한 차이를 나타냈다(p<0.001).
모든 이산화 티타늄의 농도에서 두 가지 광원 모두
Bactericidal Effects of Photocatalysts on Streptococcus mutans according to TiO2 Concentrations
광촉매에 의한
최근 다양한 항균처리 방법 중 특정 빛을 이용하여 항균력을 조절할 수 있는 광역학 처치법(photodynamic treatment)이 새롭게 대두되고 있으며 광촉매 또는 광민감제와 빛을 함께 이용하여 병원성 세균을 억제하는 방법이 연구되고 있다19,20). Salinas 등21)은
이산화 티타늄은 결정구조에 따라 rutile, anatase 및 brookite 3종류로 구분된다. 이들 중 광촉매 기능을 이용한 항균 작용에는 anatase 이산화 티타늄이 가장 효과적이라고 알려져 있다6). Rutile은 이산화 티타늄 원자가 2개 포함되어 있는 반면 anatase는 직선상의 이산화 티타늄을 4개 가지고 있는 구조이기 때문에 anatase가 rutile에 비해 강한 환원력을 가지게 된다. 또한 이산화 티타늄이 빛에너지를 흡수하여 전자가 생성되는 전도대의 위치가 rutile보다 anatase에서 더 안정된 위치에 있고 더욱 큰 에너지를 발산할 수 있어 본 연구에서는 anatase type의 이산화 티타늄을 이용하였다.
본 연구에서는 자외선과 가시광선 영역의 빛을 사용한 경우 모두에서 이산화 티타늄의 농도가 0.1 mg/ml일 때 가장 높은 항균력을 나타낸 반면 세균에 대한 선행연구들은 이산화 티타늄의 농도가 0.5∼1.0 mg/ml에서 가장 높은 항균력을 보인 것으로 보고하였다6,21). 본 연구에서 이용한 이산화 티타늄은 금속성 물질로 물에 잘 용해되지 않으며 실온에서 흰색의 분말형태로 존재하기 때문에 용액 안에서 부유되어 불투명한 환경을 재현한다. 따라서 외부의 빛이 내부까지 잘 투과하지 못하게 되고 이로 인해 광촉매 반응이 유도되지 않을 수 있다. 이를 극복하고자 본 연구에서는 반응용액을 지속적으로 교반해 주었기 때문에 보다 낮은 농도에서 항균력이 최적화된 것으로 생각된다. 한편 각기 다른 파장의 광원에 따라 TiO2의 농도별 항균력은 254 nm를 이용한 경우 이산화 티타늄의 농도가 0.1, 0.01, 1.0, 10.0 mg/ml의 순서로 높게 나타났고, 405 nm를 이용한 경우 이산화 티타늄의 농도가 0.1, 1.0, 0.01, 10.0 mg/ml의 순서로 높게 나타났다. 이러한 결과는 두 가지 광원 모두 광촉매의 농도가 0.1보다 낮거나 높으면 항균력이 떨어지고 세균을 효과적으로 사멸시키기 위해서는 파장에 따라 적절한 농도 조건이 존재한다는 사실을 의미한다.
본 연구에서는 또한 현재 임상현장에서 초기 우식 병소 및 성숙된 치면세균막을 탐지하는 데 활용하는 405 nm의 광원을 이용하여 기존의 UV (254 nm)를 통해 항균력을 나타내는 이산화 티타늄의 광촉매 반응을 유도하여 그 가능성을 확인하고 최적의 조건을 탐색함으로써 임상현장에 적용 가능한 새로운 항균 처치법을 제안해 보고자 하였다. 본 연구 결과에서 이산화 티타늄 농도가 0.1 mg/ml일 때, 20분간 광조사시 405 nm의 빛은 약 54.34%의 항균력을 나타낸 반면 254 nm의 빛의 경우는 완전히 사멸하였다. 이와 유사하게 최근 Gao 등22)은 파장이 다른 ultraviolet-A (UVA, peak wavelength=360 nm)와 ultraviolet-C (UVC, peak wavelength=250 nm)를 이용하여 이산화 티타늄 표면의 UVphotofunctionalization에 대한 차이를 연구한 결과, UVA를 이용한 것보다 UVC를 이용한 것이 더 높은 생체활성을 나타냄을 보고하였다. 이는 파장이 짧을수록 빛에너지가 높아지는 이유에 기인하는 것으로 본 연구 결과와 유사한 효과로 볼 수 있다. 본 연구를 통해 도출한 결과에서 405 nm 빛의 경우는 조사시간을 40분까지 증가시켰을 때 104 CFU/ml의 균이 완전히 사멸되었으므로 이를 임상에 적용하기에는 많은 개선이 필요하다. 따라서 향후 저농도의 과산화수소를 통해 신속한 광촉매 반응을 유도함으로써 항균력을 개선하고 작용시간을 단축하기 위한 노력이 필요할 것이다.
본 연구에서 자외선 노출 없이 순수 이산화 티타늄만을 반응시켰을 경우 농도에 따른 차이가 나타나지 않았으므로 광조사 없이 이산화 티타늄만으로는
한편 본 연구에서는 부유성 세포를 대상으로 항균력을 평가했다는 한계점이 존재한다. 즉, 실제 구강 내 존재하는 세포는 치면세균막을 형성하고 있으며, 이로 인해 이산화 티타늄이 치면세균막의 내부로 침투할 가능성이 떨어질 수 있다. 하지만 이산화 티타늄은 강력한 산화력을 나타내기 때문에 치면세균막을 형성하는 불용성 유기물을 분해할 수 있을 것으로 예상된다. 만약 이산화 티타늄에 의해 치면세균막의 불용성 유기물이 쉽게 분해된다면 지속적인 빛 조사를 통해 치면세균막의 구조를 파괴시킬 수 있고 이를 통해 내부에 존재하는 세포에 영향을 주어 균을 사멸시킬 수 있을 것으로 예상된다. 따라서 향후 연구를 통해 치면세균막을 실험실 상에서 재현한 바이오필름 모델을 이용하여 불용성 유기물의 분해와 내부 세포의 사멸 가능성을 확인해야 할 것이다.