우리나라는 2007년부터 원료축산물에 대한 동물용의약품 잔류허용기준 설정을 강화하면서 관련 시험법을 식품공전에 등재하여 활용하고 있다. 더불어 국외에서는 국제식품규격위원회와 유럽연합의 규제 강화 추이에 따라 불검출기준 물질에 대한 MRL 설정 등 낮은 농도의 정량한계를 가지는 검증된 분석법 개발 등이 활발히 진행되고 있다. 따라서 본 연구는 가금류 중 잔류허용기준은 아직 설정되어 있지 않으나, 식품안전성 조사 및 연구 등을 위해서는 시험법의 확립이 필요한 nitroxoline의 닭고기 근육 중 잔류시험법을 개발하고자 하였다. 분석에 사용된 검체는 닭고기의 근육을 이용하였다. 검체에 아세트로니트릴을 가하여 추출한 후, 이를 감압 농축하여 메탄올로 녹인 다음 MCX 카트리지로 정제한 후 HPLC-PDA에 주입하였다. 기기분석은 C18 컬럼을 사용하였고, 0.1 % TBAOH-인산용액과 메탄올을 기울기 조건으로 하여 360 nm에서 측정하였다. 또한, 액체크로마토그래프-질량분석기를 통해 확인시험을 수행하였으며, 모든 검증은 CAC 가이드라인(CAC/GL 16, 1993; CAC/GL 71, 2009) 규정에 따라 실시하였다. 그 결과, nitroxoline의 LOQ는 0.02 mg/kg 수준이었고, 회수율은 72.9~88.1 %로 나타났다. 또한, 변동계수는 2.5~11.7 %로 CAC 가이드라인(CAC/GL 16, 1993; CAC/GL 71, 2009) 규정에 만족하는 수준이었다. 따라서 개발된 분석법은 잔류동물용의약품의 분석에 있어 보다 신속하고 경제적인 분석 및 모니터링에 적용 가능할 것으로 기대된다.
Nitroxoline is an antibiotic agent. It is used for the treatment of the second bacterial infection by the colibacillosis, salmonellosis and viral disease of the poultry. When the nitroxoline is indiscreetly used, the problem about the abuse of the antibiotics can occur. Therefore, this study presented the residue analytical method of nitroxoline in food for the safety management of animal farming products.
A simple, sensitive and specific method for nitroxoline in chicken muscle by high performance liquid chromatograph with PDA was developed. Sample extraction with acetonitrile, purification with SPE cartridge (MCX) were applied, then quantitation by HPLC with C18 column under the gradient condition with 0.1 % tetrabutylammonium hydroxide-phosphoric acid and methanol was performed. Standard calibration curve presented linearity with the correlation coefficient (r2) > 0.999, analysed from 0.02 to 0.5 mg/L concentration. Limit of quantitation in chicken muscle showed 0.02 mg/kg, and average recoveries ranged from 72.9 to 88.1 % in chicken muscle. The repeatability of measurements expressed as coefficient of variation (CV %) was less than 12 % in 0.02 and 0.04 mg/kg.
Newly developed method for nitroxoline in chicken muscle was applicable to food inspection with the acceptable level of sensitivity, repeatability and reproducibility.
Nitroxoline(5-nitro-8-hydroxyquinoline)은 항생제로서 항혈관 형성, 항암 및 항진균 효과를 광범위하게 나타낸다 (Karpińska
국내 축⋅수산용 동물용의약품의 최근 5년간 사용량은 약 13,000여톤 정도로 비교적 많은 양이 사용되고 있다(Shin
현재까지 임상 등에 관련된 몇몇 문헌(Karpińska
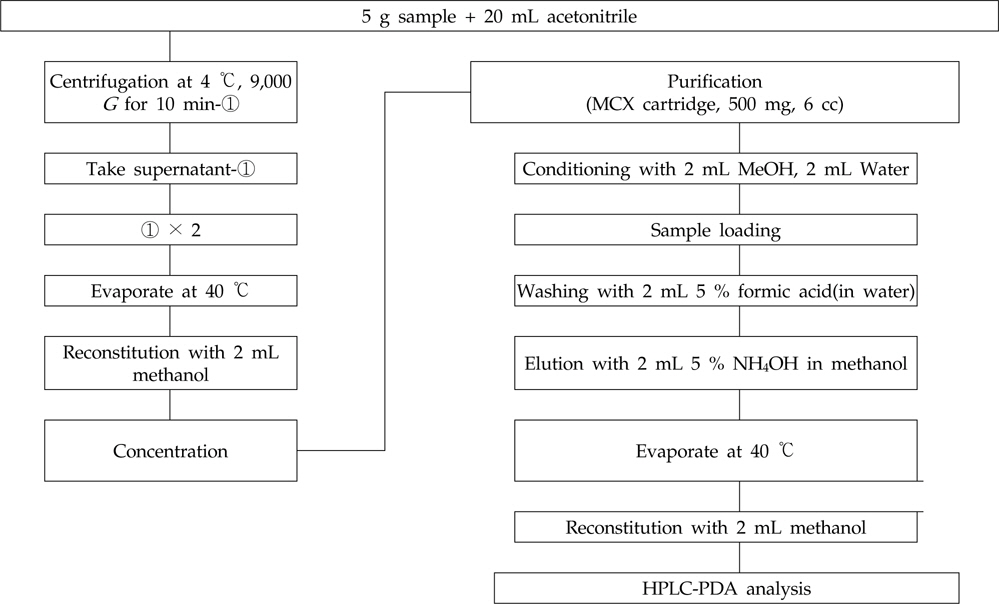
시중에서 유통되고 있는 가금류(닭고기)를 구입하여 공시험을 거쳐 nitroxoline이 잔류되지 않은 시료를 대상으로 회수율 시험을 하였다. 대상 시료의 근육을 믹서기로 마쇄하여 균질화한 후 20 g 단위로 소분하여 분석 전까지 냉동실(-20 ℃)에 보관하면서 사용하였다.
Nitroxoline(8-Hydroxy-5-nitroquinoline, 96.0 %) 표준품은 Sigma-Aldrich(St. Louis, MO, USA)로부터 구입하여 사용하였다. 표준용액은 메탄올(Merck, Darmstadt, Germany)을 사용하여 조제하였으며, nitroxoline의 물리화학적 특성은 Table 1에 나타내었다.
[Table 1.] Physicochemical properties and structure of nitroxoline

Physicochemical properties and structure of nitroxoline
액체크로마토그래피 이동상 및 전처리용 시약으로는 아세토니트릴 및 메탄올의 경우 HPLC급 시약(Merck, Darmstadt, Germany)을 사용하였다. 또한, 수산화암모늄, 개미산 및 인산은 특급 시약(Wako, Osaka, Japan)을 구입하여 사용하였고, TBAOH(tetrabutylammonium hydroxide solution(assay 55-60 % in water))는 Sigma-Aldrich(St. Louis, MO, USA)에서 구입하여 사용하였다. 분석에 사용한 고상추출 카트 리지(SPE)는 MCX 카트리지(mixed-mode cation exchange (500 mg, 6 mL), Waters, Bellefonte, PA, USA)를 이용하여 활성화 과정을 거친 후 사용하였다.
Nitroxoline 표준물질 약 10 mg을 정밀히 달아 메탄올에 녹여 100 μg/mL 표준원액으로 조제하였으며, 표준용액은 표준원액을 실험 전에 메탄올로 희석하여 사용하였다. 표준원 액과 표준용액은 모두 갈색병에 담아 -20 ℃ 냉동실에 보관하여 사용하였다.
균질화한 닭고기 근육 시료 5 g을 50 mL 원심분리관에 취하고 20 mL 아세토니트릴을 가한 후 진탕하여 추출 과정을 거쳤다. 이를 9,000
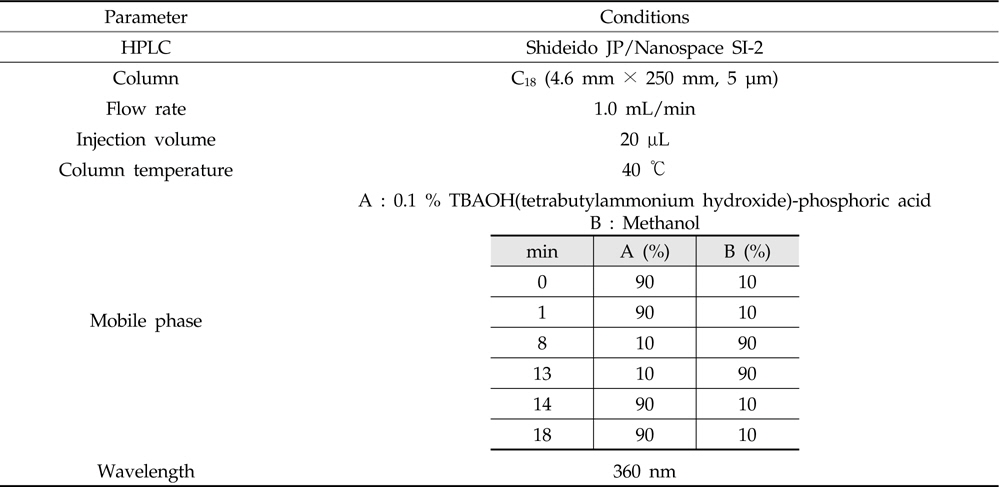
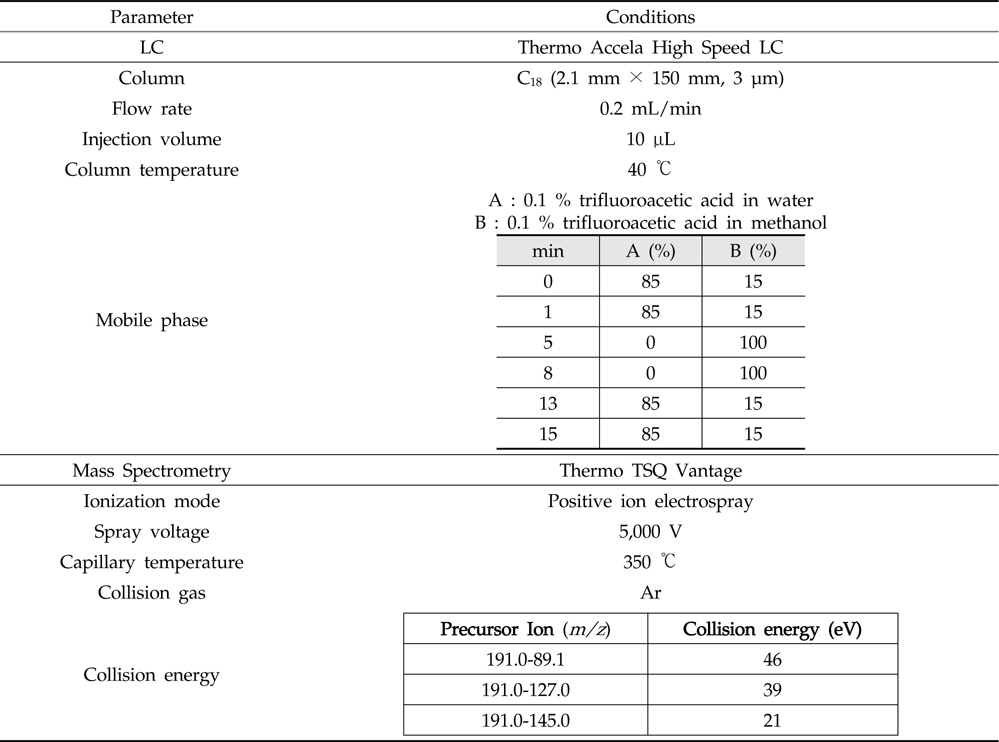
Nitroxoline의 잔류량은 PDA 검출기(photodiode-array detector)가 장착된 액체크로마토그래프(Shiseido JP/Nanospace SI-2, Tokyo, Japan)를 사용하였다. 분석용 컬럼은 XBridge C18(4.6 mm× 250 mm, 5 μm: Waters, Dublin, Ireland), 컬럼 온도는 40 ℃, 이동상으로는 용매 A: 0.1 % TBAOH-인산와 용매 B: 메탄올을 이용하여 용매기울기 조건으로 분석하였으며, 유속은 1 mL/min, 주입량은 20 μL로 하여 360 nm에서 측정하였다(Table 2). Nitroxoline의 확인 시험은 먼저 질량분석기 조건을 확립하기 위해서 표준용액을 사용하여 컬럼을 통과하지 않고 직접 탠덤 질량분석기(tandem mass spectrometry)로 도입하였 다. 텐덤 질량분석기를 통해 nitroxoline의 precursor ion을 선택하고 최적의 충돌 에너지(collision energy)를 선택한 다음 product ion을 탐색하여 표준물질에 대한 fragmentation pattern을 확인하였다(Table 3).
[Table 2.] HPLC-PDA parameter for the analysis of nitroxoline
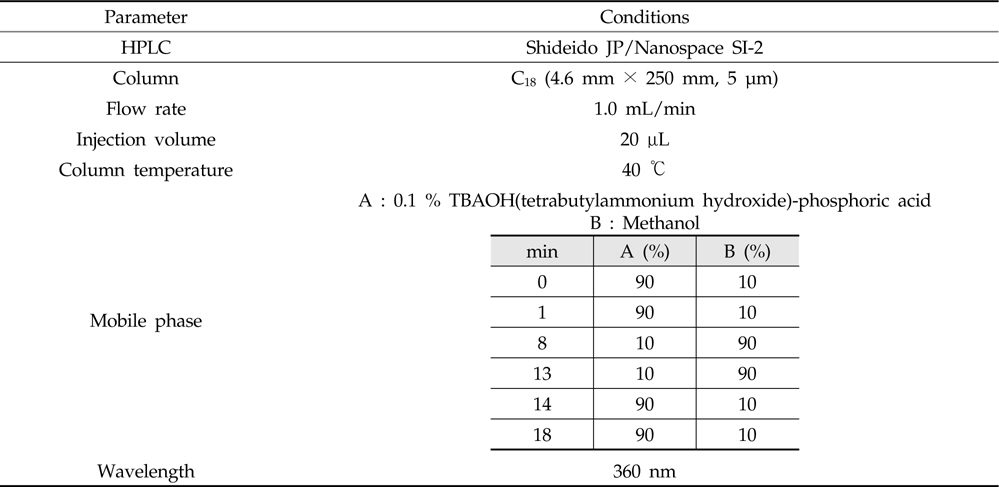
HPLC-PDA parameter for the analysis of nitroxoline
[Table 3.] LC-MS/MS parameter for the analysis of nitroxoline
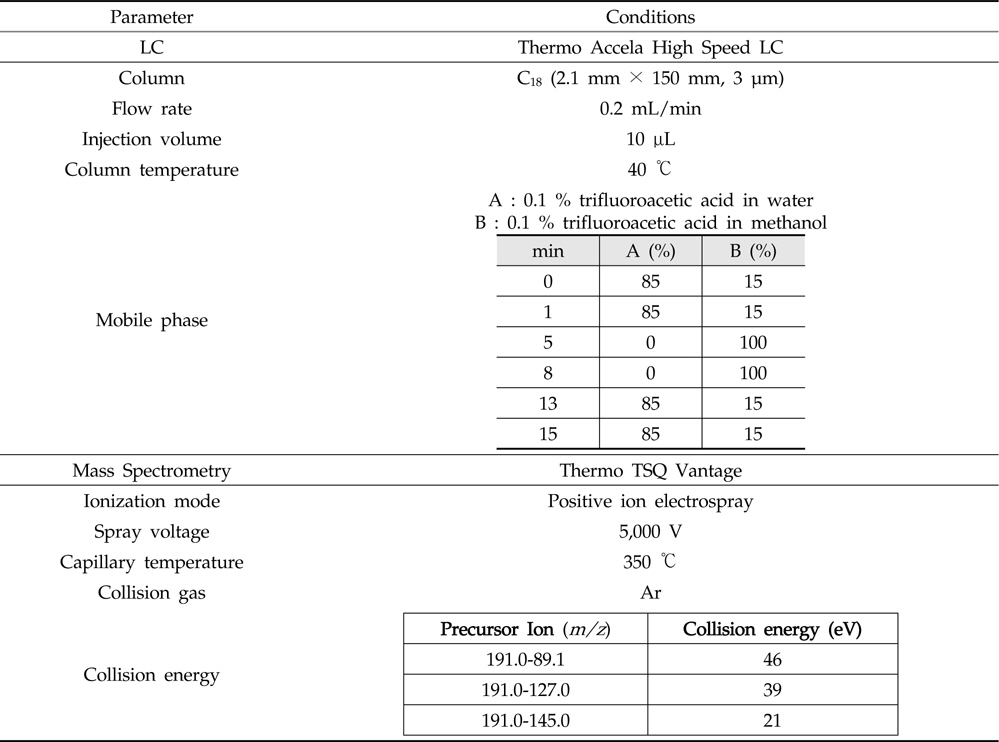
LC-MS/MS parameter for the analysis of nitroxoline
최종적으로 닭근육 시료를 이용하여 개발된 nitroxoline 의 분석법은 CAC Guide line(Codex Alimentarius Commission guidelines for the establishment of aregulatory programme for control of veterinary drug residues in foods; CAC/GL 16, 1993)에 준하여 직선성 (Linearity), 회수율, 정량 한계(LOQ), 재현성(Reproducibility) 등으로 유효성 검증을 실시하였다.
닭근육 시료로부터 nitroxoline 0.2-0.5 mg/kg의 농도에 대한 각각의 피크 면적을 이용하여 검량선을 작성하였고, 각 검량선의 상관 계수(coefficient of correlation, r2)를 구하였 다. 정량 한계는 분석결과를 수치화할 수 있는 최저 한계를 의미하는데, 각국 및 기관에서는 보통 S/N 6∼10 범위를 상용하고 있으며, 국내에 설정된 기준은 국제 기준을 수용하고 있다(Lee, 2012). 따라서 이를 근거로 하여 matrix blank에 첨가한 nitroxoline의 크로마토그램에서 신호 대 잡음비 (S/N ratio)가 10 이상이 되는 농도 값을 이용해 다음과 같 은 계산식에 의해 정량한계를 산출하였다.
Limit of quantitation (mg/kg) =a: nitroxoline의 검출량(mg/L)b: 최종 희석부피(L)w: 검체량(kg)
이에 대한 분석법의 정확성을 평가하기 위하여 최대잔류 허용기준(MRL)이 설정되어있지 않은 nitroxoline은 1 및 2배 LOQ(0.02 및 0.04 mg/kg) 농도로 회수율을 측정하였다. 분석 크로마토그램으로부터 얻은 피크의 면적을 검량선에 대입하여 시료에 대한 nitroxoline의 회수율을 구하였고, 6반복 실험을 통해 정확성과 정밀성을 평가하였다. 또한, HPLC/PDA 및 LC-MS/MS를 보유한 특정 실험실 1곳을 선정하여 동일한 전처리 과정과 분석 조건으로 5회 반복 실험을 통하여 분석법을 검증(verification)하였다.
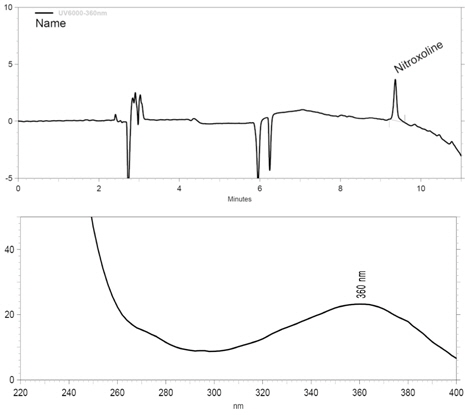
Nitroxoline을 분석하기 위한 기기조건으로 0.1 % TBAOH-인산(A)와 메탄올(B) 두 가지 용매로 용매기울기 조건을 설정하여 머무름 시간과 감도를 확인한 결과, 높은 감도와 적당한 머무름 시간을 나타내었다. 분석 파장은 UV 스펙트럼 확인 결과, 217 nm에서 가장 높은 흡광도를 보였으나 기본선(baseline)이 불안정할 뿐만 아니라 표준물질의 피크(peak) 또한 늘어짐 현상이 나타나 분석에 어려움이 있어 다음으로 높은 흡광도를 보이는 360 nm를 선택하여 위의 문제점들을 해결하였다. 분석에 사용된 칼럼은 보편적으로 사용되는 분석용 칼럼인 C18(4.6 mm × 250 mm, 5 μm)을 선택하였으며, 분석유속은 1.0 mL/분, 주입량은 20 μL을 적용하였다. 확립된 기기분석 조건으로 분석한 nitroxoline에 대한 크로마토그램과 UV 스펙트럼은 Fig. 2와 같다.
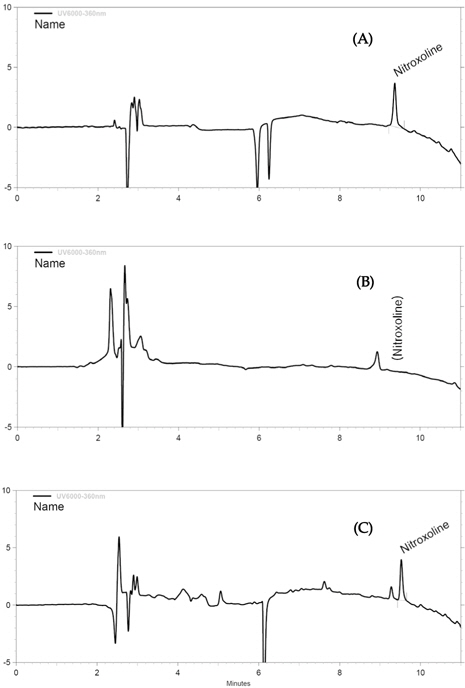
본 연구의 분석 조건에 대한 특이성(specificity)을 검증하기 위해, blank test를 한 결과, Fig. 3에서 보는 바와 같이 nitroxoline의 머무름 시간대에 어떠한 방해물질 또는 matrix 가 검출되지 않은 결과를 나타내어 본 분석법의 높은 분리능과 선택성을 가짐을 확인하였다.
Nitroxoline 표준용액의 직선성(linearity) 시험 결과, nitroxoline에 대한 상관계수(r2)가 0.999의 직선성을 나타내었으며(Table 4), 이는 CAC에서 권장하는 r2>0.95에 적합하여 매우 만족할만한 수준의 결과를 확인하였다.
[Table 4.] Standard calibration curve range, linearity and r2 of nitroxoline

Standard calibration curve range, linearity and r2 of nitroxoline
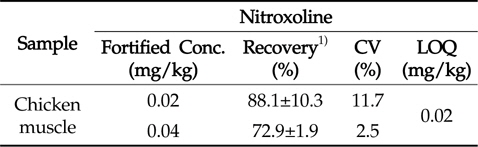
Nitroxoline의 정량한계는 크로마토그램 상에서 신호 대잡음비(S/N ratio)를 10 이상으로 하였다. 분석법의 정확성을 평가하기 위하여 닭고기 시료 5 g에 nitroxoline을 각각 LOQ 및 2 × LOQ(0.02 및 0.04 mg/kg) 농도가 되도록 표준물질을 첨가하고 시험용액 조제 과정을 거쳐 회수율 실험을 수행하였다. 분석 크로마토그램으로부터 얻은 피크의 머무름 시간을 비교하고(Fig. 3), 피크에 대한 면적을 구한 뒤, 검량선을 통해 시험용액 중 nitroxoline의 함량을 확인함으로써 회수율을 구하였고, 6반복 실험을 통해 정확성과 정밀성을 평가하였다. 회수율 시험 결과, 닭고기 시료에서의 회수율과 변동계수는 72.9∼88.1 %, 2.5∼11.7 %(Table 5)로 나타나, CAC에서 권장하는 회수율 및 변동계수에 충족하는 결과를 나타내어 잔류동물용 의약품 분석법으로서 적합함을 확인하였다.
[Table 5.] Recovery, CV and LOQ of nitroxoline in chicken muscle
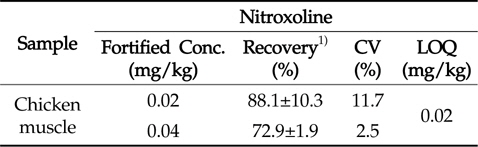
Recovery, CV and LOQ of nitroxoline in chicken muscle
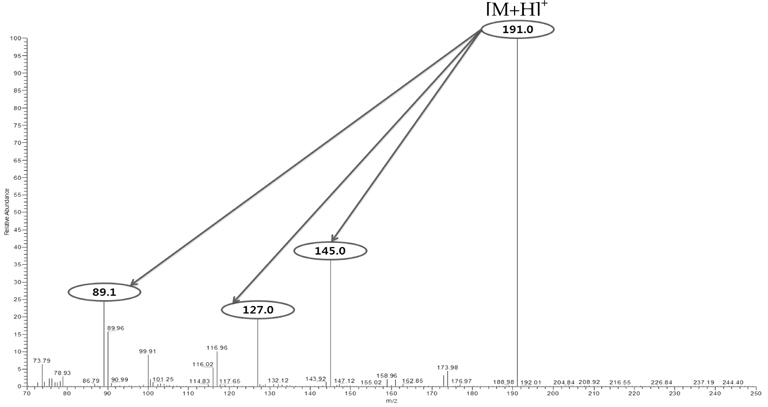
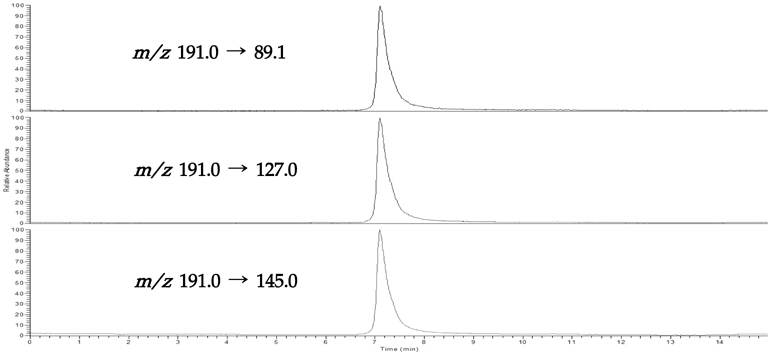
Nitroxoline의 HPLC-PDA를 통한 분석 조건은 설정되었지만, 분석 물질에 대한 정성적 확인과 차후 LC-MS/MS 를 통한 분석 조건 설정을 위해 nitroxoline에 대한 확인 이온(confirmation ion)을 설정하였다. Full scan mode에서 precursor ion을 질량 스펙트럼을 통해 확인한 다음 충돌에너지(collision energy)를 설정하여 product ion을 생성한 후 높은 감도와 양호한 스펙트럼을 보이는 이온을 선택하여 최적의 MRM(multiple reaction monitoring) 조건을 설정하였다.
Nitroxoline은 ESI(electro-spray ionization) 이온화 방법으로 positive mode에서 높은 감도를 보였으며, 모분자인
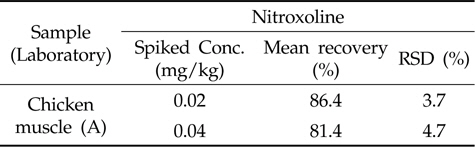
개발된 nitroxoline의 분석법에 대한 실험실간 검증을 HPLC-PDA 및 LC-MS/MS를 보유한 특정 실험실 1곳을 선정하여 동일한 전처리 과정 및 분석 조건으로 5회 반복실 험을 수행하여 이를 통해 분석법의 신뢰성을 재고하고자 검증(verification)을 수행하였다. 실험실간 분석법 검증 결과,확립된 분석법의 회수율은 81.4∼86.4 %, 변동계수가 3.7∼4.7 %의 결과를 나타내었다(Table 6).
[Table 6.] Comparison of analytical methods for nitroxoline in inter-laboratory
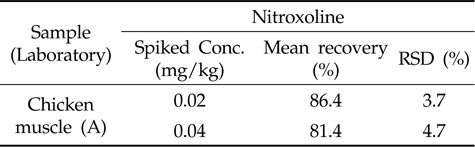
Comparison of analytical methods for nitroxoline in inter-laboratory
따라서 가금류에 사용되고 있는 nitroxoline의 잔류 분석에 대하여 효율적인 시료 전처리 방법과 최적의 정제 과정뿐만 아니라 높은 수준의 정밀성, 정확성 및 재현성을 나타내는 효과적인 분석법으로 확인되었다. 따라서 본 nitroxoline의 분석법은 축산 식품의 안전관리에 기여할 것으로 판단된다.