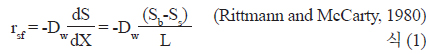This study induced biological denitrification and nitrification via a biofiltration process with the view of removing nitrogen from land-based fish farm effluent. To achieve this, we operated an aquaculture nitrogen-removal system that includes a denitrification and nitrification reactor [working volume 40 L, flow rate 64.8 L, HRT (hydraulic retention time) 14.8 h, HRT considering recycling of NOx 7.4 h]. In the continuous process, the nitrification rate of ammonium nitrogen exceeded 90% at a steady state and the denitrification efficiency exceeded 80% with recycling to a pre-anoxic reactor. In addition, the pH in the final effluent was lower with a low influent water alkalinity averaging 100 mg/L (as CaCO3). For effective denitrification reactions, carbon must be supplied via particulate organic matter (POM) hydrolysis because of the low C/N (carbon/nitrogen) ratio in the water.
최근의 양식산업은 과도한 물 사용량과 연안 오염배출원으로 인식되어 환경에 부정적인 영향을 미쳐 비판의 대상이 되고 있다. 이에 따라 선진국들은 환경기준을 포괄적으로 강화하여 왔고, 지속가능한 양식의 개념을 부분적으로 도입하는 정책으로 발전되어 왔다(Buschmann et al., 1996; Houte, 2000; Olin, 2001; Harache, 2002; Cranford et al., 2003; Pita et al., 2006). 지속가능한 양식의 개념은 다양하게 정의될 수 있으나 물 사용량 절감(FAO, 1995; Boyd and Turcker, 1998)과 오염물질의 정화에 의한 무배출이 중요요소이며, 현재에도 양식장내 효율적인 오염물질 관리를 위한 연구가 진행 중에 있다. 지금까지 양식장 RAS (recirculating aquaculture system)에서 오염물질의 관리는 생물학적 질산화(nitrification)에 의한 암모니아(NH3, NH4+) 제거, 물리적 여과 및 침전에 의한 입자성 고형물 제거가 주목적으로, 질산화에 의한 질산염과 용존 유기물의 축적으로 인한 영향을 최소화하기 위해 시스템의 약 5-10% 정도의 외부 순환수를 추가하여 운영되어 왔다(Masser et al., 1992; Park et al., 2013).
한편, 양식수처리 시스템은 소규모마을하수처리 시스템과 마찬가지로 기본적으로 설비 및 운영경비의 최소화, 간단한 운영방법, 낮은 고형물 발생량, 사육 수질기준의 만족 등의 요소를 충족하여야 하는데, 전통적인 수처리 기법인 활성슬러지법으로 충족하기에는 여러 가지 어려움이 있다(Park et al., 2003). 기존의 활성슬러지 공정을 이용한 생물학적 처리방법만으로 양식 사육 배출수를 처리하기 위해서는 낮은 C/N (carbon/nitrogen)비로 인한 한계와 넓은 부지 소요면적에 대한 문제점을 해결하기 어렵다. 이를 해결하기 위해 고도처리공정 중 생물여과공정(Biofilter process)은 생물막 공정과 여과공정이 단일 시스템에서 동시에 발현되도록 설계한 공법으로 활성슬러지의 부유성장 시스템(suspended growth system)과는 달리 여재(media)에 부착된 미생물의 작용에 의해 오염물질을 정화하는 것이다(Park et al., 2010). 생물여과 공법으로 처리할 수 있는 적용범위는 매우 다양하여 도시하수나 산업폐수 뿐만 아니라 정수처리 및 분뇨처리, 양식수처리에서 사용되고 있다(Chudoba and Pujol, 1998; Gilmore et al., 1999; Payraudeau et al., 2000; Chen et al., 2006). 따라서 생물여과 공정은 단위공정의 조합 및 module화를 통해 기능 부여하여 다양한 종류의 수질특성에 따라 설계가 가능하며, 혐기조(무산소조) 및 후단을 호기성 조건으로 운전할 경우 질산화와 탈질 반응을 유도함으로써 질소제거 성능을 개선할 수 있다.
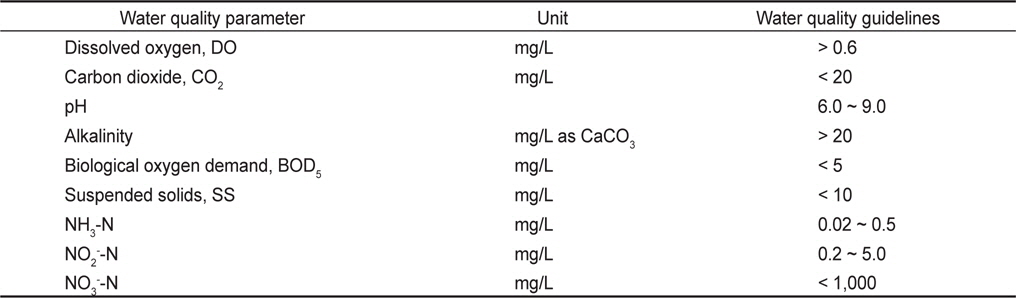
하지만 기존의 해수 이용 양식수처리는 호기성 생물막 공정을 이용하여 주로 생물학적 질산화에 의한 암모니아성 질소의 산화에 의존하여, 반응조 및 양식생물 사육조내 질산성질소의 농도가 축적되어 운영해왔다. Rakocy et al. (1992)은 RAS에서의 사육수 수질 가이드라인을 제시하였는데, 이 때 질산성질소기준은 1,000 mg/L 이하로 매우 높게 설정되어 있다(Table 1). 그러나 질산성질소의 독성이 암모니아성 질소와 아질산성질소보다 낮은 수준이지만 대부분의 양식장에서 질산성질소 농도는 일반적으로 50 mg/L 이하로 관리되어야 하며(Wiboonluk et al., 2013), 질산성질소를 제거하기 위한 가장 효과적인 방법으로 생물학적 탈질 공정을 제시하고 있다(Lee et al., 2000; Menasveta et al., 2001; Singer et al., 2008). 생물학적 탈질공정은 1960년 Wuhrmann process (Wuhrmann, 1964)에서 제안한 후탈질(post-denitrification) 공정에서 최초로 제안되었는데, 외부로부터 전자공여체를 주입하여 처리효율은 높지만 경제성 문제로 인해 혐기조를 호기조 앞에 위치하여 유입수내 유기물을 탈질에 이용하는 전탈질(pre-denitrification) 공정인 MLE(Modified Ludzack Ettinger) process (Barnard, 1973) 공정으로 발달되어 왔으며, 양식배출수 특성상 C/N비가 낮아 후탈질 공정보다는 전탈질 공정이 효과적일 수 있다.
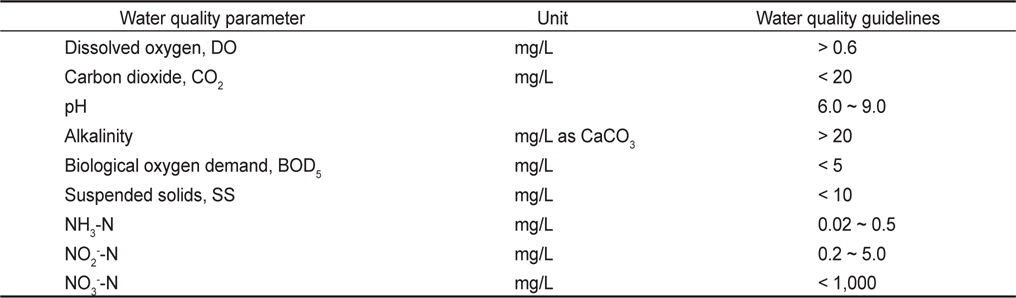
General water quality guidelines for recirculating fish culture system (Rakocy et al., 1992)
따라서 본 연구에서는 양식장 사육 배출수를 처리하기 위해 생물막 공정을 혐기성(무산소)여과조, 호기성여과조를 직렬로 연계한 ANR (Aquaculture Nitrogen Removal) 시스템을 구성하여 생물학적 질산화 및 탈질 반응에 의한 질소제거 거동을 관찰하고 기타 수질특성을 평가하였다.
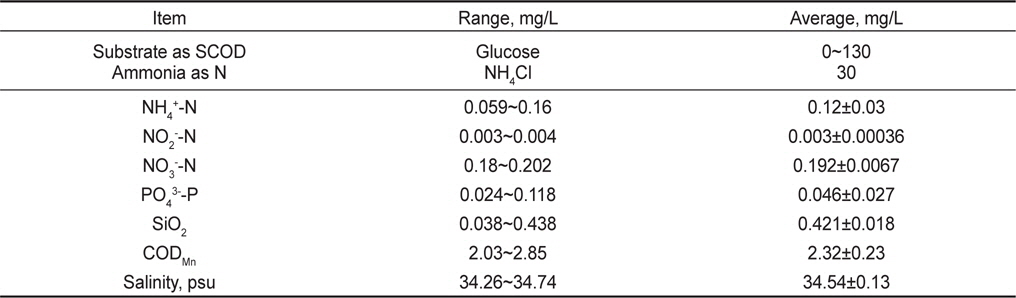
실험에 사용된 원수(raw water)는 해산어 양식 후 배출수(해수)에 암모니아성 질소의 제거 거동을 파악하기 위해 인위적으로 NH4Cl를 첨가하였고, 탈질반응의 탄소원으로 활용하기 위해 포도당(glucose)을 주입하였다(Table 2). 해산어 양식 배출수의 일반적 농도는 Table 2와 같으며, 암모니아성 질소(NH4+-N)의 농도는 평균적으로 0.12 mg/L, 아질산성 질소(NO2--N) 및 질산성 질소(NO3--N)의 농도는 0.003, 0.192 mg/L로 나타났다. 양식 배출수내 질소산화물이 존재하는 이유는 해수내 미량 존재하는 농도와 양식생물 사육기간 동안 어류 아가미에 부착되어 있거나, 사육수 내 존재하는 질산화 미생물에 의해 암모니아성 질소가 일부 산화되어 존재하였을 것으로 예상된다. 양식 사육수내 암모니아성 질소에 추가적으로 NH4Cl을 이용하여 반응조 유입원수의 암모니아성 질소의 농도를 30 mg/L로 조절하였다. 이는 양식장 사육수의 순환율이 일반적으로 시간당 0.5-1 회전으로 많은 양의 물을 사용하고 있는데, 감성돔을 대상으로 사료 주입에 따른 배출원 조사을 위한 회분식 실험 결과 시간 당 1회전의 물 사용시 약 3.8 mg NH4+-N/L가 발생되는 것으로 조사되었다. 어종과 사육밀도에 따라 다르지만 사육수 순환율을 1/3로 감소하였을 경우 질소 부하량을 산정하여 원수 암모니아성 질소의 농도를 결정하였다. 유기물의 경우 양식 배출수의 COD (chemical oxygen demand) 농도가 2.3 mg/로 낮아 탈질에 이용할 수 있는 탄소원(glucose)을 100 mg/L로 조절하여 주입하였다. 이는 생물학적 탈질을 위한 C/N비는 5이상이며, 최소 3 이상의 C/N비에서 탈질반응이 발현(van Rijn et al., 2006)되는 것으로 알려져 있어 본 연구에서는 양식배출수내 생물학적 분해가능한 유기물의 양을 고려하지 않고 glucose를 이용하여 C/N비 3 정도로 운전하였다.
[Table 2.] Characteristics of synthesis and rearing tank wastewater (sea water)
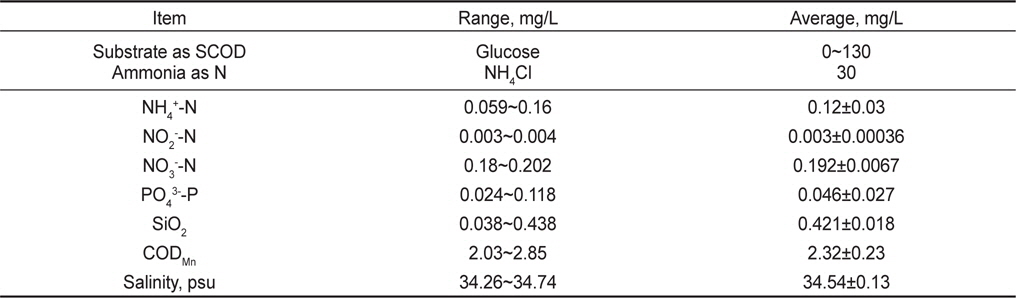
Characteristics of synthesis and rearing tank wastewater (sea water)
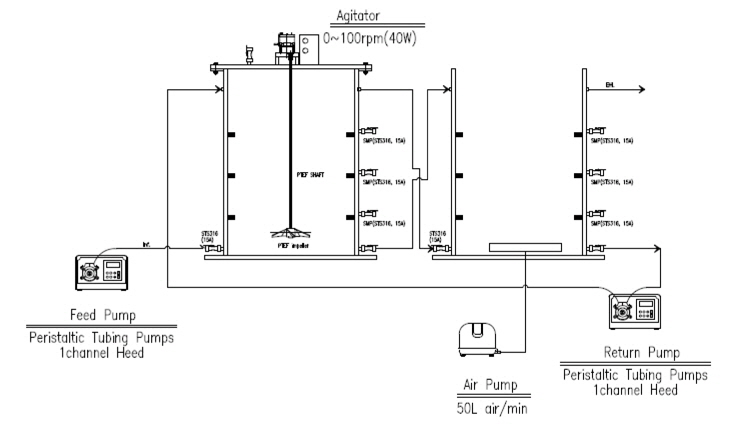
육상양식장 해수 배출수내 영양물질(질소 등)의 생물학적 제거를 위해 ANR (aquaculture nitrogen removal) 시스템을 제작하여 운전하였다(Fig. 1). 반응조의 구성은 생물학적 질산화(nitrification)-탈질(denitrification) 반응을 유도하기 위해 생물막(biofilter) 공정으로 탈질 반응조와 질산화 반응조 직렬로 배열하였고, 반응조 유입수내 유기물을 활용하기 위해 전탈질(pre-anoxic) 공정으로 운전하였다. 탈질 반응조는 유입수와 반송수의 사영역(dead space)을 방지하기 위해 10-30 rpm으로 교반하였는데, 이는 유입수내 입자성 물질을 탈질 반응의 탄소원으로 활용할 목적으로 하였고, 반응조 상단에는 탈질 반응으로 발생되는 질소가스(N2) 배출을 위해 port를 설치하였다. 질산화 반응조내 공기 주입은 송풍기를 이용하여 4-8 mg/L의 용존산소 농도를 유지하여 질산화 반응이 충분히 발현될 수 있도록 하였다.
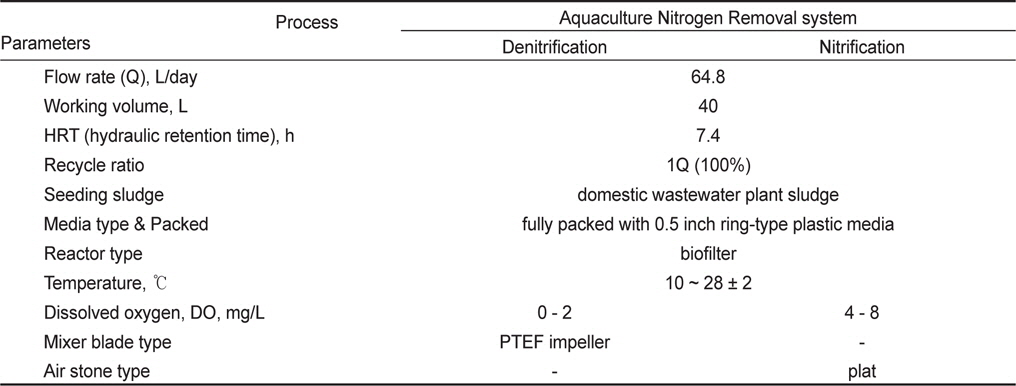
각 반응조의 운전부피(working volume)는 40 L, 유량(flow rate)은 64.8 L/day로 설정하여 운전하였고, 이때 반응조의 수리학적체류시간(HRT)은 14.8 h이었다. 질산화 반응조에서 질산화된 질소산화물의 탈질 반응을 위해 정량펌프를 이용하여 탈질 반응조로 반송(recycle) 100%을 고려하였을 경우, 시스템내 전체 수리학적체류시간은 7.4 h 이었다. 각 반응조에는 모두 여재(media)를 충전한 고정상 상향류식 필터(filter)형태로 운전하였고, 충전한 여재는 외경과 높이가 12.7 mm (0.5 inch)인 원형(ring-type)의 플라스틱 재질이었으며, 각 반응조의 충전율은 100%, 이때 공극율은 90%이었다. 각 반응조내 탈질 및 질산화 슬러지는 B시의 하수종말처리장 슬러지를 채취하여 반응조내 식종하였고, 해수에 충분히 적응하여 운전하였다. Table 3은 기타 자세한 운전조건을 나타내었다.
[Table 3.] Operation condition of ANR (aquaculture nitrogen removal) system
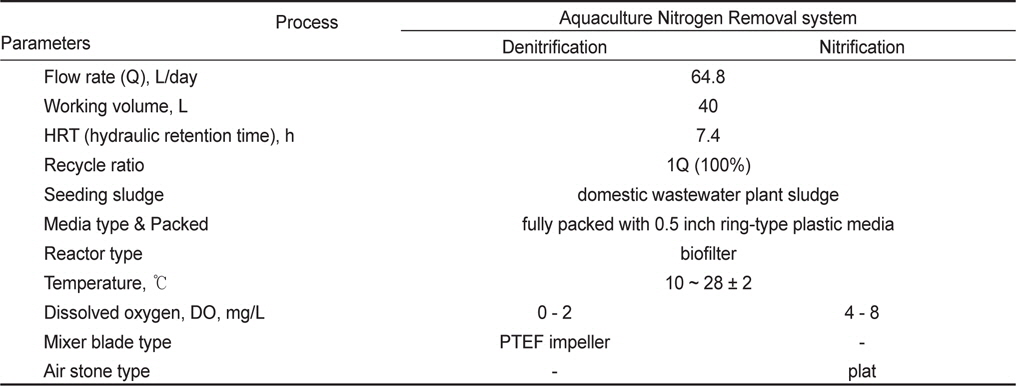
Operation condition of ANR (aquaculture nitrogen removal) system
해수 내 존재하는 질소는 Hach Co.의 기기(DR2700)를 이용하였는데, 암모니아성 질소의 분석은 Nessler법, 아질산성 질소는 Diazotization 법(Hach, USA), 질산성 질소는 Cadmium reduction 법(Hach, USA)을 이용하여 분석하였다. 화학적산소요구량(CODMn)은 해양환경공정시험법의 알칼리성 과망간산칼륨법을 이용하여 정량하였고, 알칼리도는 standard method의 적정법(APHA, 2005)을 이용하여 분석하였다. 용존산소(DO), pH, 염분농도는 YSI Co.의 기기(YSI-556NPS, USA)를 이용하여 측정하였고, 기타 항목은 standard method (APHA, 2005)와 해양환경공정시험법(해양수산부, 2008)을 이용하여 분석하였다.
일반적으로 RAS 내에서 생물막을 이용하여 질산화를 유도하는 경우 암모니아성 질소의 농도는 중요한 설계인자로 작용한다(Wheaton et al., 1994). 이는 RAS 내 생물막에서 질산화반응을 유도하기 위한 Total ammonia nitrogen (TAN)의 최소 농도와 낮은 수준의 암모니아 농도가 어류에 독성으로 작용하기 때문에 낮은 암모니아 기질조건에서 생물막에 의한 질산화 반응이 충분히 유도되어야 한다(Chen et al., 2006; Park et al., 2013). 암모니아는 수중의 pH, 온도 등에 따라 이온성과 비이온성으로 구분되며, 비이온성 암모니아는 어류에 독성이 있는 것으로 알려져 있는데(Zhu and Chen, 1999), NH3 및 NH4+ 형태로 수중에 존재하며 수중에서의 암모니아 형태 비율은 온도, pH 및 염도의 영향을 받는다(Trussell, 1972). 낮은 pH 및 수온에서는 NH4+ 농도가 증가하고, NH3 농도는 감소하여(Huguenin and Colt, 1989), TAN 보다 암모니아성 질소(NH4+-N)가 수질관리의 설계 및 운영에 주요인자(Losordo and Westers, 1994)로 작용하기 때문에 본 연구에서도 암모니아성 질소의 거동을 관찰하여 질산화율을 평가하였다.
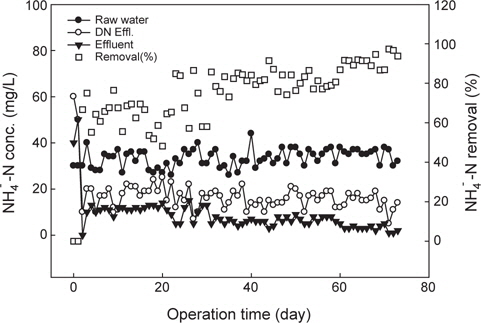
양식수 질소제거 공정에서의 암모니아성 질소 거동을 Fig. 2에 나타내었다. 반응조 유입수의 암모니아성 질소의 농도는 평균적으로 약 35 mg/L 정도였는데, 이는 NH4Cl를 첨가(30 mg/L)하고 실제 양식사육 배출수에 포함된 입자성 유기질소와 용존성 암모니아성 질소 때문에 차이가 발생된 것으로 판단된다. 운영초기 질산화 슬러지(미생물)는 B시 하수처리장 폭기조에서 채취하여 식종하였는데, 담수에서 적응된 질산화 미생물이 해수 적응에 문제가 있었을 것으로 예상하였으나, 운전개시 약 한달 후부터 정상상태(steady sate)에 도달하는 것으로 나타나 담수에서 적응된 질산화 미생물의 해수 적응에 문제가 없는 것으로 판단된다. 일반적으로 담수의 biofilter 공정에서 운전시작 약 10-30일 정도부터 질산화가 발현되며, 반응조의 정상상태에 도달하기 위해서는 반응조 SRT (solid retention time)의 3배 정도가 요구되는데, 많은 연구자들은 최소한의 질산화 반응의 발현을 위해서는 11일(Carmignani and Bennett, 1977), 15일(Yang and Yan, 1988), 17일(Luo et al., 2010) 정도가 요구된다고 하였다. 본 연구에서는 해수를 대상으로 고농도 질산화 미생물을 접종하였기 때문에 운전개시 5일 후부터 질산화가 발현되는 것으로 나타났다.
생물막 공정의 질산화 반응에 있어 여재(media) 표면의 생물막 두께 및 구조 등 biomass가 중요한 요소인데, Gjaltema et al. (1994)은 생물막 형성 및 구조는 미생물 종류, 여재 표면의 액체흐름, 반응조 종류 등 물리적, 화학적, 생물학적 등 다양한 인자에 의해 영향을 받는다고 보고하였다. 이에 따라 많은 연구자들이 정상상태에서 가장 적합한 생물막 두께에 대한 이론을 제안하였고(Yoda et al., 1987; Wang and Zhou, 1994), biofilter의 성능은 여재 type, 기질조건 및 종류, 수리학적 조건이 생물막형성에 영향을 준다고 하였다(Andrews and Przezdzie, 1986; Kugaprasatham et al., 1992; Buffiere et al., 1995). Liu et al. (2013)는 생물막 두께에 따른 암모니아 제거 속도의 상관관계를 연구하였는데, 생물막 두께가 38.2-66.7 μm 증가할 때 암모니아 제거율도 선형으로 증가한다고 하였고, 최적의 생물막 두께는 약 70 μm 정도라고 보고하였다. 본 연구에서 질산화 반응조내 이론적 생물막 두께를 산정하기 위해 Fick 의 제2법칙을 이용하여 산출하였다. 유입 암모니성 질소 농도 30 mg/L와 Table 3의 조건을 이용하여 산정한 결과(식 1), 정상상태에서 생물막 축적 및 예상되는 생물막의 두께는 65 μm로 추정되어 Liu et al. (2013)이 제시한 적정 범위의 생물막 두께를 가질 수 있는 것으로 판단된다.
rsf : rate of substrate surface flux, g/m2∙dDW: diffusion coefficient of substrate in water, m2/ddS/dx: substrate concentration gradient, g/m3∙mSs : bulk liquid substrate concentration, g/m3Sb : substrate concentration at outer layer of biofilm, g/m3L : effective thickness of stagnant film, m
유입수 암모니아성 질소의 농도는 평균적으로 약 35 mg/L 이었고, 운전기간 약 20일까지 탈질반응조 유출수내 암모니아성 질소는 약 20 mg/L, 최종 유출수는 평균적으로 약 10 mg/L로 유출되었다(Fig. 2). 탈질반응조내 암모니아성 질소가 감소하는 것은 질산화 반응조에서 산화된 질소산화물(NOx)이 반송되어 희석에 의해 유입수내 암모니아성 질소가 감소하였다. 질산화 반응조내 용존산소 농도를 충분히 주입하여 운전기간 약 35일까지 질산화율은 평균적으로 약 70% 정도였으나, 변화폭이 커 안정적이지 않았다. 운영기간 35일 이후 60일까지 최종 반응조에서 유출하는 암모니아성 질소는 평균 8 mg/L로 약 77%의 질산화율을 나타내었다. 운전기간 60일 이후 질산화 반응에서 유출되는 암모니아성 질소는 평균 2.93 mg/L로 약 91.6-97%로 유출되어 안정적으로 암모니아성 질소가 산화되는 것으로 나타났다.
질산화 반응은 유기물 부하에 의해 영향을 받는데(WEF, 1992), 수중 생물학적 분해 가능한 유기물이 다량 존재할 경우 종속영양미생물이 우점화 될 수 있다(Hagoian and Riley, 1998). 일반적으로 종속영양미생물(Heterotrophs)은 무기탄소원을 전자공여체로 활용하는 질산화미생물 등의 독립영양미생물보다 5배 정도 빠른 것으로 보고되고 있어(Grady and Lim, 1980), 질산화 반응에 있어 낮은 C/N 비의 유도가 중요하다. 따라서 본 연구에서는 유입수내 유기물을 전탈질 공정에 의해 탄소원으로 이용되어 질산화 반응조내 유입되는 C/N 비가 낮게 유지되었기 때문에 질산화 효율이 높게 나타난 것으로 판단된다.
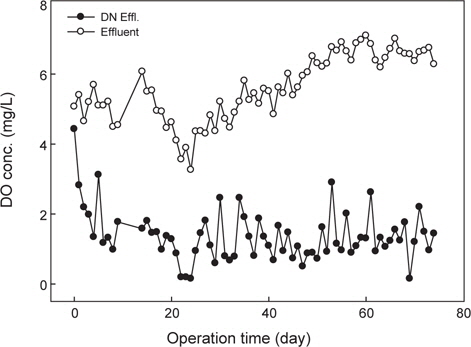
Fig. 3은 질산화 반응조내 용존산소(DO) 농도를 나타내었는데, 운전기간 20일 까지는 약 4.0 mg/L이었고, 이후 질산화 반응조내 용존산소 농도는 평균 6.0 mg/L 안정적이었다.
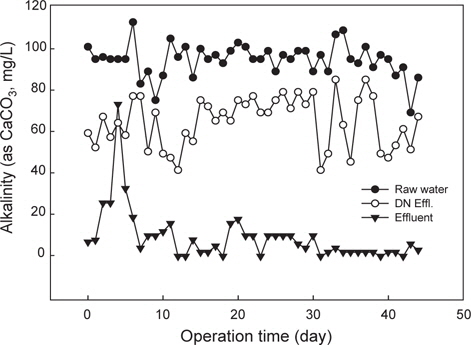
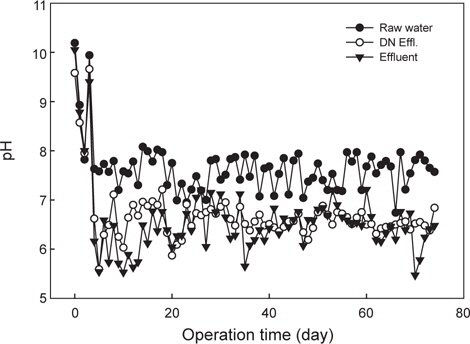
양식 사육수의 pH는 어류 양식과 질산화 및 탈질반응의 중요한 수질관리 인자로 작용한다. 일반적으로 질산화 미생물의 최적 성장 pH는 7.2-8.0으로 pH 7에서 질산화 미생물의 최대 비성장율은 pH 8보다 약 50% 감소하는 것으로 알려져 있다(Princic et al., 1998). 질산화 미생물의 초기 운전조건에서는 중성범위가 적정하며, 정상상태(steady state)에서는 낮은 pH 조건에서도 질산화 미생물은 최대 성장률을 나타내며, 미생물의 축적도 가능한 것으로 알려져 있다(Haug and McCarty, 1972). 수중 pH는 완충 역할의 알칼리도(alkalinity) 거동이 중요하며, 일반적으로 질산화 반응에서 1 mg의 암모니아성 질소가 산화되는데 약 7.14 mg (as CaCO3)의 알칼리도가 소모되며, 50 mg/L (as CaCO3) 이하에서는 질산화 반응이 저해된다고 보고하고 있다(Gujer and Boller, 1986). 본 연구의 운전조건 및 반응조에서 알칼리도 거동을 나타내었다(Fig. 4). 운전기간 동안 반응조유입수(양식사육 유출수)의 알칼리도는 평균적으로 100 mg/L (as CaCO3) 정도로 해수내 알칼리도 농도가 낮은 수준이었다. 탈질반응조 유출수의 알칼리도는 약 60 mg/L (as CaCO3) 내외였고, 질산화 반응조에서 최종 유출되는 알칼리도 농도는 질산화 효율이 90% 이후부터 10 mg/L (as CaCO3) 정도로 낮게 유출되었다. 이는 질산화 반응의 발현 후 알칼리도가 소모되어 낮게 유출되었으며, 질산화 반응 후 탈질반응조로 100% 반송되고, 탈질반응에 의한 알칼리도 생성으로 탈질반응조의 알칼리도는 약 60 mg/L (as CaCO3) 정도로 유출된 것으로 판단된다. Fig. 5는 반응조내 pH 변화를 나타내었는데, 질산화 반응 후 최종 유출수의 pH가 6 이하로 낮게 유지되어 질산화 반응과 후속되는 양식생물의 사육에 영향을 줄 수 있다. 따라서 반응조 유입수의 암모니아성 질소의 농도가 높고 해수내 알칼리도가 낮기때문에 질산화 반응 후 pH 저하를 방지하기 위해서는 추가적인 알칼리도의 투입(Park et al., 2013)이나 기타 대책이 요구된다.
>
탈질반응(denitrification)에 의한 질소제거
탈질반응은 이화작용(dissimilation)에 의하여 NO3- 또는 NO2-를 N2 가스로 환원하는 과정이다. NO3- 또는 NO2-는 에너지 생산을 위한 전자수용체로 사용되며, 탈질은 산소호흡과 같은 질소호흡을 통해 종속영양균이나 일부 독립영양균에 의해 이루어진다(Rittmann and McCarty, 2002). 특히 생물막 공정(biofilter process)은 탈질반응을 쉽게 유도할 수 있는 공정으로 알려져 있으며, 산소전달에 의한 용적부하의 감소와 침전조 문제를 해결할 수 있기 때문에 호기성 생물막 공정보다 큰 용적부하를 적용할 수 있다. 또한 여재 매질의 비표면적이 넓고 막힘 현상이 없는 경우 수리학적체류시간(HRT, hydraulic retention time)이 짧은 경우에도 탈질반응에 효과적이라고 하였는데, 유동상반응조의 경우 HRT가 10 분 이내에서 탈질반응이 발현된다고 하였다(Jeris et al., 1974).
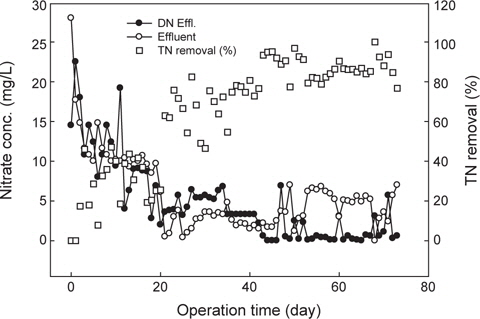
본 연구에서 탈질반응을 유도하기 위해 혐기성(무산소) 생물막 공정을 이용하여 유입수내 유기물을 탈질반응의 탄소원으로 활용하기 위해 전탈질(pre-anoxic) 공정으로 구성하였다. 유입수내 질소산화물(NOx)의 농도는 검출되지 않았고, 질산화 반응조에서 산화된 질소산화물이 반송되어 탈질반응조로 유입되었다. 운전기간 20일까지 탈질반응이 일부 관찰되었으나 반송에 의한 희석에 의해 질소산화물이 제거된 것으로 판단된다. 유입수내 탈질반응의 외부탄소원으로 사용될 수 있는 입자성 유기물 등 TCODMn 농도는 약 20 mg/L 내외였는데, 유입수내 질소 농도를 기준으로 COD/N (NH4+-N)비는 0.6으로 낮은 수준이었다. 따라서 효과적인 탈질반응의 유도를 위해 포도당(glucose)을 이용하여Total chemical oxygen demand (TCODMn) 농도를 100 mg/L 주입하여 C/N 비를 3 정도로 운전하였다. C/N비가 증가함에 따라 운전기간 20일에서 40일까지 안정적인 질산성 질소 제거율을 보였는데, 탈질반응조에서 유출되는 질산성 질소의 농도는 약 4 mg/L 정도이었고, 미처리된 암모니아성 질소 등 총질소(TN) 제거율로 계산할 경우 약 74%의 제거율을 나타내었다. 운전기간 40일 이후 탈질반응조 유출수의 질산성 질소는 거의 산화되어 유출하였는데, 이는 반응조를 상향류로 운전하면서 원수내 입자성 유기물이 반응조 하단에 침전되어, 체류시간이 증가함에 따라 가수분해에 의해 생분해성 유기물이 공급되어 탈질반응의 효율이 증가한 것으로 판단된다. 총질소 제거율이 운전기간 60일 이 후 약 평균적으로 88% 정도였는데 이는 질산화 반응조내 미처리 암모니아성 질소와 질소산화물에 의한 것으로 나타났다.