Four clays (both natural and commercial types) mainly used in Korea were tested for removal efficiency of
최근 기후변화에 따른 수온 상승, 대기 중 CO2 농도 상승, 성층현상 강화, 체류시간 증가 등으로 수생태계에서 남조류의 우점률과 기간이 증가되고 있다(Paerl and Huisman, 2009). 남조류는 종에 따라 대기 중 질소를 고정하며 세포내 공포의 크기를 조절하는 등 다른 분류군에 비하여 환경변화에 적응력이 높아 대발생하는데 유리하다(Huisman et al., 2005; Paerl and Fulton, 2006). 특히 국내에서는
이에 국내뿐만 아니라 세계 각국에서도 유해 남조류 대발생을 제어하기 위한 기술이 연구되고 있다. 유해 남조류를 제거하는 방법은 물리, 화학, 생물학적 방법으로 구분된다. 물리적인 방법으로는 수중 폭기, 선택 취수, 초음파 등이 있으며 2차 오염이 발생하지 않는다는 장점은 가지고 있지만 공공수역에서 사용 시 비용이 높은 것이 단점으로 지적되고 있다(Ahn et al., 2003; KEI, 2010; Nakano et al., 2001). 화학적 방법으로는 황산구리 등 살조제, 천연물질, 황토 등을 살포하며 즉시 효과가 발생하지만 2차 오염이 우려된다(Lim et al., 2002; Rounsefell and Evans, 1958; Sengco et al., 2005; Sengco et al., 2001). 이에 2차 오염이 우려되지 않는 친환경적인 방법을 모색하게 되었고 그 대안으로 제시된 것이 생물학적 방법이다. 생물학적 방법에는 수생식물, 세균, 미생물을 이용하는 방법과 먹이연쇄를 이용한 생물조절방법 등이 있으나 살조 세균의 분리 및 배양의 어려움, 시간이 지남에 따른 처리효과 감소, 낮은 적용성, 유지관리의 어려움 등 단점을 가지고 있다(Gastrich et al., 2004; Mitra and Flynn, 2006; Nagasaki et al., 1999; Park et al., 2000).
최근에는 황토가 경제적이고 무독성으로 2차 오염을 일으키지 않아 조류제거물질로 부각되고 있다(Hagström and Granéli, 2005; Sengco and Anderson, 2004; Sengco et al., 2001). 국내에서는 황토를 적조방제 용도로 1996년부터 지방자치단체에서 살포하기 시작하였고 1998년부터는 정부차원에서 적조방제를 위해 황토살포를 추진하였다(KMI, 2004; Park and Lee, 2006). 황토는 흡착성, 이온 교환성, 현탁성 등의 특성이 있어(Jeong et al., 1999) 조류세포와 충돌하여 응집・침전하는 과정을 통해 조류를 제거한다. 황토의 응집과 침전은 조류제거의 중요한 메카니즘으로 효과적인 조류제거를 위해서는 황토 입자가 넓게 확산되어 조류 세포와 충분히 충돌하여야 한다(Kim, 1998; Sengco and Anderson, 2004). 이는 황토의 입자 크기 및 모양, 표면전하, 성분, 조류의 종과 세포수, 물의 이온 세기와 pH 등에 영향을 받으며 이에 대한 연구가 진행되어 왔다(Hagström and Granéli, 2005; Han and Kim, 2001; Sengco et al., 2005; Sengco et al., 2001; Yu et al., 1994a, 1994b, 1995).
하지만 황토에 의한 조류 제거 연구는 대부분 해양과 적조 생물들을 대상으로 실시하였으며 담수를 대상으로 한 연구는 매우 미흡한 실정이다. 해수는 높은 농도의 전해질용액으로 이온화 세기가 높으며 황토 입자의 전기 이중층이 매우 엷어 인력이 매우 강하게 작용하므로 충돌효율이 높아 조류제거가 효율적이다(Hogg et al., 1966). 하지만 담수는 해수에 비해 이온화 세기가 낮아 황토 입자와 조류세포 사이의 충돌유효계수가 낮으므로 충돌효율이 감소되어 응집 제거 효과가 낮아진다(Ahn, 2010; Han and Kim, 2001). 이러한 차이로 인해 적정 살포량 등 기존 연구결과를 담수에 적용하기 어렵다. 또한 황토 살포 후 수생태계 영향을 고려하기 위하여 생태독성을 평가한 연구도 매우 드물다. 따라서 본 연구에서는 국내에서 주로 사용하고 있는 황토 4종의 입도 및 성분 분석을 실시하였으며 현장에서 채집한
황토는 현재 국내 하천・호소의 조류 대발생 시 수면관리자가 주로 살포하고 있는 제품을 선정하였으며 소성이나 건조과정을 거친 재생황토(황토 A, B, C)와 자연 상태의 생황토인 자연황토(황토 D)로 구분하여 조사하였다. 대상 조류는 2013년 9월 27일 오후 2시에 세종특별자치시 연서면에 위치한 고복저수지에서 Microcystis viridis 가 90% 이상 우점하는 현장 조류를 채집한 후 4°C 이하로 냉장보관・운반하여 즉시 실험에 사용하였다.
황토의 입도 분석은 KS A 0507(2007) “체가름 시험방법”을 수정하여 적용하였다. 105~110°C에서 2시간 건조시킨 황토를 눈 크기가 2 mm, 0.2 mm, 0.02 mm인 표준체에 넣고 20° 기울여 120회/분 속도로 체 틀을 두드린 후 체 망의 미세한 분말까지 솔로 제거하여 각각의 표준체에 잔존하는 황토의 중량을 정량하였다. 산출 결과는 국제토양학회법을 참조하여 자갈(gravel, 2 mm 이상), 조사(coarse sand, 0.2~2 mm), 세사(fine sand, 0.02~0.2 mm), 실트(silt, 0.02 mm 미만)로 구분하였다. 황토의 화학성분 분석은 X-선 형광분석법(X-ray Fluorescence, XRF)을 이용하였으며, X-선 회절 분석(X-ray Diffraction, XRD)을 통해 토양의 광물구조를 확인하였다. 황토에서 용출되는 중금속을 분석하기 위하여 황토와 용매(증류수)를 1 : 10 (W: V)의 비로 혼합하여 진탕・여과하고 여과액(용출액)은 수질오염공정시험기준에 준하여 6가크롬, 비소, 납, 아연, 구리, 시안, 페놀, ABS를 분석하였다.
1 L 비커에 BG-11 배지로
조류제거물질이 생태계에 미치는 영향을 알아보기 위하여 조류제거효율 평가 후 분취한 상등액으로 물벼룩(
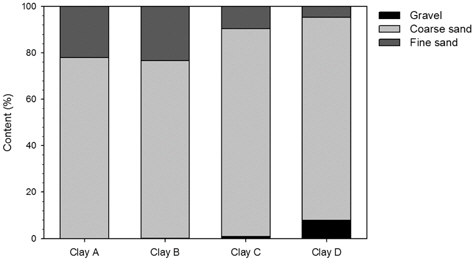
황토 4종의 입도분포는 모래(입도 0.02~2 mm)인 경우가 91.9~100% 범위로 나타나 재생황토, 자연황토 구분 없이 모래가 대부분을 차지하는 것으로 조사되었다. 자갈(입도 2 mm이상)의 경우 건조와 소성을 거친 재생황토 3종은 0~1.0%인 반면 자연황토 1종은 8.1%로 입도가 굵은 자갈의 비율이 높았다. 한편 모래 중 조사(입도 0.2~2 mm)는 76.4~89.4%, 세사(입도 0.02~0.2 mm)는 4.7~23.3% 범위로 나타났으며 황토 A와 B는 세사의 비율이 각각 22.0%, 23.3%인 반면 황토 C와 D는 각각 9.6%, 4.7%로 차이를 보였다(Fig. 1). 자연황토에 비하여 건조나 소성과정을 거친 재생황토가 비교적 작은 입도를 보였다. 조류제거를 위한 황토의 기본적인 기능은 응집과 흡착으로 황토의 입도차이에 따라 응집향을 미칠 것으로 판단되었다.
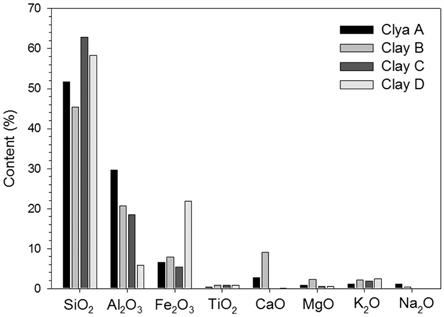
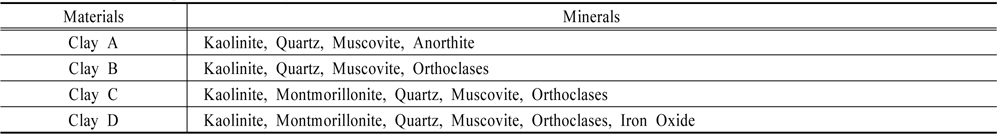
황토 4종의 화학 성분비는 이산화규소(SiO2)가 45.3~62.8%로 황토의 주 화학성분으로 나타났으며 산화알루미늄(Al2O3) 18.5~29.7%, 산화철(Fe2O3) 5.4~7.9% 순으로 조사되었다. 이산화규소의 경우 특히 황토 C와 황토 D에서 각각 62.8%, 58.2%로 높게 나타났으며, 산화알루미늄은 황토 A에서 29.7%로 가장 높았다(Fig. 2). 황토의 광물성분은 황토 4종 모두 석영, 백운모와 점토광물인 카올리나이트(kaolinite)를 함유하였다. 황토 C와 D는 점토광물인 몬모릴로나이트(montmorillonite)를 함유하였다(Table 1). 황토의 구성광물은 석영, 장석, 카올리나이트(kaolinite), 일라이트(illite), 버미큘라이트(vermiculite) 등이 다량 포함되며 각섬석, 침철석 등이 소량 함유된다(Hwang et al., 2000). 카올리나이트(kaolinite), 일라이트(illite), 버미큘라이트(vermiculite), 몬모릴로나이트(montmorillonite) 등은 1차의 규반염 광물이 풍화되어 분리된 미세입자들로 황토의 물리화학적 특성에 영향을 미친다. 특히 높은 비표면적을 가지며 양이온 교환능력이 우수하기 때문에 황토가 조류를 제거하는데 매우 중요한 역할을 한다(Cho et al., 2004; Hwang et al., 2000; Jung et al., 2003). 따라서 황토의 성분 차이는 조류 제거 효율에 영향을 미칠 것이다.
[Table 1.] Mineral composition of clays
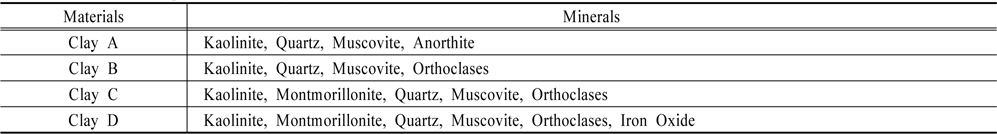
Mineral composition of clays
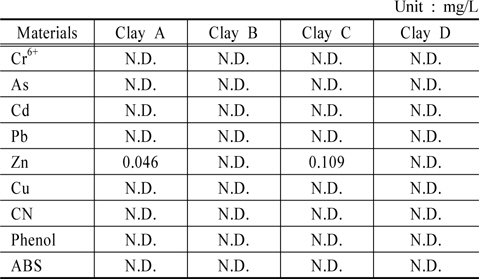
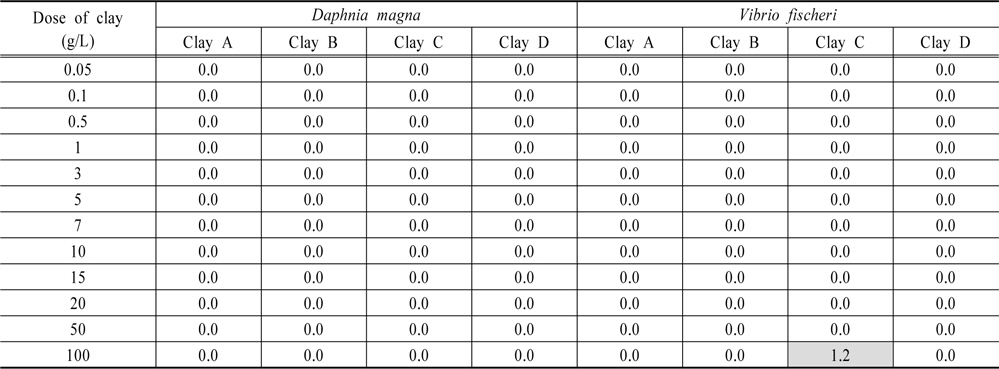
토양 내 중금속은 점토광물 및 산화광물에 흡착 또는 공침되어 다양한 형태로 존재한다(Chon et al., 2010). 이는 황토의 응집・침전 후 황토에서 용출되어 수생태계에 악영향을 끼칠 수 있기 때문에 용출 성분을 분석하는 것은 매우 중요하다. 분석 결과 6가 크롬, 비소, 카드뮴, 납, 구리, 시안, 페놀, ABS는 황토 4종 모두에서 검출되지 않았으며 아연은 황토 A, C에서 각각 0.046 mg/L, 0.109 mg/L로 검출되었으나 황토 B, D에서는 검출되지 않았다(Table 2). 아연의 검출 농도는 먹는물 수질기준(3 mg/L 이하)과 수질오염 물질의 배출허용기준(청정지역 기준 1 mg/L 이하) 미만이었다. 따라서 황토 살포에 의하여 수생태계의 중금속 영향은 거의 없을 것으로 판단되었다.
[Table 2.] Trace elements concentration in eluate of clays
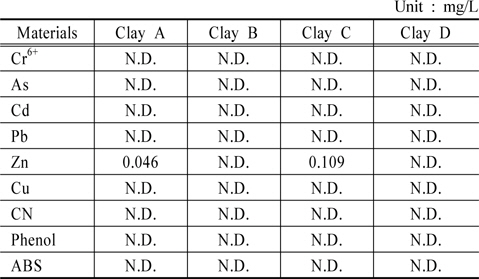
Trace elements concentration in eluate of clays
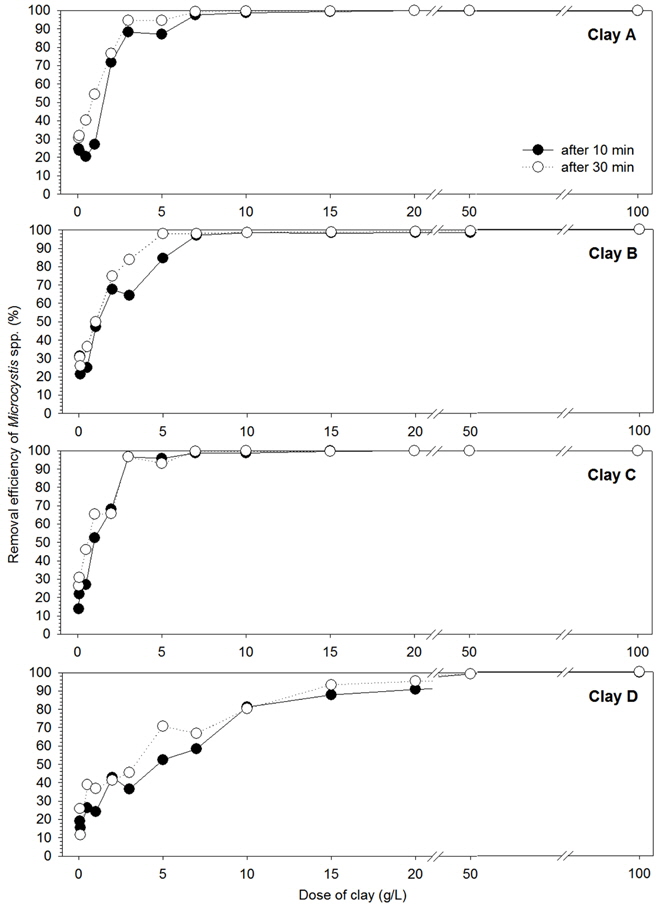
조류제거효율은 황토 살포량이 높을수록 증가하였다(Fig. 3). 황토 살포량이 증가하면 황토와 조류의 접촉기회가 증가하기 때문이다(Yun et al., 2003). 침전시간 별 제거효율은 0.05~5 g/L 살포 시 10분 침전시켰을 때보다 30분을 침전시켰을 때 높았으나 7~100 g/L 살포 시 침전시간에 따른 제거효율에 거의 차이가 없었다. 살포량이 많을수록 많은 황토 입자가 단시간 동안 동시에 응집・흡착이 이루어지는 반면 살포량이 적을수록 침전시간이 길어짐에 따라 충분한 응집・흡착이 일어나 제거효율이 높아지는 것으로 나타났다. 황토 종류에 따라서 조류제거효율은 재생황토와 자연황토간에 차이를 보였다. 재생황토인 황토 A~C는 살포량 및 침전시간에 따른 제거효율이 유사하게 나타났다. 침전시간 30분을 기준으로 할 때 황토 A는 1 g/L 살포 시 54.3%, 2 g/L에서 76.5%, 3 g/L 이상에서는 95.0% 이상 제거효율을 보였다. 황토 B는 1 g/L에서 50.0%, 2 g/L에서 74.9%, 3 g/L에서 83.8%, 5 g/L 이상에서는 98.0% 이상의 제거효율을 보였다. 황토 C의 경우 0.5 g/L에서 46.0%, 1 g/L에서 65.3%, 2 g/L에서 65.7%, 3 g/L에서는 95.0% 이상의 제거효율을 보였다. 반면에 자연황토인 황토 D는 재생황토에 비하여 제거효율이 낮았다. 1 g/L 살포 시 36.9%, 2 g/L에서 41.2%, 3 g/L에서 45.4%, 5 g/L에서 70.7%, 15 g/L 이상에서는 94.0% 이상의 제거효율을 보였다(Fig. 3). 본 연구와 마찬가지로 Na et al. (1998)의 연구에 따르면 서낙동강 하류역에서 채수한
황토 간 제거효율의 차이는 황토의 구성성분이나 입도의 차이 등에 영향을 받는다고 알려져 있다(Avnimelech et al., 1982; Han and Kim, 2001; Na et al., 1996; Pan et al., 2006). 황토의 알루미늄 성분은 수체 내 인 등 영양염을 제거하여 조류의 성장을 억제하거나 직접적으로 조류와 응집・침전을 통해 조류를 제거한다(Holz and Hoagland, 1999; James et al., 1991, Welch and Cooke, 1995). 황토 A, B, C는 황토 D보다 알루미늄 성분 함량이 높은 것으로 확인되었으며(Fig. 2) 이것은 조류제거효율 차이에 영향을 미쳤을 것이다.
점토입자는 단위 무게당 표면적이 크고 이온화된 표면을 가지므로 이온성 물질의 흡착능이 높으나(Dzombak and Morel, 1987) 입자 형태와 양이온 교환능의 차이에 따라 점토광물 종류 간 차이를 보인다. Pan et al. (2006)의 SEM 이미지 촬영 결과, 카올리나이트 입자는 과립 형태로
황토의 조류 제거 효율은 황토입자의 크기에 매우 민감하다(Han and Kim, 2001). Na et al. (1998)은
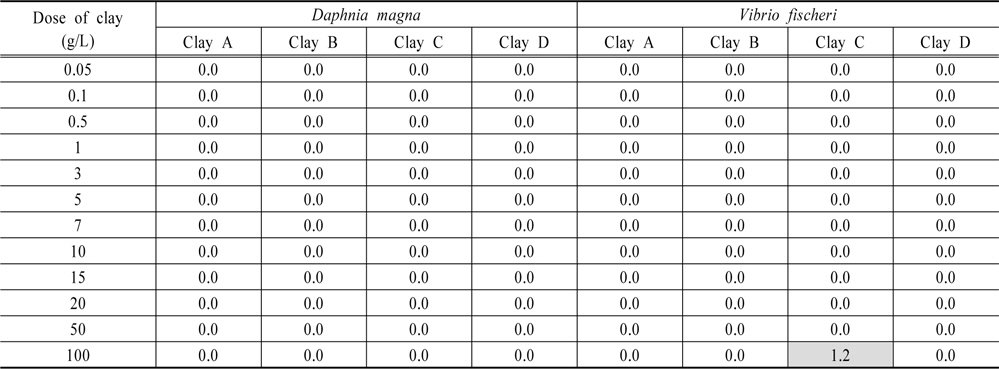
Toxicity unit value obtained from 24h-acute toxicity test of clays for Daphnia magna and Vibrio fischeri Unit : TU
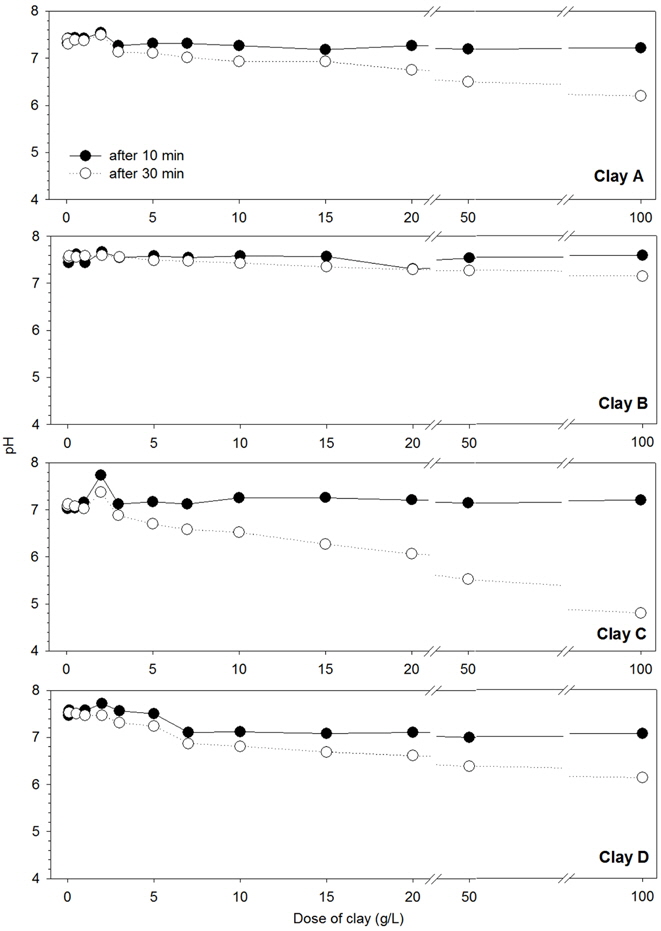
황토 살포량이 증가할수록 pH는 감소하였으며, 그 중 황토 C를 살포하였을 때 가장 큰 폭으로 감소하였고 황토 B 살포 시 변화폭이 작았다(Fig. 4). 60~70% 이상의 제거효율을 보이는 재생황토 2 g/L, 자연황토 5 g/L 살포량에서는 pH가 모두 7 이상으로 나타났다. 황토 A의 경우 살포 전 pH는 7.2~7.5 범위를 보였으며 살포 후 pH는 7 g/L 살포 시 7.0, 10 g/L와 15 g/L에서 7.0, 최고 살포량 100 g/L에서 6.2까지 감소하였다. 황토 B의 경우 살포 전 pH가 7.3~7.7의 범위를 보였고 살포 후 pH는 7.1~7.6의 범위를 보였다. 황토 C의 경우 살포 전 pH는 7.0~7.7의 범위를 보였으며 살포 후 pH는 2 g/L 이하에서 7 이상, 10 g/L에서 6.5, 20 g/L에서 6.1, 50 g/L에서 5.5, 최고 살포량 100 g/L에서는 4.8까지 감소하였다. 황토 D의 경우 살포 전 pH는 7.0~7.7의 범위를 보였으며 살포 후 pH는 5 g/L에서 7.2, 50 g/L에서 6.4, 최고 살포량 100 g/L에서는 6.1까지 감소하였다. 황토가 살포되면 황토 바깥쪽의 알루미늄 이온이 가수분해 되어 수소이온을 형성하거나(Yun et al., 2003) 황토의 Al2O3와 Fe2O3가 수화작용으로 Al(OH)3와 Fe(OH)3로 응집 석출되어 수산화이온이 소모되고 수소이온 농도가 높아져 pH가 낮아진다(Vernon and Snoeyink, 1980). Kim (2000)은 황토의 살포량이 증가할수록 pH는 일률적으로 감소한다고 하였고, Park and Lee (2007)의 연구에서도 황토 1, 3, 5, 7, 10 g/L 살포 시 pH가 7.6, 7.5, 7.3, 7.1, 6.8로 감소하였다. 따라서 황토 살포 후 pH 변화가 수중생물에게 영향을 주지 않는 범위에서 황토를 살포해야 한다.
황토 살포 후 물벼룩(
현장에서 채집한
1) 황토 4종은 입도 0.02~0.2 mm 이었고, 주요 화학성분비는 이산화규소 (SiO2, 45.3~62.8%), 산화알루미늄 (Al2O3, 18.5~29.7%), 산화철 (Fe2O3, 5.4~7.9%)로 조사되었다. 광물은 모든 황토에서 카올리나이트(kaolinite)가 검출되었으며 황토 C와 D에서 조류제거효율이 높다고 알려진 몬모릴로나이트(montmorillonite)가 검출되었다. 2) 조류제거효율은 황토 A, B, C를 2 g/L 살포 시 60% 이상의 제거효율을 보였으며 5 g/L 이상에서는 100%에 근접하였다. 반면에 황토 D는 5 g/L에서 60% 이상의 제거효율을 보였으며 20 g/L에서는 95~100% 제거효율을 보였다. 황토 살포량이 증가할수록 pH는 감소하였으며, 그 중 황토 C를 살포하였을 때 가장 큰 폭으로 감소하였고 황토 B 살포 시 변화폭이 작았다. 3) 황토 살포 후 물벼룩(D. magna)과 발광박테리아(V. fischeri)에 대한 생태독성은 황토 A, B, D의 모든 살포량에서 나타나지 않았다. 하지만 황토 C의 경우 물벼룩(D. magna)은 모든 살포량에서 독성이 발현하지 않았으나 발광박테리아(V. fischeri)는 100 g/L에서 독성(TU 1.2)이 발현하였다. 4) 현재 담수 조류발생시 살포하고 있는 황토는 제품특성에 따라 처리효율, pH 변화에 차이를 보이기 때문에 살포시 사전 검토가 필요한 것으로 사료되었다.