진흙새우(Argis lar Owen, 1839)는 자주새우과에 속하는 종으로 북태평양, 알래스카, 베링해, 오호츠크해, 동해에 서식하는 것으로 알려져 있다(Butler, 1980; Holthuis, 1980; Kim, 2000; Komai and Komatsu, 2009). 본 종은 일반적으로 22-400 m 수심에서 서식할 뿐만 아니라 대륙사면의 상부까지 서식한다(Holthuis, 1980). 우리나라에서는 주로 100 m의 대륙붕 상부에서 심해까지 분포하는 상업적 가치가 높은 중요 갑각류 자원이다(Kim, 1977; Kim, 2012). 이 종은 저서식물, 갑각류, 이매패류, 다모류 등을 섭이하고 대구의 주요 먹이로서 저서 생태계 먹이 연쇄에 있어서 연결고리 역할을 담당하고 있다(Squires, 1965; Mutoh et al., 1992; Yamamura et al., 1993).
진흙새우는 아가미 부근에 등각목(Isopoda) 십각기생과(Bopyridae)에 속하는 진흙새우아감벌레(Argeia pugettensis Dana, 1853)가 기생하는 것으로 보고되어 있다(Kim and Kwon, 1988; Cha et al., 2001). 기생 등각류는 갑각류의 외부 기생충으로 대략 500종이 알려져 있으며 10개의 아과(Subfamily)로 나누어진다(Markham, 1986). 한국에는 총 12속 12종의 십각기생등각류가 있으며 27종의 갑각류가 잠재적 숙주로 알려져 있다(Kim and Kwon, 1988). 이들 중 진흙새우아감벌레는 한국에서부터 캘리포니아 샌프란시스코만까지 북태평양의 북쪽지역에 서식하며 적어도 20종 이상의 갑각류가 이들의 숙주로 알려져 있다(Markham, 1977). 우리나라에서는 주로 진흙새우, 자주새우(Crangon affinis De Haan, 1849)와 마루자주새우(Crangon hakodatei Rathbun, 1902)가 진흙새우아감벌레의 숙주로 보고되었으며, 이들은 숙주의 아가미 부근에 침투하여 갑각의 감염부위를 부풀어 오르게 해 외부형태로 감염여부를 쉽게 알 수 있다(Kim and Kwon, 1988).
기생등각류들은 대부분 갑각류의 아가미 기생충으로 진화된 것으로 알려져 있으며, 숙주의 새강(branchial cavity) 내에서 이용 가능한 공간을 가득 채움으로써 숙주 아가미의 기능에 지장을 준다(Anderson, 1972). 또한 숙주의 생식, 성장, 대사, 환경내성 그리고 숙주의 에너지 대사작용 등에 영향을 주는 것으로 알려져 있다(Anderson, 1972; O’Brien and Van Wyk, 1985; Nelson et al., 1986; Jay, 1989; Roccatagliata and Lovrich, 1999; Smith et al., 2008; Marin Jarrin and Shanks, 2008).
본 연구의 목적은 1) 진흙새우의 생활사 동안 진흙새우아감벌레의 감염률, 2) 감염과 비감염 숙주의 갑각장과 중량간의 회귀분석을 조사하여 숙주의 성장에 대한 기생충의 영향, 3) 암컷 숙주를 대상으로 생식소숙도지수(GSI)와 포란 비율을 조사하여 기생충이 진흙새우 암컷의 생식에 미치는 영향을 조사하는데 있다.
본 연구에 사용된 시료는 경북 포항, 영덕 연안에서 2009년 7월부터 2011년 6월까지 매월 동해구 외끌이 중형저인망을 이용하여 채집하였다(Fig. 1). 채집된 모든 시료는 즉시 10% 중성 포르말린에 고정하여 실험실에 보존하였다. 보존된 개체는 실험실에서 갑각장(carapace length: CL)는 vernier callipers를 이용해서 측정했으며, 건중량(dry weight: Dwt)은 전자직시저울(electronic digital balance)을 이용하여 측정하였다. 기생충 감염여부는 갑각의 외부형태를 관찰하여 육안으로 판단하였으며 핀셑을 이용해 기생충을 분리후 기생충 전장을 측정하였다. 갑각장은 안병의 기저에서 두흉갑의 등면 뒤쪽의 오목한 부분까지를 digital calipers를 이용하여 측정하였다. 기생충의 전장은 만능투영기로 가장 긴 길이를 측정하였다(Fig. 2). 생식소숙도지수(gonadosomatic index: GSI)를 구하기 위해 성숙 체장에 도달한 감염과 비감염 암컷을 매달 30개체씩 생식소를 분리한 후 암컷의 중량과 생식소의 중량을 80℃에서 48시간 동안 Dry oven에서 건조시킨 후 전자직시저울을 이용하여 0.0001 g까지 측정하였다. 생식소숙도지수는 암컷의 무게에 대한 생식소의 무게의 비로 나타내며 다음 식에 의하여 계산하였다.
GSI = (생식소 무게 / 체중- 생식소무게) × 100
기생충이 숙주의 성장에 미치는 영향을 알기 위해 감염 개체와 비감염 개체를 대상으로 숙주의 갑각장(CL)과 건중량(DW)간의 회귀관계는 CL=aDWb (a, b는 상수) 모델을 이용하여 분석하였으며 두 회귀식의 기울기와 절편 비교는 변수를 로그로 변환 후 직선 회귀식을 이용하여 공분산분석(ANCOVA)으로 비교하였다. 암컷의 감염에 따른 생식에 미치는 영향을 조사하기 위해 감염과 비감염 개체간에 생식소숙도지수(GSI)의 평균을 비교는 실시하였다. 두 집단간의 평균차이는 생식소숙도지수(GSI)의 자료가 분산의 동질성이 없었기 때문에 비모수검정 방법인 Mann-Whitney U-test로 분석하였다. 본 연구의 통계분석은 MINITAB ver. 14 을 이용하여 분석하였다.
감염된 새우들은 갑각이 뚜렷이 돌출되어 감염여부를 육안으로 쉽게 판별 할 수 있었으며, 기생충의 수컷은 암컷의 등부위에 기생의 형태로 부착되어 있었으며, 크기는 암컷에 비해 작았다(Fig. 2).
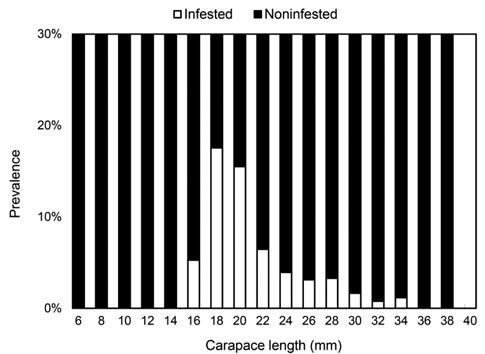
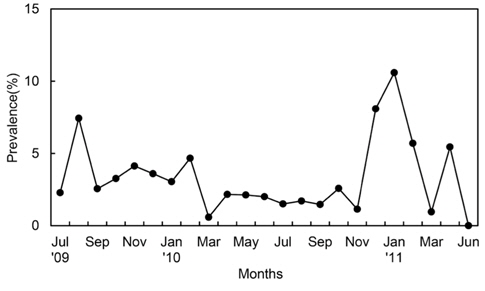
진흙새우에 대한 진흙새우아감벌레의 감염률은 3.3%였으며, 감염이 시작된 최초 갑각장은 16-17.9 mm로 5%의 감염률을 나타내었고 18-19.9 mm에서 18%로 가장 높은 감염률을 보였다. 이후 성장함에 따라 감염률이 점차 감소하였으며 36 mm CL이상에서는 감염개체가 없었다(Fig. 3). 월별감염률을 살펴보면, 2011년 1월에 10.5%로 가장 높았고 2010년 3월에 0.58%로 낮았으며 2011년 6월에는 감염개체가 출현하지 않았다. 년중으로 보면 3월, 6월, 7월이 낮고 12월, 1월, 2월의 동절기에 높은 감염률을 보였다(Fig. 4). 그러나 월별감염률은 서로 유의한 차이가 없었다(Kruskal-Wallis test, P>0.05). 진흙새우 암컷과 수컷의 갑각장(CL)과 진흙새우아감벌레의 전장(PL)간의 관계는 유의한 직선 회귀관계가 있었다(Fig. 5):
Male PL=0.84CL - 1.15 (r2=0.84, n=5, P<0.001)
Female PL=0.38CL + 6.69 (r2=0.33, n=66, P<0.001)
진흙새우 암컷과 수컷간에 회귀식을 공분산분석(ANCOVA) 통계 검정한 결과 두 회귀식의 기울기는 유의한 차이가 없었고(F=0.76, df=1, 68, P>0.30), 절편은 유의한 차이가 있었다(F=36.08, df=1, 69, P<0.001). 이러한 결과는 진흙새우의 수컷에 크기가 더 큰 기생충이 기생한다는 것을 지적해주고 있다.
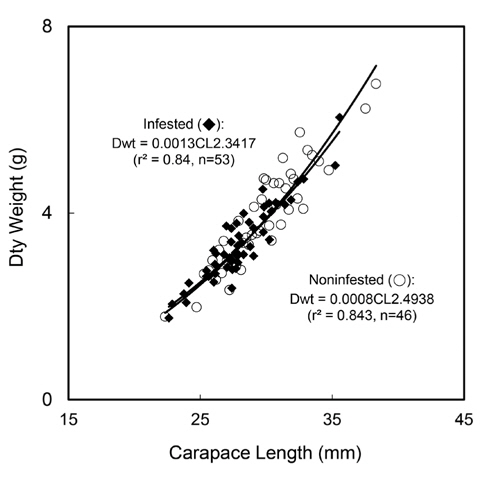
진흙새우 암컷의 감염 개체 크기는 22.62-35.57 cm, 평균(±표준편차)은 28.02 (±2.49) cm였으며, 건중량은 1.75-6.05 g, 평균은 3.35 (±0.78) g 이었다. 비감염 개체의 크기는 22.34-38.33 cm,, 평균은 29.50 (±2.69) cm 였으며, 건중량은 1.78-6.77 g, 평균은 3.75 (±0.89) g였다. 감염개체와 비감염 개체를 대상으로 갑각장(CL)과 건중량(Dwt)간의 회귀관계를 분석한 결과 유의한 회귀관계가 있었다(Fig. 6):
감염개체 Dwt=0.0013CL2.3417 (r2=0.84, n=53, P<0.001)
비감염 개체 Dwt=0.0008CL2.4938 (r2=0.84, n=46, P<0.001)
두 회귀식의 기울기에는 유의한 차이가 없었고(ANCOVA: F=0.49, df=1, 95, P=0.484), 절편에는 유의한 차이가 있었다(ANCOVA: F = 507.20, df = 1, 96, P<0.001) (Fig. 6).
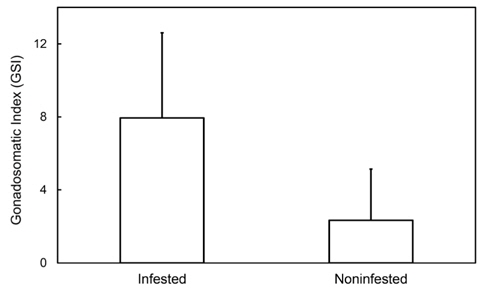
감염 개체의 생식소숙도지수는 0.1863-21.2060, 평균(±표준편차)은 7.8086 (±4.3208)였으며 비감염개체의 생식소숙도지수는 0.0932-43.8601, 평균은 9.2367 (±9.8123)이었다. 감염 개체와 비감염 개체 간의 생식소숙도지수 평균 차이는 원자료나 변환자료에서 모두 분산의 동질성이 없었기 때문에 (F-test: P<0.05) 비모수 방법인 Mann-Whitteny U-test로 통계 분석하였다. 통계 분석 결과 감염개체와 비감염개체 간의 생식소숙도지수 평균은 유의한 차이가 있었다(P<0.001). 이러한 결과는 감염된 개체의 GSI는 비감염 개체의 GSI 값보다 낮아 기생충에 감염된 암컷의 생식소의 발달이 더 지연된다는 것을 지적해주고 있다.
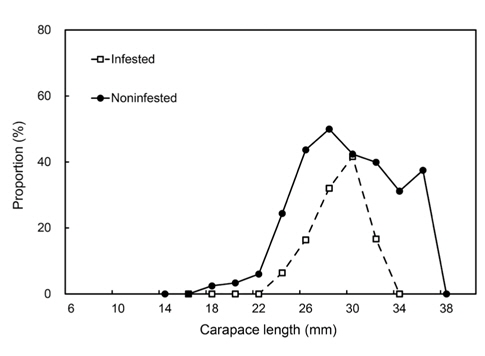
감염과 비감염 암컷의 포란 비율은 각각 평균 16.9%, 37.9%이었다. 비감염 암컷은 18-19.9 mm CL에서 포란하기 시작하여 28-29.9 mm CL에서 49.9%로 정점을 이루었으나, 감염 암컷은 더 많이 성장한 24-25.9 mm CL에서 포란하기 시작하여 30.0-31.9 mm CL에서 41.6%로 정점을 이루어 성숙이 더 늦었다(Fig. 8). 포란과 비포란 암컷간에 기생충의 감염빈도는 유의한 차이가 있었다(Kolmogorov-Smirnov test, P<0.05).
Marin Jarrin and Shanks (2008)은 자주새우과 Lissocrangon stylirostris에 대한 진흙새우아감벌레의 감염률을 63%로 보고하였으며, Hoeman (1982)는 1년에 걸쳐 포획한 L. stylirostris 1,611마리 중 8%가 진흙새우아감벌레를 가지고 있었고 하계의 감염률은 44%로 본 연구의 3.3%보다 높은 감염률을 나타내었다. Smith et al. (2008)은 조간대에 서식하는 쏙과(Upogebiidae)의 Upogebia pugettensis 아가미에 기생하는 등각류 Orthione griffenis의 감염률은 수컷 57%, 암컷 80%로 높은 감염률을 보고하였다. 우리나라 남해안에 서식하는 보리새우과 산모양깔깔새우(Metapenaeopsis dalei)에 대한 Parapenaeon consolidatum의 감염률은 45%로 보고되었다(Choi, 2001). 한편 Jay (1989)는 캘리포니아 Humboldt Bay에 서식하는 자주새우과 Crangon franciscorum에 대한 진흙새우아감벌레의 감염률을 2.9%로 본 연구와 유사하게 낮은 감염률을 보고 했다. 이러한 낮은 감염률의 원인은 C. franciscorum가 번식과 가입시기 동안 하구(estuary)와 연안사이를 이동하기 때문에 서식환경변화가 기생충의 체내침투를 어렵게 한 것과 숙주의 낮은 서식밀도에 의한 것으로 추정하였다(Marin Jarrin and Shanks, 2008).
본 연구에서는 어린시기 최고의 감염률을 나타낸 후 갑각장이 증가할수록 점차 감염률이 떨어지는 결과를 보여주었다. 이 결과는 숙주의 갑각장이 증가할수록 기생충의 감염률도 증가한다는 기존 연구들의 결과와 대조적인 결과로 나타났다 (Choi, 2001; Marin Jarrin and Shanks, 2008; Smith et al., 2008). 이러한 결과는 두 가지 원인에 의한 것으로 설명될 수 있을 있다. 첫째, 기생충이 숙주의 생존을 위협하여 감염개체가 비감염 개체보다 조기에 사망할 가능성이다. 본 연구의 결과와 같이 숙주의 성장에 따라 낮아지는 감염률을 보고한 Roccatagliata and Lovrich (1999)는 Pseudione tuberculata에 감염된 Paralamis cranulosa 어린 개체가 감염되지 않은 어린개체에 비해 사망률이 높다고 하였다. 또 일반적으로 기생등각류에 감염된 새우는 행동이 느려져 비감염 개체에 비해 어구에 어획될 확률이 높아 어획에 의한 사망율이 높다고 알려져 있다(Dall et al., 1990; Somers and Kirkwood, 1991). 둘째, 최종숙주에 침투하는 cryptoniscus 유생의 감염 유효성이다. Owens and Rothlisberg (1995)은 cryptoniscus 유생단계의 감염은 중간숙주의 풍도보다 수온, 염분, 탁도, 수심과 같은 환경적 요인들에 의해 더 많은 영향을 받는다고 하였다. 진흙새우는 어린시기(20 mm CL 이하)에 얕은 바다에 서식하며 성장함에 따라 수온이 낮은 깊은 곳으로 이동하는 것으로 알려진다. 이는 어린시기에는 기생충의 중간숙주인 copepod가 풍부하고 cryptoniscus 유생의 침투에 적합한 환경에서 성장하여 높은 감염률을 보이다가 점차 기생충의 대사활동과 침투활동이 어려운 환경으로 서식지를 이동하여 감염률이 감소되었을 가능성이 있을 수도 있다.
진흙새우의 갑각장과 진흙새우아감벌레의 전장은 양의 상관관계를 보였다. 이러한 결과는 기생충이 크기가 작은 숙주에 부착해 하여 같이 성장한다는 것을 지적해 주고 있다. Cash and Bauer (1993)는 Procopyrus pandalicola에 감염된 Palaemonetes pugio의 실험실 사육실험에서 기생충이 숙주의 탈피 후 다시 기생했던 갑각의 아가미 부분으로 재부착 한다고 보고하였다. Choi (2001)는 P. consolidatum의 전장은 산모양깔깔새우의 갑각장의 길이와 양의 상관관계를 가져 기생충이 숙주와 수명을 같이 한다고 제안하였다. 기생충의 전장과 숙주 갑각장의 양의 상관관계는 자주새우류인 Crangon francisorum과 Lissocrangon stylirostris에서도 보고되고 있다(Jay, 1989; Marin Jarrin and Shanks, 2008). 이러한 관계는 기생충이 최적크기를 가진 숙주를 선택해 배발생과 생식 성공을 위한 공간을 확보하려는 생존 전략을 의미한다(Choi et al., 2004).
일반적으로 기생충에 감염된 숙주의 성장은 감소한다고 보고되어 있으며(Somers and Kirkwood, 1991; Choi, 2001; Lester, 2005), 수컷숙주의 생식기능이 상실됨으로써 성장이 빨라진다는 보고도 있다(Mathews et al., 1988). O. griffenis에 감염된 U. pugettensis의 평균중량은 비감염개체 보다 유의하게 적었으며 숙주중량의 7.8%, 기생충 중량의 2.9배의 중량손실이 있다고 알려져 있고(Smith et al., 2008), 진흙새우아감벌레에 감염된 L. stylirostris는 비감염 개체들보다 길이 대비 중량이 더 낮았다고 보고되었다(Marin Jarrin and Shanks, 2008). 진흙새우는 감염과 비감염개체 간에 갑각장에 대한 건중량의 유의한 차이가 없어 기생충이 숙주의 성장에 대한 영향은 없는 것으로 생각된다.
기생등각류는 그들 숙주의 생식소 성숙을 저해하고, 그 정도와는 상관없이 십각류의 생식잠재력(reproductive potential)은 항상 상당히 감소된다고 알려져 있다(O’Brien and Van Wyk, 1985). 기생충에 감염된 딱총새우과(Alpheidae) Synalpheus yano의 포란 암컷은 감염되지 않은 같은 크기의 암컷에 비해 평균 41%의 포란수가 적었으며(Hernáez et al., 2010), O. griffenis에 감염된 포란한 U. pugettensis는 단지 15개의 초기난을(보통 1,800-11,000개) 가지고 있다고 하였다(Smith et al., 2008). Choi (2001)는 산모양깔깔새우에 대한 P. consolidatum의 감염 개체는 GSI값이 비감염 개체의 절반으로 보고하여 숙주의 생식에 대한 기생충의 부정적인 영향을 보고하였다. 본 연구의 감염된 암컷의 더 낮은 GSI와 체장별 포란암컷 비율에서 감염개체의 더 늦은 성숙으로 보아, 진흙새우아감벌레는 진흙새우 암컷의 생식소 발달을 저해한다고 추정 할 수 있다.