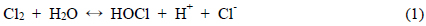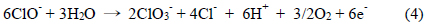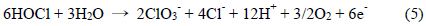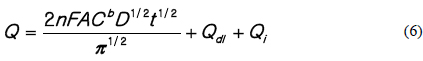We measured by electrochemical method for TRC (total residual chlorine) in ocean. From the results of Au electrode used for working electrode through cyclic voltammetry test, we obtained charge in voltage ranged from 0.0V-1.0V, and analyzed correlations of charge for TRC. Reduction peak TRC was investigated to be approximately 0.65 V vs. Ag/AgCl, and in the case that salt concentrations and temperatures in ocean appeared different, charge was analyzed for being different in the same TRC. However, in the case that each condition was constant, charge was measured at highly correlations for TRC.
세계적으로 물류네트워크 확산, 대형 물류기업의 증가로 물류산업이 성장하고 있으며, 대부분 항만을 통하여 무역이 이루어지고 있다. 우리나라도 수출입 물동량의 99.7%인 13억톤(2011년 기준)을 항만으로 선적・하역 및 운송하였다(Kim, 2012). 항만 무역이 증가함에 따라 해양 생태계에 대한 관심도 높아지고 있으며 이중 선박평형수에 대한 문제점이 대두되고 있다. 선박평형수란 선박 운항 때 무게중심을 유기하기 위해 배에 설치된 탱크에 채워넣는 바닷물인데, 화물을 선적 또는 하역하면서 바닷물을 버리거나 집어넣어 선박의 균형을 잡는다.
이런 선박평형수는 다른 국가의 항만에서 바닷물 교환이 이루어져 주변 해역의 토착 생태계를 교란시키는 해양오염의 원인이 되고 있다(Endresen et al., 2004; Gollasch et al., 2007; McCollin et al., 2007; Werschkun et al., 2012). 국제해사기구(International Maritime Organization, IMO)에서는 선박 평형수와 침천물 통제 및 관리를 위한 국제협약(International Convention for The Control and Management of Ship’s Ballast water and sediment)을 채택하여(IMO, 2004) 선박 평형수를 관리하고 있다.
IMO에서 기본승인한 선박평형수를 처리장치는 모두 34개이며(Kim et al., 2012) 이중 대부분은 직・간접의 전기분해 방식으로, 전기분해에 의해 생성된 잔류염소를 이용하여 선박 평형수를 살균하는데 이때의 잔류염소 측정은 농도제어를 위해 매우 중요하다.
수중에 존재하는 총잔류염소(Total Residual Chlorine, od, DPD colorimetric method 등이 있다(APHA, AWWA, and WEF, 1998). Iodometric method와 Amperometric titration method는 해수 중에 br-가 존재하면 HOCl과 반응하여 HBrO로 전환되고, HBrO는 요오드와 반응하여 다시 triiodide로 전환됨으로 분석 시 오차를 가져온다(Carpenter et al., 1977; George, 1980). 또한 Amperometric titration method는 분석시간이 오래 걸리며, 분석자의 숙련도가 요구되는 어려움이 있다(Edward, 1991). 가장 잘 알려진 DPD (N, N-diethylp-phenylene diamine)를 이용한 분석은 DPD가 Cl2에 의해 산화되어 Würster dye와 imine이 생성되고 Würster dye에 의해 선홍 빛으로 발색되어지는 원리로 측정된다. 하지만 이와 같은 DPD 방법은 낮은 농도의 산화제가 존재할 경우에 발색이 잘 이루어지지만, 높은 농도의 산화제가 존재할 경우 imine 계열의 화합물로 인하여 발색 유도가 잘 이루어지지 않아 분석에 오차를 가져올 수 있고 또한, monochloramine과 dichloramine이 존재하면 DPD가 tri-iodide와 반응하여 높은 농도 값을 유발하여 분석 시 애로사항이 있다(Harp, 2002). 또한, 이와 같은 방법들은 시약을 첨가해야하고, 다소 긴 분석시간이 요구되어 선박평형수 처리에서 발생되는 잔류염소를 측정하기에는 적합하지 않다. 이를 위한 대안으로 전기화학적 방식을 이용하여 수중에 존재하는 잔류염소를 측정하는 연구가 진행되고 있다. 전기화학적 방식을 이용할 경우 기존 방법에 비해 무시약으로 가능하며 수분이내에 빠르게 분석할 수 있다는 장점이 있다. 하지만 선진연구자 대부분은 수도수 또는 식수에서 TRC를 분석하였으며(Campl et al., 2005; Jin et al., 2004; Kodera et al., 2005b; Okumura et al., 2001) 해수에서의 연구는 거의 전무한 실정이다.
따라서, 본 논문에서는 해수에 존재하는 TRC를 측정하기 위하여 전기화학적 방법으로 검출하였다. 이때 사용된 전극재료로는 Au와 Pt를 사용하였고 각각 전극을 비교하여 전기화학적 센서로 유효성이 더 높은 전극을 살펴보고자 한다. 먼저 “전기화학적 방법의 TRC 측정 연구(I : Au전극 이용)”에서는 전기화학적 방식으로 TRC를 측정하기 위하여 Au전극을 이용하였고, 해수의 염분농도와 온도변화에 따라 전하량을 측정하여 TRC 측정 분석 가능성을 살펴보았다.
TRC 측정은 potentiostat/galvanostat (AMETEK, versastat 3)을 이용하여 선형 주사 전압-전류법(Linear sweep voltammetry, LSV)으로 실시하였으며, 전압 범위는 1.1 V에서 −0.6 V까지 인가하였고, 주사속도는 50 mV/sec이었다.
사용된 전극은 3전극계로 구성되며 작동전극(working electrode)은 면적 0.35 cm2의 금(Au)을 사용하였고, 기준전극(reference electrode)은 염화백금전극(Ag/AgCl, 3.5 M KCl), 상대전극(counter electrode)은 백금전극을 사용하였다.
TRC 표준용액 제조는 Aldrich사의 차아염소산나트륨(Sodium hypochlorite, NaOCl)으로 0.1 ppm, 0.5 ppm, 1.0 ppm, 5.0 ppm, 10.0 ppm, 15.0 ppm, 20.0 ppm을 조제하여 사용하였다. 해수의 pH 조정은 1N-NaOH를 주입하여 pH 7.7에서 실험을 진행하였다.
해수의 온도 조정을 위하여 워터자켓셀과 저온항온조를 이용하여 10℃, 15℃, 20℃에서 실험을 진행하였고 교반기를 이용하여 0 RPM부터 300 RPM까지 실험을 진행하였다.
해수는 우리나라 경상남도 남해(마산)에서 채취하여 사용하였으며, TRC의 DPD측정은 Pocket colorimeter(HACH)를 이용하였다.
3.1. Au전극을 이용한 TRC 측정에서 교반속도의 영향
본 연구는 전기화학적 방법으로 해수에서 TRC를 측정하고자 하였다. 선박평형수에서 TRC 측정은 ballasting 또는 deballasting 시 이루어져야 하므로 어느 정도의 교란은 일어날 것으로 예상되어 교반속도를 조절하여 실험하였다. 정체되어있을 때와 100 RPM부터 300 RPM까지 실험하였으며 이때의 해수의 조건은 20°C, 30 psu이었다. 또한 선박평형수의 전기분해 시 염소발생량은 15 ppm 전후이므로(Kim, 2012) TRC의 농도는 0부터 20 ppm까지로 하여 유효성을 살펴보았다.
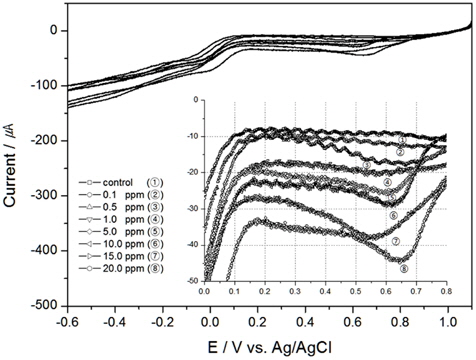
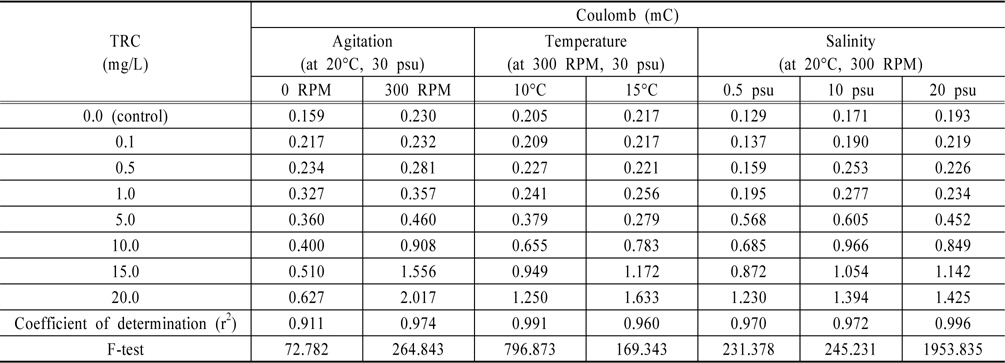
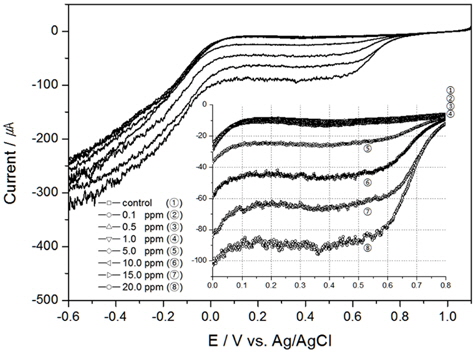
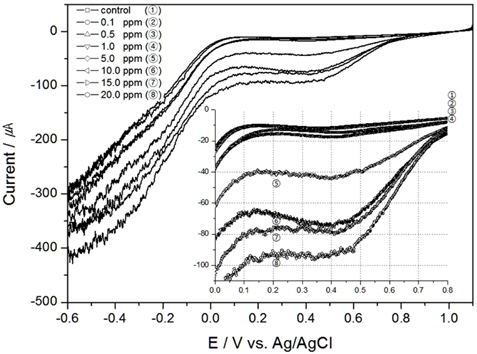
Fig. 1은 Au전극에서 0 RPM(정체되어 있을 때)에서의 TRC량을 분석한 결과이며, 안에 삽입된 그림은 0.0 V에서 0.8 V구간을 확대한 그림이다. 결과와 같이 TRC 1 ppm이하에서는 환원피크(cathodic peak)가 발생이 미미하지만, 5 ppm이상에서 부터는 환원피크(약 0.65 V vs. Ag/AgCl)가 나타남을 확인할 수 있었다.
전기분해로 발생된 염소는 수중에서 가수분해와 이온화 반응이 일어나는 식 (1), (2)와 같다(Panizza and Cerisola, 2006; Sciadone et al., 2009; Wang et al., 2010). HOCl은 H+ 이온과 OCl− 이온으로 해리되는데, pH가 낮을 경우 HOCl이 존재하고 높은 pH에서 OCl− 형태로 존재하게되며 소독효과는 HOCl이 OCl− 보다 약 100배정도 높은 것으로 알려져 있다(Chae, 2002). 여기서, 전류를 인가하여 환원반응을 일으키면, HOCl는 식 (3)과 같이 반응한다.
다른 선진연구자들의 실험결과를 살펴보면, Saputro et al. (2010)은 HOCl의 환원반응을 이용하여 검출하였다. Au전극을 사용하여 DPV(Differential Pulse Voltammetry)방법으로 HOCl를 검출하였으며, 이때 전해질은 0.01 M KCl, pH5.0, 주사속도 25 m/sec 이었다(Saputro, 2010). 환원피크는 약 0.5 V (vs. Ag/AgCl)에서 발생하여, 본 연구와 비교 시약 0.15 V 정도 이동(shift)하여 나타남을 알 수 있었다. 또한 선진연구자는 0 ppm에서 5 ppm까지만 실험을 진행하였는데, 전류변화는 0 ppm과 5 ppm의 차이가 약 0.6 μA정도 보였다. 이에 반해 Fig. 1의 결과를 살펴보면 전류값의 변화가 더 높게 나왔는데, 이는 전극면적과 전해질 등의 차이에서 생겨난 것으로 판단된다.
한편, 본 연구는 식 (3)과 같이 HOCl의 환원 반응을 통하여 실험 인자를 구하였다. 이에 반해 Murata et al. (2008)은 BDD (boron-doped diamond) 전극을 이용하여 FIA (Flow 실험조건은 전해질 0.1M NaClO4, 주사속도 100mV/sec 이었다(Murata, 2008). Kodera et al. (2004)은 Pt전극으로 전해질 0.1M NaClO4, 주사속도 50 mV/sec로 1.4 mmol부터 11.2 mmol Cl 까지 농도로 HOCl과 OCl− 를 산화반응으로 측정 및 분석하였다(Kodera, 2004). 또한 산화반응에서 HOCl만 검출하기도 하였고(Kodera, 2005a), 전극의 종류를 Pt, Au, Carbon 등으로 달리하여 잔류염소를 검출하는 연구 성과를 올렸다(Kodera, 2005b). 여기서, HOCl와 OCl- 가 산화가 일어날 경우 아래 식 (4), (5)와 같다(Körbahti and Artut, 2010; Lima, 2010; Mascia, 2012).
하지만, 본 연구에서 산화반응 시 특정 피크를 발견하지 못하였으며, 간혹 피크가 발생하였으나 잔류염소 농도에 대한 전하량의 유효성이 낮게 측정되는 바, 환원 반응에서 연구를 진행하였다. 또한, HOCl는 산화제이므로 환원으로의 반응이 쉽게 일어날 것으로 판단하여 환원반응에서 TRC의 검출 유효성을 실험하였다.
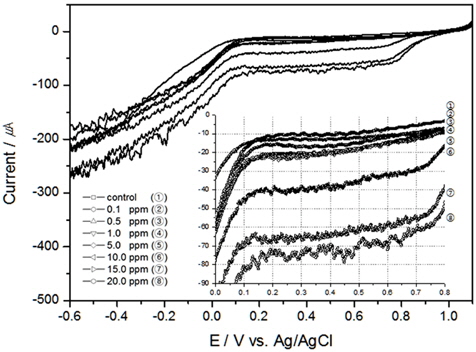
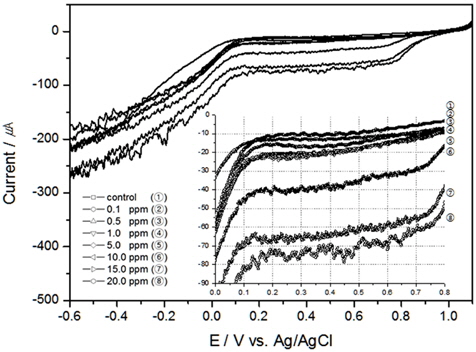
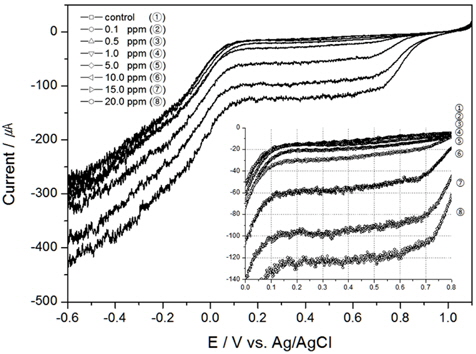
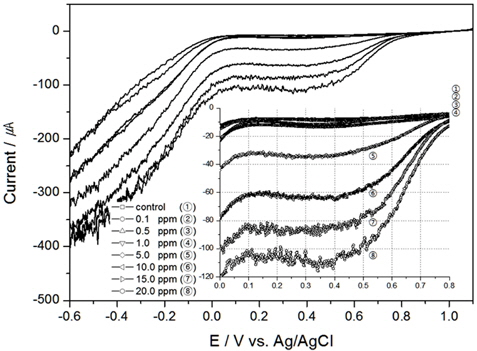
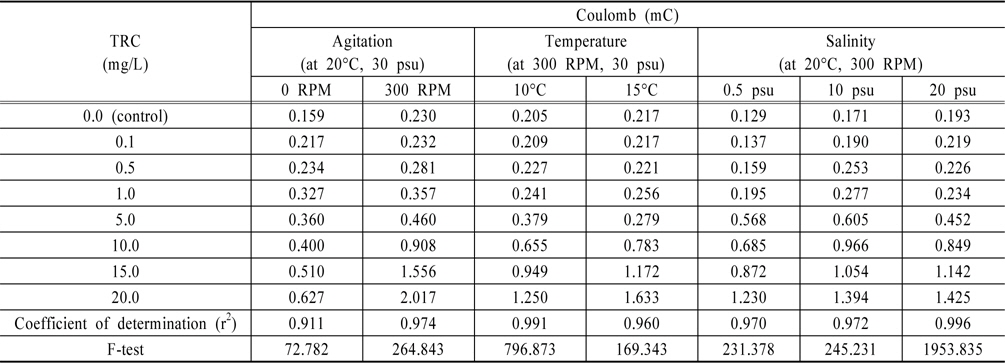
TRC를 검출하기 위하여 본 연구에서는 전기화학 방법 중 전기량법으로 분석하였다. 전압의 범위를 0.0 V에서 1.0V로 선정하고 구간을 적분하여 전하량을 산출한 결과와 이를 회귀분석하여 구한 결정계수값을 Table 1에 정리하였다. 그리고 교반속도 100 RPM부터 300 RPM까지의 결과를 각각 Fig. 2, 3, 4에 나타내었다.
[Table 1.] Summary of variations of Coulomb with Au electrode
Summary of variations of Coulomb with Au electrode
결과와 같이, 동일한 TRC 농도라도 교반속도가 빨라질수록 전하량이 커지는 것을 알 수 있는데, 이는 다음과 같은 이유로 사료된다. 전기량법은 코트렐 식(Cottrell’s equation)에 전기이중층과 흡착 등에 의한 계면에서의 상호작용 등의 관계로 아래 식과 같이 나타낼 수 있다.
Q = charge n = the number of electrons in the reaction F = Faraday A = electrode area Cb = bulk concentration D = diffusion coefficient Qdl = charge due to the double layer Qi = charge due to interfacial phenomenon
즉, 전하량은 확산이 있을 경우 그 값은 증가하게 된다. 확산계수는 단위시간, 단위 면적당 통과하는 이온의 량에 비례하므로 전극표면으로의 HOCl가 빠르게 반응하면서 전극계면과 벌크(bulk)용액 사이의 농도구배(concentration gradien)인 농도과전압(concentration overpotential)을 낮추어 전류의 이동을 증가시켜, 교반속도가 빠를수록 같은 농도이지만 전하량이 증가한 것으로 사료된다.
3.2. Au전극을 이용한 TRC 측정에서 온도와 염분농도의 영향
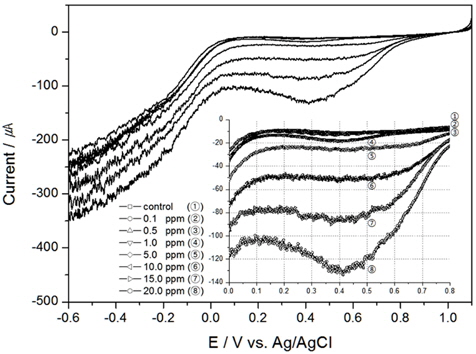
TRC 측정에서 온도의 영향을 알아보기 위하여 교반속도 300 RPM, 염분농도 30 psu로 고정 후 10℃, 15℃, 20℃에서 실험을 진행하였다. 앞서 실험한 Fig. 4가 20℃에서의 연구 결과이고 Fig. 5와 6이 각각 10℃, 15℃에서의 결과이다.
결과와 같이 TRC가 같은 농도일지라도 온도 변화에 따라 전하량이 상이하다는 것을 알 수 있었으나, Table 1에 나타낸 것처럼 온도가 일정할 경우, 전하량과 TRC와의 상관성은 매우 높게 측정되었다. 특히 온도가 낮아지면 전기전도도 또한 낮아져 결정계수가 높지 않을 것이나 예상하였으나, 온도 10℃에서도 결정계수가 0.99119로 높은 상관성을 보였다. 또한 TRC 농도가 1 ppm 이상에서는 전하량의 변화가 비례적으로 증가함을 알 수 있었으나, 1 ppm 이하에서는 비례 관계가 다소 낮게 나타났다.
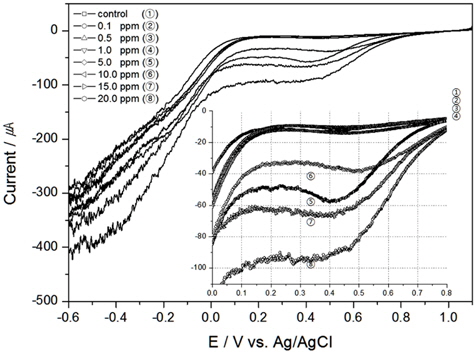
해수의 염분농도가 TRC 농도의 전하량에 미치는 영향을 알아보고자, 교반속도 300 RPM, 온도 20℃로 실험조건을 일정하게 한 후 0.5 psu, 10 psu, 20 psu로 염분농도를 달리하여 실험한 결과를 각각 Fig. 7, 8, 9에 나타내었고 30 psu에 대한 결과는 앞서 실험한 Fig. 4이다. 결과와 같은 LSV를 0.0 V에서 1.0 V 까지를 적분하여 전하량을 구하면 Table 1과 같고, 이때의 결정계수는 0.5 psu, 10 psu, 20 psu 그리고 30 psu에서 각각 0.97041, 0.97216, 0.99644 그리고 0.97416으로 염분농도가 일정하다면 TRC 농도와 전하량과의 상관성은 매우 높은 것으로 분석되었다. 또한 F검정 결과 변수들의 유의성이 있는 것으로 나타났다.
하지만 염분농도가 달라지면 TRC 농도가 같더라도 전하량은 다르게 측정되었다. 이는 식 (6)에서 전하량은 전해질의 영향을 받기 때문이다. 전해질은 그 속에 들어있는 이온의 이동에 의해 전류를 통하는 매체 역할을 하는데, 염분농도가 높을수록 이온간의 평균거리가 짧아져 정전기적인 상호작용으로 인하여 이온의 활동도가 증가하여 전류를 많이 흘려주게 되므로, 염분농도가 높을수록 같은 TRC 농도라도 전하량이 높게 측정된 것으로 판단된다.
해수에서 존재하는 TRC를 전기화학적 방법으로 측정하고자 Au전극을 이용하여 해수의 교반 유무, 온도 그리고 염분농도의 변화에 따라 TRC 농도와 전하량의 상관성을 연구하였다.
해수의 염분농도가 30 psu로 일정하고 교반속도가 300 RPM일 때 10℃, 15℃, 20℃에서 결정계수는 각각 0.99119, 0.96007, 0.97416으로 매우 높게 나왔다. 또한 해수의 온도를 20℃ 고정시키고 염분농도를 0.5 psu, 10 psu, 20 psu 그리고 30 psu로 변화시켜 실험한 결과 결정계수는 각각 0.97041, 0.97216, 0.99644 그리고 0.97416으로 TRC의 농도와 전하량은 높은 상관성을 보였다. 하지만 이와 같은 결정계수는 염분농도와 온도 등의 조건이 일정할 경우 얻어진 값으로, TRC 농도가 같더라도 인자가 달라지면 전하량이 상이하게 분석되어짐을 알 수 있었다.
따라서 “해수에서 전기화학적 방법을 이용한 TRC 측정연구(Ⅱ : Pt전극 이용)” 편에서는 그에 대한 방안과 Au전극과 Pt전극을 비교하여 TRC를 분석한 결과를 서술하였다.