We investigated a nematode infection in the epithelial tissue of rockfish
조피볼락(
어류는 선충(Nematode)의 중간숙주 혹은 종숙주가 되며, 현재까지 약 650종 이상의 선충이 어류에 감염되는 것으로 보고되어 있다. 일반적으로 선충은 자연산 어류에서 주로 감염보고가 많으며, 그 생활사에서 중간숙주를 필요로 하기 때문에 밀폐된 양식 환경의 양식어류에서는 선충류에 감염되는 경우는 많지 않다. 담수어에서는 Camallanoidea 및 Ascaroidea 목의 선충류가, 해산어에는 일반적으로 Ascaridoidoiea (
2012년 7월 서해안 충청남도 천수만(126.42°N, 36.60°E) 구매항 가두리 양식장 한 곳에서 사육되는 조피볼락에서 지느러미, 아가미 뚜껑의 상피 조직에 감염되는 선충이 최초로 확인되었으나, 당시 여러 가지 이유로 선충 특성 및 피해량 등에 대한 조사가 이루어지지 못했다. 그래서 본 연구에서는 천수만 일대가두리 양식장의 조피볼락에서 해당 선충 감염 및 피해 현황을 정확히 파악하기 위하여 2013년 5월부터 2014년 4월까지 1년간 총 5회에 걸쳐 천수만 일대 조피볼락을 대상으로 해당 선충감염에 대한 피해 조사를 실시하였다. 또 선충의 감염 특성을 밝히기 위하여 샘플링한 조피볼락에 대한 일반적인 질병검사인 기생충, 세균 및 바이러스 검사를 수행하였으며, 계절별 선충 감염율 및 조피볼락 폐사율의 관계를 조사하여 조피볼락 선충 감염에 대한 기초자료를 수집하고자 하였다.
2013년 5월, 8월, 10월, 2014년 1월 및 4월, 총 5회에 걸쳐 약 1년간 서해안 천수만 일대의 해상가두리 6개 지점(Fig. 1)의 조피볼락을 대상으로 양식 현황 및 어류 폐사율을 조사하였다. 각양식장마다 조피볼락을 각각 3-10마리씩 샘플링 하였으며(Table1), 시험어는 샘플링 후 2시간 이내에 일반적인 질병검사를 실시하였고 검사 전까지 냉장상태로 보관하였다.
[Table 1.] Diagnosis results of this study
Diagnosis results of this study
샘플링 된 조피볼락의 기생충 검사를 위하여 체표 및 아가미를 광학현미경을 사용하여 외부기생충을 검경하였다. 모든 조피볼락의 내부장기 및 외부기관에서 해부용 가위와 핀셋을 사용하여 선충 감염 부위의 확인 및 분리를 실시하였다. 어류당 선충의 감염 개체 수를 확인하였으며 또한 분리된 선충의 크기를 측정하였다.
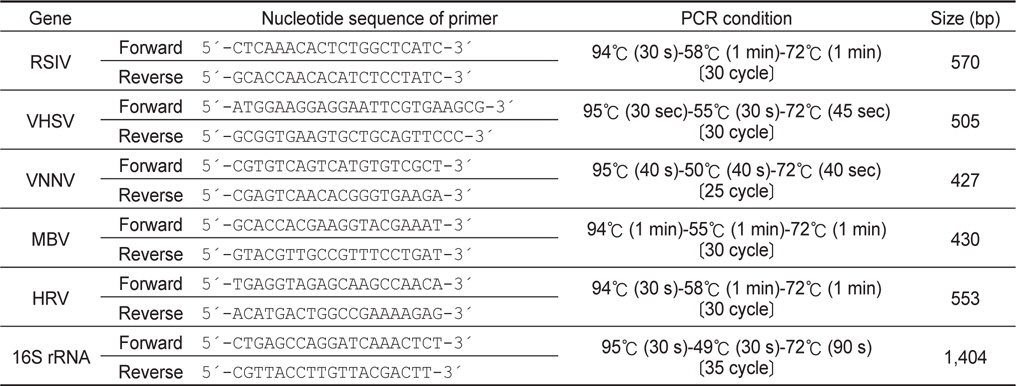
세균검사를 위하여 신장과 비장 조직을 무균적으로 적출한뒤 1.5% NaCl이 포함된 Brain Heart Infusion Agar (BHIA, Gibco, USA) 평판배지에 도말한 뒤 25℃ 항온배양기에 배양하였다. 배양된 세균은 계대배양을 실시하여 순수분리하였으며, 종 동정을 위해 16S rRNA유전자에 대한 염기서열 분석을 실시하였다. 분리균의 genomic DNA 추출과 PCR 분석은 상기와 동일하게 High pure template preparation kit (Roche, Germany)와 Ex TaqⓇ (Takara, Japan)을 사용하였다. 16S rRNA 유전자는 Table 2의 조건으로 PCR을 수행하였고, 증폭된 PCR산물은 전기영동으로 band를 확인한 후, Gel SV kit (GeneAll, Korea)로 정제하고 Topo TA cloningⓇ (Invitrogen, USA)을 이용하여 cloning하여 염기서열을 확인하였다. 염기서열의 분석에는 Genetyx Ver. 8.0 (SDC Software Development, Japan)을 사용하였으며, NCBI에서 제공되는 BLAST program 정보를 이용하여 상동성을 비교하였다.
[Table 2.] Oligonucleotide primers used in PCR amplification
Oligonucleotide primers used in PCR amplification
시험어의 신장과 비장 조직을 적출하여 마쇄한 뒤 High pure PCR template preparation kit (Roche, Germany)를 사용하여 DNA를 추출하였고, Easy-spin Total RNA Extraction Kit (Intron, Korea)를 사용하여 RNA를 추출한 뒤 SuperScriptTMⅡReverse Transcriptase (Invitrogen, USA)를 사용하여 cDNA를 합성하였다. PCR 분석은 Ex TaqⓇ (TaKaRa, Japan)을 이용하여 매뉴얼에 따랐으며, 사용된 primer set 및 PCR 조건은 Table 2에 나타내었다. 증폭된 산물은 전기영동으로 확인하였으며, 모든 PCR 분석은 양성대조 및 음성대조를 함께 비교하였다. 해산어에서 주로 검출되는 바이러스인 참돔이리도바이러스(Red sea bream irido virus; RSIV), 바이러스성출혈성패혈증바이러스(Viral hemorrhagic septicaemia virus; VHSV), 바이러스성신경괴사증바이러스(Viral nervous necrosis virus; VNNV), 마린버나바이러스(Marine birna virus; MBV), 히라메랩도바이러스(Hirame rhabdo virus; HRV)를 검사 대상으로 하여 polymerase chain reaction (PCR법)으로 검사하였다 (Table 1). 증폭된 산물은 1.5% Agarose gel (Bioneer, Korea)을 사용하여 전기영동을 실시하였으며 UV 상에서 band를 확인하였다.
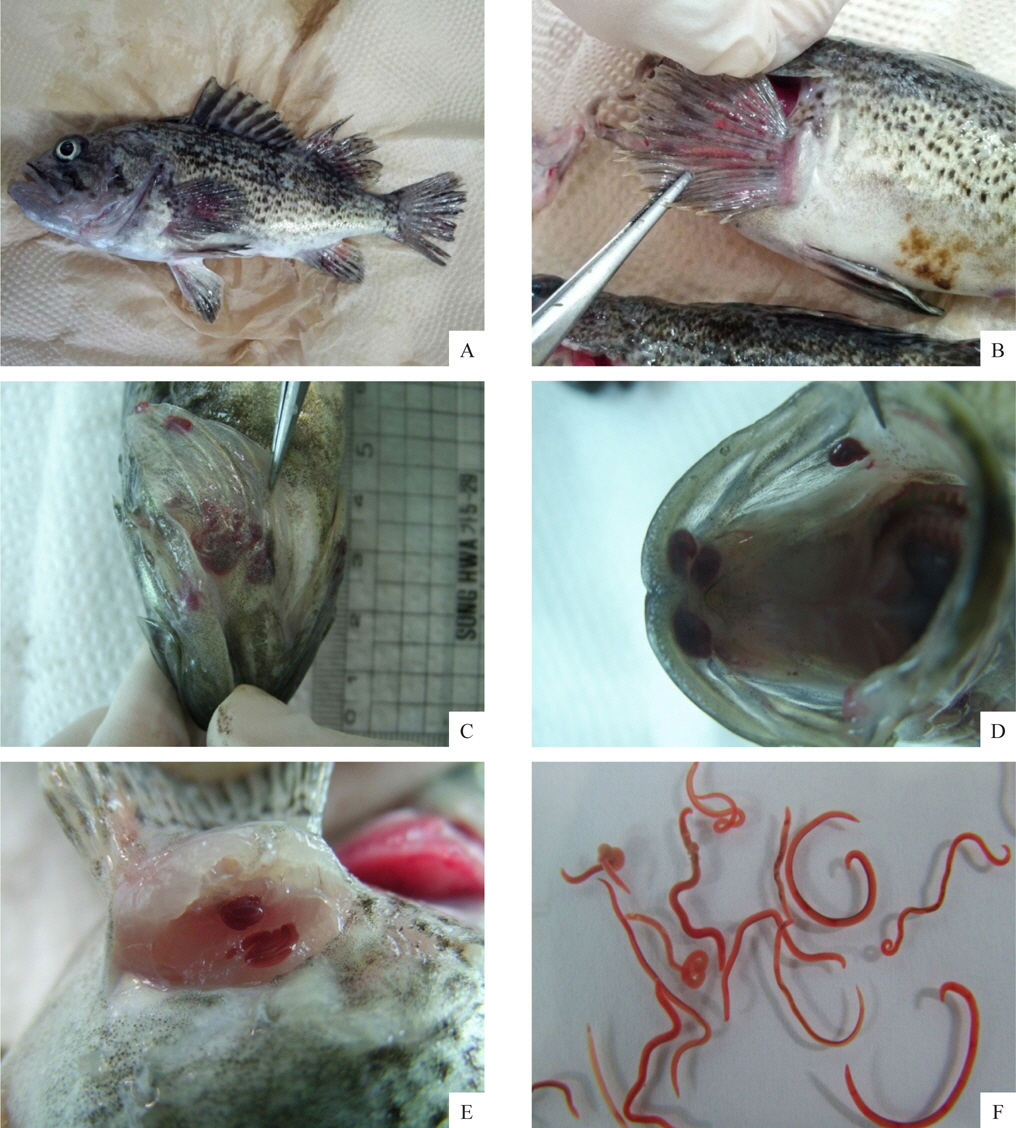
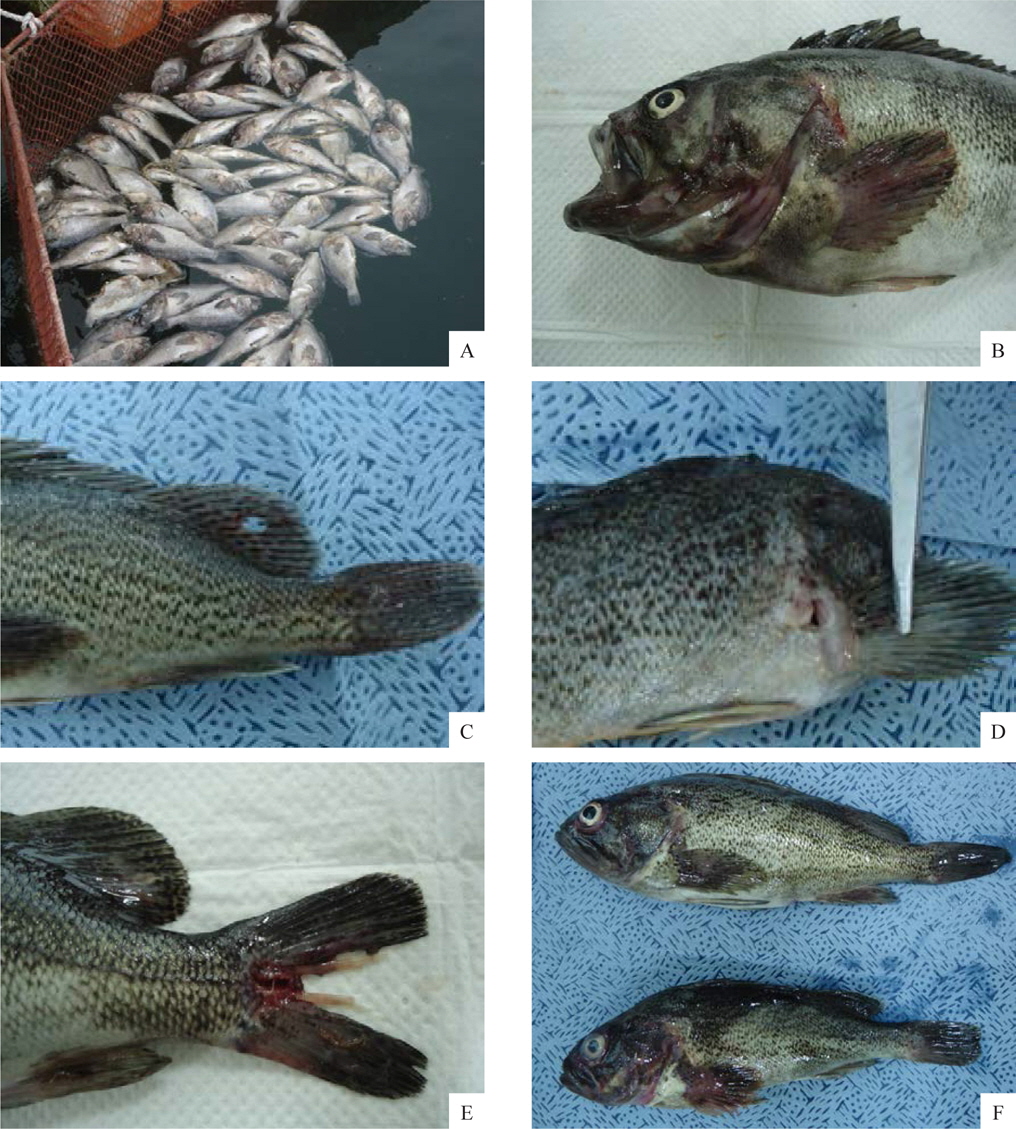
선충에 감염된 조피볼락은 육안적으로 특별한 외상이 없었으며, 지느러미나 아가미뚜껑 부위가 붉게 보였다(Fig. 2A, 2B, 2C). 그러나 이것을 핀셋 등으로 조심스럽게 긁어보면 붉은색의 선충을 확인 할 수 있는데(Fig. 2F), 본 연구에서 최초로 확인된 양식 조피볼락의 선충은 대부분 가슴지느러미 연골과 연골사이의 상피부위에 가장 많이 감염되어 있었으며, 그 외에도 아가미뚜껑, 주둥이 연골주위, 그 외 지느러미의 상피에 감염되어 있는 것이 확인되었다.
조피볼락에서 분리한 선충은 붉은색의 원통형으로서 현미경으로 관찰하였더니 표면이 매끈하였다. 본 연구에서는 선충의 동정을 위하여 어체에서 분리한 선충의 genomic DNA를 분리하여 18S rRNA 유전자(1,483 bp) 염기서열을 분석, NCBI에서 제공되는 BLAST program 정보를 이용하여 상동성을 비교였다. 분석 결과 금붕어에서 분리되는 선충류인
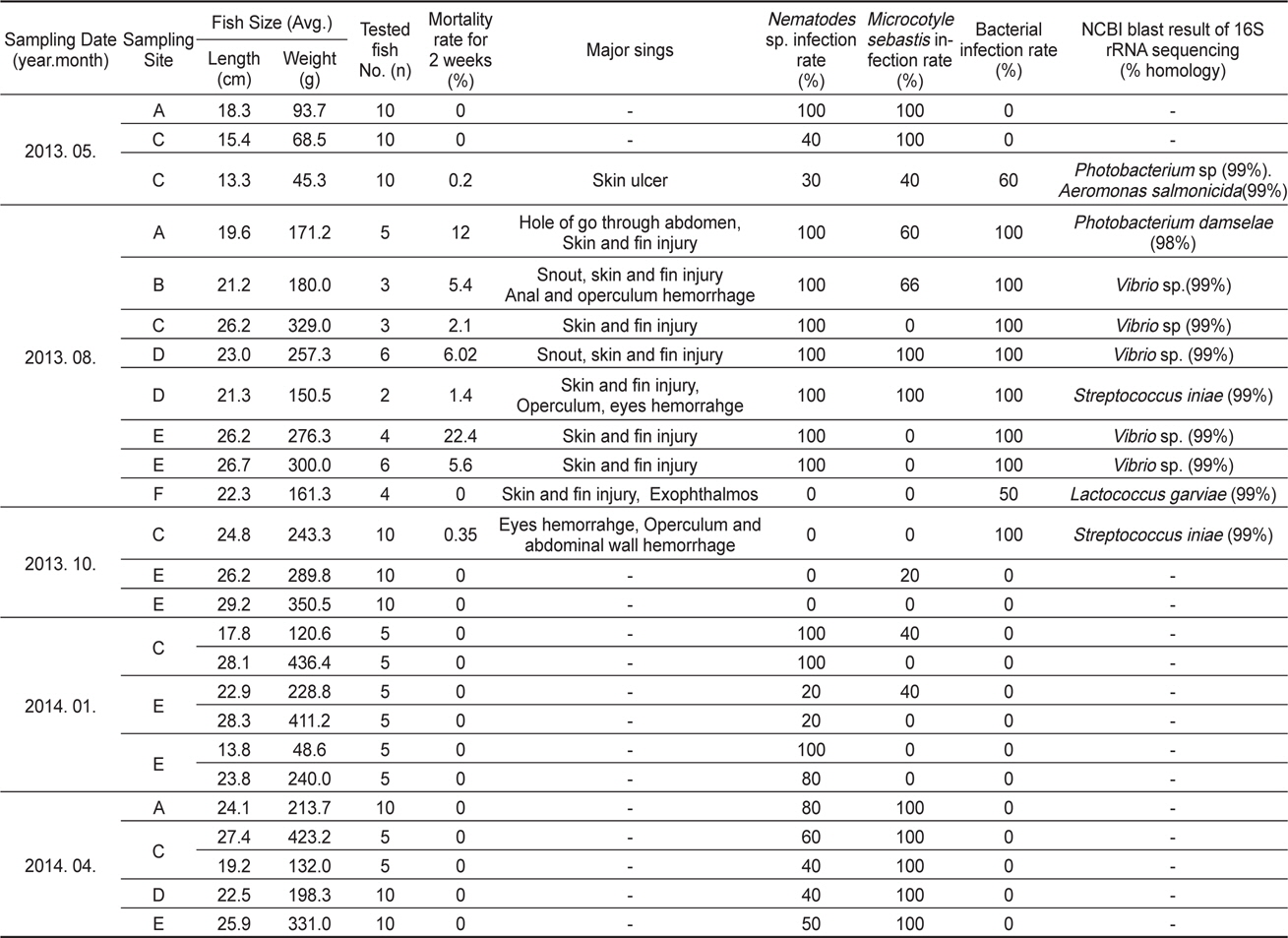
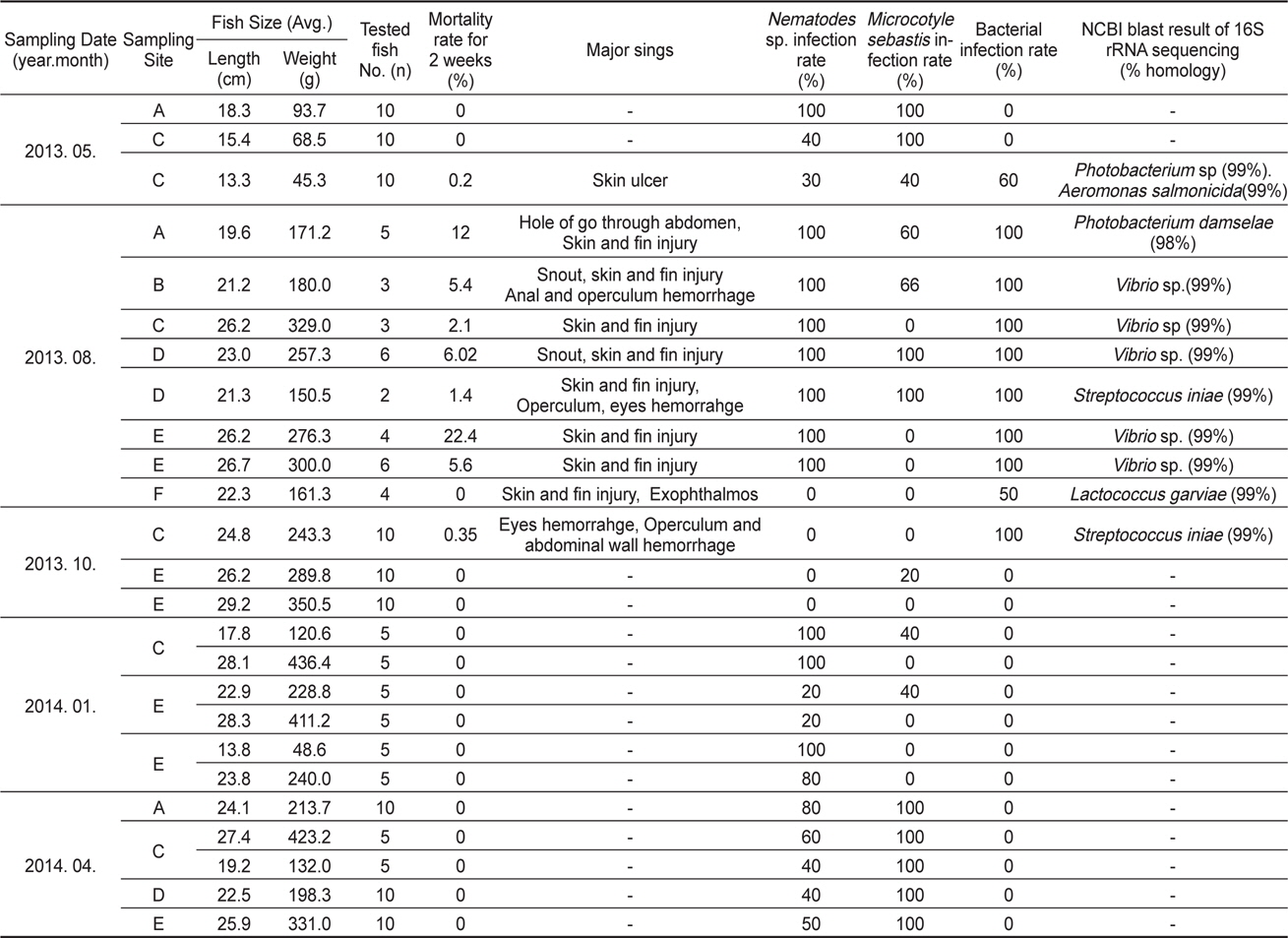
2013년 5월부터 2014년 4월까지 약 1년간 천수만 일대 6개 (A-F) 지역의(Fig. 1) 가두리 양식장에서 사육하는 조피볼락의 질병 검사 결과를 Table 1에 나타내었다. 조사기간 동안의 천수만 일대의 연간 수온은 2013년 5월 10-12℃, 2013년 8월 25-27℃, 2013년 10월 18-19℃, 2014년 1월 3-4℃, 2014년 4월9-10℃로 나타났다. 2013년 5월 및 10월에 조사한 각각 1개소의 양식장 및 2013년 8월 고수온기를 제외하고, 대부분의 조피볼락 양식장에서 질병으로 인한 폐사가 발생하지 않았다. 고수온기인 7월 말부터 8월 초까지 2주간 조피볼락의 폐사율이 조사 기간 중에 가장 높았으며 해당 기간 조피볼락 누적 폐사율은 0-22.4% 로 나타났다. 또 조사 지역별로는 2013년 10월에 조사 한 해역 중 당암리(F 지역)를 제외하고, 모든 조사 지역과 조사시기에 선충 감염이 확인되었으며(Table 1), 모든 검사개체에서 바이러스는 검출되지 않았다.
선충의 감염률은 2013년 5월 양식장 3개소에서 56.7% (
조피볼락의 대량폐사가 확인된, 2013년 8월에는 선충 뿐만 아니라 조사한 모든 조피볼락의 내부 장기에 1-2종의 병원성 세균이 같이 분리되었다(Table 1). 분리된 세균의 16S rRNA 유전자 염기서열 분석결과
조사한 모든 조피볼락에서 어류 개체당 감염된 선충의 마리수를 확인하지 못하였으나, 2013년 5월에 샘플링을 실시한 조피볼락에서는 어류 한마리 당 1-209마리의 선충이 분리되었으며, 2014년 1월에는 1-93마리가, 4월에는 1-262마리의 선충이 분리되었다. 위의 결과로부터 선충의 감염 정도는 조피볼락의 개체별로 크게 차이가 나는 것을 확인할 수 있었다. 2014년 4월에 조사한 선충의 길이 및 무게를 측정한 결과 2년간 양식한 조피볼락에서는 15.5±3.5 mm, 29±15 mg의 선충이, 3년간 양식한 조피볼락에서는 19.5±2.5 mm, 37±8 mg의 선충이 분리되었다. 선충의 크기와 어류 연령간의 연관성이 있어 보여 통계학적으로(t-test) 연관성을 분석하였으나, 연령과 선충 크기 사이에는 통계학적으로 유의적인 연관성이 없는 것으로 나타났다(선충 길이,
이전의 많은 연구 결과, 어류에 선충 감염 자체가 숙주의 직접적인 폐사를 유발하는 경우는 거의 없었다(Park and Oh, 2009). 본 연구에서도 이와 마찬가지로 선충 단독 감염 시에 조피볼락의 폐사가 확인되지 않았으며, 또 육안적으로도 지느러미나 아가미 뚜껑에 선충이 감염된 조피볼락에서도 유영 및 호흡의 이상 증상이 확인되지 않았다. 이러한 결과로 볼 때 조피볼락의 선충 감염 자체가 숙주에 직접적인 폐사를 유발한다기 보다는 선충이 빠져 나간 부위에 생긴 상처를 통하여 2차 병원세균의 감염이 발생하여 폐사가 발생한 것으로 추정된다.
생활사가 가장 잘 알려진 선충류인 잉어의 사상충병의 원인체인
서해안 천수만 일대의 조피볼락 가두리 양식장의 경우 대부분수심 5 m 이하로, 비교적 수심이 깊은 남해안 및 동해안의 가두리 양식장과는 환경적인 특성이 많이 다르다. 현재까지 남해안과 동해안에서 양식되는 조피볼락에서는 이와 같은 선충 감염보고가 되지 않는 점에서 천수만의 지역적인 특성이 선충 감염과 연관성이 있을 가능성도 있어, 천수만 이외의 타 지역의 조피볼락의 선충 감염에 대한 추가적인 조사가 필요할 것으로 보인다. 또한 선충류의 특성상 숙주로부터 선충을 제거하기가 사실상 불가능하므로, 감염환의 단계에서 종숙주로의 선충의 감염을 차단하여야 한다. 따라서 선충의 중간숙주 혹은 운반숙주를 탐색하여 감염경로를 제거하는 방법에 대한 연구가 필요할것으로 생각된다.
전 세계적으로 조피볼락에 기생하는 선충은 현재까지 보고된적이 없기에 이번 연구에서 분리한 선충이 신종일 가능성이 높으나, 전자현미경을 통한 형태학적 분석 및 유전학적 특성 분석을 통한 정확한 종 분류가 필요하여 현재 연구 중에 있다. 또, 이후의 연구로 선충의 근본적인 구제를 위해서는 선충 생활사 규명이 필요할 것이다.