A sequencing batch reactor (SBR) was operated to obtain thiosulfate-utilizing denitrifier cultivated with two types of electron accepter (nitrate and nitrite). Using the microbial biomass obtained from the SBR, batch tests were conducted with different nitrite concentrations (50 and 100 mg-N/L) at pH 7.0, 7.5 and 7.9 to see how free nitrous acid (FNA) negatively works on the thiosulfate-utilizing denitrification of nitrate. The specific denitrification rate (SDR) of nitrate was significantly influenced by pH and FNA. The presence of nitrite caused a remarked decrease of the SDR under low pH conditions, because of the microbiological inhibitory effect of FNA. The minimum SDR was observed when initial nitrite concentration was 100 mg-N/L at pH 7.0. Moreover. the SDR was influenced by the type of electron acceptor used during the SBR operation. Thiosulfateutilizing denitrifier cultivated with nitrite showed smaller SDR on the thiosulfate-utilizing denitrification of nitrate than those cultivated with nitrate.
생물학적 방법으로 산업폐수를 처리하는 공공하수시설의 대부분은 질소 제거에 많은 어려움을 겪고 있다. 이는 생물학적 질소 제거를 위한 적정 수준의 C/N비 유지가 어렵기 때문으로 탈질 효율을 향상시키기 위해 메탄올과 같은 외부 탄소원을 이용하고 있다. 최근에는 음식물 쓰레기 탈리액(Lee et al., 2011)이나 식품공장 폐액인 미당(Lee et al., 2012)과 같은 폐기물을 외부 탄소원으로 이용해 탈질 효율을 높이고자 하는 노력을 기울이고 있다. 그러나 외부 탄소원의 추가적 공급에 따른 슬러지 발생량 및 동력비 증가가 하수처리장의 운전비용을 크게 증가시키는 요인으로 지적되고 있다.
이에 기존 종속영양탈질공정의 단점을 보완할 수 있는 공정이 다수 개발되어 사용되고 있는데 암모니아를 아질산성 질소로 산화시킨 후, 질소가스로 환원시켜 제거하는 단축질소제거공정이 대표적이다. 이 공정에서는 아질산 산화균의 성장 억제와 암모니아 산화균의 우점화를 통해 암모니아의 부분 산화가 이루어지며, FA (Free ammonia), FNA (Free nitrous acid), pH, 용존산소, 온도 및 고형물체류시간 등이 주요 운전조건으로 알려져 있다(Chung and Bae, 2002; Hellinga et al., 1998). 기존 공정에 비해 이론적으로 암모니아 산화 과정에서 산소 요구량을 약 25% 절감할 수 있고, 탈질 시 필요한 유기물 요구량도 메탄올 기준으로 약 40%나 절감할 수 있어 경제적인 공정이다.
최근에는 경제성 극대화를 위해 유기물 대신 황화합물을 전자공여체로 이용하는 독립영양탈질공정을 도입한 단축질소제거공정이 개발되어 이용되고 있다. 이 공정은 탈질에 필요한 전자가 유기물에서 공급되는 기존 종속영양탈질공정에 비해 외부 유기물 탄소원 공급이 필요 없고 슬러지 발생량도 적어 경제적인 공정이다. 그러나 아질산성 질소는 미생물의 대사작용을 저해하기 때문에 황화합물을 이용한 독립영양탈질에 큰 영향을 미치는데 낮은 농도에서도 황탈 질능을 크게 저해하지만 알칼리도가 충분한 조건에서는 그 영향이 적은 것으로 알려져 있다(Kang and Oh, 2010; Oh et al., 2000).
이와 같이 아질산성 질소가 독립영양탈질에 미치는 다양한 저해는 pH와 깊은 관계를 갖는 FNA에서 기인한 것으로 판단된다. FNA 농도는 pH와 아질산성 질소 농도와의 관계(Anthonisen et al., 1976)에 의해 결정되는데 탈질과정 에서 기질의 세포막 통과나 에너지 생성, 세포 성장 등에 영향을 주며(Mortensen et al., 2008), 아질산성 질소의 환원 효소인 NirK의 발현을 저해하는 것으로 알려져 있다(Beaumont et al., 2004). 더욱이 아질산성 질소의 탈질과정에서 발생하는 N2O의 환원효소 활성 사이트와 반응하여 경쟁적 저해를 일으키는 것으로도 알려져 있다(Rasmussen et al., 2005). 따라서 낮은 pH 조건은 황탈질균의 에너지 생산과 성장을 크게 저해하는 것으로 알려진 FNA 농도를 상승시켜 아질산성 질소의 탈질능을 크게 저해할 수 있다.
이에 본 연구에서는 전자공여체로 황화합물을 이용한 질산성 질소 및 아질산성 질소의 독립영양탈질에 미치는 FNA의 영향을 알아보기 위하여 전자수용체로 질산염과 아질산염으로 각각 배양한 황탈질균을 이용해 다양한 pH 조건 및 아질산성 질소 농도에서 탈질능을 측정하고, 그 결과를 FNA 농도와 함께 논의하였다.
전자공여체로 티오황산염(S2O3−)을 이용해 질산성 질소와 아질산성 질소를 질소가스로 환원시킬 수 있는 황탈질균을 얻기 위하여 2리터 용량의 회분식 반응기와 합성폐수를 이용해 30℃에서 약 4개월간 황탈질 반응조를 운전하였다. 이 기간 동안 전자수용체의 종류에 따라 황탈질 반응조를 두 단계로 나누어 운전하였는데 첫 번째 단계(stage I)에서는 전자수용체로 질산성 질소를 이용해 약 2개월간 운전하였다. 운전 초기에 황탈질균의 원활한 우점화를 위해 안산 하수처리장의 반송 슬러지를 식종하였고, 질산성 질소의 농도를 하루에 20 mg-N/L씩 단계적으로 증가시켜 5일째부터 100 mg-N/L가 되도록 하였다. 두 번째 단계(stage II)에서는 전자수용체를 질산성 질소에서 아질산성 질소로 바꾸어 약 2개월간 운전하였다. 전자수용체의 변화에 따른 황탈질균의 탈질능 저하를 최소화하기 위해 첫 번째 단계와 유사하게 아질산성 질소의 농도를 이틀에 25 mg-N/L씩 단계적으로 증가시켜 10일째부터 100 mg-N/L가 되도록 하였다. 황탈질 반응조를 운전하는 동안 황탈질균이 성장한 혼합 배지액 200 mL를 이틀에 한 번씩 제거하고 그에 상응하는 양의 새로운 합성배지를 공급하여 수리학적 체류시간과 고형물 체류시간을 20일로 유지하였다. 이때 각 단계의 휘발성 부유물질(VSS) 농도는 50일째 680 mg/L, 115일째 620 mg/L로 유지되었다.
황탈질 반응조 내 혼합 배지액을 구성하는 각각의 성분들의 초기농도가 1리터 당 KNO3 721 mg (stage I) 혹은 KNO2 607 mg (stage II), Na2S2O3・5H2O 1.5 g, NaHCO3 700 mg, K2HPO4 5.6 mg, NH4Cl 5.7 mg, MgCl2・6H2O 1.0 mg, CaCl2・2H2O 1.0 mg, FeSO4・4H2O 1.0 mg, MnSO4・4H2O 1.0 mg이 되도록 합성폐수를 준비하였다(Kim, 2004).
다양한 FNA 농도가 질산성 질소 및 아질산성 질소의 황탈질능에 미치는 영향을 평가하기 위하여 황탈질 반응조에서 51일과 116일에 얻은 각각의 슬러지와 합성폐수를 이용해 회분식 실험을 실시하였다.
회분식 실험은 Table 1에 나타낸 것과 같이 다양한 pH 조건 및 FNA 농도에서 실시하였는데 용존산소가 탈질에 미치는 영향을 최소화기 위해 회분식 실험 전 질소 가스로 충분히 퍼징한 후, 30℃로 유지되는 교반형 항온조에서 실시하였다.
[Table 1.] Various pH conditions and FNA concentrations for batch experiments
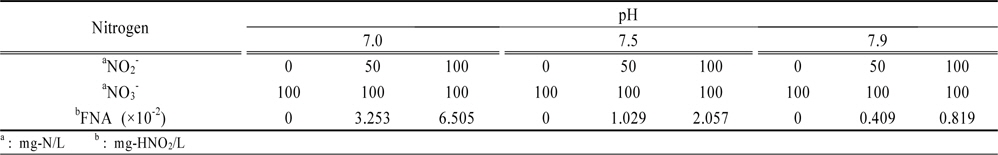
Various pH conditions and FNA concentrations for batch experiments
황탈질 반응조 및 회분식 실험에서 얻은 시료의 질산성 질소 및 아질산성 질소 농도는 나이론 실린지 멤브레인 필터로 여과한 후, 이온크로마토그래프(IC-1000, Varian)로 측정하였고, 휘발성 부유물질 농도는 Standard method (APHA, AWWA, and AWEF, 1999)의 분석법을 이용하여 측정하였다.
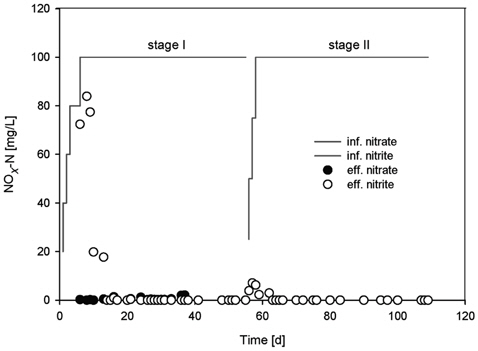
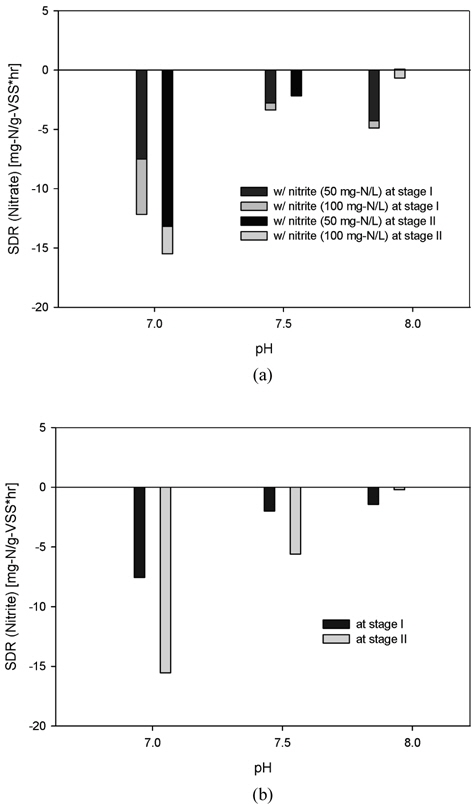
전자수용체의 종류에 따라 두 단계로 나누어 운전한 회분식 황탈질 반응조의 탈질능 결과를 Fig. 1에 나타내었다. 첫 번째 단계에서는 전자수용체로 질산염을 이용하여 반응조를 운전한 결과(stage I), 초기에는 질산성 질소의 대부분이 아질산성 질소의 형태로 축척되었으나 14일째부터는 아질산성 질소의 탈질도 원활히 진행되어 더 이상의 축적은 관찰되지 않았다. 두 번째 단계인 56일째부터는 전자수용체를 질산염에서 아질산염으로 바꾸어 운전한 결과(stage II), 초기에는 불안전한 탈질로 약간의 아질산성 질소의 축적이 관찰되었으나 곧 안정화되어 63일째부터는 검출되지 않았다. 황탈질 반응조가 안정적으로 운전되는 동안, 질산성 질소 및 아질산성 질소의 탈질과정에서 지체기(Lag phase)는 관찰되지 않았고, 더욱이 질산성 질소의 탈질과정에서 아질산성의 축적도 관찰되지 않았다. 이때 50일째 질산성 질소의 비탈질속도(Specific denitrification rate)는 16.3 mg-N/g-VS S・hr이었고, 115일째 아질산성 질소는 52.1 mg-N/g-VSS・hr으로 아질산성 질소의 비탈질속도가 약 3.2배나 큰 탈질능을 보였다. 이에 전자공여체로 티오황산염을 이용해 황탈질 반응조를 운전하는 동안 질산성 질소 및 아질산성 질소의 높은 탈질효율을 안정적으로 얻을 수 있었다.
각각의 전자수용체 조건에서 배양한 황탈질균을 이용하여 질산성 질소 및 아질산성 질소의 탈질능을 측정하였다. 그 결과를 Table 2에 나타내었는데 단위시간 당 황탈질균에 의한 질산성 질소 및 아질산성 질소의 탈질량(비탈질속도)이 아질산성 질소의 초기농도와 pH 조건에 큰 영향을 받는 것으로 나타났다. 질산염으로 배양한 황탈질균의 경우(stage I), 질산성 질소의 탈질량은 아질산성 질소의 초기농도와 pH가 증가할수록 감소하는 것으로 나타났다. 아질산성 질소가 존재하지 않을 때, pH 7.0에서 가장 많은 탈질량이 관찰되었으나 아질산성 질소 농도가 100 mg-N/L일때, pH 7.9에서 가장 적은 탈질량이 관찰되었다. 그러나 아질산성 질소의 탈질량은 질산성 질소와 유사하게 아질산성 질소의 초기농도가 증가할수록 감소하지만 pH의 영향은 크게 다른 것으로 나타났다. 아질산성 질소의 농도가 50 mg-N/L에서는 pH가 증가할수록 탈질량이 감소하지만 100 mg-N/L에서는 탈질량이 증가해 pH 7.0에서 아질산성 질소의 초기농도에 따라 가장 많은 탈질량과 가장 적은 탈질량이 모두 관찰되었다.
[Table 2.] Specific denitrification rate under different pH conditions
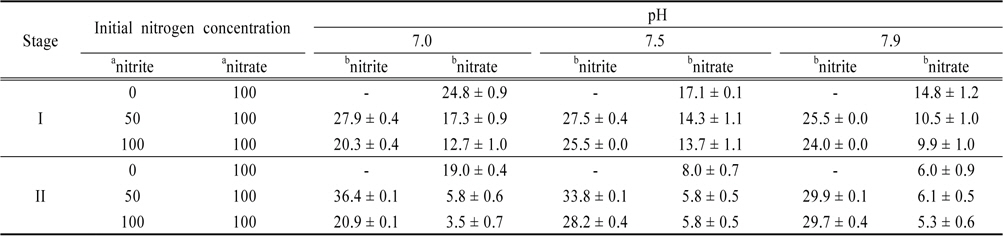
Specific denitrification rate under different pH conditions
아질산염으로 배양한 황탈질균의 경우(stage II)도 질산염으로 배양한 황탈질균의 경우와 유사하게 질산성 질소의 탈질량이 아질산성 질소의 초기농도가 증가할수록 감소하는 것으로 나타났다. 그러나 pH 영향은 달라 아질산성 질소가 존재하지 않을 때에는 pH가 감소할수록 탈질량은 증가하지만 아질산성 질소가 존재할 때에는 감소하는 것으로 나타났다. 한편 아질산성 질소의 탈질량은 질산염을 이용해 배양한 황탈질균의 경우와 동일한 경향이 관찰되었다.
이와 같이 아질산성 질소가 존재하지 않을 때, pH 7.0에서 가장 높은 탈질능이 관찰된 것은 황탈질균을 배양하는 과정에서
한편 황탈질균 배양에 사용된 전자수용체의 종류에 따라 탈질능에도 큰 차이가 관찰되었다. 아질산염으로 배양한 황탈질균의 질산성 질소 탈질능은 질산염으로 배양한 황탈질균보다 낮은 것으로 나타났다. 질산성 질소만 존재할 때, 아질산염으로 배양한 황탈질균의 탈질능은 pH 7.0에서는 23.4%, pH 7.5와 7.9에서는 각각 53.2%와 59.5%나 낮았다. 또한 아질산성 질소가 함께 존재할 때에도 아질산염으로 배양한 황탈질균의 탈질능이 질산염으로 배양한 경우보다 낮았다. 아질산성 질소의 농도가 50과 100 mg-N/L일 때, 아질산염으로 배양한 황탈질균의 질산성 질소 탈질능은 질산성 질소로 배양한 황탈질균과 비교해 pH 7.0에서 각각 66.4%와 72.4%, pH 7.5에서 각각 59.4%와 57.7%, pH 7.9에서 41.9%와 46.5% 낮았다. 그러나 아질산성 질소의 탈질능은 질산성 질소의 경우와 달리 높은 것으로 나타나 아질산성 질소의 탈질능이 pH 7.0에서 각각 30.5%와 3.0%, pH 7.5에서 각각 22.9%와 10.6%, pH 7.9에서 각각 17.3%와 23.8% 높았다.
이와 같이 질산염으로 배양한 황탈질균보다 아질산염으로 배양한 황탈질균에서 질산성 질소의 탈질능은 낮지만 아질산성 질소의 탈질능은 높았는데 질산성 질소의 낮은 탈질능은 황탈질균의 배양 과정에서 Nar (Respiratory nitrate reductase)와 같은 질산염 환원효소의 발현이 억제되었기 때문으로 판단된다(Körner and Zumft, 1989). 또한 아질산성 질소의 높은 탈질능은 세포 성장 및 에너지 생산 능력을 저해하는 FNA에 장기간 노출되면서 살균효과(Biocidal effect)에 일부 적응했기 때문으로 판단된다(Jiang et al., 2011).
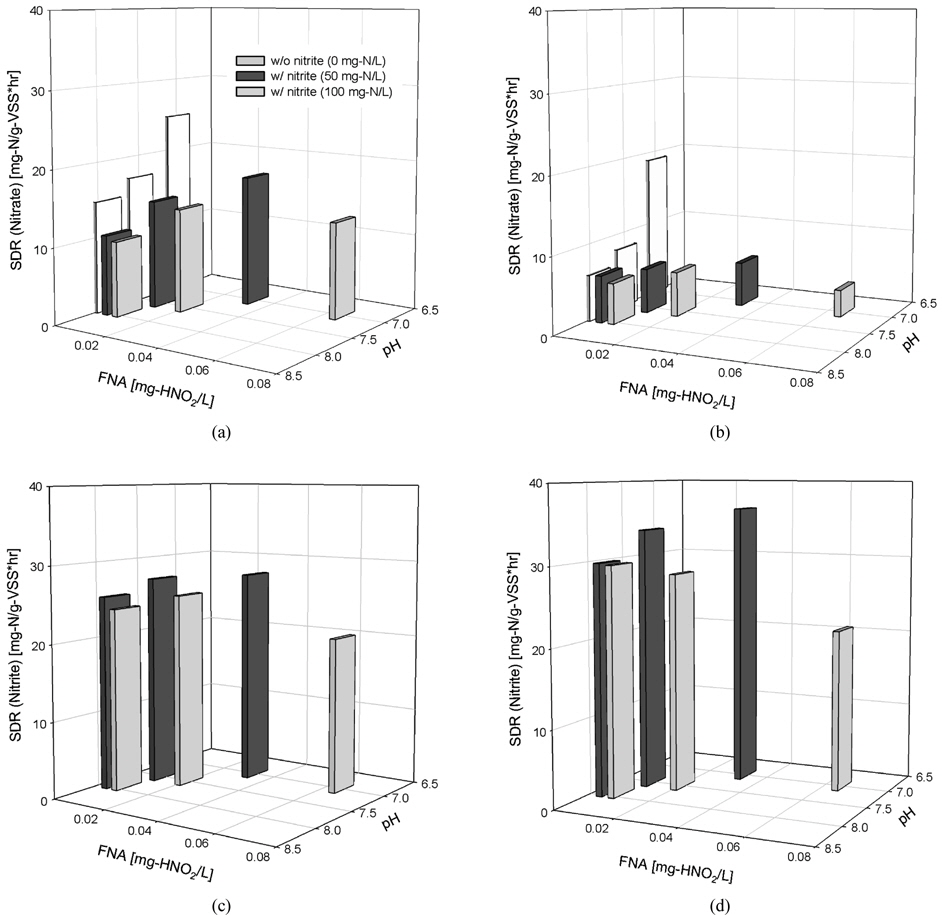
질산성 질소 및 아질산성 질소의 탈질량은 아질산성 질소의 초기농도가 증가할수록 감소하지만 pH 조건에 큰 영향을 받는 것으로 나타났다. 이에 FNA가 황탈질균의 탈질능에 어떻게 영향을 미치는지를 Fig. 2에서 검토하였다. 그 결과, 아질산성 질소의 초기농도가 동일한 조건에서도 pH감소에 의해 FNA 농도가 증가하면 질산성 질소 및 아질산성 질소의 탈질량은 감소하며, 그 감소폭은 FNA 농도가 클수록 증가하는 것으로 나타났다.
질산염으로 배양한 황탈질균의 경우, 아질산성 질소가 존재하지 않을 때와 비교해 아질산성 질소의 초기농도가 증가 할수록 질산성 질소와 아질산성 질소의 탈질량이 감소하였는데 pH 7.0에서 가장 큰 감소폭이 관찰되었다. 한편 아질산염으로 배양한 황탈질균의 경우에서도 질산염으로 배양한 황탈균의 경우와 유사한 결과가 관찰되었다. 이와 같이 아질산성 질소의 초기농도가 증가할수록 그리고 pH 조건이 낮을수록 큰 폭의 탈질능 감소가 관찰된 것은 아질산성 질소 자체의 미생물에 대한 독성과 질산성 질소 및 아질산성 질소의 탈질능에 대한 FNA의 저해가 이를 배가시켰기 때문으로 판단된다. 이와 유사한 결과가 anammox균을 이용한 독립영양탈질(Egli et al., 2001)과 종속영양탈질(Ma et al., 2010)에서도 보고된 바 있는데 질산성 질소의 탈질 저해가 FNA 농도와 깊은 관계를 가지는 것으로 알려져 있다.
또한 황탈질균 배양에 사용한 전자수용체의 종류에 따라 FNA의 영향이 크게 다른 것으로 나타났다. Fig. 3에 나타낸 것과 같이 질산염으로 배양한 경우와 비교해 아질산염으로 배양한 황탈질균의 경우에서 큰 폭의 탈질능 감소가 관찰되었다. 아질산성 질소가 존재하지 않을 때와 비교해 아질산성 질소의 농도가 50과 100 mg-N/L으로 증가할 때, FNA 농도가 가장 높은 pH 7.0에서 질산성 질소의 감소폭이 각각 75.6%와 27.3%나 더 크고, 아질산성 질소의 감소폭은 더욱 커서 105.7%에 이르는 것으로 나타났다. 이와같이 배양에 사용된 전자수용체의 종류에 따라 관찰된 탈질량 감소폭 차이의 원인은 정확히 알 수 없지만 황탈질균 배양에 사용된 전자수용체의 종류에 따라 이들 세균의 생태계 구성의 변화와 이에 따른 탈질능의 차이에서 기인한 것으로 판단된다. 아질산염으로 황탈질균을 배양한 경우, 질산염으로 배양한 경우와 비교해 황탈질균의 생태계 구성이 크게 다른 것으로 알려져 있다(Yoon, 2010).
본 연구는 티오황산염을 이용한 질산성 질소 및 아질산성 질소의 탈질에 있어서 황탈질균의 배양에 사용한 전자 수용체의 종류, pH 및 FNA의 영향을 검토하였으며, 다음과 같은 결론을 도출하였다.
1) 황탈질균의 배양에 사용된 전자수용체의 종류에 따라 탈질능이 다른 것으로 나타났는데 아질산염으로 배양한 경우, 질산염으로 배양한 경우와 비교해 아질산성 질소의 탈질능은 높으나 질산성 질소의 탈질능은 낮았다.2) 질산성 질소 및 아질산성 질소의 황탈질능은 pH 조건에 큰 영향을 받았는데 아질산성 질소가 존재하지 않을 경우에는 pH가 낮을수록 질산성 질소의 탈질량은 크게 증가 하였다.3) 아질산성 질소가 존재할 경우에는 FNA 농도의 영향을 크게 받아 아질산성 질소의 초기농도가 높고 pH가 낮을수록 질산성 질소 및 아질산성 질소의 탈질량 감소폭이 크게 증가하였다.4) 한편, 황탈질균 배양에 사용된 전자수용체의 종류에 따라 FNA 농도 증가에 따른 탈질량의 감소폭도 다른 것으로 나타났는데 아질산염으로 배양한 경우, 질산염으로 배양한 경우와 비교해 질산성 질소와 아질산성 질소의 탈질량 감소폭이 더 컸다.5) 이와 같은 결과는 배양에 사용된 전자수용체의 종류에 따라 황탈질균의 탈질능에 차이가 있고, 이들의 탈질능이 pH 조건과 FNA 농도에 큰 영향을 받기 때문으로 판단된다.