어류에서 분리 된 쿠도아속 점액포자충은 전 세계적으로 수많은 종류가 보고되어 왔으며(Moran et al., 1999; Kent et al., 2001; Yokoyama, 2003; Lom and Dyková, 2006), 대부분의 종이 체근육, 뇌, 심장막, 소화관, 신장, 난소 등의 기관에 육안으로 보이는 시스트를 형성하는 조직 기생성이다(Nakajima and Egusa, 1978; Egusa and Shiomitsu, 1983; Maeno et al., 1993; Blaylock et al., 2004; Burger et al., 2007; Sitjà-Bobadilla, 2009). 일반적으로 쿠도아충에 의한 감염은 숙주인 어류의 생리, 행동, 생존 등에 영향을 미치지 않지만(Moran et al., 1999), 근섬유에 기생하는 Kudoa thyrsites, Kudoa musculoliquefaciens, Kudoa paniformis, Kudoa clupeidae, Kudoa miniauriculata 등은 숙주가 죽은 후에 젤리화’(기생충의 단백질 분해효소에 의한 근육 용해)를 일으킴으로써 상품 가치를 떨어뜨려 경제적으로 피해를 일으키는 것으로 알려져 왔다(Kudo et al., 1987, Moran et al., 1999, Yokoyama et al., 2004). 그러나, 최근Kudoa septempunctata가 한국에서 일본으로 수출 한 넙치의 근육에서 기생하는 것이 최초로 보고 된 이후(Matsukane et al., 2010), K. septempunctata에 의한 식중독 발생 가능성에 대한 실험동물을 사용한 연구(Kawai et al., 2012), 식중독을 나타내는 환자의 분변에서 K. septempunctata 검출에 관한 보고(Harada et al., 2012a) 등의 연구 결과로부터 K. septempunctata은 일본에서 식중독의 새로운 원인 물질로 분류가 되었다. Kawai et al. (2012)에 의한 연구에서 식중독 발생 시 잔품의 조사 결과 대부분이 넙치 1그램 안에 106 이상의 포자가 확인 되어, 일본에서 이 농도를 식중독을 일으키는 양성 기준으로 정하였다. 그러므로, 인체에 병원성을 나타내는 쿠도아충의 보고는 K. septempunctata가 최초의 보고이며, 포자 1개 당 7개(5-7개)의 극낭을 가지며 숙주의 염증 반응을 일으키거나 근육 내 시스트를 형성하지 않아 육안으로 감염이 확인되지 않는 특성을 가진다(Matsukane et al., 2010). 극낭이 7개(5-7개)인 K. septempunctata와 달리 4개의 극낭을 가지는 Kudoa thyrsites, Kudoa lateolabracis 등의 쿠도아 또한 넙치의 근육에 기생하는 것이 보고되어 있으므로(Yokoyama et al., 2004; Grabner et al., 2012), 이러한 다른 종류의 쿠도아와 구분을 위한 정확한 진단이 매우 중요하다. 선행 연구에서 K. septempunctata의 다양한 진단법이 보고되었으며(Grabner et al., 2012; Harada et al., 2012a; Harada et al., 2012b), 최근에는 민감도와 정확도 측면에서 더욱 뛰어난 loop-mediated isothermal amplification (LAMP)법(Jeon et al., 2014)이 보고되기도 하였다.
본 연구팀은 이전 연구에서 우리나라 넙치의 주요 대일 수출지역인 제주의 양식 넙치와 자연산 어류를 대상으로 쿠도아 감염 현황을 조사하여 양식 넙치 육성어 4.9% (143마리 중 7마리)에서 K. septempunctata가 검출되었고 자연산 넙치를 비롯한 타 어종에서는 K. septempunctata가 검출되지 않음을 밝힌바 있다(Song et al., 2013). 본 연구에서는 양식 넙치의 K. septempunctata의 감염이 특정 지역에 국한되어 발생하는지 전국에 만연하여 발생하는지 조사하기 위하여, 양식 넙치 쿠도아 감염 현황을 전국적으로 조사하였다. 양식 넙치 육성어에 대하여 전국의 5개 지역, 양식 넙치 종묘에 대하여 전국의 7개 지역을 대상으로 쿠도아 감염 현황을 조사하였다.
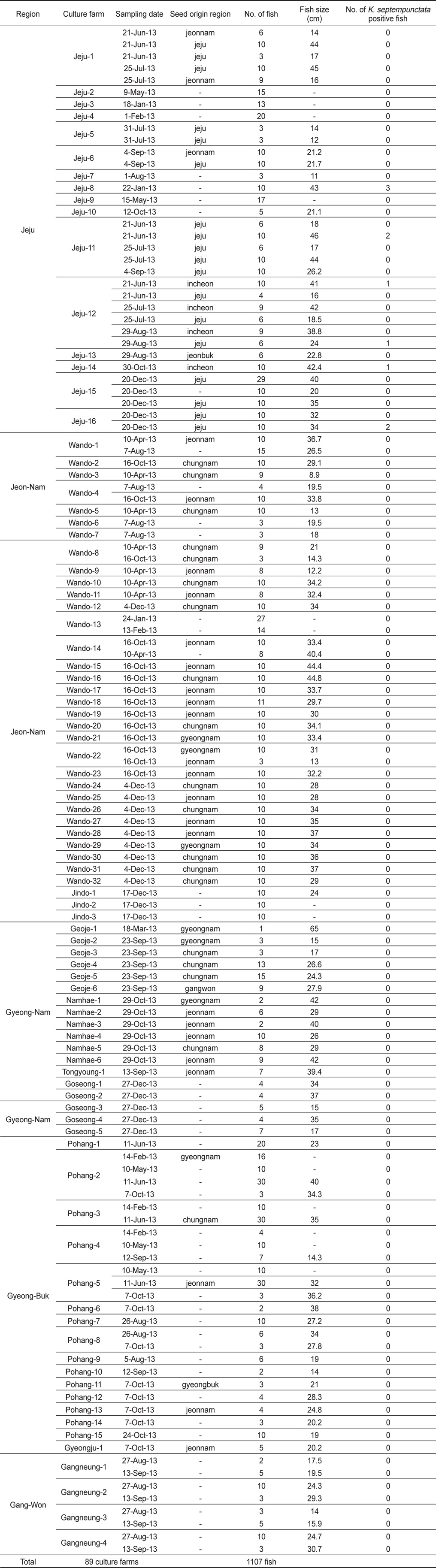
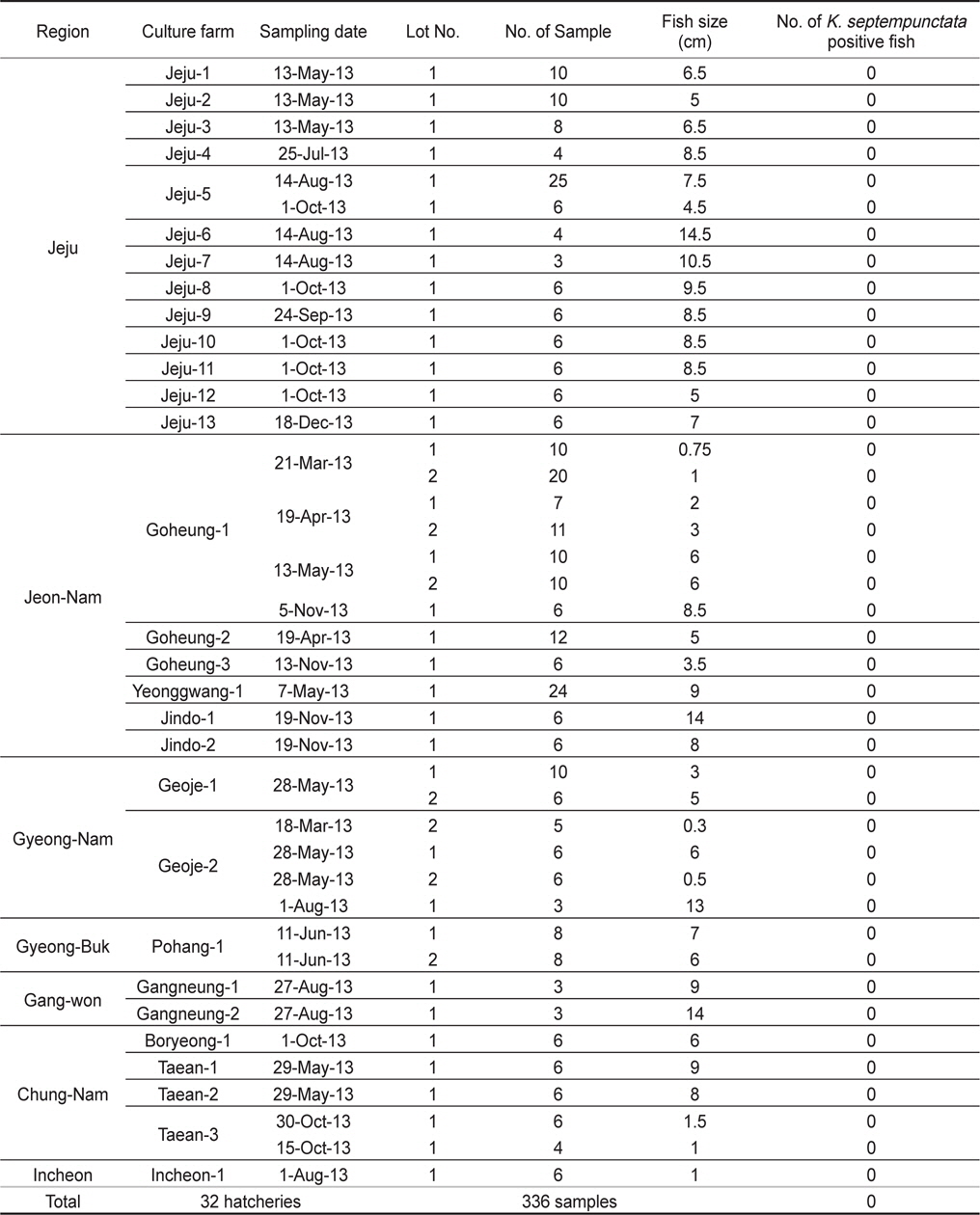
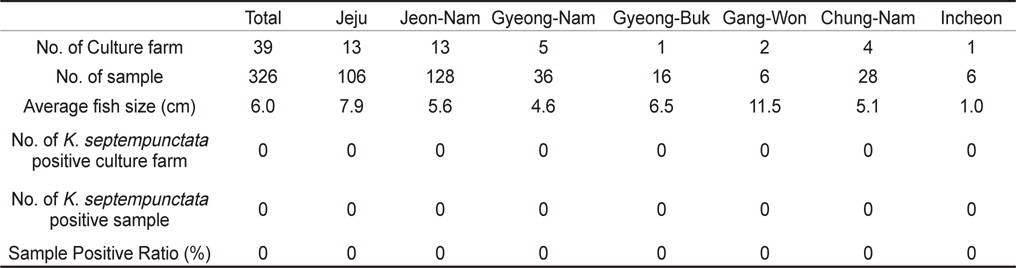
2013년 1월부터 12월까지 전국을 5개 지역으로 구분하여 제주, 전남, 경남, 경북, 강원 지역으로부터 양식 넙치 육성어(육성장 입식 이후)에 대하여 쿠도아 감염 현황을 조사하였다(Table 1, Table 3). 샘플 채취는 직접 양식장을 방문하여 냉장 상태에서 실험실로 이송하거나, 수산질병관리원 또는 관련 기관의 도움을 받아 넙치를 냉동 후 아이스박스에 넣어 우편으로 실험실로 이송하였다. 샘플 분석을 위하여 각 양식장으로부터 평균 12마리(2-30마리)의 어류를 샘플링 하였다. 넙치 종묘(육성장 입식 이전)의 쿠도아 감염 현황을 조사하기 위하여, 전국에서 넙치 종묘를 생산하는 지역 중7개 지역을 선정하여 제주, 전남, 경남, 경북, 강원, 충남, 인천을 대상으로 넙치 종묘를 샘플링하였다(Table 2, Table 4).
실험 방법은 일본 후생노동성(MHLW, 2011), 일본수산청(MAFF, 2012), Grabner et al. (2012) 및 Song et al. (2013)에 의한 방법에 기초를 두었으며, 육성어와 종묘 샘플의 쿠도아 감염 조사를 위해 real-time PCR법으로 스크리닝 후 PCR과 현미경 검사를 통해 감염 유무를 판정을 하였다.
육성어로부터 쿠도아 감염 조사를 위해 Song et al. (2013)에 의한 방법에 의해 등근육 전체 부위로부터 근육 샘플(1-5 g)을 채취하여 분석에 사용하였다. 종묘의 경우, 1 cm 미만의 작은 사이즈의 넙치는 어체 전체를 실험에 사용하였으며(Fig. 1a), 1cm 이상의 사이즈는 두부와 내장 부위를 실험용 가위로 절단하고 뒷부분을 모두 사용하거나(Fig. 1b) 근육부분만 채취가 가능한 크기의 경우에는 근육부분만을 샘플링한 후, 5-10마리 pool하여 분석하였다.
쿠도아의 유전자 분석(real-time PCR, conventional PCR)을 위하여 채취한 근육으로부터 DNA를 추출하였다. 근육 샘플 200 mg을 2 mm ziruconia와 5 mm stainless beads가 들어있는 튜브(WATSON, Japan)에 넣은 후 Nuclease free water(Qiagen, Japan)에 5배 희석하여 FastPrep®-24 (MP, USA)에서 20초간 근육 조직을 완전히 마쇄하였다. 피펫으로 마쇄액 100μL (근육조직 20 mg에 해당)를 덜어 DNA 추출에 사용하였다. DNA는 시판되는 QIAamp DNA mini kit (Qiagen, Japan)를 사용하여 매뉴얼에 따라 추출하였으며, 최종적으로 200 μL의 volume으로 elusion하였다. 추출한 DNA는 real-time PCR과conventional PCR (이하 PCR로 표기)에 사용하기 위하여 -20℃에 보존하였다.
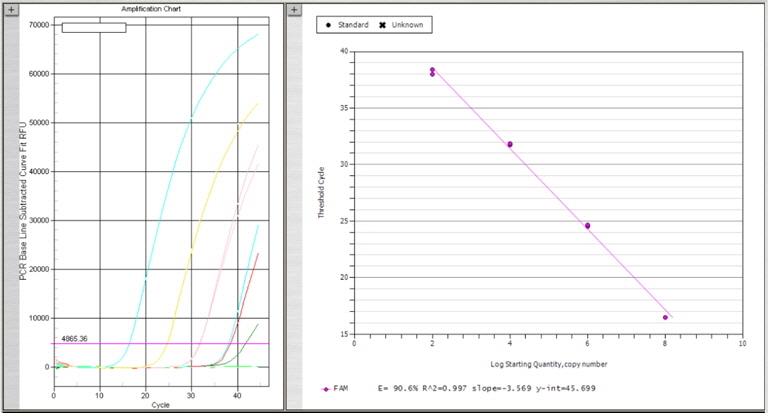
넙치 육성어 1,107개 및 종묘 326개의 DNA sample로부터 1차 스크리닝을 위하여 K. septempunctata의 18S rDNA (AB553293)를 검출하는 real-time PCR을 수행하였다. Primers와 Probe는 일본 후생노동성 방법에 따라 Kudoa-F (5’-CATGGGATTAGCCCGGTTTA-3’), Kudoa-R (5’-ACTCTCCCCAAAGCCGAAA-3’), Kudoa-P (5’-FAM-TCCAGGTTGGGCCCTCAGTGAAAA-TAMRA-3’)를 사용하였다. PCR 반응액 제조는 넙치 근육 샘플로부터 채취한 DNA 4 μL 또는 plasmid positive control 4 μL, Taqman 2x Universal master mix (AB, USA) 10 μL, forward와 reverse primer 각 0.4 μM, probe 0.25 M을 넣어 최종 20 μL의 volume이 되도록 제조하였다. PCR 반응은 95℃ 10분 1 cycle, 95℃ 15초와 60℃ 60초에서 45 cycles 반응하였으며 모든 샘플은 duplicate로 반응을 수행하였다. Plasmid positive control의 제작을 위하여 K. septempunctata 의 18S rDNA (AB553293) 중 real-time PCR target gene이 포함되도록 primer를 제작하였다. 제작한 forward primer (Kudoa-plasmid-F: 5’-taaactatgccaacatggga-3’)와 reverse primer (Kudoa-plamid-R: 5’-cgttaccggaataaacctga-3’), 넙치로부터 추출한 K. septempunctata positive DNA를 AccuPower® PCR premix 와 혼합하여 95℃ 30초, 58℃ 30초, 72℃ 30초에서 40 cycles PCR 반응을 수행하여 1.5 % agarose gel에 전기영동하여 293 bp의 target size band를 확인하였다. Agarose gel에서 DNA를 정제하기 위하여 x-tracta™ Gel extractor (Promega, USA)를 사용하여 target band를 잘라낸 후, DNA gel extraction kit (Millipore, USA)를 사용하여 DNA를 정제한 후 일부를 사용하여 agarose gel에서 정제를 확인하였다. 정제된 DNA는 T-blunt PCR cloning kit (Solgent, Korea)를 사용하여 ligation 하고 Cempetent cell DH5α (Biofact, Korea) 에 transformation 후 plasmid mini extraction kit (Bioneer, Korea)를 사용하여 plamid를 분리하여, K. septempunctata positive plamid를 제작하였다. Plasmid positive control은 Nanodrop ND-1000 spectrophotometer에서 DNA를 정량하여 plasmid copy수를 계산하였으며, 2.5×107 (최종 108농도), 2.5×105 (최종 106농도), 2.5×103 (최종 104농도), 2.5×101 (최종 102농도)copies/의 농도로 plasmid를 단계 희석한 후 각 4 μL씩 사용하여plasmid positive control 검량선을 작성(Fig. 2)하여 positive control로서의 사용가능성을 확인한 후, 모든 real-time PCR 반응에 plasmid positive control를 함께 반응하였다.
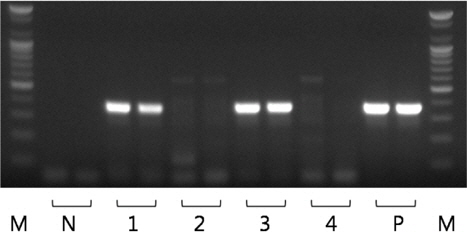
모든 샘플의real-time PCR 실험을 수행한 결과, Ct 값 35 이하의 샘플을 스크리닝한 후, PCR로 유전자의 증폭 유무를 확인하였다. PCR에 사용한 primer는 K. septempunctata 의 28S rDNA를 검출하는 primer set (forward: 5’-gtgtgtgatcagacttgatatg-3’, reverse: 5’-aagccaaaactgctggccattt-3’)를 사용하였다 (MAFF, 2012). 추출한4 μL template와 위의 primer를 AccuPower® PCR premix (Bioneer, Korea)와 혼합하여 20 μL의 반응액에서 PCR을 수행하였다. PCR 산물은 ethidium bromide가 첨가 된 1.5% agarose gel에 전기영동 한 후 MultiImage®Ⅱ (Alphainnotech, USA)로 PCR 산물의 증폭(target size 356 bp, Fig. 3)을 확인하였다.
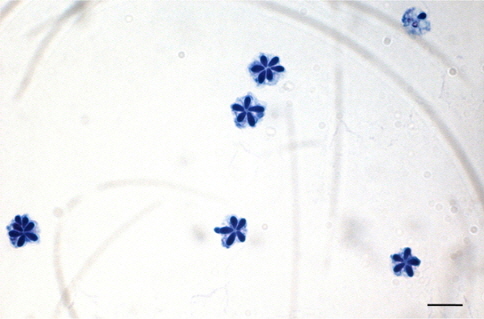
Real-time PCR 실험을 통해 스크리닝한 샘플 중 PCR 양성으로 확인 된 개체에 대하여 현미경을 통해 포자를 확인하였다. 채취한 근육 샘플을 TE buffer (Promega, USA)에 5배 희석 후 완전히 마쇄하여 10 μL를 슬라이드글라스 위에 떨어뜨린 후 건조하였다. 건조 후, 99.5 % 에탄올(Merck, Germany)을 슬라이드글라스에 1 mL정도 가하여 1분간 고정하였다. 에탄올을 제거하고 슬라이드 글라스 위에 남은 에탄올이 건조된 후, Loffler’s methylene blue solution (Merck, Germany)을 1 mL 가하여 1분간 염색한 후, 증류수를 이용하여 세척하였다. 광학현미경 하에서 200-1,000배 배율로 관찰하여 5-7개의 극낭(Fig. 4)을 가지는 쿠도아 포자를 확인하였다. 포자가 확인 된 샘플은 Loffler’s methylene blue solution과 1:1로 혼합하여 cell-counting chamber에서 포자를 계수하였으며, 한 면에 포자의 수가 n<5일 경우, 계수한계이하로 정하고 n≥5 경우에는 근육 1 g당 포자수로 환산하였다.
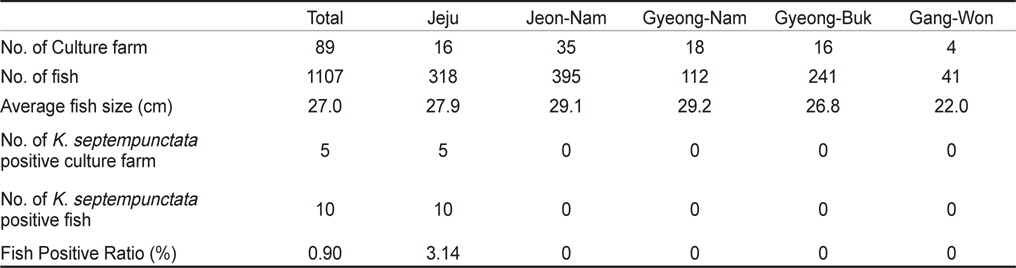
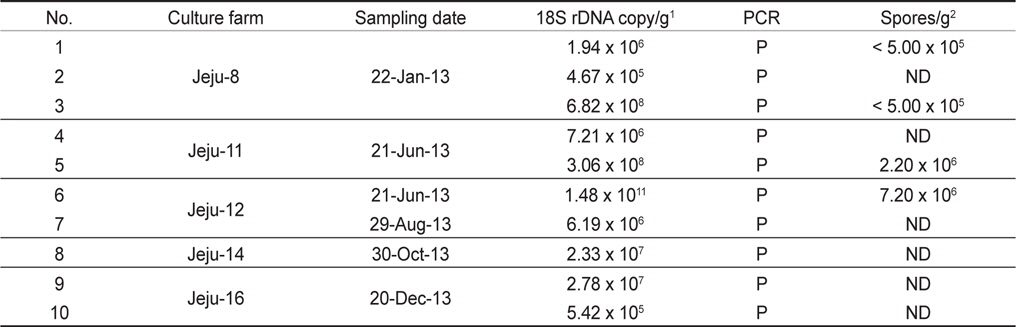
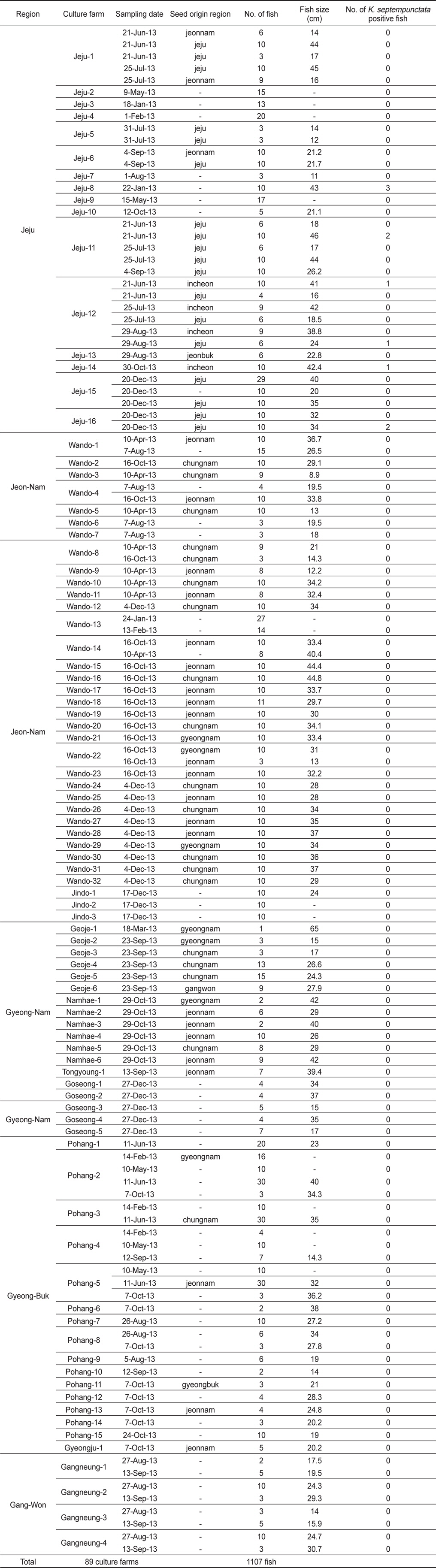
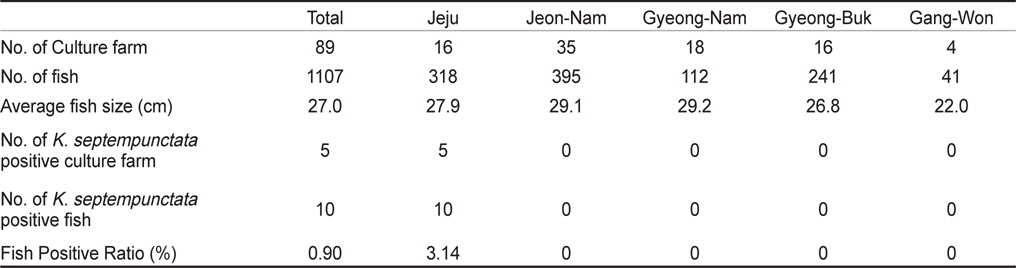
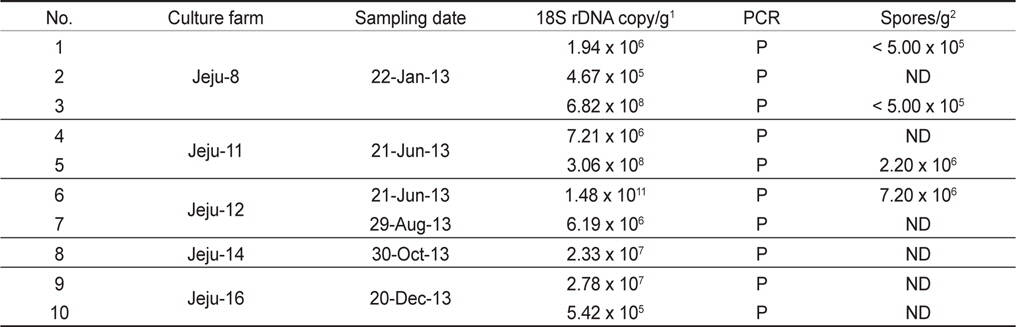
우리나라의 주요 넙치 양식 지역인 제주, 전남, 경남, 경북, 강원의 5개 지역 총 89개 양식장으로부터 양식 넙치 육성어 1,107마리에 대하여 쿠도아 감염 현황을 조사하였다(Table 1 and 3). 모든 샘플은 real-time PCR로 screening후 ct값 35이하의 샘플에 대하여 PCR을 수행하여 쿠도아 감염에 대한 최종 판정을 하였고, 현미경 검사를 통하여 포자의 관찰 유무와 포자 수를 계수하였다. 6개 지역의 넙치 육성어 조사 결과 제주지역 양식장 16개소 중 5개소의 10마리(3.14 %) 넙치에서 PCR 양성 반응으로 쿠도아 감염 양성 결과가 나타났다. 쿠도아가 검출 된 10마리의 real-time PCR 결과 4.67×105 rDNA copy/g부터 1.48×1011 rDNA copy/g까지 다양하게 검출되었다(Table 5). PCR 결과에 의해 최종판정을 하였으므로 PCR은 모든 샘플이 양성이며, 10마리 중 4마리에서 쿠도아 포자가 < 5×105 spore/g ~ 7.2×106 spore/g검출되었다(Table 5 and Fig. 4). 나머지 4개 지역으로부터 조사한 넙치 육성어에서는 쿠도아가 검출되지 않았다.
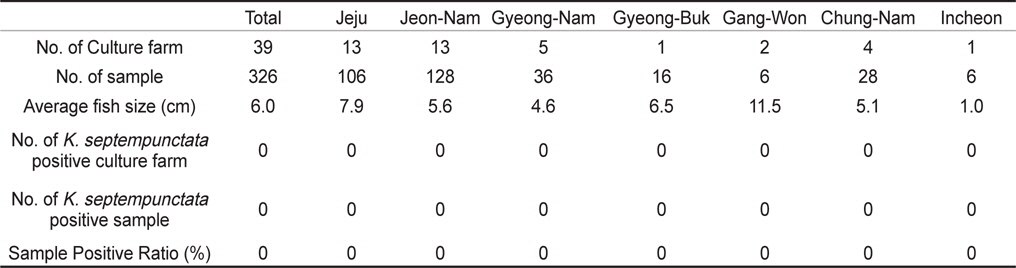
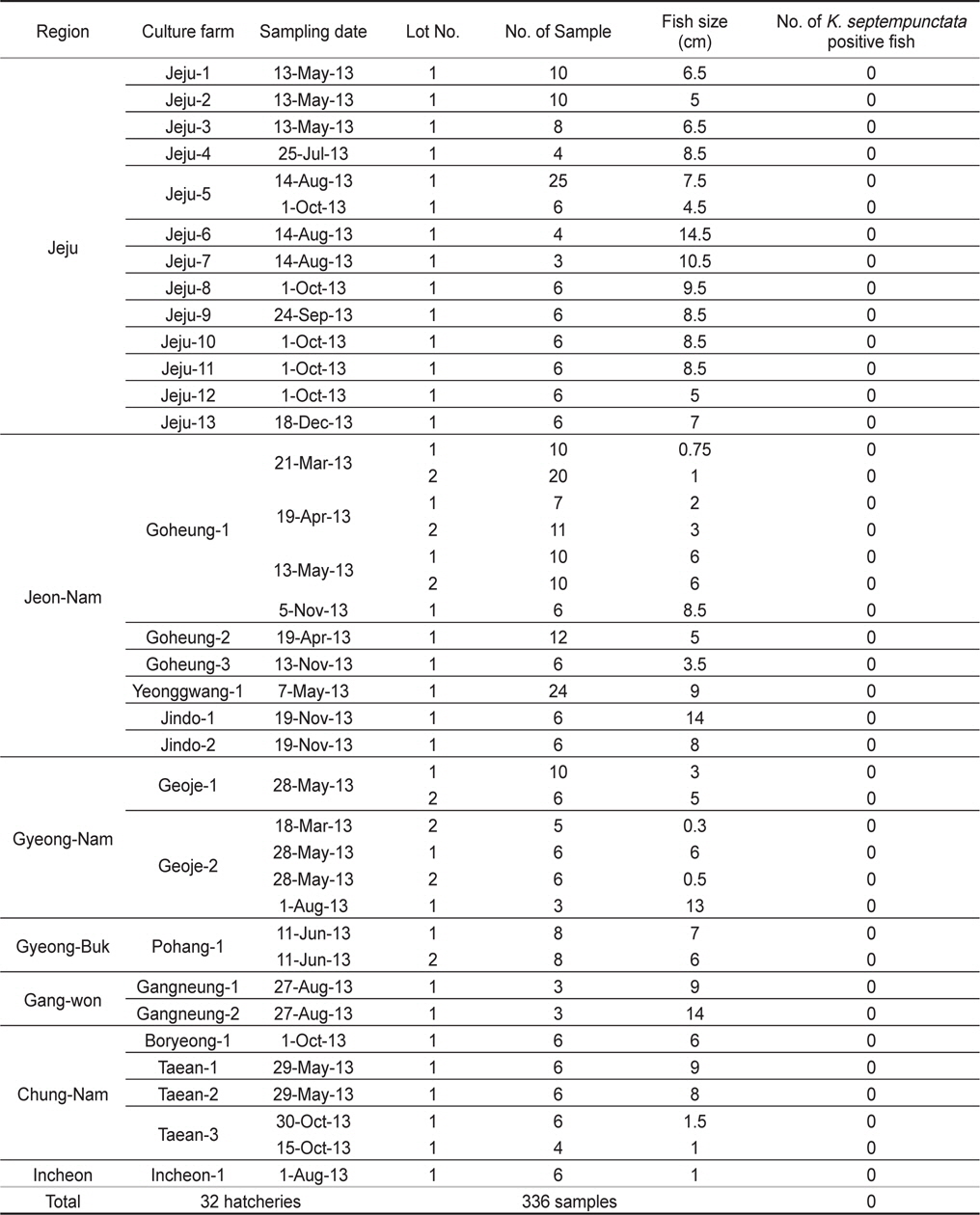
제주, 전남, 경남, 경북, 강원, 충남, 인천의 넙치 종묘생산장 39개소로부터 쿠도아 감염 현황을 조사하였다. 종묘의 경우 5-10마리를 pool하여 하나의 샘플로 분석하여 7개 지역으로부터 총 326샘플을 PCR 방법에 의해 분석하였다. 그 결과 조사 한 모든 샘플에서 쿠도아 감염 양성어가 검출되지 않았다(Table 2 and Table 4).
본 연구에서는, 2013년 1월부터 12월까지 제주를 비롯한 전국의 넙치 양식장을 대상으로 넙치 육성어와 넙치 종묘의 K. septempunctata의 감염 현황을 조사하였다. 제주, 전남, 경남, 경북, 강원 지역의 넙치 양식장 89개소로부터 1,107마리의 넙치 육성어의 K. septempunctata 감염 현황을 조사 한 결과, 제주지역의 넙치 3.14% (제주 지역 넙치 318마리 중 10마리)에서 K. septempunctata 감염 양성임을 확인하였다. K. septempunctata양성 넙치는 1월부터 12월 사이 특정 시기가 아닌 연중 검출되었으며, 10마리 양성개체 중4마리에서 포자가 검출되었고 이 중 2마리는 일본 후생노동성의 식중독 발생 양성 기준치(106 spores/g이상)를 초과한 포자가 검출되었다. 반면, 제주 이외의 다른 4개 지역에서 채취한 넙치 육성어 789마리에서는 K. septempunctata가 검출되지 않아 지역에 따른 차이가 나타남을 확인하였다. 본 연구의 결과 제주 지역에서만 K. septempunctata가 검출되는 이유는 밝혀지지 않았지만, 검출 된 양성장에서 사용 한 종묘가 쿠도아에 감염 된 종묘일 가능성과, 제주 지역의 해양환경 특성이 관계가 있는 것을 생각할 수 있다. 첫 번째, 종묘의 감염 가능성은 본 연구의 조사 결과 모든 지역의 종묘에서 쿠도아가 검출되지 않았다는 점에서 연관성을 찾을 수 없었다. 또한, 제주 지역의 경우 제주, 전남, 전북, 인천 등에서 넙치 종묘를 도입하여 사육하고 있었으며, 본 연구에서 조사한 양식장의 경우 쿠도아 감염 양성어는 제주 또는 인천유래의 종묘를 사용하였다(Table 1). 하지만, 본 연구 외의 우리 연구팀에 의한 제주지역의 다른 조사의 결과 쿠도아 감염 양성어의 종묘 유래 지역이 제주, 충남, 경남, 전남 등 전국적으로 다양하게 나타나(data not shown), 특정 지역의 종묘에 의한 쿠도아 감염 가능성은 낮은 것으로 생각되었다. 두 번째, 해양환경 특성 인자는 여러 가지가 있으나 그 중 해수의 온도 관점에서 볼 때, 제주 서부 앞바다 연평균 수온이 2013년에 18.2℃이지만, 전남 서부 앞바다의 경우 12.7℃, 경남 서부 앞바다의 경우 15.6℃, 경북 남부앞바다의 경우 15.1℃, 강원 남부 앞바다의 경우 15.1℃로 기록되어 제주에 비하여 타 지역의 연평균 수온이 약 2.6℃ - 5.5℃ 낮은 사실로부터(국립수산과학원 종합상황정보, NFRDI), K. septempunctata의 발생이나, 생활사에 관여하는 중간 숙주의 분포가 수온과 관련되어 있을 것으로 사료된다. Yanagida et al. (2006)의 연구에 따르면, tiger puffer Takifugu rubripes에 미포자충인 Enteromyxum fugu와 Enteromyxum leei를 경구감염 시킨 후 온도에 따른(10-25℃) 발병률을 조사한 결과, E. fugu의 경우 온도와 상관없이 발병은 하였으나 10℃와 15℃에서 포자 형성이 저해되었으며, E. leei의 경우 15℃ 미만에서 기생충의 발생과 발병률이 저하되어 낮은 온도에 의해 기생충의 발생을 저해하여 발병률을 낮추는 것을 입증하였다. 반면, 2012년 3월부터 12월 사이 quantitative PCR법에 의해 해수 중의 Kudoa yasunagai 분포 조사에서, 수온이 가장 높은 8월과 9월에는 DNA가 전혀 검출되지 않은 반면, 수온이 낮은 12월에 가장 높은 검출률을 나타내었다(Ishimaru et al., 2014). 그러므로, 쿠도아충을 포함한 점액포자충의 생활사 발달은 온도와 깊은 관계가 있으며, 종에 따라 최적 온도의 범위가 다른 것으로 생각된다.
양식 넙치에 K. septempunctata의 감염 경로나 감염 시기는 현재까지 밝혀져 있지 않다. 본 연구에서는, 넙치의 종묘 생산단계에서 이미 K. septempunctata의 감염이 시작되는 것인지 확인하기 위하여 전국의 7개 지역의 넙치 종묘장 39개소로부터 326 샘플의 K. septempunctata 감염 현황을 조사하였다. 난으로부터 부화 후 착저 이전 단계의 넙치 치어 사이즈부터 육성장으로 도입되기 이전의 종묘 사이즈까지 다양한 샘플을 조사하였으나, 모든 샘플에서 쿠도아가 검출되지 않아 종묘단계에서의 쿠도아 감염을 확인할 수 없었다. 일본의 후생노동성으로부터 넙치 종묘의 검사는 PCR법에 의한 판정을 추천하고 있으나, 본 연구에서는 real-time PCR에 의해 1차적으로 screening 후 PCR법에 의해 최종판정을 하였다. Real-time PCR 결과 105-107 rDNA copies/g 의 정량값을 나타내는 샘플의 경우에도(data not shown), PCR 수행 결과 음성으로 나타나 최종적으로 음성 판정을 하였다. 육성어 감염 양성 샘플의 경우 K. septempunctata가 존재할 경우, 105 rDNA copies/g의 양에서도 PCR 양성이 나타났으므로(Table 5), 종묘 샘플의 real-time PCR에서 검출이 되는 샘플은 비특이적 반응으로 생각되지만 K. septempunctata의 DNA가 실제 미량으로 존재할 가능성도 있으므로, 감염 초기의 종묘 샘플에 대해서는 보다 고감도의 정밀한 방법의 적용이 필요한 것으로 생각된다.
K. septempunctata의 감염이 문제가 되는 것은 넙치를 회로 섭취하였을 경우 K. septempunctata의 포자에 의한 식중독의 발생 가능성이 있기 때문이므로(Kawai et al., 2012; Ohnish et al., 2013), 넙치 육성어에서의 쿠도아 검사는 현미경 검사법만으로도 충분히 검출이 가능하다. 그러나, K. septempunctata의 감염 예방 연구나 감염 경로의 연구를 위해서는 K. septempunctata가 미량 감염되어 있는 감염 초기 단계에서도 정확한 검출이 가능하여야 한다. 현재 개발되어 있는 real-time PCR법을 본 연구에 적용한 결과 비특이적 반응이 다수 관찰되어 정확한 진단을 위해서 PCR이나 현미경 등 추가적인 실험을 통하여 진단을 하였다. 그러므로 보다 고감도이며 특이성이 높은 real-time PCR법의 개발에 대한 연구가 더욱 필요하며, 이러한 방법을 적용하여 넙치 양식 산업에 심각한 문제를 일으키는 K. septempunctata의 감염 경로 연구, 생활사 연구가 필요하다.