서양민들레는 국화과 식물로서 한국 전역에서 자생하고 있다. 최근에는 서양민들레의 효능으로 인해 최근 약용식물로 재배되고 있다. 그러나 서양민들레는 골프장 잔디밭이나 과수원에서는 잡초로 고려되고 있다. 본 실험은 다른 농도의 식물생장조절물질[gibberellins (GA3); kinetin; salicylic acid (SA); ethephon)] 처리가 서양민들레 종자발아율에 미치는 영향을 조사하기 위해 수행하였다. 실험결과, GA3 및 kinetin 처리 모든 농도에서 무처리에 비하여 종자발아율이 약 24.2~41.9% 높았다. Ethephon 0.5 mM의 처리에서는 무처리에 비해 종자발아율이 7.5% 높았으나, 1.0 및 1.5 mM 처리에서는 약 11~22% 가량 낮은 경향이었다. 반면에 SA와 GA3의 혼합처리 경우에는 했을 때 종자발아율은 SA 단독처리보다 더욱 낮았다.
Dandelion (
서양민들레(
일반적인 식물 종자는 배와 배유로 구성되며, 종자의 발아는 종자가 수분을 흡수하여 배에서 유근이 발생되는 현상을 의미한다(Bewley, 1997). 이러한 종자의 발아에는 다양한 생리적, 환경적 요인이 관여를 하는 것으로 알려져 있다. 대표적인 생리적 요인으로는 식물호르몬을 들 수 있으며, 환경적 요인으로는 온도, 광, 수분을 들 수 있다. 종자발아를 촉진하는 것으로 알려진 대표적인 식물호르몬 지베렐린(gibberellin, GA)은 diterpenoid 화합물의 형태로 색소체(proplastid)에서 geranylgeranyl diphosphate (GGDP)를 전구체로하여 소포체막(endoplasmic reticulum membrane)과 세포질(cytoplasm)에서 다양한 효소의 작용을 통해 생합성된다(Olszewski et al., 2002). 2013년 현재 GA1에서 GA136까지 136종이 있는 것으로 밝혀져 있으며(Kim et al., 2010; Sohn et al., 2010), 136종의 GA중 GA1, GA4, GA3를 제외한 대부분의 GA류는 GA를 생합성 하는 중간 대사 산물로 알려져 있다(MacMillan, 2002). Kinetin은 Cytokinin의 한 종류로 고압 멸균한 청어 정자 DNA로부터 분리되었으며, 식물의 세포분열을 촉진, 곁눈의 활성화와 같은 생리적 현상과 아울러 종자의 발아에도 영향을 미치는 것으로 알려져 있다(Miller, 1956; Wittwer and Dedolph, 1963). 식물생장조절물질 salicylic acid(SA)는 페놀성 화합물로 다양한 식물반응(개화, 종자발아, 기공개폐 등)에 영향을 미치는 것으로 알려져 있다. 특히 SA는 식물체가 병원균에 의한 침입이 발생하게 되면 상처 주변에서 전신획득저항성(systemic acquired resistance, SAR)을 유도하는 신호물질로 작용하는 것으로 알려져 있다(Klessig and Malamy, 1994; Ribnicky et al., 1998). 또 다른 식물생장조절물질인 ethephon은 흔히 에틸렌 발생제로 알려져 있으며, ‘에스렐’이라는 상품으로 시중에 판매되고 있는 액체 에틸렌이다. 에틸렌은 주로 과실의 성숙, 낙엽, 낙과, 신장성장의 억제와 촉진, 통기조직의 형성 및 뿌리 발달과 같은 다양한 식물의 생리현상에 영향을 미치는 것으로 알려져 있다(Abeles, 1986; Lelièvre et al., 2006).
위에서 언급하였듯이 서양민들레는 자원식물과 잡초로서의 기능을 동시에 지니고 있는 식물이고, 식물생장조절물질은 다양한 식물의 생리적 작용을 조절하는 것으로 알려져 있으므로 본 연구에서는 서양민들레의 효과적인 이용 및 방제를 위해 식물생장조절물질처리가 서양민들레 종자발아에 미치는 영향에 대해서 연구를 수행하였다.
실험에 사용된 서양민들레(
>
식물생장조절물질 GA3와 SA 혼합처리 및 ethanol 처리
종자발아 실험결과 GA3처리에서 서양민들레의 종자발아율이 증가되었고, 반면 SA 처리구에서는 종자발아율이 감소되어 GA3와 SA 혼합처리가 서양민들레 종자발아율에 미치는 영향(negative, positive)을 확인하기 위해 2 mL의 GA3 0.5, 1.0, 1.5 mM과 2 mL의 SA 0.5, 1.0, 1.5 mM을 혼합하여 동일한 생장상 조건에서 실험을 진행하였다. 식물생장조절물질 SA는 물에 녹지 않는 성질을 지니고 있어 실험에서 SA처리를 위해서는 소량의 ethanol에 SA를 녹인 후 이차증류수에 희석하여 실험에 이용하였으므로 ethanol처리가 서양민들레 종자발아율에 미치는 영향을 확인하기 위해 ethanol을 1, 10, 100, 1,000 ppm 농도로 희석하여 동일한 생장상 조건에서 실험중인 서양민들레 종자에 처리하였다.
모든 실험은 5회 반복 실시하였고, 그 결과를 SAS(SAS Institute, 2000, USA)를 활용하여 분석하였으며, 처리간 차이는 던컨의 다중검정(Duncan’s Multiple Range Test, DART)을 통해 비교하였다.
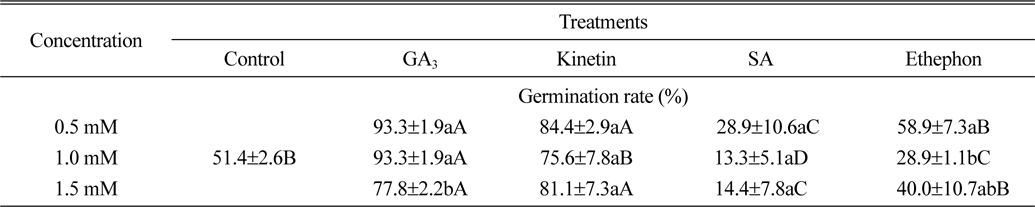
식물생장조절물질처리에 따른 서양 민들레의 최종 발아율(처리 10일 후)은 Table 1과 같다. 먼저 GA3 처리에 따른 서양민들레의 발아율은 0.5 mM, 1.0 mM 처리에서 모두 93.3%, 1.5 mM 처리에서는 77.8%로 무처리구에 비해 26.4%~41.9% 정도 높았다. Kinetin 처리에 따른 서양민들레의 발아율은 0.5 mM 처리에서 84.4%, 1.0 mM 처리에서 75.6%, 1.5 mM 처리에서는 81.1%로 무처리구에 비해 24.2%~33.0% 정도 높은 결과를 확인할 수 있었다. 반면 ethephon 처리에서는 0.5 mM 처리에서 58.9%의 발아율을 나타내어 무처리구에 비해 7.5% 정도 높았으나, 1.0 mM과 1.5 mM 처리에서는 각각 28.9%와 40.0%의 발아율을 나타내어 무처리구에 비해 11.4%~22.5% 정도 낮은 결과를 확인할 수 있었다. 식물생장조절물질 SA 처리에서도 0.5 mM 처리에서 28.9%, 1.0 mM 처리에서 13.3%, 1.5 mM처리에서 14.4%의 발아율을 나타내어 무처리구에 비해 22.5%~37.0% 정도 낮은 것을 확인할 수 있었다(Table 1).
[Table 1.] Effect of plant growth regulators on seed germination rate of dandelion.
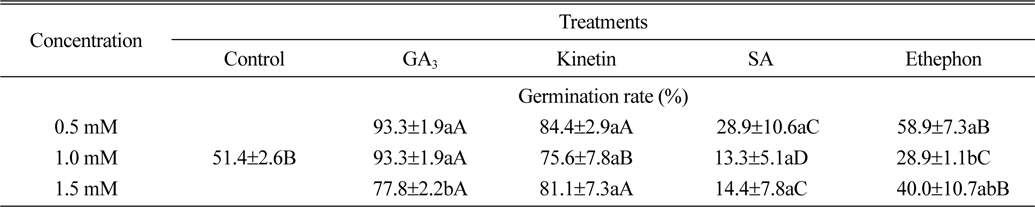
Effect of plant growth regulators on seed germination rate of dandelion.
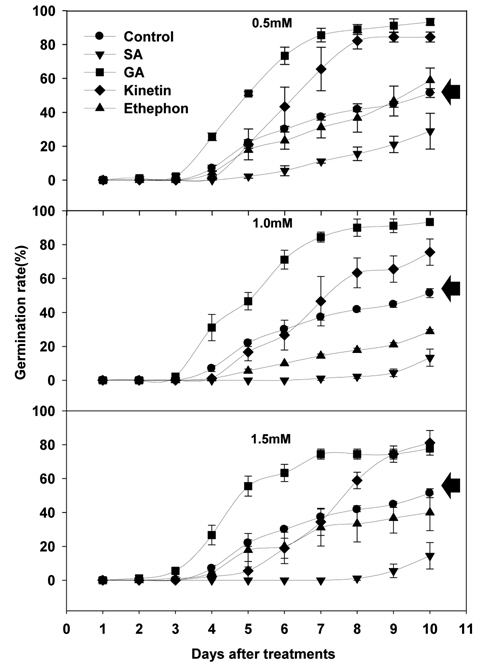
식물생장조절물질 처리에 따른 서양민들레의 발아는 SA처리를 제외한 모든 처리구에서 처리 후 3~4일 사이에 시작되는 것으로 조사되었다. 서양민들레의 발아율은 GA3 및 Kinetin 처리시 모든 처리농도에서 무처리구에 비해 높은 것으로 조사되었다. Ethephon 처리에서는 낮은 농도(0.5 mM)수준에서는 무처리구보다 종자발아율이 높았지만, 농도가 증가됨에 따라 무처리구보다 낮은 것으로 조사되었다. SA 처리에 따른 서양민들레의 종자발아율은 모든 처리농도에서 무처리구에 비해 크게 낮아지는 결과를 얻을 수 있었으며, 처리농도가 높아질수록 낮아짐을 확인 할 수 있었다(Fig. 1).
식물생장조절물질은 아주 소량 10-6 M 이하의 농도에서도 식물에 작용하여 다양한 생리적 반응을 유도하는 것으로 알려져 있다(Bewley, 1997). 식물생장조절물질 GA는 식물에서 다양한 생리적 작용을 유도하는 것으로 알려져있는데, 가장 대표적인 작용은 바로 식물의 신장 성장(세포신장의 촉진, 세포분열의 촉진)의 촉진이며, 이외에도 휴면타파, 발아촉진, 꽃눈형성, 개화촉진, 가수분해효소의 활성화가 있다(Blázquez et al., 1998; Groot and Karssen, 1987; Gubler et al., 1995; Pharis and King, 1985; Wilson, et al., 1992). 식물에서 자발 휴면은 대부분 종자에서 일어나는 생리적 현상으로 수분, 온도, 광 등의 환경조건이 발아를 유도하기에 적당한 조건임에도 불구하고 발아가 되지 않는 상태를 말하며, 이러한 생리적 현상은 abscisic acid (ABA)와 같은 종자발아를 억제하고 휴면을 유도하는 물질에 의해서 대부분 유도되며, 식물생장조절물질 GA는 이러한 휴면현상을 타파하는 신호전달물질로 작용하는 것으로 알려져 있다(Kim et al., 2009). 또한 GA는 화본과 작물(벼, 보리 등)에서 발아촉진을 유도하는 것으로 알려져 있는데, 이러한 현상은 배에서 생합성 된 GA가 종자 호분층 세포에 작용을 하여 α-amylase 분비를 촉진시켜 유도하는 것으로 알려져 있으며, 분비가 활성화 된 α-amylase는 배유에 함유되어 있는 전분이나, 단백질을 분해하여 배 발달을 촉진시키고 이는 곳 종자발아촉진으로 유도되는 것으로 알려져 있다(Abeles, 1986; Kim et al., 2009). 최근에 발표된 논문에 의하면 보리에서 GA 처리에 의한 종자발아의 촉진은 GA가 보리종자 호분층 내 존재하는
식물생장조절물질 kinetin은 cytokinin류의 일종으로 주로 식물의 세포분열에 영향을 미치는 것으로 알려져 있으나, 이 외에도 조직배양에서 지상부 형성, 식물노화억제 및 종자의 발아에도 영향을 미치는 것으로 보고되었다(Miller, 1956; Wittwer and Dedolph, 1963). 특히 kinetin처리가 종자의 발아에도 영향을 미치는 것으로 보고되고 있는데(Miller, 1956; Olszewski et al., 2002), 본 실험 결과에서도 서양민들레 종자에 kinetin처리는 종자의 발아율을 상승시킨 것으로 조사되었는데, 이는 아마도 서양민들레종자발아 과정 중 핵 분열 과정에서 kinetin이 작용을 하여 유도된 결과로 판단된다.
Ethephon은 ethylene으로 변환되어 생장조절 효과를 나타내는 생장조절물질로 알려져 있다. ethylene은 탄소원자가 수소원자와 이중 결합한 비교적 단순한 구조를 가지고 있으면서 식물의 다양한 생리적 반응(과실의 성숙, 낙엽, 낙과, 화아형성, 종자휴면 유도 및 타파 등)을 유도하는 것으로 알려져 있다. 특히 Whitehead and Nelson (1992) 보고에 따르면 ethylene은 땅콩, 상추, 도꼬마리와 같은 식물종의 종자발아를 촉진시킨다고 하였는데, 이러한 현상은 ethylene이 종자휴면에 관여하는 종자휴면 유도물질의 활성을 억제시켜 휴면타파를 유도하기 때문이라고 보고하였다. 그러나 Edwards and Miller (1972)의 보고에 따르면 ethylene은 오히려 야산고비(
서양민들레 종자의 발아율은 식물생장조절물질 SA처리에서 가장 억제되었는데 SA의 가장 주된 작용은 식물체내에서 pathogen-related (PR) 단백질 생합성에 관여하여 식물의 병 저항성을 유도하는 것이라고 하였는데(Kim et al., 2009), 이외에도 ethylene 발생량의 조절 및 식물호르몬 jasmonic acid (JA) 생합성 조절에 관여하는 것으로 알려져있다(Klessig et al., 2000; Lee et al., 1995; Xie et al., 2007). 특히 Xie et al. (2007) 보고에 따르면 보리에서 종자의 발아는 배에서 생합성된 GA가 호분층내 가수분해효소인 α-amylase의 활성을 촉진시키게 되어 종자발아를 유도하게 되나, 보리종자에 SA를 처리하게 되면, 배에서 GA 생합성이 억제되어 최종적으로 종자 발아가 억제되는 것으로 보고하였다. 또한 식물호르몬 SA 처리에 의한 종자발아 억제현상은 ABA 작용으로 인한 종자의 휴면유도와도 상당한 연관성을 지니고 있을 것으로 추정하고 있으며, 그러한 근거는 보리 종자 내 SA와 ABA 처리에서 α-amylase의 활성을 조절하는
>
GA3와 SA의 혼합 처리에 따른 서양민들레의 발아율
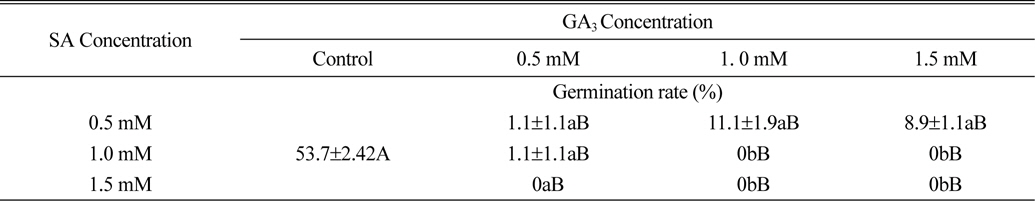
식물생장조절물질 처리에 따른 서양민들레 종자발아율은 GA3와 kinetin 처리에서 무처리에 비해 크게 높았고, SA와 ethephon 처리에서 무처리에 비해 종자발아율이 낮아짐을 확인할 수 있었다. 위의 결과를 바탕으로 서양민들레 종자발아율이 가장 높은 GA3와 발아율을 가장 낮은 SA를 각각 0.5, 1.0, 1.5 mM 농도로 혼합 처리시 서양민들레 종자 발아에 미치는 영향에 대해서 실험을 진행하였다. 실험 결과 식물생장조절물질 SA와 GA3의 모든 혼합처리조합에서 종자발아율이 무처리에 비해 현저히 낮아지는 것으로 조사되었다(Table 2). 특히 1.0, 1.5 mM의 SA와 0.5, 1.0, 1.5 mM의 GA3 혼합처리에서는 1.0 mM의 SA과 0.5 mM의 GA3 혼합처리를 제외한 모든 처리구에서 종자가 발아하지 않는 것으로 조사되었다. 또한 서양민들레 종자가 약 1.1~11.1% 가량 발아한 0.5 mM의 SA와 0.5, 1.0, 1.5 mM의 GA3 혼합처리구도 0.5, 1.0, 1.5 mM의 SA 단독처리구에 비해 종자발아율이 크게 낮아지는 것으로 조사되었다(Table 1, 2).
[Table 2.] Effect of plant growth regulators on seed germination rate of dandelion.
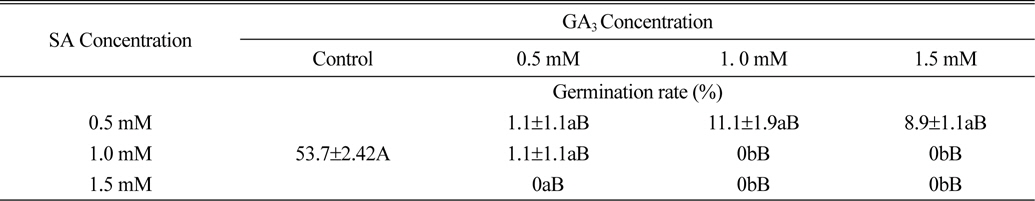
Effect of plant growth regulators on seed germination rate of dandelion.
일반적으로 GA는 종자 내 α-amylase의 활성을 유도하여 종자발아를 촉진시키는 것으로 알려져 있으며, 반대로 SA는 종자 내 GA 함량 및 α-amylase 활성을 조절하는 유전자의 발현에 관여하여 종자발아를 억제하는 것으로 알려져 있다(Xie et al., 2007). 이들 두 식물생장조절물질을 혼합하여 처리하였을 경우 SA 단독처리보다 더욱 낮은 종자발아 억제현상을 확인 할 수 있었고, SA 처리 농도가 높아질수록 발아율이 매우 낮거나 발아되지 않았다. 몇 몇의 연구결과에서 보고된 식물생장조절물질 SA 작용에 의한 종자발아 억제현상이 GA 처리로 인해 경감되는 결과는 본 실험에서는 확인 할 수 없었으며, 더욱이 GA와 SA혼합처리가 종자발아를 완전히 유도하지 않는다는 결과는 다른 연구에서 확인할 수 없었다(Rajjou et al., 2006; Xie et al., 2007). 이는 아마도 서양민들레 종자에서 GA3와 SA혼합처리는 종자의 발아억제 혹은 휴면을 유도할 수 있는 특이적 내생 물질 합성을 유도하여 나타난 결과로 추정되며, 이에 대한 추가적인 실험이 필요하다고 생각된다. 결론적으로 위의 결과를 다양한 잡초 종자발아 유도 실험에 적용하여 종자발아 억제를 통한 효과적인 잡초방제 방법으로도 응용이 가능할 것으로 생각된다.
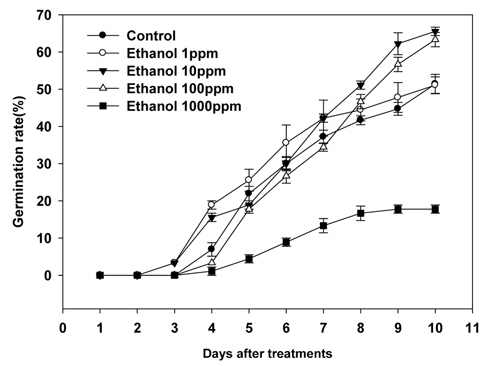
본 실험에 사용된 생장조절물질 중 SA는 물에 녹지 않는 성질을 지니고 있어 소량의 ethanol에 SA를 녹인 다음 증류수로 희석하여 실험에 사용하였고, 실험결과 SA처리에서 서양민들레 종자발아율이 감소됨을 확인할 수 있었다. 따라서 위의 결과가 SA단독 효과임을 확인하기 위해 ethanol를 1, 10, 100, 1000 ppm 농도로 희석한 다음 동일한 실험을 진행하였다. 실험결과 ethanol처리시 종자의 발아는 생장조절물질처리에서의 결과와 같이 처리 후 3~4일 사이에 발아를 시작하는 것으로 조사되었다(Fig. 2).
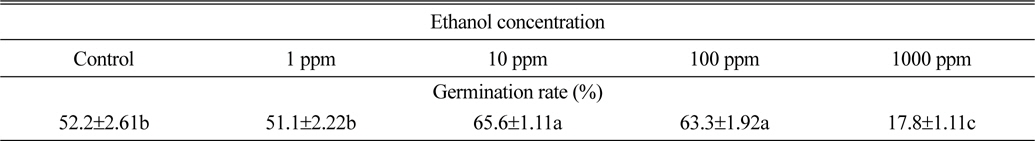
Ethanol처리에 따른 서양민들레 종자발아율은 Table 3과 같다. Ethanol 1ppm 처리에서는 서양민들레종자발아율이 51.1%로 조사되어 무처리와 큰 차이가 없는 것으로 조사되었다. 반면 10 ppm과 100 ppm의 ethanol처리에서는 각각 65.6%와 63.6%의 발아율을 나타내어 무처리보다 11.1%~13.4% 가량 종자발아율이 증가되는 것으로 조사되었다. 그러나 1000 ppm의 ethanol 처리에서는 17.8%의 발아율을 나타내어 무처리보다 34.4% 발아율이 감소된 것으로 조사되어 고농도의 ethanol 처리는 서양민들레 종자의 발아율을 억제할 수도 있을 것으로 추정된다(Table 3).
[Table 3.] Effect of ethanol on final seed germination rate of dandelion.
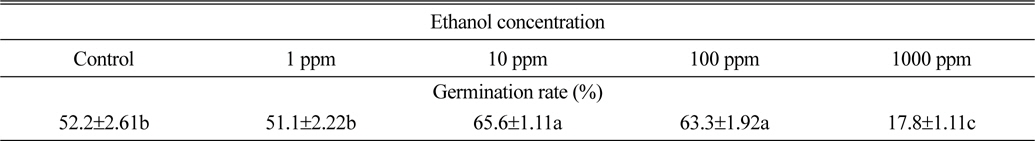
Effect of ethanol on final seed germination rate of dandelion.
본 실험에서 사용된 식물생장조절물질 SA 처리를 위해 사용된 ethanol의 농도는 1~10 ppm 수준이었기 때문에 SA 처리에 의한 서양민들레 종자발아율 감소현상은 ethanol 처리에 의한 효과와는 무관한 것으로 조사되었다.