A bacterium producing α-galactosidase (α-ᴰ-galactoside galactohydrolase, EC 3.2.1.22) was isolated. The isolate, KM-1 was identified as
사료의 주성분인 어분(fish meal)의 생산량은 어족자원의 감소로 인하여 정체 또는 감소하는 추세에 있어 어분의 수급불안정에 따른 어류양식업의 채산성악화가 문제점으로 대두되고 있다. 따라서 일부 어류양식업체에서는 어류의 사료를 제조함에 있어서 단백질 함량이 높고 수급이 비교적 안정적인 탈지대두박을 어분 대체소재로 많이 사용되고 있다(Kim et al., 2013). 그러나 대두박의 탄수화물의 경우, 단당류가 거의 없으며 올리고당은 sucrose, maltose, raffinose, stachyose 등으로 구성되어 있고 다당류에는 arabinnan 등으로 구성되어 있다. 특히 stachyose와 raffinose는 α-galactosyl 결합으로 이루어져 있어 소화기관내에 α-galactosidase (α-ᴅ-galactoside galactohydrolase, EC 3,2,1,22) 효소를 갖지 않은 인간과 단위동물에게 있어서 raffinose와 stachyose는 소화되지 않은 채 대장에 도달하고, 대장 내의 혐기성 세균에 의해 메탄, 이산화탄소 그리고 수소가스가 생성되어 고창증의 원인(Rackis, 1981)이나 복부 팽만감의 원인(Reddy et al., 1980; Steggerda et al., 1968)이 될 수 있다. 또한 분뇨 내 질소 배출량 증가 및 악취가 발생할 수 있고 어류의 성장을 억제하거나 질병을 유발시키는 것으로 알려져 있다 (Yoo et al., 2007). 이러한 항영양인자의 영향으로 소화가 잘 되지 않아 어류용 사료제조에 사용이 제한되고 있다(Li et al., 1991). 따라서 사료생산 과정에서 이들을 분해할 수 있는 효소인 α-galactosidase에 대한 연구가(Min et al., 2002; Kim and Yoon, 1998; Choi et al., 1998; Kim et al., 2004; Irish et al., 1995) 활발히 진행되고 있으며 미생물로부터 생산되는 α-galactosidase 특성에 관한 연구(park., 2011; Kim. et al., 2002; Kum and Yoon., 1998; Choi et al., 1998)도 다양하게 이루어 지고 있으나 아직까지 고온성 미생물을 활용한 발효대두박 제조에 대한 연구는 부족한 실정이다. 또한 stachyose와 raffinose 같은 항영양인자를 분해할 수 있는 고온성 미생물을 탐색하고 이에 대한 활용방안 연구가 필요한 실정이다.
한편, α-galactosidase는 식품, 미생물, 동물에 널리 분포되어 있으며, galactose 잔기를 함유한 galactomannan 다당류나 melibiose, raffinose, stachyose 등의 저당류 또는 galactomannan에서 α-1,6 결합의 α-galactose 잔기를 가수분해하는 것으로 알려져 있다(Dey and Campillo, 1984). 이에 본 연구에서는 멸치(
미생물 분리를 위하여 Nutrient broth (NB, Difco, St. Louis, MO, USA)와 Nutrient Agar (NA, Difco)를 사용하였고 계대배양에는 NA를 사용하였다. 균주의 보존을 위하여 균배양액에 glycerol이 15% (V/V)가 되도록 하여 −75℃ 심온동결고(IIshin DF8514l, Seoul, Korea)에 보관하면서 사용하였다.
기장군 연안에서 어획한 생멸치(raw anchovy, Engraulis Japonica) 10 g을 내장을 제거하지 않고 멸균수 40 mL와 함께 균질기로 파쇄하여 5분간 방치한 뒤 상층액 10 mL을 취하여 100 mL의 NB에 5 mL를 접종한 후 50℃, 100 rpm의 진탕배양기(VISION SCI., VS-8480SR, Daejeon, Korea)에서 24시간 동안 배양하였다. 배양액 1 mL을 NA에 도말하여 50℃ incubator에서 배양하면서 발생하는 독립적인 colony를 분리하여 실험에 사용하였다.
위에서 분리한 미생물 배양액 각각 1 mL를 채취하여 12,000×g에서 15분 동안 원심분리하고 맑은 상층액을 취하여 α-galactosidase의 활성을 측정을 하였다. α-galactosidase 활성의 측정은 기질인 p-nitrophenyl-α-ᴅ-galactopyranoside (pNPαGal)를 사용하여 실시하였다(Food Research International, 2009). 즉, 700 µL의 100 mM potassium phosphate buffer (pH 6.5)에 100 µL의 배양액과 200 µL의 9.9 mM pNP αGal을 혼합하여 5분간 50℃에서 반응시킨 후, 2 mL의 0.2 M borate buffer (pH9.8)를 첨가하여 반응을 중지시키고 405 nm에서 흡광도를 측정하여 α-galactosidase 활성 정도를 특정하여 활성이 높은 균주를 선발하였다.
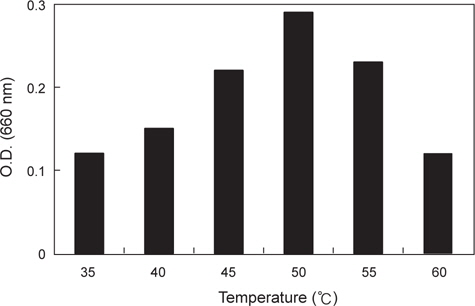
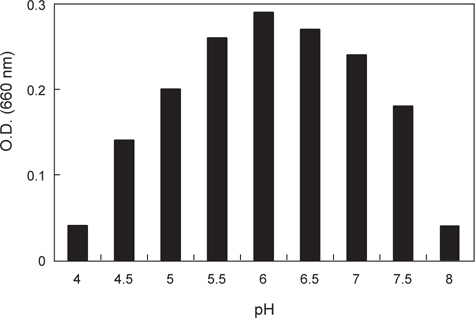
분리된 미생물 균주의 최적 발육온도를 측정하기 위하여 30-70℃의 온도범위에서 각각 12시간 동안 배양한 후 균체의 농도를 660 nm (Hitachi U-2900, Tokyo, Japan)에서 흡광도로 측정하였으며 최적 pH를 알아보기 위해 NB의 pH를 4.0-8.0으로 각각 조정하여 50℃에서 12시간 동안 배양한 후 균체의 농도를 역시 660 nm에서 흡광도로 측정하였다.
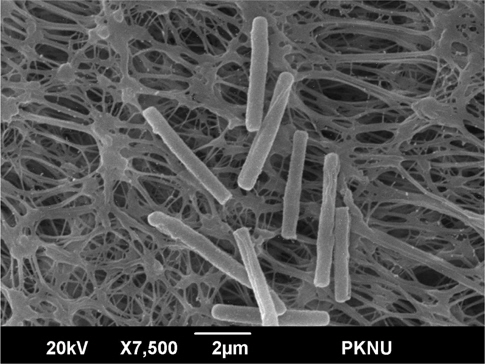
미생물 균주의 외형 및 크기의 측정은 Scanning Electron Microscopy (SEM, S-2400, Hitachi, JAPAN)을 이용하였다. SEM 측정을 위하여 고체배지 위에 세포를 고정시키고 0.1 M sodium phosphate buffer (pH 7.2-7.4)로 제조한 2.5% glutaraldehyde (TAAB Laboratoties Equipment Ltd, Berks, UK) 용액으로 3시간 고정시킨 후 0.1 M sodium phosphate buffer로 2회 세척한 다음 1% osmium tetroxide (Sigma, St Louis, MO, USA) 용액으로 30분간 최종 고정하였다. 그 다음 50-100% 농도 구배 알코올로 각각 단계적으로 5분씩 탈수시킨 후 100% hexamethyldisilazane로 완전히 탈수하고 건조하였다. 전처리된 샘플은 SEM으로 20 kV의 가속전압에서 7500배율로 관찰하였다.
분리한 미생물 균주의 생화학적 특성 검사를 위해서 APIZYM(BioMèrieux, France)를 사용하여 19종의 효소활성을 조사하였으며 α-galactosidase 활성이 높게 나타난 균주를 대상으로 API-50CH (BioMèrieux, France)을 사용하여 탄소원의 이용패턴을 조사하였다.
16S rRNA 유전자 염기서열과 계통수(phylogenetic tree) 분석
미생물 균주의 동정은 16S rDNA 염기서열의 상동성을 분석하여 수행되었다. 즉, 16S rDNA 염기서열을 결정하기 위해 일반적인 방법에 따라 정제된 DNA를 주형으로 하여 PCR로 증폭하였다. 증폭된 DNA 단편을 Big Dye Terminator Cycle Sequencing kit (Applied Biosystems, USA)로 정제한 다음, DNA sequencer (Applied Biosystems model 3730XL, USA)를 이용하여 염기서열을 결정하였다. 결정된 염기서열을 Ez-Taxon server 2.1을 이용하여 상동성을 분석하였다. 계통수는 NCBI의 BLASTN 결과 상위 50개를 사용하여 EMBL-EBI에서 제공하는 ClustalW2의 Neighbor Joining (Saitou and Nei, 1987) 방법을 통해 phylogenetic tree를 작성하였다.
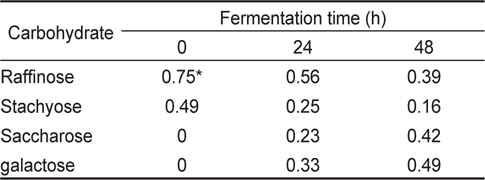
미생물 균주가 난소화성 탄수화물을 분해하는지 알아보기 위해서(Scalabrini et al., 1998) stachyose와 raffinose를 각각 10 g/L씩 첨가한 NB에 미생물 배양액을 5% (w/v)씩 각각 접종하여 50℃ 항온수조에서 48시간동안 배양하였다. 배양액 1 mL을 12,000×g에서 15분간 원심분리하여 얻은 상층액 250 µL에 아세토니트릴 750 µL 첨가하여 같은 조건에서 다시 원심분리하여 침전물을 제거하고 맑은 상층액을 0.2 µm 막 여과기(membrance filter)로 여과한 것을 최종 분석시료로 사용하였다. Stachyose와 raffinose의 정량은 APS-2 hypersil column(thermo scientific; 250×4.6 mm, 5 μm, 120A)이 장착된 고속 액체크로마토그래피를 이용하여(column 온도, 40℃; 이동상, 75% ACN; 유속, 1.5 mL/min) 분석하였다. 검출기는 RI 검출기(refractive index detector, Dionex)를 사용하였다.
>
미생물 균주가 생산하는 α-galactosidase의 최적 반응온도 측정
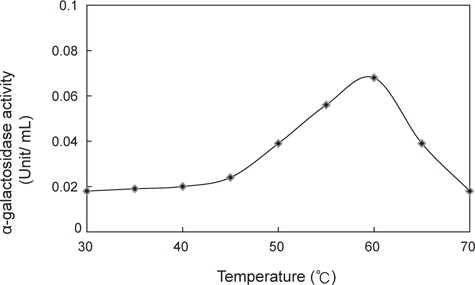
미생물 균주가 생산하는 α-galactosidase의 최적 반응온도를 알아보기 위하여 미생물 균주를 50℃에서의 48시간 진탕배양한 다음 8,000 rpm에서 20분간 원심분리하여 균체와 배양액을 분리하였다. 배양액은 ammonium sulfate를 35-85%로 포화되게 첨가하고 4℃에서 12시간 동안 방치하였다. 침전된 단백질은 13,000×g에서 20분간 원심분리하여 50 mM Tris-HCl(pH7.0)에 용해시킨 후 동일 완충액으로 4℃에서 12시간 동안 투석하여 조효소액을 획득하였다. α-galactosidase 활성측정은 기질로 p-nitrophenyl-α-ᴅ-galactopyranoside (pNPαGal)를 사용하여 실시하였다(Sigma, St. Louis, MO, USA). 700 µL의 100 mM potassium phosphate buffer (pH 6.5)에 200 µL의 9.9 mM pNPαGal과 100 µL의 조효소액을 혼합하여 5분간 30-70℃ 범위에서 각각 반응시킨 후, 2 mL의 200 mM borate buffer (pH 9.8)를 첨가하여 반응을 중지시키고 405 nm에서 흡광도를 측정하여 α-galactosidase 활성을 측정하였다. 효소활성 1 unit는 1분에 1 µmol의 p-nitrophenol이 효소에 의해 생성되는 양으로 나타내었으며, 활성도(specific activity)는 단백질 1 mg당 효소 1 unit로 나타내었다.
>
미생물 균주의 분리 및 α-galactosidase 활성
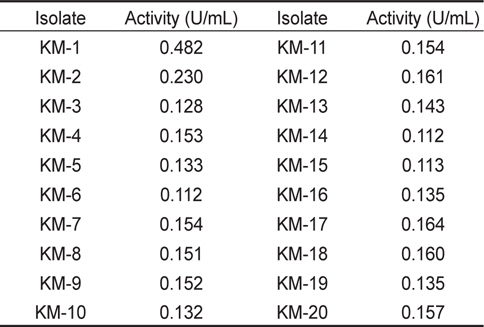
NA 및 NB 배지를 이용하여 기장일대에서 서식하는 멸치로부터 고온에서 독립적인 colony를 나타내는 20개의 미생물 균주를 분리하였고 α-galactosidase 활성을 알아보기 위하여 효소액에 대한 기질의 분해도를 측정하였다. 그 결과(Table 1) KM-1이 0.482 Unit/mL로 19개의 다른 미생물 보다 활성이 가장 높게 나타났으며 이는 사료제조에 있어 항영양인자인 stachyose와 raffinose를 분해시켜 어류의 사료 섭취시 소화력을 더욱 높여 줄 것이라 판단된다.
[Table 1.] α-galactosidase activity of microorganisms isolated from raw anchovy
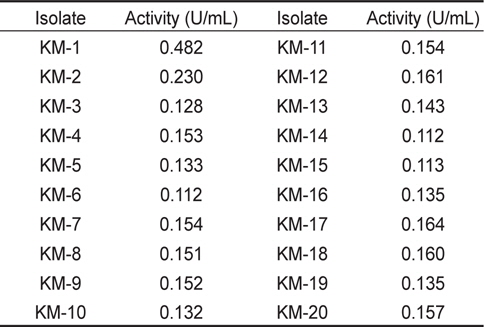
α-galactosidase activity of microorganisms isolated from raw anchovy
α-galactosidase 활성이 가장 높은 KM-1 균주의 최적 발육조건을 조사한 결과는 Fig. 1과 같다. 온도는 45-55℃의 범위에서 잘 자랐으며 최적발육온도는 50℃인 것으로 나타났다. pH의 경우, pH 5.5-7.0의 범위에서 잘 자랐으며 최적 발육 pH는 6.0인 것으로 나타났다. 이는 시료에 따라 약간의 차이를 나타내고 있는데 pH변화에 따른 콩, 메주, 된장의 α-galactosidase의 활성(Kim and Yoon, 1998)연구에서는 pH 7.0-7.5에서 가장 활성이 높아 본 연구결과와 약간의 차이를 보였다.
멸치로부터 분리한 20종의 미생물 중 α-galactosidase 활성이 가장 높게 나타난 KM-1 균주에 대한 형태학적 특성을 분석하기 위해 KM-1 균주를 최적 조건에서 배양하여 그람염색(Gram staining)과 포자염색(Spore staining)를 실시한 결과, 포자를 형성하는 그람양성균으로 나타났으며 KM-1 균주를 전자현미경으로 관찰한 결과(Fig. 3) 세균의 지름과 길이는 각각 0.5-0.7 µm, 3.3-4.4 µm로 길이가 지름의 2배 이상 되는 장간균(long rod)인 것으로 관찰되었다. 또한 카탈라제(catalase) 실험결과 양성반응을 보여 바실러스속(
>
API-ZYM과 API-50CHL Kit를 이용한 균주의 특성
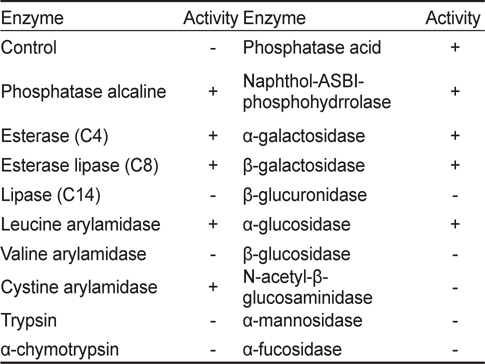
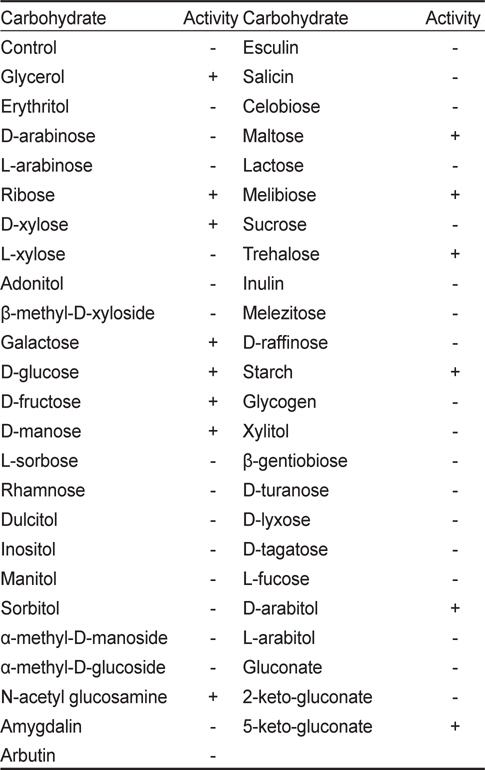
KM-1 균주의 생화학적 특성 분석하기 위해 API-ZYM(BioMèrieux, France)를 사용하여 19종의 효소활성을 조사한 결과(Table 2) KM-1 균주는 alkaline phosphatase, esterase (C4), esterase lipase (C8), leucine arylamidase, cystine arylamidase, phosphatase acid, naphthol-ASBI-phosphohydrrolase, α-galactosidase, β-galactosidase 및 α-glucosidase에 대한 양성반응을 나타내었다. 또한 API-50CH (BioMèrieux, France)을 사용하여 50종의 탄소원 이용패턴을 조사하였는데(Table 3) glycerol, ribose, D-xylose, galactose, D-glucose, Dfructose, D-manose, N-acetyl glucosamine, maltose, melibiose, trehalose, starch, D-arabitol 및 5-keto-gluconate를 이용하는 것으로 나타났다.
[Table 2.] Enzyme activities of Bacillus coagulans KM-1 by APIZYM kit
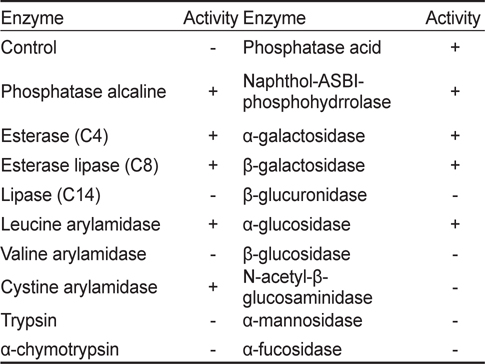
Enzyme activities of Bacillus coagulans KM-1 by APIZYM kit
[Table 3.] Carbohydrate utilization pattern of Bacillus coagulans KM-1 by API-50CH kit
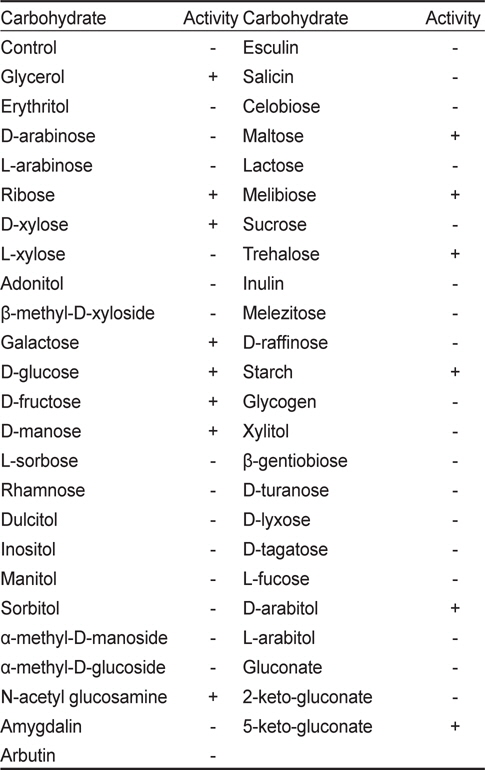
Carbohydrate utilization pattern of Bacillus coagulans KM-1 by API-50CH kit
16S rRNA 유전자 염기서열 분석과 계통수(phylogenetic tree)
α-galactosidase 활성이 높은 KM-1 균주의 16S rDNA의 염기서열을 분석한 결과 B.
B.
[Table 4.] Non-digestible carbohydrate resolution of Bacillus coagulans KM-1
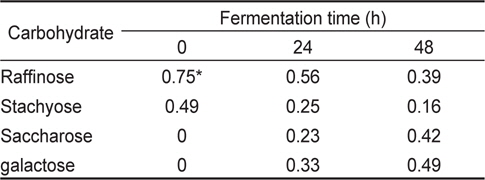
Non-digestible carbohydrate resolution of Bacillus coagulans KM-1
>
미생물 균주가 생산하는 α-galactosidase의 최적 반응온도
B.