The conventional methods for total residual chlorine such as iodometry and DPD colorimetric can cause secondary pollution due to additional agents, also have a wide error range. As for alternative, electrochemical method can measure TRC(Total residual chlorine), and is not required as additional agents, also very suitable for using the fields of ballast water because test time is relatively fast. Therefore, this study was investigated for changing charge by agitation, salt concentration, and temperature change. Charge showed differences based on changes of reduction peak with or without agitation. In contrast, TRC and charge were well correlated in constant agitation speed. As TRC and charge were analyzed with high correlations in constant salinity and temperature of ocean, thereby conductivity was firstly measured, and charge had high correlation for TRC in spite of changing salinity and temperature Pt electrode revealed high reliability (r2=0.960) because it was rarely effected by TRC, On the other hand, Au electrode appeared inadequate (r2=0.767) to use sensor in less than 1.0 ppm of TRC. For high accuracy and detection of TRC, Pt and Au electrodes for test time were, respectively, 14 and 22 seconds. As a result, Pt electrode was more valuable than Au electrode in terms of response time.
전해소독장치는 소규모의 급수 및 급식시설 그리고 선박평형수 처리를 위한 전해장치 등을 중심으로 적용범위가 확대되고 있는데, 안정적인 공정 운전을 위하여 전기분해시 발생하는 산화제 농도 측정 연구가 매우 중요하다. 특히, 최근에는 전기분해를 이용한 선박평형수 처리에서 그 활용도가 높이지고 있어 본 연구에서는 해수에서 전기분해시 발생하는 산화제를 측정하기 위하여 Au와 Pt 등의 전극을 이용하여 전기화학적인 방법으로 산화제를 측정함으로써 센서로의 유효성을 연구하였다.
선박평형수 내의 잔류염소 측정은 세균학적 안정성 확보와 과다한 중화제 억제를 위하여 매우 중요하다. 물속의 염소(Cl2)는 물의 pH에 따라 차아염소산(HOCl)이나 차아염소산이온(OCl−)로 존재한다. 낮은 pH에서 HOCl의 생성이 많고 높은 pH에서는 OCl−의 생성이 많으며, pH 5이하에서는 Cl2로 존재한다(Körbahti et al., 2010; Scialdone et al., 2009). 이들 염소성분을 유리염소(free chlorine)라고 하고 이화합물중 HOCl은 활성염소(active chlorine)라 하며, 가장 강한 산화력과 소독력을 가진다. 유리염소를 측정하는 방법 중 요오드 적정(iodometry)와 DPD법(N,N-diethyl-p-phenylenediamine sulfate, (C2H5)2NC6H4NH2H2SO4) 등이 알려져 있다. 요오드적정은 요오드의 산화작용 또는 요오드화물 이온의 환원작용으로 적정하는 방법으로 실험 시 기구와 시약이 많이 필요하고, 높은 농도에서는 적정이 잘 이루어지지 않으며, 실험에 숙련도를 요한다.
또한, 이러한 염소의 가장 일반적인 측정법은 N, N-다이에틸-p-페니렌다이아민황산염 시약을 이용하는 DPD-colorimetric 방식으로 유리잔류염소와 TRC(Total residual chlorine)를 측정할 수 있다. 이 방법은 시료에 지시액인 DPD와 완충용액을 넣어 pH를 6.3~6.6로 조절한 후 분광광도계로 510 nm에서 흡광도를 측정하여 유리잔류염소를 구하거나, pH를 5.1정도로 조절하고 potassium iodide를 추가로 넣어 흡광도로 측정하여 구한다. 하지만 이와 같은 DPD방법은 낮은 농도의 산화제가 존재할 경우에 발색이 잘 이루어지지만, 높은 농도의 산화제가 존재할 경우 imine 계열의 화합물로 인하여 발색 유도가 잘 이루어지지 않아 분석에 오차를 가져올 수 있다.
본 논문에서는 전기화학 센서 방법 중 전기량법으로 수중에 존재하는 산화제를 측정하였는데, 전기량법(chronocoulometry)은 시료용액 중 분석대상성분이 모두 전기화학적 반응을 끝내는 동안 흐른 전기량을 측정하여, 분석대상 성분의 정보를 얻는 방법이다. 즉, 강한 산화력을 가지는 HOCl를 환원반응으로 직접 검출함으로 전처리 없이 잔류염소를 실시간 연속 모니터링이 가능하다.
전기량법은 작동전극과 기준전극에 전위를 걸면 화학종의 산화나 환원이 일어나며, 발생한 전류의 전자이동 반응을 측정하게 되고 이는 분석물의 농도에 비례하게 되는데, 선행연구로 작동전극을 Au로 사용하였고 본 논문에서는 Pt를 사용하였다.
수중에서 HOCl/OCl−는 식 (1)과 같이 존재하는데, 환원반응이 일어나면 식 (2)와 같은 반응식으로 HOCl를 검출할 수 있어 실시간 연속 모니터링이 가능하다.
Au전극의 경우 용존산소의 영향을 덜 받는 것으로 알려져 있어 전기화학적 센서로 사용되어지고 있으며(Campl et al., 2005; Saputro et al., 2010), Pt전극은 가장 잘 알려진 보이므로(Deṡiċ et al., 2005), 각각 전극을 비교하여 전기화학적 센서로 유효성이 더 높은 전극을 살펴보고자 하였다.
따라서 본 논문에서는 작동전극으로 Pt전극을 이용하여 TRC 농도에 대한 전하량을 교반유무와 온도 그리고 염분농도가 미치는 영향을 살펴보았으며, Au전극을 이용한 선행 연구와 비교하여, 전기화학적 센서로서 Au와 Pt전극의 유효성을 연구하였다.
TRC 측정은 potentiostat/galvanostat (AMETEK, versastat 3)을 이용하여 선형 주사 전압-전류법(Linear sweep voltammetry, LSV)으로 실시하였으며, 전압 범위는 1.1 V에서 −0.6 V까지 인가하였고, 주사속도는 50 mV/sec이었다. 전하량 분석은 LSV의 전압범위 0.4 V에서 1.0 V 구간을 적분하여 나타낸 값이다.
사용된 전극은 3전극계로 작동전극(working electrode)은 면적 0.35 cm2의 백금(Pt)을 사용하였고, 기준전극(reference electrode)은 염화백금전극(Ag/AgCl, 3.5 M KCl), 상대전극(counter electrode)은 백금전극을 사용하였다.
TRC 표준용액 제조는 Aldrich사의 차아염소산나트륨(Sodium hypochlorite, NaOCl)으로 0.1 ppm, 0.5 ppm, 1.0 ppm, 5.0 ppm, 10.0 ppm, 15.0 ppm, 20.0 ppm을 조제하여 사용하였다. 해수의 pH 조정은 1N-NaOH를 주입하여 pH 7.7에서 실험을 진행하였다.
해수의 온도 조정을 위하여 워터자켓셀과 저온항온조를 이용하여 10℃, 15℃, 20℃에서 실험을 진행하였고 교반기를 이용하여 100 RPM부터 300 RPM까지 실험을 진행하였다.
해수는 우리나라 경상남도 남해(마산)에서 채취하여 사용하였으며, TRC의 DPD측정은 Pocket colorimeter(HACH)를 이용하였다.
3.1. Pt전극을 이용한 TRC측정에서 교반속도, 온도 그리고 염분농도의 영향
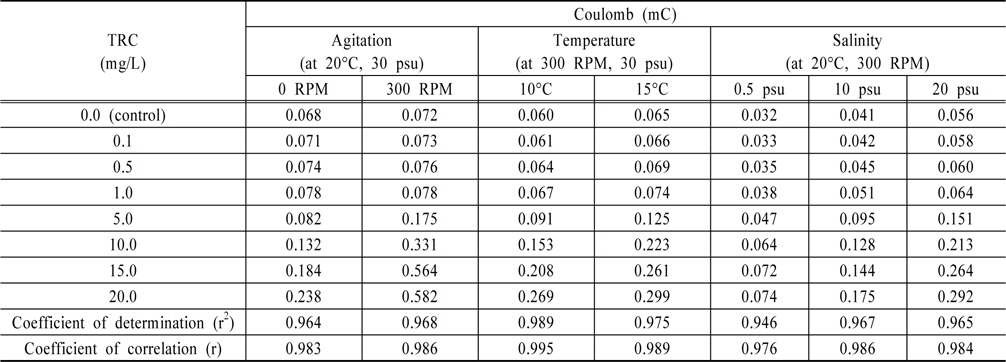
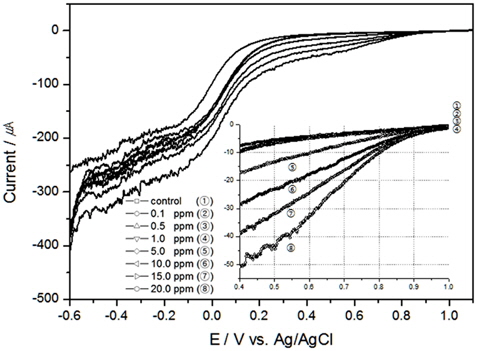
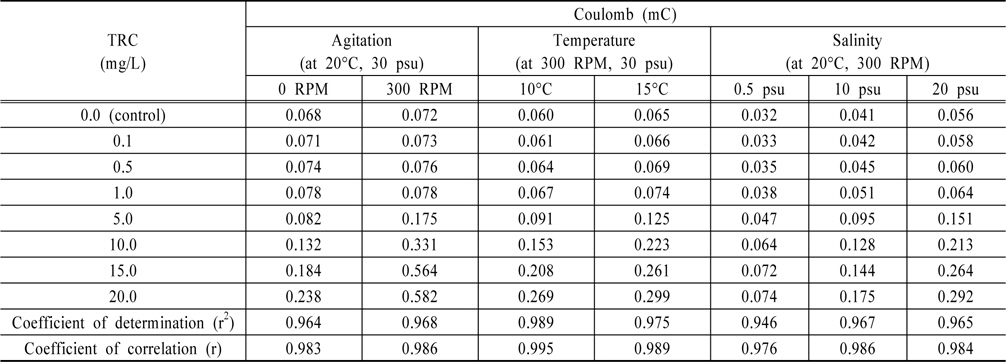
Pt전극을 이용하여 TRC에 대한 전하량의 변화를 살펴보기 위해 먼저, 해수의 염분농도 30 psu, 온도 20℃에서 0 RPM과 300 RPM의 교반속도에 대한 결과를 Fig. 1과 2에 보였다. 선박평형수 처리 시 TRC를 빠른 시간에 분석하기 위해서는 시료를 채취하지 않고 선박 파이프 내에 흐르고 있는 상태에서 바로 분석을 하여야 하기에 교반 유무에 따른 TRC의 전하량 변화를 살펴보았으며, 이에 대한 전하량을 분석하여 Table 1에 정리하였다. 교반속도에 따라 전하량의 차이가 있지만, 교반속도가 일정하면 TRC에 대한 전하량의 변화는 서로 상관성이 높다는 것을 알 수 있었다.
[Table 1.] Summary of variations of coulomb with Pt electrode
Summary of variations of coulomb with Pt electrode
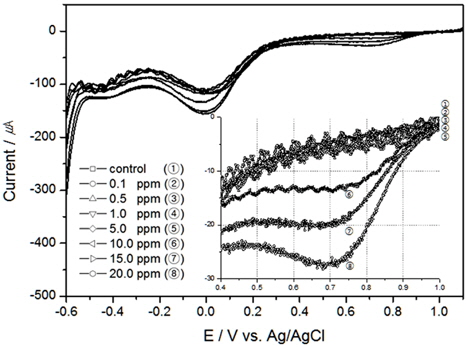
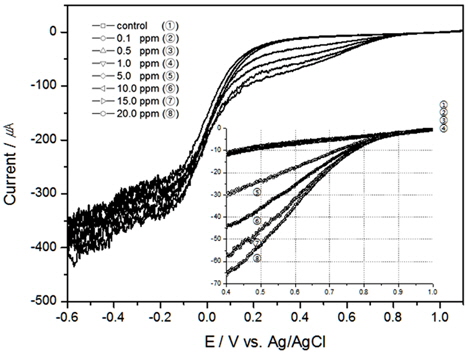
먼저 해수가 정체되어 있는 실험 결과인 Fig. 1를 살펴보면, 약 0.7 V(vs. Ag/AgCl)와 0.0 V(vs. Ag/AgCl)에서 두 개의 피크가 확인되었다. Kodera 등의 연구를 살펴보면 본 연구와 같이 약 0.5 V와 -0.2 V (vs. Ag/AgCl)에서 두 개의 환원피크가 발생하였다(Kodera et al., 2005). 약 0.2 V정도 피크가 이동(shift)되어서 나온 이유는 전해질의 차이인 것으로 사료된다. 본 연구에서 발생된 0.7 V 부근의 피크는 HOCl이 환원되면서 발생된 피크로 판단되며, 0.0 V 부근의 피크는 용존산소의 영향으로 나타난 것으로 사료된다. Pt 전극은 Au전극과 비교 시 용존산소의 영향을 더 받는 것으로 알려져있는데(Campl et al., 2005; Kodera et al., 2005), 본 연구결과 HOCl의 환원피크와 용존산소 발생 전위는 차이가 있으므로 Pt 전극을 이용한 산화제 검출에서 용존산소의 영향은 적은 것으로 판단된다.
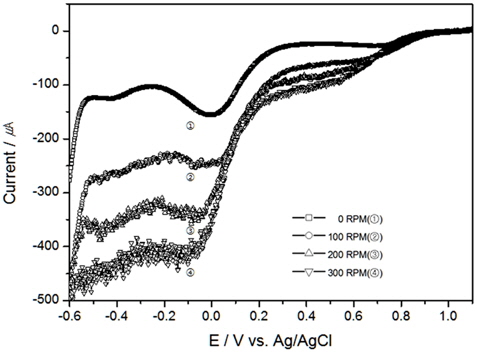
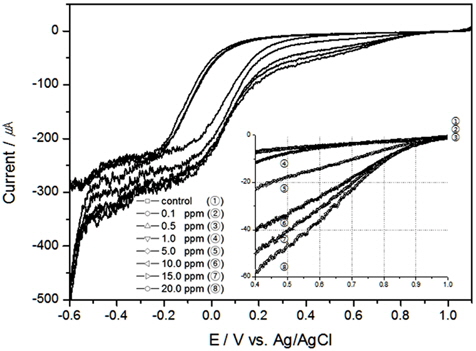
이러한 환원피크는 교반이 이루어진 Fig. 2의 결과에서는 발생하지는 않았으나, 교반속도가 빠를수록 같은 TRC 농도일지라도 전류가 증가하는 것을 알 수 있었으며, TRC 농도20 ppm에서 교반속도의 영향에 따라 LSV가 달라질 수 있음을 Fig. 3에 표현하였다. 이와 같은 이유는 확산으로 인한 농도 과전압이 낮아져 전류값이 변한 것으로 사료된다.
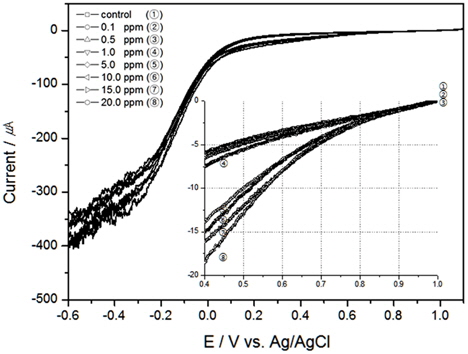
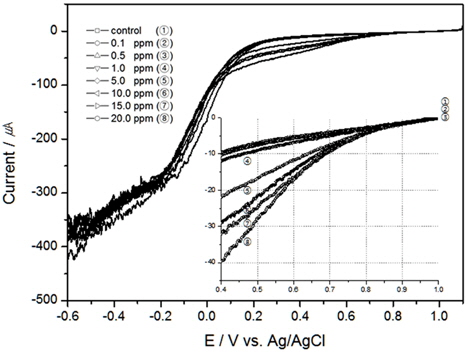
해수의 온도와 염분농도의 변화에 따른 TRC의 전하량 변화를 알아보고자 다음 실험을 진행하였다. 먼저, 염분농도에 대한 영향을 배제하고 위하여 30 psu로 고정하고 교반속도는 300 RPM에서 온도 10℃, 15℃의 결과를 Fig. 4, 5에 도시하였으며, 20℃에 대한 결과는 Fig. 2와 동일하다. 그리고 염분농도는 0.5 psu, 10 psu, 20 psu, 그리고 30 psu에서 염분농도 변화에 대한 TRC농도와 전하량의 상관관계를 보기 위하여 각각 Fig. 6, 7, 8에 나타내었고, 30 psu의 실험은 Fig. 2의 결과와 같으며, 이때의 실험조건은 교반속도 300 RPM, 온도 20℃이었다.
Table 1에 온도와 염분농도 변화에서 전하량을 도출하고 회귀분석을 통하여 결정계수를 구하였다. 결과와 같이 조건이 일정하다면 TRC 농도에 대한 전하량 변화의 상관성은 매우 높은 것으로 나타났으나, 온도와 염분농도가 올라갈수록 같은 TRC 농도에서 전하량이 더 높게 나오는 것을 알수 있었다.
3.2. 전기화학적 방법을 이용한 해수에서의 TRC 측정의 유효성
지금까지 해수 중에 있는 TRC를 측정하기 위하여 전기화학적 방법으로 분석을 실시하였다. 순환전위주사법을 실시하여 Au전극은 0.0 V에서 1.0 V, Pt전극의 경우에는 0.4 V에서 1.0 V까지의 전하량으로 잔류염소 농도에 대한 전하량과의 상관성을 연구하였으며 교반속도, 염분농도 그리고 온도 변화가 이에 미치는 영향을 살펴보았다.
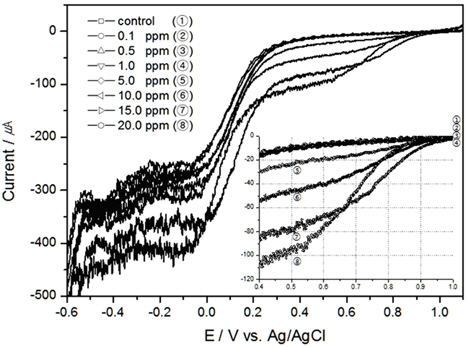
교반이 없는 경우 TRC에 대한 환원피크는 Au 전극이 약 0.65 V(vs. Ag/AgCl)에서 나타났으며, Pt 전극은 약 0.75 V(vs. Ag/AgCl) 부근에서 발생하였고, 같은 TRC 농도에서 전하량은 Au 전극보다 Pt 전극에서 더 많이 생성되었다.
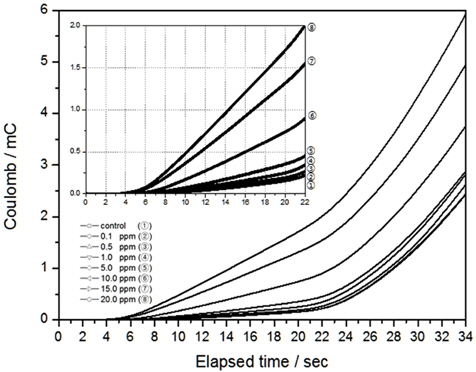
본 연구에서 인가한 전압의 범위는 -0.6 V에서 1.1 V이며 주사속도는 50 mV/sec로 이를 시간으로 보여주면 약 34초 정도의 분석시간이 필요하다. Au전극의 경우 Fig. 9와 같이 시간이 흐를수록 전하량이 늘어나지만, 약 22초 이후부터는 기울기가 변하는 것을 알 수 있었다. Fig. 9안에 삽입된 그림은 0초에서 22초 구간을 확대한 것으로 이 구간에서는 전하량이 잔류염소 농도에 대하여 선형적으로 증가하는 것을 알 수 있다. 0초에서 22초 구간이 전압 범위 0.0 V에서 1.0 V구간에 해당하는 것으로, 이 전압 범위에서 결정계수가 높게 나오는 이유는 전하량의 잔류염소 농도변화가 선형적으로 나타나는 구간이기 때문인 것으로 판단된다.
[Fig. 9.] Variation coulomb by elapsed time with Au electrode (scan rate 50 mV/sec, 30 psu, 300 RPM)
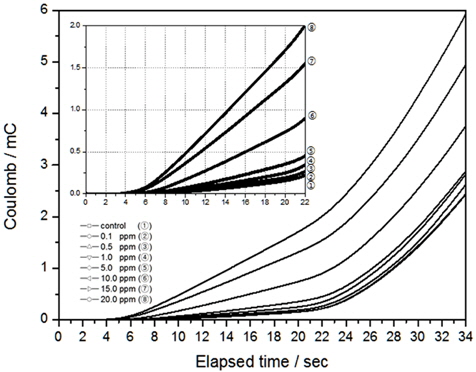
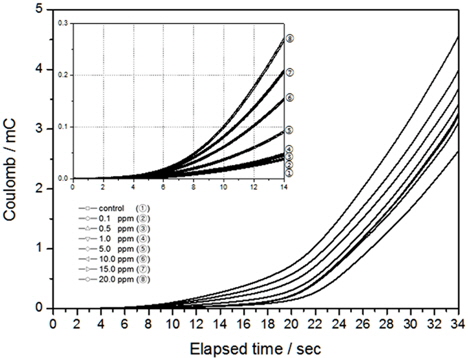
Pt 전극의 분석시간에 대한 전하량의 변화를 Fig. 10에 나타내었다. 앞선 실험에서 결정계수가 높게 나오는 전압 범위는 0.4 V에서 1.0 V이며 이를 시간으로 나타내면 약 14초까지 분석하게 된다. 결과와 같이 Pt 전극 사용 시 전하량의 변화도 14초까지는 선형적으로 증가하다가 점점 곡선을 그리면서 지수함수적인 모양으로 변하게 된다. 따라서 14초까지의 전하량을 잔류염소 농도 측정을 위한 인자로 사용한다면 좋은 상관관계를 얻을 수 있을 것으로 판단되며, 이에 대한 결정계수는 앞선 실험에서 모두 높게 분석되었다.
즉, Au 전극을 사용한 잔류염소 분석 시에는 전압 범위 0.0 V에서 1.0 V까지 분석하여 전하량을 도출하면 좋은 유효성을 얻을 수 있고, 반면 Pt는 0.4 V에서 1.0 V까지 분석하여 전하량을 구한 값으로 잔류염소 분석에 인자로 사용한다면 높은 상관관계를 얻을 수 있을 것으로 판단된다. 또한 이를 시간적으로 서술하면, Au 전극 이용 시 잔류염소 분석에는 약 22초가 소요되고 Pt 이용 시 약 14초가 필요하여 Pt 전극이 8초 정도 더 빠른 시간에 잔류염소를 검출 할 것으로 판단된다.
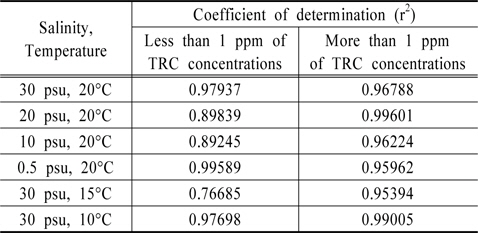
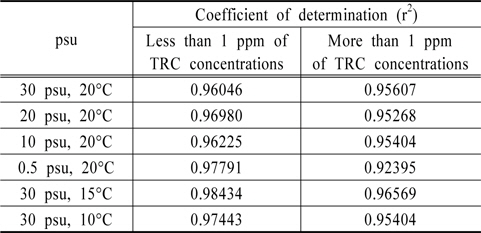
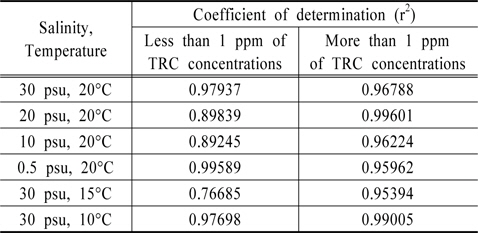
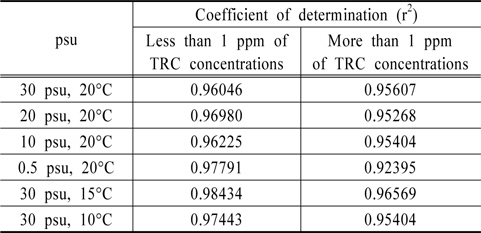
Au와 Pt 전극을 이용하여 잔류염소 측정에 대한 유효성을 판단하기 위하여 Au 전극은 0.0 V에서 1.0 V까지의 전하량에서 우수한 결정계수를 얻을 수 있었고, Pt 전극은 0.4 V에서 1.0 V까지 분석하여 높은 상관성을 도출하였다. 하지만 이는 TRC 농도 0 ppm부터 20 ppm까지를 회귀분석한 결과이며, 이를 1.0 ppm 이하와 1.0 ppm 이상으로 구분하여 회귀분석을 실시한 결과를 Table 2, 3에 정리하였다. 김은찬 등의 연구에서, 전기분해 방식의 처리장치의 산화제 농도는 처리 시 15 ppm에서 1 ppm까지 다양하게 분포되나 배출 시 농도는 대부분 0.2 ppm으로 나타나는 것으로 조사되어(Kim et al., 2012), 1 ppm이하의 낮은 농도에서의 상관성도 매우 중요한 것으로 사료된다.
[Table 2.] Comparison of r2 between low and high concentrations of TRC with Au electrode
Comparison of r2 between low and high concentrations of TRC with Au electrode
[Table 3.] Comparison of r2 between low and high concentrations of TRC with Pt electrode
Comparison of r2 between low and high concentrations of TRC with Pt electrode
Table 2를 살펴보면 Au 전극은 1.0 ppm 이상의 잔류염소 검출 시에는 결정계수가 최저 0.95394이며 최고 0.99601로 분석되어 좋은 상관성을 보이지만, 1.0 ppm 이하에서는 최저 0.76685, 최고 0.97937로 그 유효성에서 상당한 차이를 보인다. 즉 Au 전극 사용 시 저농도인 1.0 ppm 이하에서는 잔류염소 농도 분석에 오차가 발생할 수 있는 것으로 판단된다. Table 3의 Pt 전극을 살펴보면, TRC 농도 1.0 ppm 이상에서는 최저 0.92395, 최고 0.96569로 분석되었고, 1.0 ppm 이하에서는 최저 0.96046, 최고 0.97791로 분석되어 저농도와 고농도 구분 없이 우수한 상관관계를 보여주었다. 이에, 분석시간과 잔류염소의 저농도, 고농도에서의 감도를 고려한다면 Au 전극보다는 Pt 전극이 해수에 존재하는 잔류염소 분석 시 좀 더 유리할 수 있을 것으로 판단되어진다.
그리고, TRC농도를 종속변수로 하여 염분농도, 교반속도 그리고 온도 변화에서의 전하량을 독립변수로하여 다중회귀분석을 실시하였다. 연구결과, TRC농도 =15.052×염분농도 + 4.709×교반속도 − 5.125×온도 − 2.96의 모형식을 구하였으며, 표준오차 0.42031에서 모형의 검정통계량 F값이 788.186로서, 유의확률 p값은 0.000으로 산정되었다. 따라서 염분농도와 교반속도 그리고 온도변화에 따른 전하량으로 판단된다.을 독립변수로 하고 TRC농도를 종속변수로 하는 다중회귀모형은 유의수준 0.01에서도 유의한 모형이라고 사료되며, 독립변수 중 염분농도가 TRC 농도에 대한 전하량에 가장 큰 영향을 미치는 것으로 판단된다.
상기와 같이 해수에서 산화제 측정을 위하여 작업전극 Au전극과 Pt전극을 서로 비교하여 센서로의 유효성을 살펴보았다. 하지만, 해수의 염분농도와 온도 등의 영향 인자에서 전하량이 서로 상이하게 나오는 것을 알 수 있었다. 즉, 전기분해 시 발생하는 산화제를 전기화학적인 방법으로 검출하기 위해서는 염분농도와 온도 등을 보정해주어야 한다. 하지만, 염분농도와 온도는 모두 전기전도도와 상관성이 높은 인자이다.
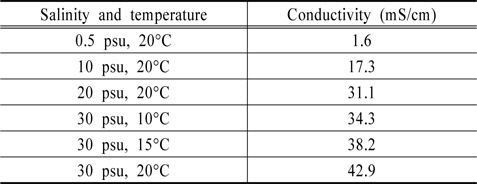
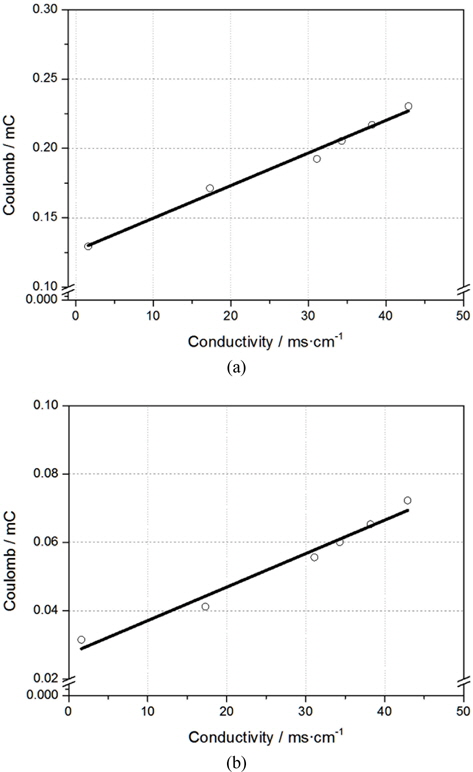
Table 4는 염분농도와 온도에 따른 전기전도도로 Wely(1964)의 연구와 유사함을 알 수 있다(Wely, 1964). Fig. 11에는 각각 Au와 Pt전극에서 NaOCl이 주입되지 않은 해수(control)의 전하량과 전기전도도와의 회귀분석 결과를 나타낸 것으로, 피팅된 직선 근처에 변수들이 존재하는 것을 알 수 있다. 이는 전기화학적 방법으로 TRC 측정 시 수중의 전기전도도를 먼저 측정한다면, 염분농도와 온도 등의 인자가 변하여도 높은 유효성으로 분석이 가능함을 의미한다.
[Table 4.] Changing conductivity by salinity and temperature
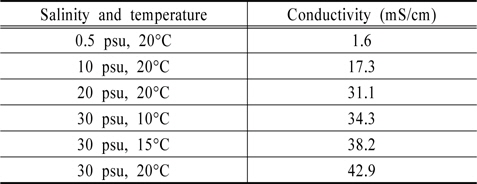
Changing conductivity by salinity and temperature
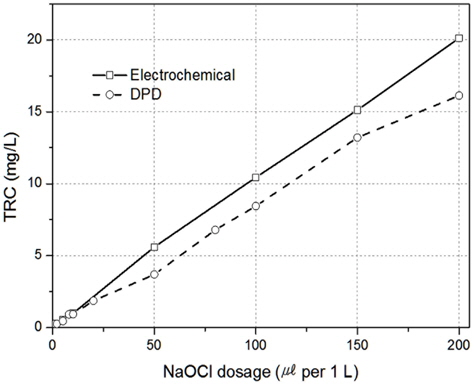
끝으로, Pt 전극을 이용하여 해수에서 잔류염소 분석을 위한 전기화학적 방법과 HACH의 colorimeter를 서로 비교하여 Fig. 12에 보였다. HACH의 경우 저농도에서는 비교적 상관관계가 잘 나타났으나, 약 5 ppm 이상부터는 차이가 발생하기 시작하여 잔류염소가 20 ppm 존재하여도 약 16 ppm 정도로 인식하였다. 이는 HACH의 경우 DPD법으로 분석하는데 높은 농도의 산화제가 존재할 경우 imine 계열의 화합물로 인하여 발색 유도가 잘 이루어지지 않아 분석에서 오차가 발생된 것으로 사료된다(Harp, 2002).
반면 Pt 전극을 이용한 TRC 측정은 저농도와 고농도 부근에서도 실험값에 유사하게 나와, 해수에서 TRC 측정을 위한 전기화학적 방법은 그 유효성이 좋은 것으로 판단된다.
해수에서 존재하는 산화제를 전기화학적 방법으로 검출하기 위해서 Au와 Pt 등의 전극으로 산화제의 농도를 측정하여 센서로서의 유효성을 연구한 결과, Au와 Pt전극의 HOCl 환원피크는 각각 0.65 V(vs. Ag/AgCl), 0.70 V(vs. Ag/AgCl)에서 발생하였다.
일정한 해수의 염분농도와 온도에서는 TRC 농도와 전하량의 유효성이 매우 높게 분석되었다. 하지만, 염분농도와 온도가 변하면 해수의 염분농도와 온도에 따라 TRC 농도에 대한 전하량은 다르게 측정되었다. 이를 보정하기 위하여 먼저 전기전도도를 측정한 후 전기화학적 방법으로 TRC농도에 따른 전하량을 분석한다면 염분농도와 온도가 상이하게 변하더라도 센서로서 높은 유효성을 얻을 수 있었다. 또한 교반 유무에 따라 환원피크가 변하여 전하량의 차이가 나타났지만, 교반이 일정한 경우에는 TRC 농도와 전하량의 상관성은 매우 높게 측정되었다.
Pt전극은 TRC의 농도범위에 영향을 거의 받지 않아 r2= 0.960으로 신뢰도가 매우 높게 나온 반면, Au전극의 경우 TRC 농도 1.0 ppm 이하에서 전하량과의 상관성은 r2 = 0.767로 센서로 사용하기에는 부적합 것으로 생각되어진다. TRC 농도 검출의 높은 정확성을 위하여 필요한 분석시간은 Pt전극이 14초, Au전극이 22초 소요되어 반응속도 측면에서도 Pt전극이 더 우수하였다.