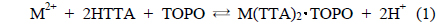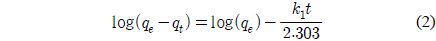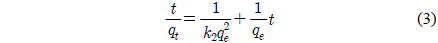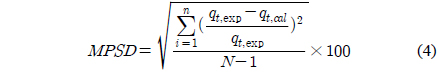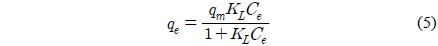테노일트리플루오로아세톤(thenoyltrifluoroacetone, HTTA)과 트리옥틸포스핀옥사이드(trioctylphoshineoxide, TOPO)를 폴리비닐알콜(poly vinyl alcohol, PVA)로 고정화한 PVA 겔 비드를 제조하고, 이를 사용하여 수중의 Cu2+를 제거하였다. 제조한 PVA 겔 비드의 Cu2+ 제거특성은 유사 2차 속도식에 잘 적용되었으며, 랑미어 등온식에서 구한 Cu2+의 최대 제거량은 9.59 mg/g이었다. Cu2+ 제거의 최적 pH 범위는 pH 3.5~6이었다. PVA겔 비드를 5차례 재사용한 경우에도 추출제의 손실이나 PVA겔 비드의 손상은 관찰되지 않았다.
PVA gel beads were made by immobilization of thenoyltrifluoroacetone (HTTA) and trioctylphoshineoxide (TOPO) with poly vinyl alcohol (PVA). The prepared PVA gel beads were used for the removal of Cu2+ from aqueous solution. The removal characteristics of Cu2+ by PVA gel beads was found to follow the pseudo-second-order kinetic equation. The maximum removal capacity calculated from Langmuir isotherm equation was 9.59 mg/g. The optimal pH was in the range of 3.5~6. Even when the PVA gel beads were reused 5 times, the leakage of extractant and the damage of PVA gel beads was not observed.
많은 산업 분야에서 폐수 중의 유용 금속들을 회수하거나 분리하기 위해 많은 노력을 기울이고 있으며, 일반적으로 유용 금속을 회수하기 위해서 용매 추출공정이 사용되고 있다[1]. 하지만 용매 추출공정은 많은 양의 유기 용매를 사용하게 되며, 공정이 복잡해진다. 또한 용매와 용액을 분리하는 과정에서 유기 용매 및 추출제가 손실되어 환경오염, 불쾌한 악취 및 화재의 원인이 되기도 한다[2].
이로 인하여 많은 연구자들에 의해 추출제를 함침시키거나 캡슐화하여 사용하는 연구가 시도되고 있다. Kabay et al.[3]은 추출제인 Aliquat 336을 이온교환수지 HP-20과 HP-2MG에 함침시켜 수중의 Cr(VI)을 제거하는 연구를 행하였으며, Juang and Lee[4]는 추출제인 디-2-에틸헥실 포스포릭산(di-2-ethylhexylphosphoric acid, D2EHPA)을 이온교환수지 Amberlite XAD에 함침시켜 Zn(Ⅱ) 및 Cu(Ⅱ)를 제거하는 연구를 수행하였다. 하지만 추출제를 수지에 함침시켜 사용하는 경우에는 고분자 수지의 체인망에 가두어져 있는 추출제가 지속적으로 손실되면서 추출능이 떨어지게 되는 단점이 있다[5]. Trochimczuk et al.[6]은 추출제인 Aliquat 336을 이온교환수지 Amberlite XAD-4에 함침시킨 후, 다시 폴리비닐알콜(poly vinyl alcohol, PVA)로 표면을 코팅한 결과 추출제가 유출되지 않았다고 하였다. 그러나 이 경우 추출제를 함침시킨 후 다시 코팅하는 공정을 거쳐야 하기 때문에 공정이 복잡해지는 단점이 있다.
PVA는 hydroxide group을 많이 가지고 있는 친수성 고분자 물질로 쉽게 분해되지 않으며, 산에 대한 내구성이 높은 물질로 알려져 있다[2,7]. 본 연구자들은 선행연구[8]에서 추출제인 테노일트리플루오로아세톤(thenoyltrifluoroacetone, HTTA)와 트리옥틸포스핀옥사이드(trioctylphoshineoxide, TOPO)를 PVA내에 고정화한 고상추출제를 제조하고, 이를 이용하여 Sr2+을 효과적으로 제거하는 결과를 얻었다. 추출제 HTTA와 TOPO에 의한 2가 금속의 추출은 HTTA 2분자와 TOPO 1분자간의 시너지 효과에 의한 것으로 알려져 있다[9].
따라서 본 연구에서는 HTTA와 TOPO를 고정화한 고체상 추출제인 PVA 겔 비드를 제조하고, 제조된 PVA 겔 비드에 의한 Cu2+의 제거 특성을 검토하였다. 또한 속도모델, 등온식, pH의 영향, PVA 겔 비드를 반복 재사용시의 Cu2+의 제거능 변화에 대해 연구하였다.
실험에 사용한 시약인 HTTA, TOPO 및 PVA는 Sigma-Aldrich로부터 구입하여 사용하였다. 그 외의 시약은 알긴산 나트륨(sodium alginate, Samchun, EP), 자일렌(xylene, Samchun, EP), 염화칼슘(CaCl2, Shinyo pure chemicals Co, EP), 수산화나트륨(NaOH, Shinyo pure chemicals Co, GR), 붕산(boric acid, Shinyo pure chemicals Co, GR)을 사용하였다.
Cu2+ 용액은 황산구리 5수화물(CuSO4・5H2O, Junsei, EP)을 초순수(Milli-Q Millipore 18.2 Mcm−1 conductivity)에 녹여 1,000mg/L의 stock solution을 제조하여 사용하였다.
본 연구에서 사용한 PVA 겔 비드는 선행연구[8]에서와 같은 방법으로 합성하였다. 50 mL의 초순수에 4 g의 PVA와 0.675g의 알긴산 나트륨를 넣은 후 90 ℃ 항온조에서 용해시켰다. 그런 다음에 4 mL의 자일렌에 HTTA 0.44 g과 TOPO 0.44g을 녹인 용액과 혼합하였다. 혼합된 이 용액을 기계식 교반기(Global lab, S-10)를 이용하여 500 rpm으로 1 h 동안 교반한 다음에 주사기를 이용하여 3% CaCl2가 들어 있는 붕산포화용액에 방울방울 떨어뜨려 24 h 동안 경화시켰다. 이렇게하여 만들어진 PVA 겔 비드를 초순수로 수차례 세척하여 실험에 사용하였다.
Cu2+의 제거실험은 회분식으로 진행하였다. 500 mL 삼각플라스크에 일정 농도의 Cu2+용액 200 mL에 PVA 겔 비드를 3g 투입하였다. 그 후 수평진탕기(Johnsae Co. Js-Fs-2,500)를 사용하여 150 rpm에서 교반하면서 일정시간 간격으로 시료를 채취하여 원심분리기(Eppendorf, Centrifuge 5415c)로 10,000rpm로 5 min 동안 원심 분리한 후 상등액을 분석에 사용하였다. Cu2+의 농도는 원자흡광광도계(Shimadzu, AA-7,000)를 사용하여 분석하였다. 용액의 pH는 0.1 M NaOH와 0.05 M H2SO4를 사용하여 조절하였으며, pH 미터(Istek, AJ-7,724)를 이용하여 측정하였다. 재사용 실험은 사용한 PVA 겔 비드 3g을 2 M HNO3 200 mL에 넣고 150 rpm에서 300 min 동안 교반시켜 Cu2+를 회수한 후에 재사용하기 전과 같은 방법으로 실험을 수행하고 제거량을 구하였다.
일반적으로 추출제 HTTA와 TOPO에 의한 2가 금속(M2+)의 추출반응은 식 (1)과 같다[9].
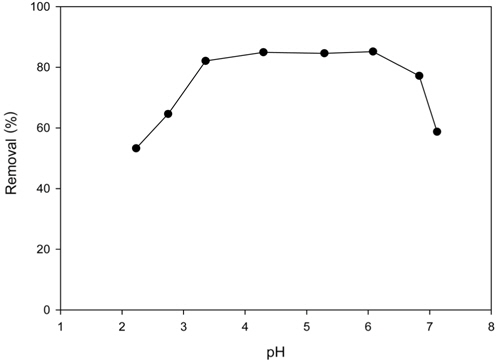
Figure 1은 Cu2+용액의 pH를 2~7로 변화시킨 경우에 제거능 변화를 나타낸 것이며, Figure 2는 화학평형모델 프로그램인 Visual MINTEQ (Ver 3.0)을 사용하여 pH에 따라 형성되는 Cu 이온종들의 분포를 나타낸 것이다. Figure 1에서 보듯이 pH 3.5~6에서는 80%의 제거율을 보였으나, pH 3.5 이하에서는 제거효율이 감소하였다. 이는 pH가 감소함에 따라 많은 양의 수소이온이 존재하게 되므로 이들 수소이온이 Cu2+에 대하여 경쟁 이온으로 작용할 뿐만 아니라, 식 (1)과 같이 반응이 정방향으로 일어나지 않기 때문에 제거율이 낮아지는 것으로 사료된다[10].
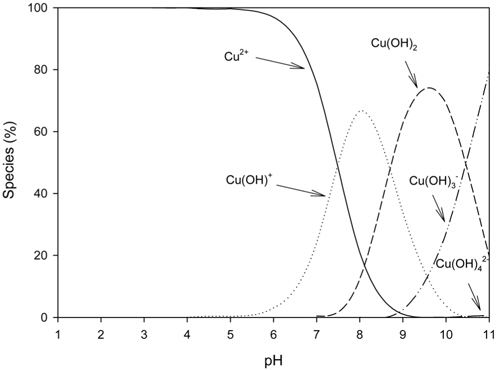
한편, pH 6 이상에서는 제거율이 급격히 감소하였는데, 이는 Figure 2에서 보는 바와 같이 pH 6 이하에서는 Cu2+가 자유이온의 상태로 존재하지만 pH가 높아짐에 따라 Cu(OH)+형태의 착이온과 Cu(OH)2, Cu(OH)3− 및 Cu(OH)42−와 같은 수화물형태로 존재하기 때문으로 사료되었다. 따라서 차후 실험은 pH 5에서 수행하였다.
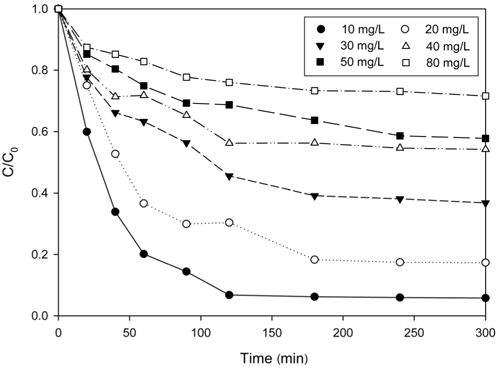
Figure 3은 Cu2+ 용액의 초기 농도를 달리하여 운전한 경우에 PVA 겔 비드에 의한 Cu2+의 농도변화를 나타낸 것이다. 그림에서 보는 바와 같이 Cu2+의 제거는 초기 60 min 동안에는 매우 빠르게 진행되며, 120 min 이후부터 점차 제거가 천천히 이루어지다가 300 min에서 평형에 도달하였다.
PVA 겔 비드를 이용한 Cu2+ 제거 실험자료를 유사 1차 속도식과 유사 2차 속도식에 적용하여 비교하였다. 유사 1차 속도식은 다음과 같이 표현된다[11].
여기서 t는 운전시간(min), qt는 t에서의 Cu2+의 제거량(mg/g), qe는 Cu2+의 평형 제거량(mg/g), k1은 유사 1차 속도상수(l/min)를 나타낸다.
유사 2차 속도식은 다음과 같다[11].
여기서 k2는 유사 2차 속도상수(g/mg·min)이다.
검토된 흡착속도 모델식들을 평가하기 위하여 오차함수인 Marquardt의 퍼센트 표준편차(Marquardt’s percent standard deviation, MPSD)를 사용하여 각각의 흡착 속도 모델식에 적용하였으며, MPSD는 다음과 같이 표현된다[11].
여기서 N은 실험 데이터들의 갯수, qt,exp는 실험으로부터 구한 제거량(mg/g), qt,cal는 계산하여 구한 제거량(mg/g)이다.
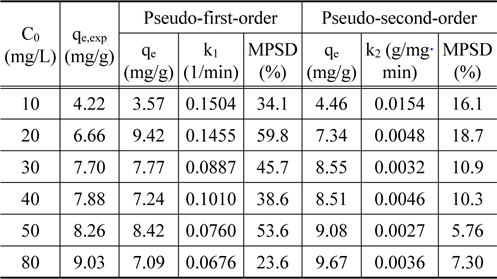
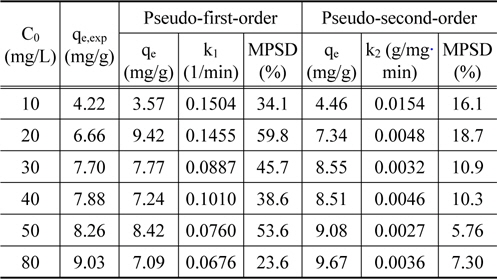
Figure 3에 주어진 실험 결과들을 식 (2)~(4)에 적용하여 구한 파라미터 값들을 Table 1에 정리하여 나타내었다. Table 1에서 MPSD의 값을 비교해보면, 유사 2차 속도식의 경우에는 5.76~18.7%인데 비하여 유사 1차 속도식의 경우에는 23.6~59.8%로 Cu2+의 흡착 속도는 유사 2차 속도식에 보다 잘 만족하였다. Cu2+의 농도가 증가함에 따라 평형 제거량이 증가하였는데, 이는 농도가 증가함에 따라 물질전달 구동력인 농도차가 증가함에 의한 것으로 판단된다.
[Table 1.] Pseudo-first-order and pseudo-second-order kinetic parameters
Pseudo-first-order and pseudo-second-order kinetic parameters
Langmuir 등온식은 다음과 같이 표현된다[9].
여기서 Ce는 Cu2+의 평형농도(mg/L), qm은 Cu2+의 최대 제거량(mg/g), KL은 Langmuir 상수(L/mg)이다.
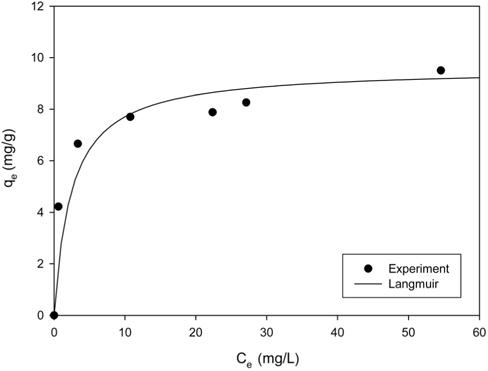
Figure 4는 Cu2+ 평형 농도와 PVA 겔 비드에 제거된 Cu2+의 평형 제거량의 관계를 나타낸 것으로, 그림에서 실선은 실험 자료를 식 (5)에 적용하여 계산한 결과이다. 이때 R2 값은 0.9745로 실험 결과는 Langmuir 등온식에 잘 부합하였다. Langmuir 등온식에서 구한 KL은 1.33 L/mg이며, qm은 9.59 mg/g이었다. 이 결과를 Ciopec et al.[12]이 추출제인 D2EHPA를 polysulfone으로 고정화한 마이크로캡슐을 사용한 경우에 Cu2+의 제거량이 2.8 mg/g인 것과 비교해보면, 본 연구에서 제조한 PVA 겔 비드의 경우에 더 높은 제거량을 보였다. 이는 본 연구에서 고정화에 사용한 PVA는 붕산과 가교결합을 통해 많은 기공을 가진 구조를 형성할 뿐만 아니라 친수성 고분자이기 때문에 polysulfone을 사용한 경우보다 용액의 유동이 원활한 특성을 가지고, 또한 추출제의 첨가량이 3배 이상 많기 때문으로 생각된다.
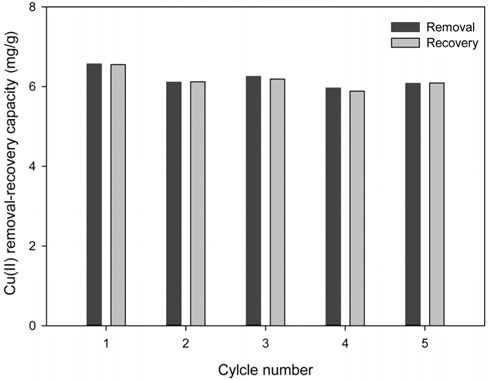
PVA 겔 비드의 재사용가능성을 살펴보기 위해 Cu2+의 농도가 20 mg/L인 조건에서 재사용실험을 5차례 반복하여 수행한 결과를 Figure 5에 나타내었다. 그림에서 보듯이 PVA 겔비드에 의한 Cu2+의 제거량은 약 6.2 mg/g으로 재사용하기 전과 후의 제거량과 회수량은 초기값의 약 95% 이내의 수준으로 거의 변화가 없는 것으로 나타났다. 또한 PVA 겔 비드를 5차례 반복하여 사용하는 과정에서도 PVA 겔 비드내의 추출제의 손실이 육안으로 관찰되지 않았으며, PVA 겔 비드의 손상도 발생하지 않으므로 반복 재사용이 가능한 것으로 사료되었다.
본 연구에서는 PVA를 이용하여 TOPO와 HTTA를 고정화한 PVA 겔 비드를 합성하였으며, 이를 사용하여 수중의 Cu2+을 제거하는 실험을 수행하였다. PVA 겔 비드에 의한 Cu2+의 제거는 pH 3.5~6 범위에서 용이하였다. PVA 겔 비드에 의한 Cu2+의 제거에서 평형도달 시간은 약 120 min이었으며, Cu2+의 제거속도는 유사 2차 속도식에 더 부합하였다. 평형 실험 결과는 Langmuir에 잘 적용되었으며, Cu2+의 최대 제거량은 9.59 mg/g으로 계산되었다. PVA 겔 비드를 5회까지 반복 사용한 경우에도 Cu2+ 제거량의 변화는 없었으며, 추출제의 손실도 없었다. 따라서 HTTA와 TOPO를 고정화한 고체상 추출제인 PVA 겔 비드는 액상으로부터 Cu2+ 제거에 적용이 가능할 것으로 기대된다.