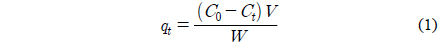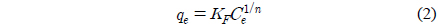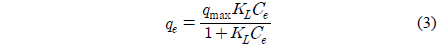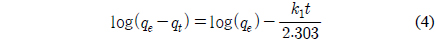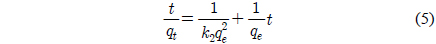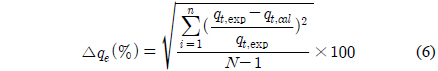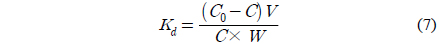In this study, PU-LMO was made by immobilization of LMO on urethane foam (PU) with using an EVA as a binder. PU-LMO was characterized by using X-Ray Diffractometer (XRD) and Scanning Electron Microscopy (SEM). The optimal ratio of EVA/LMO for preparation of PU-LMO was 0.26 gEVA/gLMO. The adsorption of lithium ions by PU-LMO was found to follow the pseudo-second-order kinetic model. The equilibrium data fitted well with Langmuir isotherm model and the maximum removal capacity of lithium ions was 17.09 mg/g. The PU-LMO was found to have a remarkably high selectivity of lithium ions and high adsorption capacity because the distribution coefficient (Kd) of lithium ion was higher than those of other metal ions.
리튬은 전 세계적으로 매장량이 극히 적은 희귀 금속중의 하나로 2차 전지, 항공기용 경합금의 원료, 핵융합 발전용 연료 등과 같은 여러 분야에서 사용되면서 그 수요가 증가하고 있다[1]. 육상에 매장되어 있는 리튬의 매장량은 약 400만 톤으로 추정되나, 지역적으로 편중이 심하다[2]. 반면에 해수 중에 존재하는 리튬의 양은 2,300억 톤으로 육상 매장량의 약6만 배[3]에 달하는 막대한 것으로 알려져 있다. 그러나 해수에 용존 되어 있는 리튬이온의 농도는 극히 낮기 때문에 해수로부터 리튬을 회수하기 위해서는 미량으로 존재하는 리튬이온의 효율적인 회수가 중요하다.
수중의 리튬을 회수하기 위하여 공침법[3], 용매추출[4], 흡착[5,6] 등의 다양한 방법들이 시도되고 있다. 하지만 공침법은 다량의 슬러지 발생과 금속이온을 선택적으로 제거하는데 한계가 있으며, 용매 추출의 경우에는 많은 양의 유기 용매가 필요로 할 뿐만 아니라 유기 용매가 손실하게 되면 환경오염, 불쾌한 악취 및 화재의 원인이 되기도 한다[7]. 이에 비해 흡착법은 공정이 간단하며 효율적이기 때문에 활성탄, 제올라이트, 이온교환수지, 리튬망간산화물(lithium manganese oxide, LMO) 등과 같은 다양한 흡착제를 이용하여 리튬이온을 회수하는 흡착연구가 되고 있다. Seron et al.[5]은 활성탄을 사용하여 리튬이온을 흡착시킨 경우에 흡착량이 1.0 mg/g이었다고 하였으며, Navarrete et al.[8]은 제올라이트로 리튬이온을 흡착시 흡착량이 3.2 mg/g, 이온교환수지를 사용한 경우에 리튬이온 흡착량은 10.5 mg/g이었다고 하였다[9]. 본 연구자들은 선행연구[6]에서 LMO를 사용하여 리튬이온을 흡착시키는 연구에서 흡착량이 27 mg/g인 결과를 얻었다. LMO는 일반적으로 LixMnyOz의 형태를 가지며, 이를 산 처리하게 되면 LMO 격자에서 리튬이온이 용출되어 이온체의 형태가 되면서 리튬이온에 대해서 높은 선택성과 흡착량을 보인다. 그러나 LMO는 미세한 분말 형태이기 때문에 공정을 통하여 유출될 수 있으며, 컬럼에 충전하여 사용할 경우에는 압력강하를 일으킬 수 있다[10,11].
이에 따라 최근에는 LMO를 다공성 물질에 함침시키거나 고정화하여 사용하는 연구가 이루어지고 있다. Onodera et al. [12]은 실리카 비드에 LMO를 함침하여 사용하였지만 리튬 흡착량은 2.0 mg/g으로 매우 낮았다. 또한. Umeno et al.[13]은 PVC를 사용하여 LMO를 고정화시킨 멤브레인 형태의 흡착제를 제조하여 사용한 경우에 리튬 흡착량은 약 16 mg/g이었다고 하였다. Ma et al.[11]은 피치 바인더를 사용하여 LMO를 폴리우레탄(polyurethane, PU)에 부착하여 사용한 경우에 흡착량은 3.83 mg/g (C0 = 700 mg/L)이라고 하였다. 폴리우레탄은 화학적, 기계적으로 매우 안정하고, 가공이 용이할 뿐만 아니라 다양한 공극 구조를 가지고 있어 우수한 담체[14]이다. 그러나 Ma et al.[11]과 같이 폴리우레탄에 LMO를 부착시키는데 많은 양의 피치 바인더를 사용하기 때문에 바인더인 피치가 LMO의 활성점을 막아 흡착량을 감소시키는 문제점이 있으므로. 본 연구에서는 피치바인더 대신에 에틸렌 비닐 아세테이트(ethylene vinyl acetate, EVA)를 바인더로 사용하여 LMO를 고정화하고자 한다. 널리 사용되고 있는 바인더 중의 하나인 EVA는 점성과 탄성을 동시에 가지고 있어 종이나 목재 등의 다양한 물질에 접착제로 사용이 되고 있으며, 수용성이기 때문에 작업에 용이하다는 장점을 가지고 있다[15,16]. 피치 바인더 대신에 이와 같이 높은 접착력을 가진 EVA를 바인더로 사용하는 경우에는 폴리우레탄에 고정된 LMO가 유출하는 현상을 방지할 수 있고, 해수와 같은 물의 유동이 심한 환경에 적용이 가능할 것으로 사료된다.
따라서 본 연구에서는 EVA를 바인더로 사용하여 다공성구조를 가진 폴리우레탄 폼에 LMO를 고정화한 새로운 흡착제인 PU-LMO를 제조하고, XRD와 SEM을 이용하여 특성분석을 하였다. 또한 제조한 PU-LMO를 흡착제로 사용하여 리튬이온 흡착시에 흡착 등온식 및 흡착 속도식에 대해 검토하고 공존하는 염의 영향에 대해 고찰하였다.
본 연구에서 사용한 LMO는 선행연구[5]에서와 같은 방법으로 합성하였다. 탄산망간(MnCO3, Samchun, EP) 1.67 mol과 탄산리튬(Li2CO3, Samchun, EP) 1.33 mol을 20 mL 에탄올에 넣고 12 h 동안 혼합하였다. 70℃ 건조기에서 12 h 건조한 뒤 500℃ 전기로(Thermolyne, F-62700)에서 4 h 동안 소성하여 LMO을 합성하였다.
EVA (810F, Smitomo, Japan)와 증류수를 1:1 비율로 혼합한 용액에 합성한 LMO 5 g을 추가하여 혼합한 다음에 30 mm × 20 mm × 10 mm로 자른 폴리우레탄 폼(PU, UH100)에 담지한 후 상온에서 12 h 건조하여 PU-LMO를 제조하였다. X선 회절 분석기(X-ray diffractometer, XRD, D/MAX2100H, Rigaku)를 사용하여 XRD 분석을 하였으며, 표면특성은 주사전자현미경(scanning electron microscopy, SEM, XL20, Philips)을 이용하여 관찰하였다.
리튬이온의 흡착실험은 회분식으로 행하였다. 500 mL 삼각플라스크에 일정농도의 리튬이온 용액 200 mL와 일정량의 PU-LMO를 넣은 다음에 수평진탕기(Johnsae Co. Js-Fs-2,500)를 사용하여 48 h 동안 교반하면서 일정시간 간격으로 시료를 채취하였다. 채취한 시료는 원심분리기(Eppendorf, centrifuge 5415c)를 사용하여 10,000 rpm으로 5 min 동안 원심 분리한 후 상등액을 취하여 분석에 사용하였다. 리튬이온의 농도는 이온크로마토그래피(ion chromatography, Dionex, DX-120)를 사용하여 분석하였다. 선행연구[6]에서 LMO로 리튬이온을 흡착시킨 경우에 적정 pH는 10으로 나타나 용액의 pH를 10으로 조절하여 실험을 실시하였다.
흡착제에 흡착된 리튬이온의 흡착량은 아래 식을 이용하여 계산하였다.
여기서 qt는 시간 t에서의 리튬이온의 흡착량(mg/g), C0는 초기 리튬이온의 농도(mg/L), Ct는 t시간 후의 리튬이온의 농도(mg/L)이며, V는 리튬이온 용액의 부피(L), W는 사용한 흡착제의 양(g)이다.
Figure 1은 폴리우레탄과 PU-LMO의 표면을 SEM 촬영하여 나타낸 것이다. Figure 1(a)는 폴리우레탄의 표면사진이며, Figure 1(b)는 EVA를 이용하여 LMO를 부착시킨 PU-LMO의 표면사진이다. Figure 1(b)에서 보듯이 EVA에 의해 LMO가의 고정되면서 표면이 거칠게 된 것을 관찰할 수 있었으며, 5,000배로 확대한 Figure 1(c)에서는 EVA에 의해 고정되어 있는 LMO 입자들을 확인할 수 있었다.
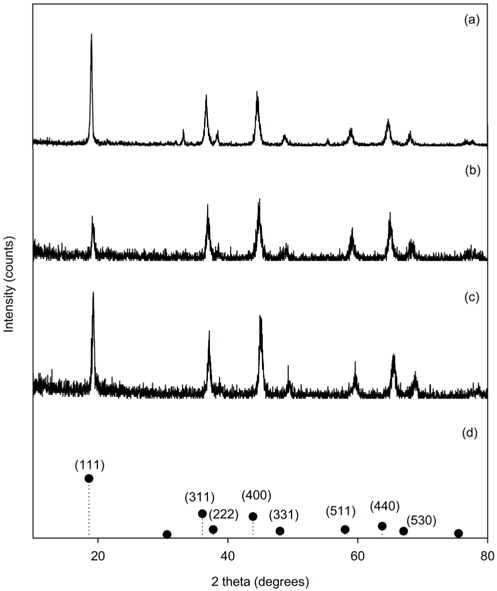
Figure 2는 LMO, PU-LMO, 그리고 PU-LMO를 산 처리한 경우의 XRD 분석 결과를 나타낸 것이다. Figure 2(a)는 LMO의 XRD 분석 결과로 (111), (311), (400)의 스피넬 결정면과 일치하는 19.08, 36.69, 및 44.52에서 회절 피크가 관찰되었다[17]. Figure 2(b)에서 PU-LMO의 XRD 분석결과를 보면 2θ값이 19.08, 36.88, 및 44.76에서 회절피크가 확인됨으로써 LMO가 EVA를 사용하여 폴리우레탄에 고정화된 후에도 LMO의 스피넬 구조 특성이 유지되며, Figure 2(c)에서 PU-LMO를 산처리한 경우의 XRD 분석결과를 보면 산 처리한 뒤에도 스피넬 구조가 유지되는 것을 알 수 있었다.
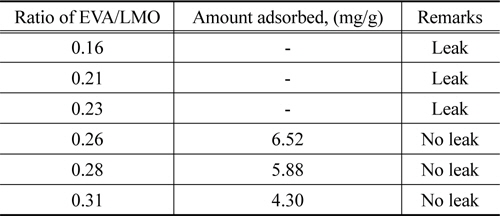
Table 1은 리튬 EVA/LMO의 비율을 0.16~0.31로 달리하여 PU-LMO를 제조한 경우에 LMO의 유출 유무와 리튬이온의 흡착량을 살펴본 결과를 나타낸 것이다. EVA/LMO의 비율이 0.16~0.23인 경우에는 바인더의 함량이 작아 LMO가 잘 고정되지 못하여 유출되었으나, EVA/LMO의 비율이 0.26 이상인 경우에는 LMO가 유출되지 않았다. 한편 EVA/LMO의 비율이 0.26~0.31로 증가함에 따라 리튬이온 흡착량은 6.52~4.30mg/g으로 감소하였는데, 이는 EVA의 함량이 증가하면서 LMO의 활성점을 막아 흡착을 방해하기 때문으로 사료되었다. 따라서 리튬이온 흡착실험은 EVA/LMO의 비율를 0.26으로 하여 제조한 PU-LMO를 사용하여 실험을 진행하였다. Ma et al.[10]의 피치를 바인더로 사용한 경우에 피치/LMO의 비율이 3인 것과 비교하면 본 연구에서 사용한 바인더의 양이 약10배 이상 적게 사용되었다.
[Table 1.] Synthetic conditions of PU-LMO
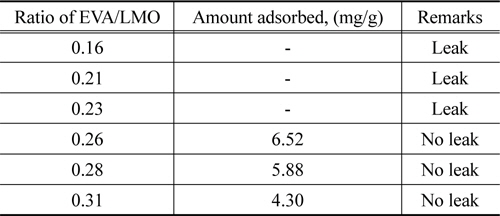
Synthetic conditions of PU-LMO
등온 흡착실험에서 얻어진 실험 데이터를 Freundlich 등온식과 Langmuir 흡착 등온식에 적용하여 검토하였다.
Fruendlich 흡착 등온식은 다음과 같다.
여기서 KF는 Freundlich 상수(L/mg)이며, qe은 평형 흡착량(mg/g) 그리고 1/n은 흡착강도를 나타내는 상수이다.
Langmuir 흡착 등온식은 다음과 같다.
여기서 KL는 Langmuir 상수(L/mg) 그리고 qmax은 최대 흡착량(mg/g)이다.
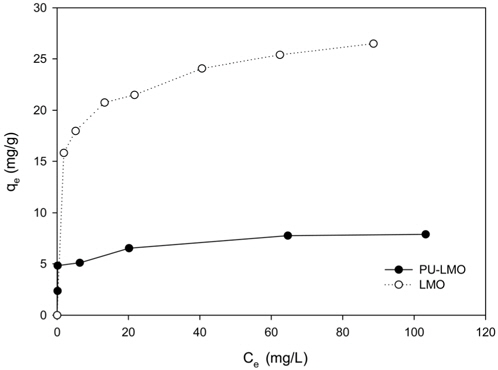
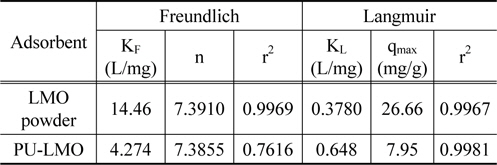
Figure 3은 분말 LMO와 PU-LMO의 리튬이온 흡착량을 비교하기 위하여 등온 흡착 실험을 행한 결과를 나타낸 것이다. 그림에서 보이는바와 같이 평형농도가 증가함에 따라 평형흡착량은 증가하다가 일정 농도 이후에서는 흡착량이 일정해지는 경향을 보였다. Figure 3의 자료를 식 (2)와 (3)에 적용하여 구한 파라미터 값들을 Table 2에 나타내었다.
[Table 2.] Freundlich and Langmuir isotherm parameters for the adsorption of lithium ions
Freundlich and Langmuir isotherm parameters for the adsorption of lithium ions
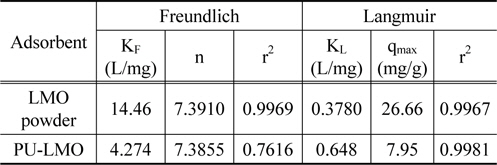
Table 2에서 보듯이 LMO 분말과 PU-LMO의 결정계수(r2)의 값은 Freundlich 흡착 등온식의 경우 0.7616~0.9769인데 비하여 Langmuir 흡착 등온식의 경우는 0.9967~0.9981로 Langmuir 흡착 등온식에 더 잘 부합하였다. Langmuir 흡착 등온식으로부터 구한 리튬 이온의 최대 흡착량(qmax)은 LMO 분말의 경우26.66 mg/g이며, PU-LMO의 경우는 7.95 mg/g으로 PU-LMO의 경우에 흡착량이 낮았다. 이는 PU-LMO의 경우 바인더로 사용된 EVA가 LMO의 활성점을 막기 때문에 분말상태의 LMO에 비해 흡착량이 감소한 것으로 사료된다. 그러나 Ma et al.[10]의 피치 바인더로 LMO를 우레탄에 부착하여 사용한 경우의 리튬 이온 흡착량이 3.83 mg/g (C0 = 700 mg/L)인 것과 비교해 보면, 본 연구에서 EVA를 바인더로 합성한 PU-LMO의 경우의 리튬이온 흡착량이 약 2배 정도 높은 결과를 보였다. 이는 Ma et al.[11]의 연구에 비해 바인더 사용량이 10배 정도 적게 사용되었기 때문으로 사료된다.
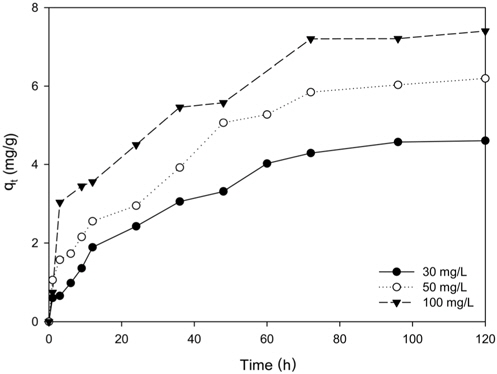
Figure 4는 리튬이온의 농도가 30 mg/L, 50 mg/L, 100 mg/L인 경우에 PU-LMO에 의한 리튬이온의 흡착량 변화를 나타낸 것이다. 그림에서 보이는 바와 같이 PU-LMO에 의한 리튬이온의 흡착은 72 h까지는 빠르게 흡착이 이루어지다가 약 120h에서 농도변화가 5% 이내가 되었다. 따라서 이 시간을 흡착이 평형에 도달한 평형 도달시간으로 간주하였다. 초기 리튬이온의 농도가 30 mg/L 경우에 리튬이온 흡착량은 5.01 mg/g이었으며, 50 mg/L인 경우에는 6.53 mg/g, 그리고 100 mg/L에서는 7.59 mg/g으로 농도가 증가함에 따라 리튬이온의 흡착량이 증가하는 것을 그림에서 볼 수 있다. 이는 농도가 증가함에 따라 흡착 구동력인 농도차가 증가하기 때문으로 사료되었다. 한편, Ma et al.[11]이 피치바인더로 폴리우레탄에 LMO를 부착하여 사용한 경우에 흡착 평형시간이 24 h으로 본 연구에서 EVA를 바인더로 사용한 경우보다 흡착평형 도달시간이 짧았는데, 이는 피치바인더에 비해 EVA가 접착력은 높으나 물의 유통성이 낮기 때문으로 사료된다. 그러나 Umeno et al.[13]이 PVC를 사용하여 LMO를 고정화한 멤브레인을 사용한 경우에 흡착 평형시간은 약 15 d (360 h)인 것과 비교할 경우에는 흡착평형에 도달하는 시간이 빠른 것으로 나타났다.
Figure 4의 흡착 실험데이터를 유사 1차 속도식과 유사 2차 속도식에 적용하여 검토하였다.
유사 1차 속도식은 다음과 같다[15].
여기서 k1은 유사 1차 속도식의 속도상수(1/h)이다.
유사 2차 속도식은 다음과 같다[15].
여기서 k2은 유사 2차 속도식의 속도상수(g/mg·h)이다.
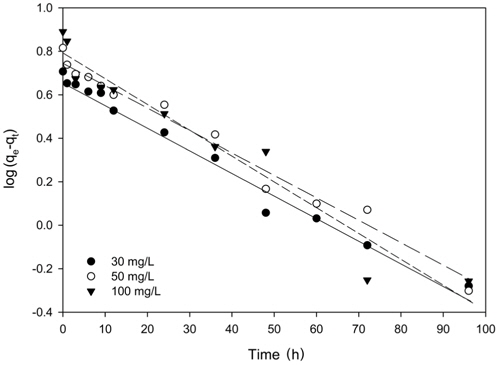
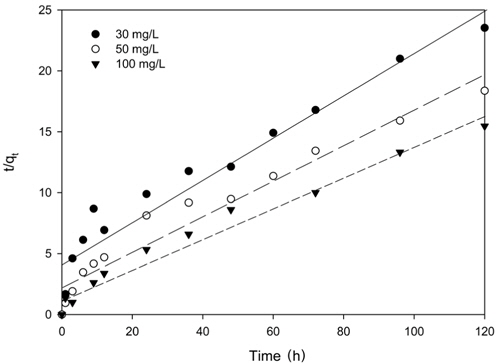
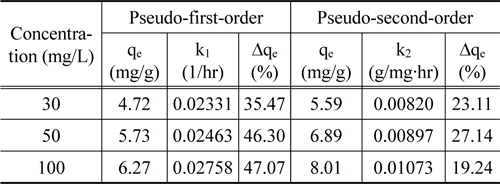
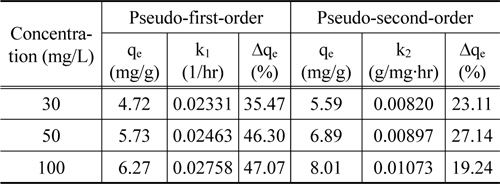
Figure 4의 흡착 실험 자료를 식 (4)과 (5)에 적용한 결과를 각각 Figure 5와 6에 나타내었으며, 이로부터 구한 파라미터 값들을 Table 3에 정리하였다. Table 3에서 △qe (%)는 아래와 같이 정의된다[15].
[Table 3.] Kinetic parameters for the adsorption of lithium ions
Kinetic parameters for the adsorption of lithium ions
여기서 N은 실험 자료의 수, qt,exp는 실험으로부터 구한 흡착량(mg/g), qt,cal는 속도식에서 계산한 흡착량(mg/g)이다.
Table 3에서 보듯이 유사 1차 속도식의 경우 △qe 값은 34.94~47.07%이었으며, 유사 2차 속도식의 경우는 19.24~27.56%로 리튬이온의 흡착 속도는 유사 1차 속도식 보다는 유사 2차 속도식에 잘 만족하였다.
해수내의 많이 존재하는 Na+, K+, Mg2+ 및 Ca2+이 Li+와 공존하는 경우의 리튬 이온 흡착 특성을 살펴보기 위하여 리튬이온과 각 이온들의 농도를 각각 1.5 mmol/L로 하여 실험을 실시하였다.
분배계수(Kd)는 용액내에 존재하는 금속이온과 흡착제 내금속이온의 분배 정도를 나타내며 다음과 같다[18].
식 (7)에서 구한 Kd의 값은 리튬이온이 1.11 L/g인 반면에 Na+ 0.05 L/g, K+ 0.03 L/g, Mg2+ 0.07 L/g 그리고 Ca2+ 0.27 L/g로 리튬이온이 다른 금속이온들에 비해 4~20배 이상 높은 수치를 보였다. 따라서 리튬이온이 다른 이온들에 비해서 PULMO내에 더 많이 흡착됨을 말해준다. 이러한 결과는 금속이온들의 이온 반경이 각각 Na+(1.02Å), K+(1.38Å), Mg2+ (0.72Å) 및 Ca2+(0.99Å)인데 비하여 리튬이온의 이온 반경이 0.76Å으로 작아 PU-LMO에는 Li+이 더 용이하게 흡착이 이루어지기 때문으로 사료된다[5]. 따라서 본 연구에서 제조한 PU-LMO는 다양한 금속이온이 포함된 용액에서도 리튬에 대한 선택성이 높은 것을 알 수 있었다.
본 연구에서는 EVA를 바인더로 사용하여 우레탄 폼에 LMO를 고정화시킨 새로운 흡착제 PU-LMO를 제조하였다. XRD분석과 SEM 사진을 통해서 EVA에 의해 LMO가 폴리우레탄에 잘 고정화된 것을 확인할 수 있었다. 폴리우레탄에 EVA로 LMO를 고정화시에 EVA/LMO의 최적 비율은 0.26이었다. 리튬이온 흡착실험 결과 흡착 속도는 유사 2차 속도식에 잘 부합하였으며, Langmuir 흡착 등온식에 잘 적용되었다. Langmuir 흡착 등온식으로부터 구한 최대 흡착량은 17.09 mg/g이었다. 또한 Na+, K+, Mg2+ 및 Ca2+의 공존이온이 존재시에 Li+의 분배계수는 1.11 L/g으로 다른 금속이온들에 비해 4~20배 이상 높은 수치를 보였다. 따라서 본 연구에서 제조한 PU-LMO는 Li+의 흡착능이 우수할 뿐만 아니라 Li+에 대한 높은 선택성을 가지진 흡착제로 사료된다.