



This study was aimed to develop catalytic system for the dry-based reduction of oxidized mercury (Hg2+) to elemental mercury (Hg0) which is one of the most important components comprising mercury continuous emission monitoring system (Hg-CEMS). Based on the standard potential in oxidation-reduction reaction, transition metals including Fe, Cu, Ni and Co were selected as possible candidates for catalyst proceeding spontaneous reduction of Hg2+ into Hg0. These transition metal catalysts revealed high activity for reduction of Hg2+ into Hg0 in the absence of oxygen in reactant gases. However, their activities were greatly decreased in the presence of oxygen, which was attributed to the transformation of transition metals by oxygen to the corresponding transition metal oxides with less catalytic activity for the reduction of oxidized mercury. Hydrogen supplied to the reactant gases significantly enhanced Hg2+ reduction activity even in the presence of oxygen. It might be due to occurrence of combustion reaction between H2 and O2 causing the consumption of O2 at such high reaction temperature at which oxidized mercury reduction reaction took place. Because the system showed high activity for Hg2+ reduction to Hg0, which was compatible to that of wet-chemistry technology using SnCl2 solution, the catalytic reduction system of Fe catalyst with the supply of H2 could be employed as a commercial system for the reduction of oxidized mercury to elemental mercury.
수은은 잔류독성이 크고 장기간에 걸쳐 인간과 동식물에 악영향을 주는 대표적인 중금속 오염물질의 하나이다[1-3]. 수은은 인체 및 생태계에 직·간접적인 영향을 미치는 신경독성 물질로서 생물의 성장장애 및 생물농축을 일으킨다. 특히, 원소 수은에 만성적으로 노출되면 신경과민, 흥분 및 떨림 현상이 나타나며, 원소수은으로부터 생성된 메틸수은에 만성적으로 노출되면 감각 이상 및 시력감퇴 등이 나타난다. 가장 대표적인 인위적인 수은 배출원은 석탄화력발전소로 수은 화합물의 장거리 이동성 때문에 수은은 지역적인 문제일 뿐만 아니라 전 지국적인 문제로 부각되고 있다[4-9]. 국가 간 인위적인 수은배출을 억제하기 위한 규제 방안으로 유엔환경계획(UNEP) 을 중심으로 각 국가의 산업시설별 수은 배출원 목록과 배출량 산정을 통해 자발적인 수은 배출원 관리 및 저감 방안 도출을 추진해 오고 있기 때문에 이의 근간이 되는 표준화된 수은농도 연속측정시스템 개발은 지속적인 관심의 대상이다[10,11].
수은 연속측정시스템은 수은 관련 연구와 수은 배출규제 준수를 위한 수은 농도 측정에 유용한 도구로서 각각 특징적인 장단점을 갖는 다양한 분석기가 사용된다. 가스상 수은 연속측정시스템에 사용되는 가장 보편적인 수은 검출기는 CVAAs (cold-vapor atomic absorption spectroscopy)와 CVAFs (cold-vapor atomic fluorescence absorption spectroscopy) 이다[12-16]. 그러나 CVAAs 나 CVAFs 검출기는 단지 원소수은(Hg0)만 측정 할 수 있기 때문에[17] 통상 석탄화력발전소 배기가스에 포함된 총 가스상 수은(원소수은+산화수은) 이나 수은 종 분석을 위해서는 산화수은(Hg2+)을 원소수은으로 전환하기 위한 전처리와 전환시스템이 요구된다. 따라서 전형적인 수은 연속측정시스템은 산화수은을 원소수은으로 환원시키는 전환시스템과 원 소수은의 농도를 측정하는 분석시스템(검출기) 2개 부분으로 구성된다. 수은 연속측정시스템 제작사나 연구자들은 측정 신뢰성과 안정성이 우수한 검출기와 전처리/전환시스템 개발에 노력을 기울이고 있지만 특히, 수은 종 분석을 위한 전처리/전환시스템 개발에 더 많은 관심과 노력이 모아지고 있다[10,11].
상업용 수은 연속측정시스템에 적용되고 있는 산화수은 환원기술은 SnCl2 수용액을 환원제로 하는 습식화학(wet-chemistry) 전환기술과 촉매를 이용하는 건식방법인 열촉매 환원기술로 대별된다. Table 1에는 산화수은 환원 기술의 장단점을 비교하여 정리하였다. 습식화학 전환시스템은 통상 SnCl2 수용액을 환원제로 사용하여 산화수은을 원소수은으로 전환시킨다. 습식화학 전환시스템은 갈탄(lignite)이나 아역청탄(subbitumious coal)을 연소하는 석탄화력발전소 배기가스에 함유된 수은 농도 분석에는 잘 작동한다. 그러나, 황성분이나 염소성분이 많은 역청탄을 연소하는 석탄화력발전소 배기가스의 경우 고농도의 SO2로 인해 생성되는 높은 농도의 SO3가 에어로졸 상태로 습식화학 시스템을 통과하면서 수은 종의 변화를 일으키거나 백필터(bagfilter)나 시료채집관(sample line)에 침적되어 수은 포집을 어렵게 하는 문제점을 갖고 있다. 또한 전처리/전환시스템으로 SnCl2를 사용할 때 SO2가 산화수은 환원을 방해하는 것으로 알려져 있어 SO2를 전처리로 제거해야 한다. 습식화학 전환 시스템은 어떤 형태의 수은분석기에도 적용될 수 있는 장점이 있다[8].
[Table 1.] Comparison of technologies for the reduction of oxidized mercury to elemental mercury
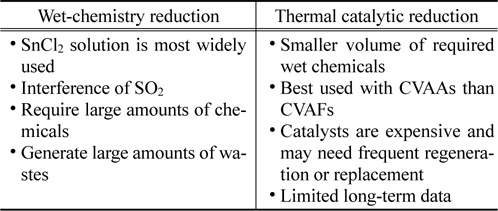
Comparison of technologies for the reduction of oxidized mercury to elemental mercury
열촉매 환원기술은 산화수은을 원소수은으로 환원시킬 수 있는 건식 촉매를 적용하는 기술이다. 현재까지 열촉매 환원시스템의 가장 큰 관심은 석탄화력보일러나 소각시스템과 같은 연소공정으로 배출되는 배기가스에 노출될 때 상대적으로 낮은 촉매 수명이다. 그러나 열촉매 환원시스템은 산성가스와 같은 간섭 가스를 반드시 제거할 필요가 없기 때문에 CVAFs보다 CVAAs 분석기에 잘 적용될 수 있는 장점이 있다.
본 연구는 전기전도도가 높아 산화수은을 원소수은으로 환원시킬 능력이 우수할 것으로 기대되는 전이금속의 산화수은에 대한 환원 활성을 검토하여 SnCl2 수용액을 환원제로 사용하는 기존의 습식화학 환원기술을 대체할 수 있는 건식 환원기술을 개발하기 위한 목적으로 수행되었다. 이를 위해 산화-환원 표준전위를 기준으로 산화수은의 원소수은으로의 환원반응에 대해 높은 활성이 기대되는 Fe, Cu, Ni 및 Co 4종류의 전이금속의 반응가스 조성을 중심으로 하는 반응조건에 따른 산화수은의 환원특성을 파악하였다. 또한 반응조건에 따른 이들 전이금속의 구조 변화를 XRD로 파악하고 반응조건에 따른 산화수은 환원 활성 변화의 원인을 규명하였다.
2.1.1. 반응시스템 구성 및 실험 방법
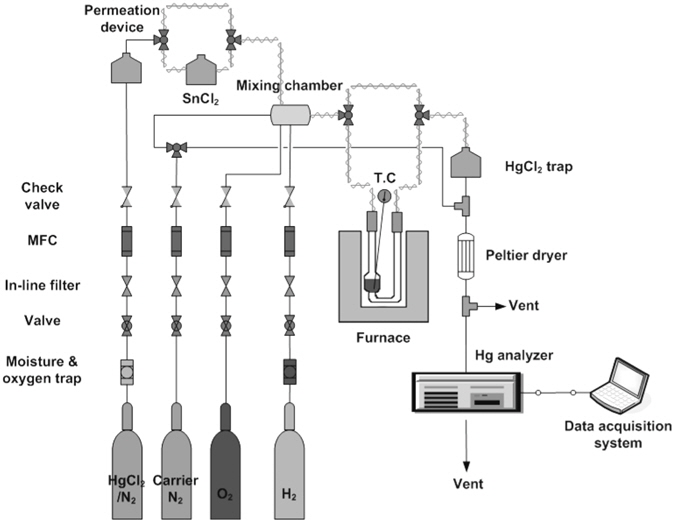
산화수은 건식 환원촉매 개발을 위해 본 연구에서 사용된 반응시스템은 Figure 1과 같다. 반응시스템은 반응에 필요한 반응가스를 공급하는 반응가스 주입부, 산화수은 환원촉매의 활성을 조사하기 위한 반응부, 반응 후 배기가스 중 수은농도를 측정하기 위한 분석부로 구성된다. 산화수은은 dynacalibrator (Model 150, VICl Metronics Inc.)에 HgCl2 permeation tube (Lot No. 130-008-0053-S56-U50, 370 ng/min at 50 ℃)를 넣고 고순도의 질소(99.999%)를 운반기체로 통과시켜 발생시켰다. 산화수은의 농도는 dynacalibrator의 chamber 온도를 조절하여 변경시켰다. 원소수은이나 산화수은이 함유된 가스에 노출되는 배관부분은 teflon 재질의 tube를 사용하였고 이들 물질이 배관에 흡착되는 것을 방지하기 위해 열선을 감아 170-180 ℃ 이상이 유지되도록 하였다. 반응기는 Quartz로 제작된 u-tube를 사용하였다. 반응기의 온도는 전기로로 조절하며 반응기에 열전대를 삽입하여 촉매층의 온도가 ±1 ℃로 유지되게 제어하였다. 반응 후 반응가스에 존재하는 산화수은(주로 HgCl2 형태)은 배관에 부착되거나 분석기의 구성품을 부식시킬 수 있으므로 순수가 담겨져 있는 임핀저(impinger)를 통과시켜 제거하였다. HgCl2 제거용 임핀저로부터 반응가스와 함께 유출되는 수분이 원소수은 측정에 미치는 영향을 없애기 위해 분석기 바로 전단에 열전소자(peltier)를 이용한 수분제거기를 설치하였다. 원소수은의 농도는 파장 253.7 nm에서 수은 원소의 공명흡수를 이용하여 원소수은 농도를 측정하는 CVAAs (Model VM 3000, Mercury Instruments Analytical Technologies)를 이용하여 측정하였다. 수은 농도는 PC를 이용한 data acquisition system을 통해 저장하고 관리하였다.
2.1.2. 건식 환원촉매의 환원반응 활성 측정 방법
산화수은 환원촉매의 활성은 SnCl2 수용액에 의한 환원 활성을 기준으로 평가하였다. 즉, 환원촉매 활성을 측정하기 위한 매 실험조건에서 dynacalibrator에 운반기체(99.999% N2) 200 cc/min를 통과시켜 HgCl2 permeation tube로부터 발생하는 산화수은 함유가스를 SnCl2 수용액에 통과시킨다. SnCl2 수용액에서 산화수은은 원소수은으로 환원되고 반응가스 중의 원소수은의 농도는 CVAAs를 이용한 수은 연속측정시스템에서 측정된다. 이때 SnCl2는 10 wt%의 수용액을 이용하였다. 산화수은은 SnCl2 수용액에 의해 100% 환원된다고 가정하고 이렇게 측정된 산화수은(원소수은의 농도와 동일) 농도는 건식 환원촉매의 산화수은 환원 성능 측정의 기준이 된다. SnCl2 수용액을 통과하는 산화수은 함유가스의 농도가 안정화되면 산화수소 함유가스를 촉매층으로 보내 촉매층의 온도변화에 따른 원소수은의 농도를 측정하여 각 온도에서 산화수은의 환원 활성을 조사하였다. 반응이 완료된 후에는 산화수은 함유가스를 SnCl2 수용액과 촉매층을 통과시키지 않고 원소수은의 농도를 측정하여 산화수은이 환원되지 않는 것을 확인하고 반응을 종료하였다.
반응기에 장착되는 건식 환원촉매는 1 g으로 하고 산화수은을 함유한 반응가스는 200 cc/min로 하였다. 이때 반응기에 주입되는 산화수은의 농도는 약 1,500 μg/m3 정도이다. 반응가스 조성으로 산소가 공급되는 경우 산소의 농도는 3%로 하였으며 수소가 공급되는 경우에 수소의 농도는 9%로 하고 모든 실험에서 질소를 운반기체로 하였다.
2.2. 산화수은 환원을 위한 건식 환원촉매의 물리적, 전기 화학적 물성
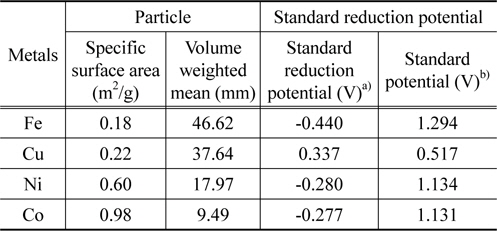
본 연구에서 산화수은의 원소수은으로의 환원촉매로 사용된 전이금속은 Fe, Cu, Ni 및 Co로 레이저 산란 방법(Mastersizer 2000, Malvern Instruments)을 통해 측정한 이들 전이금속의 평균 입자크기와 비표면적은 Table 2에 정리한 바와 같다. 4가지 전이금속은 비다공성 물질로 입자크기가 다르기 때문에 반응활성을 금속의 비표면적 기준으로 나타내기 위해 각 금속의 비표면적을 측정하였다. 4종의 전이금속에 대한 표준환원전위와 표준전위도 Table 2에 정리했다. 본 연구에서 산화수은의 환원 촉매로 적용된 4가지 전이금속의 산화수은의 원소수은으로의 환원에 대한 표준전위는 모두 0보다 큰 값을 갖는 것을 확인할 수 있다.
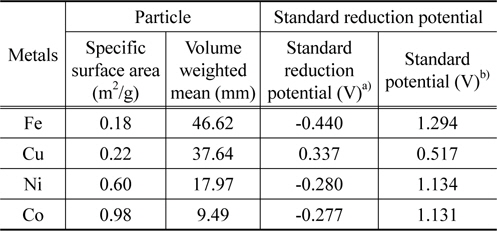
Physical and electrochemical properties of transition metals employed as reducing catalysts in this study
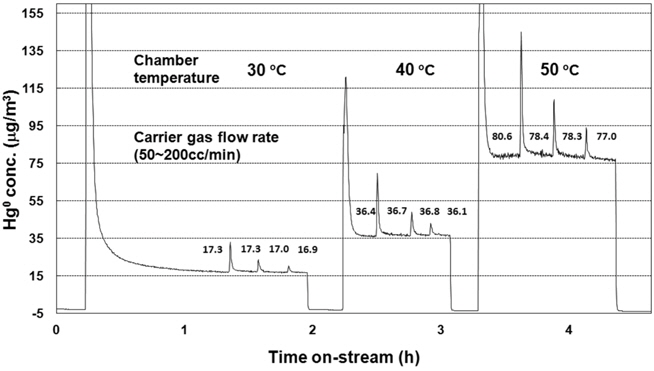
본 연구에서 제작된 산화수은 환원반응 시스템의 안정성을 확인하기 위해 원소수은 permeation tube를 사용하여 생성된 원소수은의 농도를 확인하였다. Figure 2는 permeation chamber 온도를 30-50 ℃ 범위로 설정할 경우 각 온도에서 운반기체(carrier gas) 유량에 따른 원소수은 생성 농도의 변화를 실시간으로 측정한 결과를 보여주고 있다. Permeation chamber에서 발생되는 가스 농도는 permeation tube가 들어 있는 chamber의 온도에 의해서 결정되는 특성을 갖고 있다. Figure 2에서 확인할 수 있듯이 각 온도에서 운반기체의 유량을 50-200 cc/min로 변화시켜도 생성되는 원소수은의 농도는 큰 차이가 없음을 확인하였다. 또한 permeation chamber의 온도가 증가함에 따라 생성되는 원소수은의 농도가 증가하여 permeation system의 특징에 잘 따름을 알 수 있다. 온도와 운반기체 유량에 따른 원소수은의 농도 측정의 응답 속도도 매우 빨라 본 연구에 적용된 장치의 안정성이 매우 높은 것을 확인할 수 있었다.
3.1. 산화수은 환원 촉매로서 전이금속의 가능성 검토
SnCl2 수용액에서 산화수은(Hg2+)의 원소수은(Hg0)으로의 환원은 반응 (1)에 의해 진행된다. Sn2+는 전자 2개를 내어 놓으면서 산화되고 Hg2+는 Sn2+이 내어 놓은 전자 2개를 받아 Hg0로 환원된다. 즉 Sn2+이 산화수은을 원소수은으로 환원시키는 환원제로 작용하는 것이다.
이러한 산화-환원 반응의 진행방향은 환원전위 개념으로 설명할 수 있다. 외부회로를 통해 전자가 흐르는 볼타전지의 전위는 환원음극과 산화양극의 반쪽전지에 의존한다. 이때 전자가 자발적으로 흐르게 하는 전위는 환원전위를 사용하며 이를 표준환원전위(standard reduction potential, Eo red)라 한다. 전지의 표준전위는 환원음극반응의 표준환원전위와 산화양극반응의 표준환원전위의 차이다(식 (2)).
볼타전지는 두 반쪽반응이 결합되어야 하며 각각의 반쪽반응 자체의 표준환원전위는 직접 측정할 수 없다. 그러나 어느기준 반쪽반응과 조합하여 그 기준전극에 대한 상대적 표준환원전위를 결정할 수 있는데 반응 (3)과 같이 H+(aq)가 H2(g)로되는 환원반응을 기준 반쪽반응으로 정하고 이 반응의 표준 환원전위를 0 V로 정의한다.
산화수은의 원소수은으로의 환원반응의 표준환원전위는 0.854 V로 표준환원전위가 0.854 V보다 작은 물질이 산화양극으로 작용할 경우 표준전위가 0보다 크기 때문에 자발적으로 산화수은을 환원시키는 환원제로 작용할 수 있다. Sn2+이 환원제로 적용될 경우 표준전위는 0.7 V로 SnCl2 수용액이 산화수은 환원제로 적용되는 것의 타당성을 확인할 수 있다.
표준전위 측면에서 보면 다양한 금속이 자발적으로 산화수은을 환원시킬 수 있다. 특히, 전자를 쉽게 내어주는 알칼리금속이나 알칼리토금속이 환원제로 작용했을 때 표준전위의 값이 커서 자발적인 반응에 의해 산화수은을 원소수은으로 환원시킬 수 있는 가능성이 매우 높다. 주기율표상 3주기와 4주기에 포함되는 다양한 전이금속도 산화수은 환원 반응을 자발적으로 일으킬 수 있는 표준환원전위 값을 갖는다[18]. 알칼리금속이나 알칼리토금속이 표준전위 측면에서 산화수은 환원능이 우수할 것으로 판단되나 이들 물질은 산소와의 결합력이 뛰어나 안정성이 떨어지고 폭발 등의 위험성을 갖고 있기 때문에 이들 금속 자체를 환원제로 적용하는 것은 문제가 있는 것으로 판단된다. 전이금속 중에서는 위해성 및 고온에서 유도될 것으로 예상되는 산화수은 환원반응의 특징을 고려할 때 낮은 융해온도를 갖는 물질을 제외하고 본 연구에서는 철(Fe), 구리(Cu), 코발트(Co) 및 니켈(Ni) 4종류 전이금속을 산화수은 환원 촉매로 적용하였다. Table 2에서 확인되듯이 산화수은의 원소수은으로의 환원 반응에 대해 본 연구에서 적용된 4종의 전이금속의 표준전위는 모두 0보다 큰 값을 갖기 때문에 자발적인 반응에 의해 산화수은을 원소수은으로 환원시킬 가능성이 있는 물질로 판단된다.
3.2. 반응가스 조성에 따른 전이금속 촉매의 산화수은 환원 활성
Figure 3은 본 연구에서 적용된 4가지 전이금속의 반응온도에 따른 산화수은 환원 활성을 보여주는 그림이다. Figure 3(a)와 3(b)는 각각 반응가스에 산소가 없는 조건과 산소가 3%의 조성을 갖는 반응가스 조건에서 산화수은의 원소수은으로의 환원 활성을 보여주고 있다. 본 연구에서 적용된 4가지 전이금속은 비다공성 물질이기 때문에 주로 전이금속 표면에서 산화수은의 환원 반응이 진행될 것으로 예상된다. 따라서 전이금속 입자크기의 영향을 배제하기 위해 환원 활성을 전이금속 단위면적당 환원되는 산화수은의 양으로 나타내었다. 4가지 전이금속의 비표면적은 Table 2에 정리하였다. Figure 3(a)에서 알 수 있듯이 모든 전이금속의 환원활성은 반응온도가 증가할수록 증가하는 것으로 나타났다. 본 연구에 적용된 4가지 전이금속은 Fe, Cu, Ni, Co 의 순서로 높은 환원 활성을 나타내었다. 그러나 이들 전이금속의 산화수은 환원에 대한 활성은 Table 2에 나타낸 표준전위 값과는 비례하지 않는 것으로 확인되었다. 이는 산화수은의 환원반응이 자발적으로 진행되기 위해서 산화수은의 원소수은으로의 환원 반응에 대해 0보다 큰 표준전위 값이 요구되기는 하지만 전이금속의 표준전위 값과 환원 활성과는 직접적인 상관성이 없는 것을 보여주는 결과이다.
수은연속측정시스템이 주로 적용되는 석탄화력발전소에서 배출되는 배기가스에는 3-5% 정도의 산소가 함유되어 있다. 따라서 반응가스 중 산소가 산화수은 환원에 미치는 영향을 알아보기 위해 Figure 3(a)에 적용한 4가지 전이금속 촉매들에 대해 반응가스에 3%의 산소가 존재할 경우 산화수은환원 활성을 측정하고 그 결과를 Figure 3(b)에 나타내었다. Figure 3(a)와 3(b)의 결과를 비교하면 반응가스에 산소가 함유되어 있을 경우가 산소가 없는 경우에 비교하여 산화수은의 환원 활성이 크게 감소하는 것을 알 수 있다. 또한 반응가스에 산소가 존재하는 경우에는 전반적으로 반응온도 600-700℃ 이상에서는 반응온도가 증가하여도 환원 활성에 변화가 없거나 오히려 감소하는 것으로 나타났다. 산소가 없는 경우와 달리 반응가스에 산소가 존재하는 경우에는 900 ℃에서 반응이 종료된 후 모든 전이금속은 소결되어 석영관 반응기에 달라붙는 현상을 확인할 수 있었다. 따라서 반응온도 600-700℃ 이상에서 산화수은의 환원 활성이 증가하지 않거나 오히려 감소하는 것은 전이금속이 소결되고 이에 따라 channeling 현상에 의해 전이금속 표면에서 충분한 환원반응이 진행될 수 없기 때문으로 판단된다. 또한 반응온도가 높을수록 소결현상이 더 잘 일어나기 때문에 반응온도가 증가할수록 산화수은의 환원 활성이 낮아지는 것으로 판단된다. 산화수은 환원에 대한 전이금속의 활성은 반응가스에 산소의 존재 여부와 상관없이 거의 동일한 순서를 보이는 것을 확인할 수 있었다.
반응가스에 존재하는 산소가 산화수은의 원소수은으로의 환원 활성을 낮추는 것을 완화시키기 위한 방법으로 반응가스에 수소를 공급하는 방안을 검토했다. 이는 산화수은의 환원반응이 진행되는 온도 범위에서 산소와 수소의 반응을 유도해 산화수은의 환원을 방해하는 산소의 영향을 제거하자는 목적으로 시도되었다. Figure 4는 본 연구에서 적용된 4가지 전이금속 촉매 중 산화수은의 환원 활성이 가장 우수한 것으로 확인된 Fe에 대해 반응가스 조성별로 반응온도에 따른 산화수은의 환원활성을 보여주는 결과이다. 반응가스 조성은 산소가 없는 경우(a), 산소가 3% 존재하는 경우(b) 그리고 산소 3%와 함께 수소가 9%가 존재하는 경우(C) 3가지로 하였다. 모든 반응 조건에서 2~3회의 반복 실험을 수행하고 공급된 산화수은 중 원소수은으로 환원되는 비율을 산화수은의 환원활성으로 나타내었다. 전체적으로 모든 반응온도에서 반응가스 조성에 따른 산화수은 환원 활성은 산소 3%와 수소 9%가 함께 존재하는 경우(c) > 산소가 없는 경우(a) > 산소가 3% 존재하는 경우(b)의 순서로 높게 나타났다. 또한 모든 반응온도에서 반응가스에 산소가 없을 경우에 비해 산소가 3%가 존재 할 경우 산화수은의 환원율은 크게 감소하여 산소가 Fe의 산화수은의 환원 활성을 크게 감소시키는 것을 확인했다. 그러나 산소가 3% 있어도 수소가 9% 수준으로 동시에 존재하면 산화수은 환원 활성이 크게 증가하여 오히려 산소가 없는 경우에 비해 높은 환원 활성을 보였다. 수소 존재에 의한 산화수은의 환원 활성 증가는 600 ℃ 이상에서 확연하게 나타났다. 수소 공급에 의한 산화수은 환원 활성 증가는 본 연구의 온도 범위에서 수소가 산소와 반응하여 Fe의 산화수은 환원활성을 감소시키는 산소를 소모하기 때문으로 판단된다. 즉, 본 연구의 온도 범위에서 자발적으로 진행하는 다음의 산소와 수소의 연소반응으로 인해 산소가 완전히 소모되기 때문으로 판단된다.
본 연구에서는 위의 연소반응에 의해 산소를 완전히 제거하기 위해 수소(9%)는 산소(3%)에 대한 양론비 이상으로 충분히 공급하였다. 반응가스에 수소가 존재할 경우 산소가 없는 경우보다도 높은 산화수은 환원 활성을 나타내는데 이는 과잉으로 공급된 수소의 일부가 산화수은의 환원을 일으키는 작용을 하기 때문으로 판단된다.
Figure 4에서 알 수 있듯이 Fe의 경우 반응온도 700 ℃ 이상에서 수소를 공급할 경우 기존에 산화수은 환원제로 널리 적용되는 SnCl2 수용액 성능과 비교해 거의 동등한 수준의 산화수은 환원 활성을 갖는 것을 확인하였다. 전술한 바와 같이 수은농도 분석의 대상이 되는 석탄화력발전소에서 배출되는 배기가스에는 수% 수준의 산소가 존재하고 산소는 Fe와 같은 전이금속의 산화수은 환원 활성을 크게 낮춘다. 그러나 반응가스에 산소가 존재한다고 하더라도 수소를 공급할 경우에는 산소의 영향을 배제할 수 있어 본 연구에서 적용된 Fe를 포함한 일부 전이금속은 수은연속측정시스템을 구성하는 산화수은의 원소수은으로의 환원시스템의 건식 환원촉매로 적용 가능한 물질임을 확인할 수 있었다.
3.3. 반응가스 조건에 따른 전이금속 촉매의 구조 변화
반응가스에 산소가 없는 경우에 비해 산소가 존재하는 경우 산화수은 환원 활성이 급격히 감소하고 고온에서 반응이 진행될 경우 전이금속의 소결이 진행되는 원인을 규명하기 위해 산화수은 환원반응 전 그리고 반응가스에 산소가 없는 경우와 반응가스에 3% 산소가 존재하는 경우에 산화수은 환원반응이 완료된 Fe 시료에 대해 XRD 측정을 통해 구조변화를 확인하였다. 반응 후에 반응가스가 Fe에 미치는 영향을 배제하기 위해 반응 종료 후 불활성기체인 질소를 반응기에 흘리면서 상온으로 급랭하여 반응 후 시료를 얻었다. Figure 5에서 보는 바와 같이 산화수은의 환원 촉매로 작용하는 Fe는 산소가 없는 조건에서 900 ℃까지의 산화수은의 환원반응 실험 후에도 반응 전과 동일하게 Fe 결정 구조가 유지되는 것을 확인할 수 있다. 그러나 반응가스에 3%의 산소가 존재하는 경우에는 900 ℃까지의 산화수은의 환원반응 실험 후에 Fe는 확인되지 않고 Fe2O3 결정 구조만 확인이 되었다. 이는 반응가스에 존재하는 산소에 의해 Fe가 Fe2O3로 산화되는 것을 보여주는 결과이다. 따라서 반응가스에 산소가 있는 경우 산소가 없는 경우에 비해 산화수은의 환원 활성이 크게 감소하는 이유는 전기전도성이 커 산화수은 환원 활성이 뛰어난 Fe가 고온에서 산소에 의해 환원 활성이 낮은 Fe2O3로 산화되기 때문으로 판단된다. 또한 반응 후 확인된 Fe의 소결 현상은 Fe의 산화에 의해 생성된 Fe2O3가 고온에서 소결되기 때문으로 판단된다.
Figure 4에서 알 수 있듯이 반응가스에 산소가 존재하여도 수소를 공급하면 산소가 없는 반응조건에 비해 오히려 더 높은 산화수은 환원 활성을 나타내었다. Figure 5에서 보는 바와 같이 반응가스에 산소 3%와 수소 9%가 함께 존재하는 경우 900 ℃까지의 산화수은의 환원반응 실험 후 시료에서 FeO피크만 확인된다. 비록 900 ℃에서 반응이 완료된 후에 질소 가스만 흘리면서 상온으로 급랭하여 반응가스의 영향을 최소화하는 과정을 거치기는 하지만 급랭되는 과정에서 반응가스에 잔존하는 산소가 Fe를 산화시켜 FeO가 생성될 가능성을 전혀 배제할 수 없었던 결과로 판단된다. 따라서 비록 산소와 수소가 함께 존재하는 반응가스 조성에서 반응한 후 Fe 시료가 FeO로 변환된 것으로 확인되었지만 실제 산소가 과잉의 수소와 공존할 경우에는 산소가 수소와 반응하여 소모되어 Fe를 산화시키지 못하거나 일부 Fe가 FeO 등으로 산화되었다 하더라도 반응가스에 존재하는 수소에 의해 다시 Fe로 환원될 수 있기 때문에 고온에서 진행되는 산화수은 환원반응 동안에는 대부분의 Fe가 산화수은에 우수한 환원 성능을 갖는 금속 Fe로 존재할 것으로 판단된다. 따라서 반응가스에 산소가 존재하여도 수소가 공존하는 경우에 Fe가 뛰어난 산화수은 환원 활성을 나타내는 이유는 산소에 의해 Fe가 산화수은 환원 활성이 낮은 FeO나 Fe2O3로 변환되는 것을 수소가 억제하기 때문으로 판단된다.
산화수은을 원소수은으로 환원시키는 시스템은 수은연속 측정시스템을 구성하는 가장 중요한 요소의 하나이다. 본 연구는 기존에 널리 적용되고 있는 SnCl2 수용액을 이용한 습식환원기술을 대체할 수 있는 건식 환원촉매를 개발하기 위해 수행되었다. 산화-환원 표준전위를 기준으로 대부분의 전이금속은 산화수은의 원소수은으로의 환원반응을 자발적으로 일으킬 수 있는 물질임을 확인하였다. 본 연구에 적용된 Fe, Cu, Ni 및 Co 4종류 전이금속은 반응가스 조성에 따라 산화수은 환원 활성에서 큰 차이를 보였는데 특히, 반응가스에 산소가 존재하는 경우에는 해당 전이금속이 산화되어 전이금속 산화물로 변환되기 때문에 산화수은 환원 활성이 크게 낮아지는 것으로 확인되었다. 반응가스에 산소가 존재하여도 수소를 과잉으로 공급하면 산화수은 환원 활성이 크게 증가하는데 이는 전이금속을 산화시키는 산소가 산화수은의 환원반응이 진행되는 고온의 반응조건에서 수소와의 연소반응에 의해 소모되기 때문으로 판단된다. 수은농도 연속분석의 대상이 되는 석탄화력발전소에서 배출되는 배기가스에 통상 수% 수준의 산소가 존재하지만 Fe 촉매의 경우 반응온도 700 ℃이상에서 수소를 공급하면 기존에 산화수은 환원제로 널리 적용되는 SnCl2 수용액의 성능과 비교해 동등한 수준의 산화수은 환원 활성을 갖는 것을 확인하였다. 이는 본 연구에서 적용된 Fe를 포함한 일부 전이금속이 수은연속측정시스템을 구성하는 산화수은의 원소수은으로의 환원시스템의 건식 환원촉매로 적용 가능한 물질임을 보여주는 결과이다.
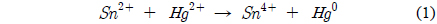
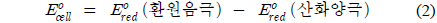
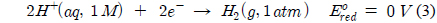
![Activity of transition metals for the gas-phase reduction of Hg2+ to Hg0 with respect to reaction temperature under the flow of (a) N2 and (b) O2 (3%) / N2 ; Catalyst (metal) = 1 g, Gas flow rate = 200 cc/min, [Hg2+]in ? 1,500 μg/m3.](http://oak.go.kr/repository/journal/14612/CJGSB2_2014_v20n3_269_f003.jpg)
![Hg2+ reduction activity of Fe powder with respect to reactant gas compositions of (a) N2, (b) O2 (3%) / N2 and (c) O2 (3%) / H2 (9%) / N2; Catalyst (metal) = 1 g, Gas flow rate = 200 cc/min, [Hg2+]in ? 1,500 μg/m3.](http://oak.go.kr/repository/journal/14612/CJGSB2_2014_v20n3_269_f004.jpg)
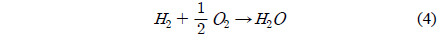
![XRD patterns of Fe powder after the gas-phase reduction of Hg2+ to Hg0 under various reactant gas compositions; (a) fresh Fe powder, (b) N2, (c) O2 (3%) / N2 and (d) O2 (3%)/H2 (9%) / N2; Catalyst (metal) = 1 g, Gas flow rate = 200 cc/min, [Hg2+]in ? 1,500 μg/m3.](http://oak.go.kr/repository/journal/14612/CJGSB2_2014_v20n3_269_f005.jpg)