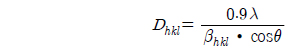Mg-Al mixed oxides with molar ratio of Mg/Al = 1-3 were prepared by co-precipitation and characterized by using X-ray diffraction, scanning electron microscopy, BET surface area and pore volume measured by N2 sorption analysis, and temperature programmed desorption of
Mg-Al 혼합 산화물은 γ-Al2O3보다 화학적으로 안정하며 내열성과 기계적 강도 등의 특성을 갖기 때문에 촉매 공정의 지지체로 널리 사용되어 왔다. 특히, n-부탄의 탈수소화 반응에서 백금을 주촉매로 한 담체로 스피넬 구조의 MgAl2O3가 사용되었었고[1], Ni/Mg(Al)O 촉매를 사용하여 CH4 개질 반응으로 수소 생성에 적용된 바 있으며[2,3], 다양한 귀금속을 MgAl2O3에 함침하여 담체로 사용하여 NOx 저감 반응에 이용[4,5], 금촉매의 담체로 MgAl2O3를 사용하여 저온 CO 산화반응[6] 등에 이용된 바 있다.
혼합 상 중 스피넬 구조의 MgAl2O4는 3.58 g cm−3의 낮은 밀도와 2135 ℃의 고온 용융점을 나타내며 고온에서 높은 내구성을 갖기 때문에 내화성 물질, 마이크로파 유전체, 촉매지지체로서 주목받고 있다[7,8]. MgAl2O4는 졸-겔법[9,10], 공침법[11], 분무 건조법, 수열 합성법[12] 등에 의해 얻어지며 합성 방법에 따라 순도, 입자 크기, 균일성 등이 영향을 받는것으로 알려져 있다.
이소프로판올의 분해반응은 산·염기 특성을 살펴보기 위한 표준반응으로 널리 사용되고 있다[13,14]. 일반적으로 이소프로판올의 분해반응은 다음과 같이 두 종류의 평행반응으로 진행된다. 첫째, 산점에서의 탈수반응에 의한 프로필렌의 생성, 둘째, 염기점에서의 탈수소화반응에 의한 아세톤 생성이다. 그리고, 저온에서 이소프로판올의 축합 및 탈수반응에 의한 디이소프로필 에테르 생성을 예로 들 수 있다.
따라서 본 연구에서는 Mg-Al 혼합 산화물상의 촉매에서 몰비와 소성온도에 따른 안정성 및 결정상에 미치는 영향을 알아보기 위해 촉매를 제조하였다. 제조된 Mg-Al 촉매의 몰비에 따른 결정상의 물리·화학적 특성을 알아보기 위해 X-선 회절분석(X-ray diffraction, XRD), 비표면적과 세공분포측정, 주사전자현미경(scanning electron microscopy, SEM)을 수행하였고 이소프로판올 승온탈착(IPA-temperature programmed desorption, IPA-TPD) 그리고 이산화탄소 승온탈착(CO2-temperature programmed desorption, CO2-TPD)을 통해 산·염기 특성에 대해 알아보았다. 모델반응으로 이소-프로판올의 탈수반응을 수행하여 본 연구에서 제조된 Mg-Al 혼합 산화물상에서 산·염기 특성을 비교하였다.
본 연구에서는 질산 마그네슘(Mg(NO3)2・6H2O, Sigma-Aldrich), 질산 알루미늄(Al(NO3)3・9H2O, Sigma-Aldrich)과 암모니아수(28 wt% NH4OH, SK Chemical)를 이용하여 Mg/Al 몰비 변화에 따른 산화물 촉매를 제조하였다. 먼저 질산 마그네슘을 증류수에 용해시킨 뒤에 Mg/Al의 몰비를 1, 0.5, 0.33, 0으로 질산 알루미늄을 용해시켜 총 10 M의 수용액을 제조하였다. 사용된 금속염을 충분히 용해시키기 위해 상온에서 30 분간 교반시킨 후 암모니아수를 첨가하여 pH 11로 맞추어 침전시킨 후 상온에서 24 시간동안 교반하였다. 이렇게 숙성된 용액은 진공회전증발기를 이용하여 수분을 제거한 후에 100 ℃에서 24시간 동안 충분히 건조시킨 후에 회수하였다. 회수한 수화물은 2 ℃ min−1의 승온속도로 500, 700, 900 ℃에서 5시간 동안 소성하여 결정성을 갖는 산화물을 얻었다. 소성하여 얻어진 산화물은 MgO, Mg:Al = 1:1, Mg:Al = 1:2, Mg:Al = 1:3, Al2O3로 표시하였다.
결정성과 구조적 특성을 확인하기 위해 Rigaku사의 SmartLab 기기(λCu Kα = 1.5418 Å)를 이용해 XRD를 수행하였다. 이 때, 사용전류와 전압은 40 mA, 40 kV이며 0.4 degree min−1의 주사 속도로 2θ = 10~80° 범위에서 측정하였다. 분석 결과는 JCPDS (Joint Committee on Powder Diffraction Standards) 파일(MgO #45-0946, MgAl2O4 #77-0435, γ-Al2O3 #10-0425)을 기준으로 피크의 위치를 확인하였고 각 결정상의 입자크기는 Scherrer식을 이용하여 측정하였다.
제조된 촉매의 비표면적 및 기공 부피를 측정하기 위해 액체 질소 온도 하에서 Micrometrics사의 ASAP2020을 사용하여 질소 흡탈착법으로 분석하였다. 시료 표면의 불순물을 제거하기 위해 250 ℃에서 4시간 동안 3 × 10−3 Torr 이하의 압력으로 유지시켜 전처리하였다. 촉매의 비표면적은 등온흡착곡선을 구한 후 BET (Brunauer-Emmet-Teller) 식을 이용하여 P/P0 = 0.05~0.2 범위에서 계산한 값으로 구하였고 총 기공부피는 P/P0 = 0.995에서의 흡착량으로 계산하였다. 평균기공크기는 4x총 기공부피/비표면적 식을 이용하여 계산하였다.
제조된 촉매의 입자 표면을 관찰하기 위해 SEM 분석을 수행하였다. Carl Zeiss사의 LEO-1530를 사용하여 40,000배 확대하여 측정하였고 표면 함량분석을 위해 EDS (Energy Dispersive Spectroscopy) 분석을 수행하였다.
촉매의 산-염기 성질을 알아보기 위해 이소프로판올 승온탈착(
U자 석영 고정층 반응기에 촉매 0.1 g을 충진하여 반응하였고 MgO 촉매의 경우 비표면적이 매우 작아 0.3 g을 충진시켰다. 질소(50 cm3 min−1) 흐름 하에서 5 ℃ min−1의 승온 속도로 400 ℃까지 상승시켜 1시간 동안 전처리 하였다. 전처리 후, 300 ℃에서 5시간 동안 탈수소-탈수반응을 수행하였다. 희석가스인 질소가 IPA가 채워진 포화기를 통과하며 3 kPa의 IPA 분압으로 반응기에 공급하였고 이때 총 유량은 50 cm3 min−1으로 고정하였다. 반응기를 통과한 가스는 GC로 분석하였고 다음 식을 통해 전환율, 선택도를 계산하였다.
반응 시 운송 기체인 질소는 질량 흐름 제어기(mass flow controller, Brooks 5820 E MFC)로 유량을 조절하였다. 또한 비례적분미분 제어 온도조절기(PID temperature controller)를 사용하여 온도를 조절하였고 반응 후 생성물의 농도는 불꽃이온화 검출기(flame ionization detector, FID)가 장착된 GC(Chrompack 9002)를 이용하여 분석하였다. GC 칼럼은 CPVolamine(60 m X 0.32 mm ID)을 사용하였다.
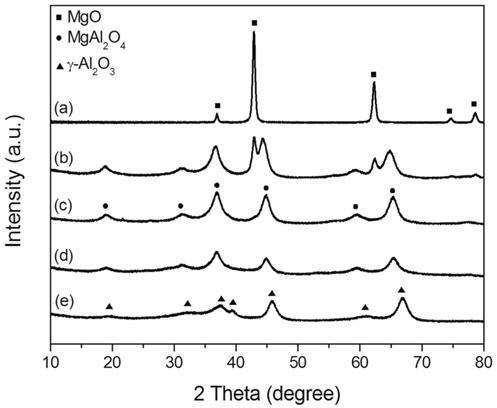
몰비가 다르게 제조된 Mg-Al 혼합산화물의 결정상을 알아보기 위해 700 ℃에서 5시간 소성한 촉매의 XRD 분석 결과를 Figure 1에 나타냈다. Mg-Al 몰비에 따라 MgO, MgAl2O4, γ-Al2O3와 MgAl2O4 혼합상이 생성되었다. Mg-Al 혼합산화물에 있어 알루미늄의 양이 증가함에 따라 (311) 피크의 2θ 값이 증가함을 보였다. 이는 Mg:Al 몰비가 변화함에 따라 단일상의 MgAl2O4를 기준으로 격자상수의 변화를 의미한다[15]. Mg:Al 몰비가 1:2인 촉매는 다른 불순물이 존재하지 않은 단일상 MgAl2O4 스피넬 구조로 확인되었다.
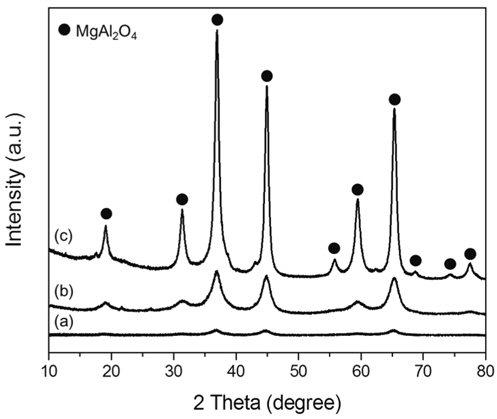
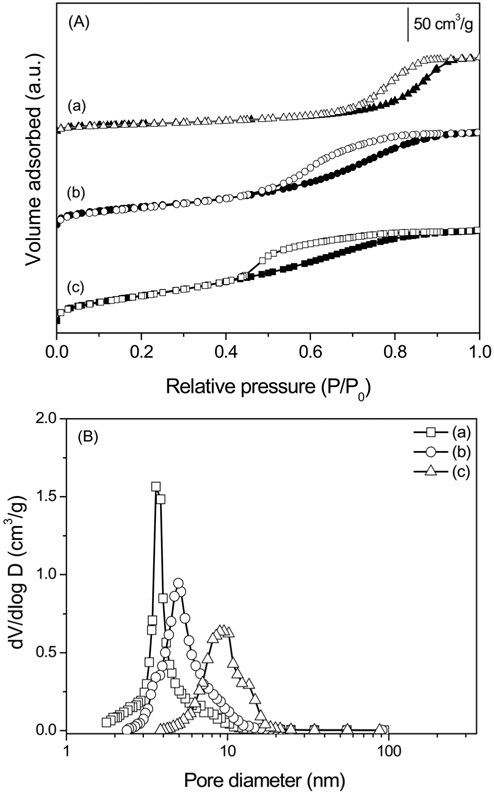
소성온도에 따른 촉매의 입자크기 변화를 알아보기 위해 Mg:Al 몰비가 1:2인 촉매를 500, 700, 900 ℃에서 소성한 시료에 대하여 XRD 분석을 수행하여 Figure 2에 도식화하였다. 500 ℃에서 900 ℃로 소성온도가 증가할수록 피크 크기가 증가하며 폭이 감소하는 것을 알 수 있으며 이는 고온에서 소성한 촉매의 입자 크기가 증가하는 것을 의미한다. Scherrer 식을 이용하여 (311)면의 입자 크기를 측정하여 비교하였다. 소성 온도가 증가할수록 4.5 nm, 5.1 nm, 11.1 nm로 입자 크기가 증가하는 경향을 나타내었다.
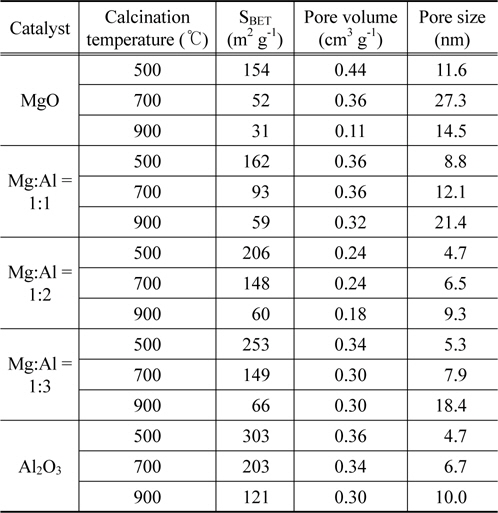
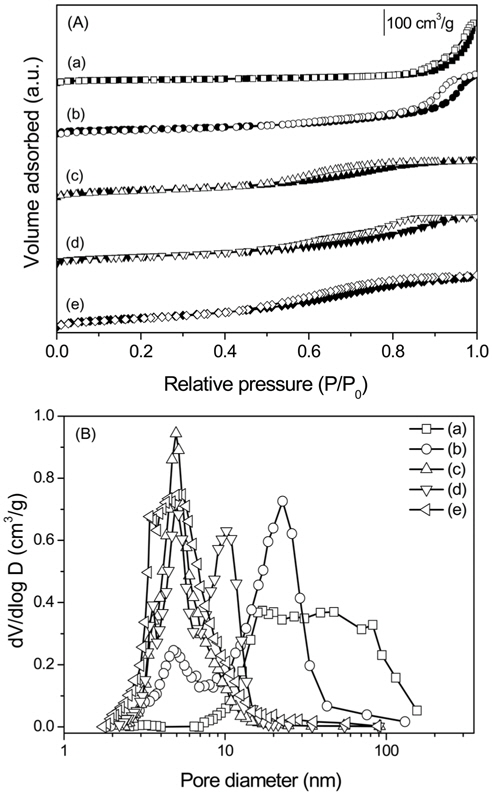
제조한 Mg-Al 혼합산화물의 소성온도에 따른 비표면적 및 총 기공부피를 측정하여 Table 1에 나타내었다. 전체적으로 소성온도가 증가할수록 비표면적과 총 기공부피는 감소하였으며 모든 촉매에서 알루미늄의 양이 증가할수록 비표면적과 총 기공부피는 증가하였다. 몰비가 Mg:Al = 1:2인 산화물에서 소성온도가 500, 700, 900 ℃에서 비표면적은 각각 206, 148에서 66 m2 g−1으로 감소하였고 기공 크기는 4.7에서 9.3 nm로 증가하였다. 이러한 결과는 모든 촉매에서 같은 경향으로 나타났으며 이는 소성온도가 증가하면서 기공 벽이 허물어져 촉매기공의 크기는 증가하고 그로 인해 비표면적은 감소하였기 때문이다[11]. 또한 소성온도 증가에 따른 비표면적의 감소는 XRD 결과의 결정 크기 증가와 연관 지어 설명할 수 있었다.
[Table 1.] Physical properties of Mg-Al oxide catalysts calcined at different temperatures for 6 h
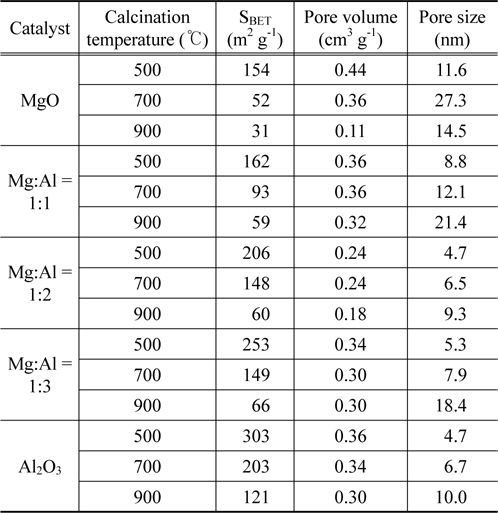
Physical properties of Mg-Al oxide catalysts calcined at different temperatures for 6 h
Figure 3에 700 ℃에서 소성한 Mg-Al 산화물의 질소 흡·탈착 등온선 및 기공 크기 분포를 도식화하였다. MgO는 다른 촉매보다 작은 비표면적과 기공 부피를 갖기 때문에 그래프 모양이 뚜렷이 나타나지 않았으나 모든 촉매에서 중간 기공이 존재하는 IV형을 나타낸 것을 확인할 수 있다. Mg:Al = 1:1인 산화물은 10 에서 100 nm 사이의 기공 크기 분포를 나타내었으나 그 외의 촉매는 10 nm 이하의 기공 크기를 나타내었다. Mg:Al 몰비가 1:2인 촉매의 소성 온도에 따른 질소 흡·탈착 등온선 및 기공 크기 분포를 Figure 4에 나타내었다. 모든 소성 온도에서 중간 기공이 존재하는 IV형태를 나타내었고, 기공 크기 분포를 통해 소성온도가 증가할수록 기공 크기가 증가하는 것을 확인할 수 있다.
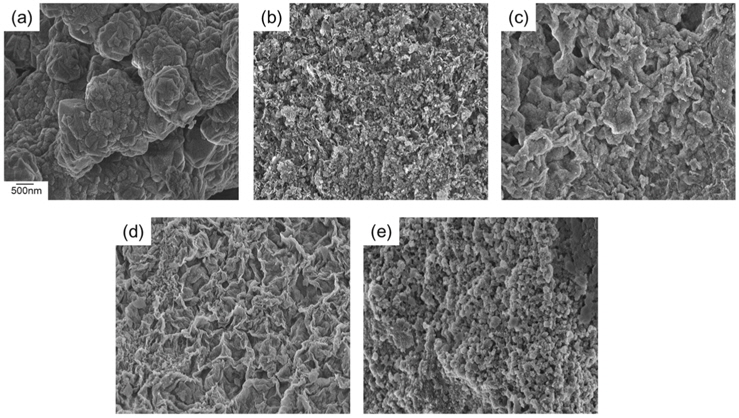
Mg-Al 산화물의 입자모양 분석을 위하여 700 ℃에서 소성한 시료에 대하여 SEM 분석을 수행하여 Figure 5에 나타내었으며 이때 배율은 40,000배로 고정하여 관찰하였다. MgO의 경우 심하게 뭉쳐진 상태로 기공이 거의 존재하지 않은 형태를 보여주었다. Al 양이 증가함에 따라 둥그런 입자상 물질이 더 많이 관찰되었으며 입자간 뭉침 현상이 많이 감소하였다. 표면 조성을 관찰하기 위하여 EDS 분석을 실시하여 Table 2에 정리하였다. 전체적으로 원래 조성과 거의 일치된 값을 보여주었다. 실제 이론상으로 존재할 수 있는 산소 양보다 조금 높게 결과가 도출된 것은 표면 흡착에 관여된 산소가 존재하기 때문으로 사료된다.
[Table 2.] Surface composition determined by EDS for Mg-Al oxide catalysts calcined at 700 ℃ for 6 h
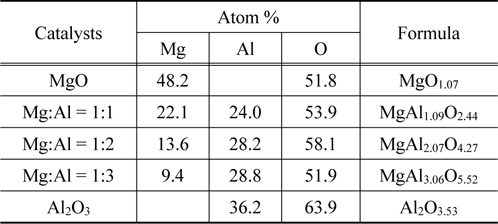
Surface composition determined by EDS for Mg-Al oxide catalysts calcined at 700 ℃ for 6 h
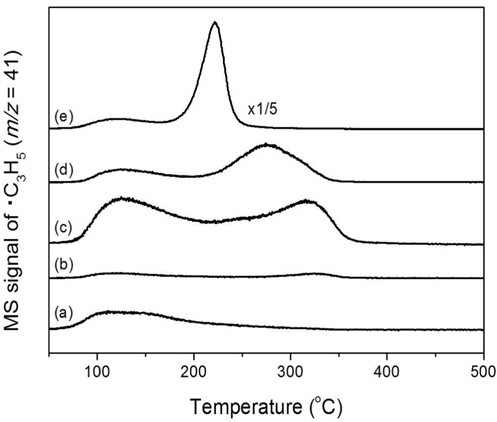
700 ℃에서 소성한 촉매의 산점 특성을 알아보기 위해 IPATPD를 수행하여 Figure 6에 도식화하였다. 100~400 ℃의 온도 범위에서 탈착현상이 관찰되었으며 탈착 피크의 위치로 보아 하나 이상의 서로 다른 이소프로판올 흡착점이 있는 것으로 유추된다. MgO 촉매의 경우 Al이 함유된 다른 혼합산화물에 비해 저온인 120 ℃ 부근에서 약산점 피크를 나타내었다. 알루미늄을 첨가한 촉매는 약산점 이외에도 200~350 ℃의 넓은 범위에서 강산점의 피크가 관찰되었고 알루미늄 양이 늘어날수록 강산점 피크의 온도가 낮아져 순수한 Al2O3의 경우 210 ℃까지 낮아진 것을 알 수 있다. 첨가되는 알루미늄의 양이 증가함에 따라 제조된 촉매 표면에서 IPA의 탈착이 용이함을 의미하는 것이라 할 수 있다. 탈착온도가 낮은 Al2O3 촉매에 있어 탈착양도 상대적으로 증가함을 확인하였다. 이러한 알루미늄 함량 증가에 따른 탈착양의 증가는 촉매의 높은 비표면적과 연관성이 있음을 알 수 있다. 이러한 탈착온도의 변화 정도는 IPA 탈수-탈수소반응에 적절하게 적용될 수 있었다.
700 ℃에서 소성한 촉매의 염기점 특성을 알아보기 위해 CO2-TPD를 수행하여 Figure 7에 나타내었다. 상온에서 500 ℃까지 넓은 범위에서 CO2 탈착 피크가 관찰되었고 각각의 피크를 α, β, γ, δ 피크로 명명하였다. 저온 피크인 α 피크는 약 염기점에서의 탈착을 나타내며 β, γ 피크는 중간세기의 염기점에서의 탈착을 나타낸다. 또한 300 ℃ 이상에서 나타나는 δ 피크는 상대적으로 더 강한 염기점에서의 탈착을 나타낸다[14]. Al2O3 촉매는 200 ℃ 이하의 α 피크의 크기가 가장 크게 나타났으며 그 이외의 촉매는 γ, δ, β, α 피크 순으로 크기가 감소하였다. 몰비의 변화는 탈착 피크 온도뿐만 아니라 피크 크기에도 영향을 미치는 것을 알 수 있다. MgO 촉매의 탈착 피크가 가장 크게 관찰되었으며 Al 함량이 증가할수록 탈착피크가 감소하는 경향을 나타내었다.
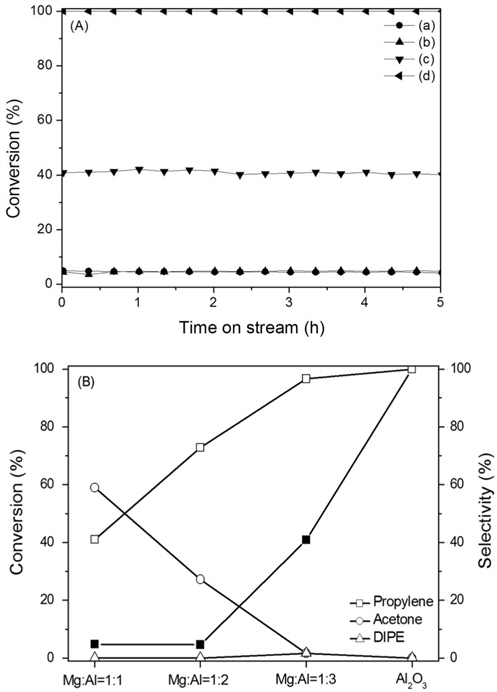
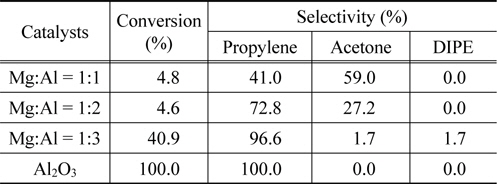
Mg-Al 산화물에 대한 반응성을 검토하기 위하여 IPA의 탈수소-탈수반응을 반응온도 300 ℃에서 수행하여 그 결과를 Figure 8과 Table 3에 정리하였다. MgO, Mg:Al = 1:1, 1:2 의 촉매 경우 반응성이 매우 낮아 5% 전환율을 넘지 못했고 특히 MgO 촉매의 경우 전환율을 나타내지 않았다. 이러한 결과는 IPA 탈착온도와 밀접한 관계로 설명할 수 있었다. Figure 6의 IPA-TPD에서 알 수 있듯이 IPA 탈착 피크 온도가 300 ℃ 이상에서 형성됨을 알 수 있었다. 이러한 강한 IPA 흡착은 반응성의 저하와 연관지울 수 있으며, 반응 온도 300 ℃이상에서 IPA 탈착이 원활하게 이루어짐을 알 수 있었다. Mg:Al = 1:3 산화물 촉매 경우 IPA 탈착 온도가 275 ℃ 부근에서 최대 피크로 나타남은 반응온도 300 ℃에서 반응이 원활하게 진행됨을 보여 주고 있다 전환율 41%, 프로필렌 선택도 73%, 아세톤 선택도 27%를 나타냄은 이 산화물이 산염기점을 동시에 확보한 촉매라 할 수 있다. Al의 함량이 증가함에 따라 IPA전환율과 프로필렌의 선택도 같이 증가함을 알 수 있었다.
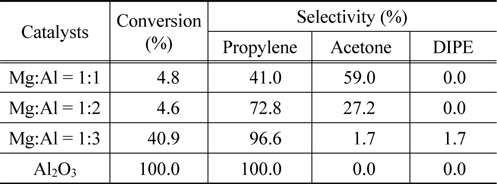
Conversions and product selectivities in the dehydrationdehydrogenation of iso-propanol over Mg-Al oxide catalysts
Mg-Al 혼합 산화물 제조에 있어 몰비와 소성온도가 미치는 영향에 대해 검토하였다. MgO 촉매에 알루미늄을 첨가할수록 Mg-Al 혼합 상이 나타났으며 몰비가 1:2일 때 MgAl2O4 스피넬 구조를 형성하는 것을 확인하였다. 알루미늄 몰비가 증가할수록 비표면적 및 기공 부피가 증가하였으며 고온에서 소성할 경우 비표면적이 감소하고 입자 크기가 성장하여 결정성이 증가하는 것을 확인하였다. 700 ℃에서 소성한 촉매에서 알루미늄 함량이 증가할수록 300 ℃ 부근의 강산점의 탈착온도가 감소하였으며 비표면적이 가장 큰 Al2O3 촉매의 산점 피크가 가장 크게 관찰되었다. 이러한 산점 변화는 이소프로판올의 전환율 및 프로필렌의 선택도에 직접적인 영향을 미쳤다. 또한 Mg-Al 비는 염기점의 분포에도 영향을 미쳤으며 MgO 촉매에서 가장 높은 염기점 피크를 나타내었으며 알루미늄 함량이 증가할수록 감소하는 것으로 나타났다.