Two studies were conducted to investigate the effects of dietary nucleotides (NT) on the growth performance, hematological parameters, and innate immune responses of red seabream
뉴클레오티드(nucleotide, NT)는 핵산을 구성하는 단위체로서 에너지 공급원, 세포 내 신호전달 및 효소반응에 중요한 역할을 한다(Carver and Walker, 1995). 양어사료 분야에서는 사료섭이율이 증가한다는 연구결과가 보고되면서 NT에 대한 관심이 계속적으로 높아지고 있다(Mackie, 1973; Kiyohara et al., 1975; Li and Gatlin, 2006; Song et al., 2012). Inosine monophosphate (IMP)와 guanosine monophosphate (GMP)는 식품 내 특정 풍미를 변화시키며, 화학조미료인 monosodium glutamate와의 상승작용으로 인해 식품첨가제로 이용되고 있다(Adamek et al., 1996; Kubitza et al., 1997). Adenine monophosphate (AMP)와 uridine monophosphate (UMP)는 모든 생체내에 존재하며 에너지 전달체로써 중요한 역할을 한다. 양어사료 내 NT를 첨가함으로써 어류의 성장과 면역활성이 증가된 여러 연구결과가 있지만, 그 원인에 대한 정확한 메커니즘은 현재까지도 분명하게 밝혀지지 않았다(Li et al., 2007; Lin et al., 2009).
참돔은 농어목(Perciformes), 도미과(Sparidae)에 속하는 상품가치가 높은 대표 양식어종이다. 성장률이 빠르고 다양한 환경변화에 내성이 높은 어류로 알려져 있지만, 성장단계에 맞는 영양소 제공과 양식환경이 적절치 못하면 성장률이 감소하고 질병이 자주 발병하게 된다(Kinoshita and Tanaka, 1990; Tang et al., 2003). 어류의 질병치료 및 예방을 위한 방법으로 항생제를 많이 사용하고 있지만, 항생제 사용의 오남용으로 인해 내성균 출현과 체내잔류 등의 문제를 일으켜 항생제를 대체하는 연구가 절실히 필요하다. 사료 내 천연물질을 첨가하여 어류의 성장, 비특이적 면역반응 및 질병저항성을 증가시킨다는 연구결과는 보고되었지만 양식현장에서 실제로 이용되는 경우는 미비한 실정이다.
현재까지 보고된 대부분의 NT 첨가실험은 상업제품을 이용하여 진행되었다(Burrells et al., 2001ab; Tahmasebi-Kohyani et al., 2011). 상업제품은 NT외에 미네랄, 아미노산 등 다양한 물질을 함유하고 있어 양식어종에 따른 정확한 NT 요구량을 제시하기가 어려웠다. 따라서 실험 I에서는 정제된 형태의 IMP, AMP, GMP, UMP 및 혼합 Mix-NTs (IMP+AMP+GMP+UMP)가 치어기 참돔의 성장, 사료효율 및 비특이적 면역반응에 미치는 영향을 조사하여 최적의 NT를 선별하였다. 실험 II에서는 선별된 IMP를 상업화 한 제품을 이용하여 미성어기 참돔에 농도 별로 공급한 후 성장, 혈액성상 및 면역반응에 미치는 영향을 조사하여 실제 양식현장에서 적용가능한지를 판단하고자 수행되었다.
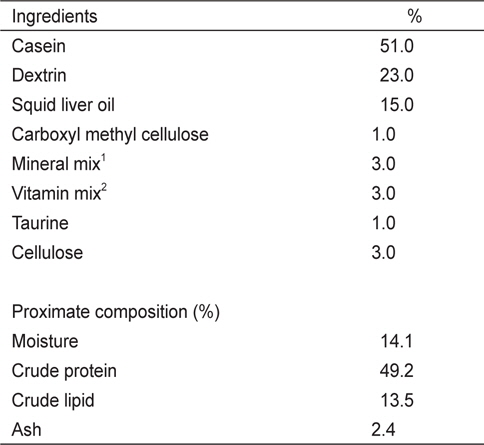
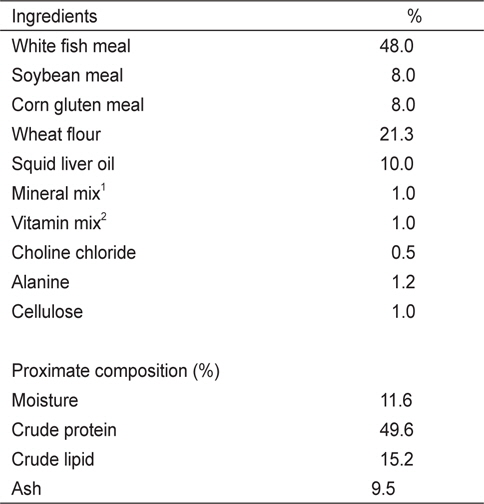
실험 I에 사용된 6개의 실험사료는 49%의 조단백질과 19.1 MJ/kg의 에너지 함량이 되도록 제조하였다(Table 1). 사료원으로부터 NT 함량을 최소하기 위해 어분 대신 casein을 사용하였다. NT 첨가효과를 조사하기 위해 대조사료(Con)에 cellulose 양을 감소시켜 IMP, AMP, GMP, UMP, Mix-NTs를 0.15%씩 각각 첨가하였다. Mix-NT는 IMP, AMP, GMP, UMP를 같은 비율로 혼합하여 준비한 다음 사료에 첨가하였다. 실험 II에 사용된 5개의 실험사료는 어분을 단백질원으로 사용하여 48%의 조단백질과 20 MJ/kg의 에너지 함량이 되도록 동일하게 제조하였다(Table 2). 실험에 사용된 상업 NT제품은 46%의 IMP와 그 외 다른 NT를 극소량 함유하고 있다. 상업제품인 IMP의 첨가효과를 조사하기 위해 대조사료에 alanine 양을 감소시켜 농도 별로 첨가하였다(Con, 0.1%, 0.2%, 0.4%, 1.0%). 실험사료제조는 파쇄기로 모든 사료원을 분말형태로 일정하게 만든 후, 각 사료원을 사료조성표에 따라 정확히 무게를 측정하고 혼합하였다. 혼합 후 사료원 총량의 20-30%에 해당하는 증류수를 첨가하여 사료혼합기(NVM-14-2P, Korea)로 혼합하였다. 혼합물은 소형초파기(SMC-12, Korea)를 이용하여 압출 성형하였다. 제작된 실험사료는 선풍기로 2일간 자연 건조시킨 후, 시브(sieve)를 이용하여 적당한 크기로 준비하였으며 사료공급 전까지 -20℃ 냉동고에 보관한 후 실험에 사용하였다.
[Table 1.] Composition of basal diet for juvenile red seabream Pagrus major in Exp I
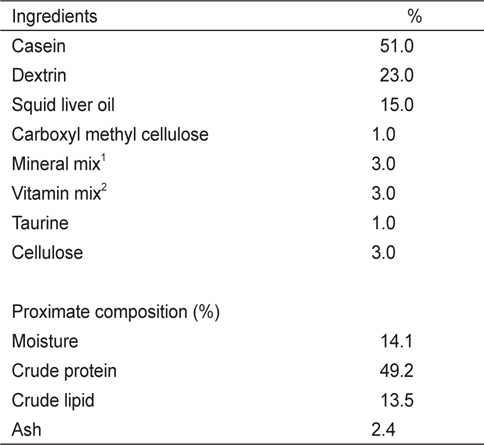
Composition of basal diet for juvenile red seabream Pagrus major in Exp I
[Table 2.] Composition of basal diet for growing red seabream Pagrus major in Exp II
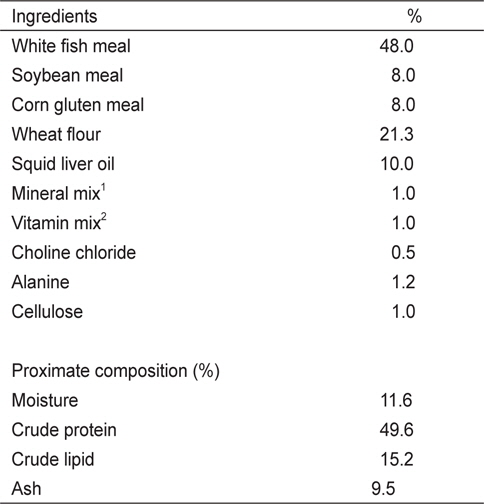
Composition of basal diet for growing red seabream Pagrus major in Exp II
참돔은 경상남도 고성군에 위치한 양어장에서 구입하여 제주대학교 소속 해양과학연구소로 운송하였다. 예비사육 후, 실험 I은(초기평균무게: 33.1 g) 18개의 150 L 원형 플라스틱 수조에 15마리씩 무작위 배치하였고, 실험 II는(초기평균무게: 120 g) 15개의 300 L 원형 플라스틱 수조에 10마리씩 무작위 배치하였다. 사료공급은 실험구당 3반복구를 두었으며, 사육수는 모래 여과해수를 사용하여 1-2 L/min의 유수량이 공급되도록 하였고 모든 실험수조에 충분한 용존산소 유지를 위하여 에어스톤을 설치하였다. 실험 I의 사육실험은 저수온(15℃-18℃)에서 8주 동안 1일 2회로 만복 공급하였다. 실험 II의 사육실험은 적수온(22℃-26℃)에서 12주 동안 1일 2회로 만복 공급하였다.
실험종료 후 실험어의 최종무게, 마리수, 사료공급량을 측정하여 사료전환효율(feed conversion ratio), 단백질이용효율(protein efficiency ratio) 및 생존율을 계산하였다. 최종무게 측정 후, 각 수조당 6마리의 실험어를 무작위로 선별하여 2-phenoxyethanol 용액(100 ppm)으로 마취시킨 후 6마리 중3마리는 헤파린이 처리된 주사기로 꼬리 미병부에서 채혈하였다. 채혈된 전혈은 hematocrit (Ht), hemoglobin (Hb) 및 대식세포활성(nitro-blue tetrazolium, NBT) 분석에 이용되었고 분석이 끝난 후, 원심분리기로(5,000×
실험사료의 일반성분 분석은 AOAC (1995) 방법에 따라 수분은 상압가열건조법(125℃, 3 h), 조회분은 직접회화법(550℃, 12 h), 조단백질은 자동조단백질 분석기(Kejltec system 2300, Sweden)로 분석하였고, 지방은 Folch et al. (1957)의 방법에 따라 Soxhelt 추출장치(Soxhlet heater system C-SH6, Korea)로 분석하였다.
Ht은 혈액진단원심분리기(Micro hematocrit VS-12000, Korea)에서 10분간 원심분리하여 값을 측정하였고 Hb, total protein (TP), glucose는 kit시약과 반응시킨 후 혈액생화학분석기 (Express plus system, USA)로 분석하였다.
혈액 내 대식세포 활성은 Kumari and Sahoo (2005)의 분석방법을 토대로 호중구의 oxidative radical 생성량을 측정하였고, lysozyme 분석은 Sankaran and Shanto (1972)의 방법으로 분석하였다. Myeloperoxidase (MPO)활성은 Kumari and Sahoo (2005)의 방법을 기초로 분석하였고, superoxide dismutase (SOD)활성은 SOD assay kit (Sigma, USA)로 분석하였다.
>
사료유인성(Instantaneous feed intake) 테스트
실험 9주째(실험 II), 동일한 환경조건에서 3분 동안 사료를 만복공급 하였을 때 어류가 섭취한 사료의 양을 측정하였다. 3일간 3번의 반복실험을 통하여 100 g의 어류가 섭취한 양으로 계산하였다.
실험사료의 배치는 완전확률계획법(Completely randomized design)으로 실시하였고, 성장 및 분석결과는 SPSS (Version 11.0)프로그램을 이용하여 One-way ANOVA로 통계 분석하였다. 데이터 값은 최소유의차 검정 (LSD; Least Significant Difference)으로 유의성(
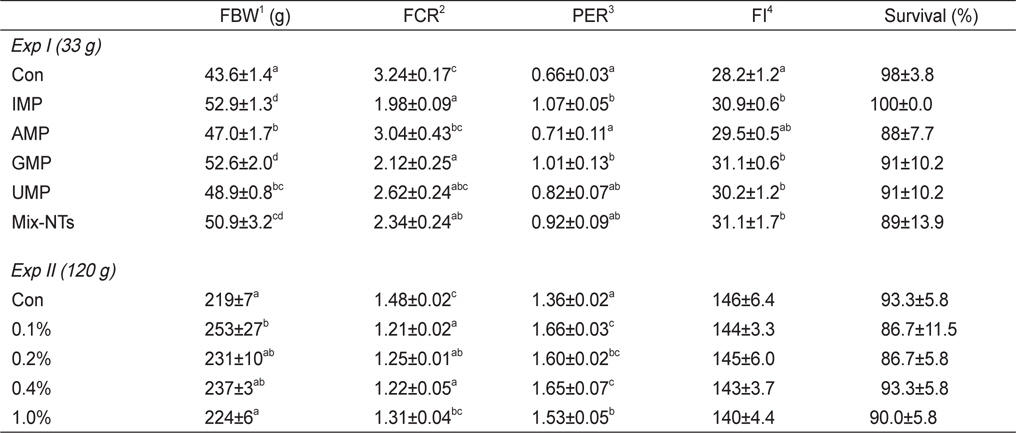
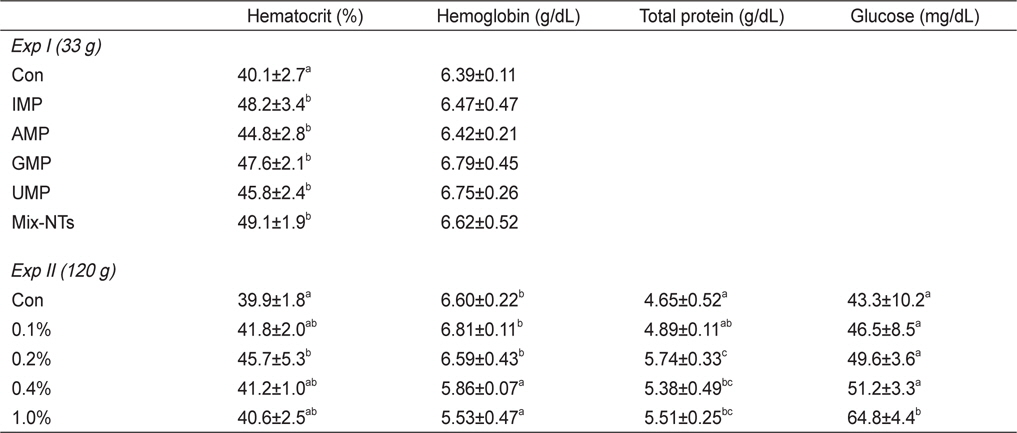
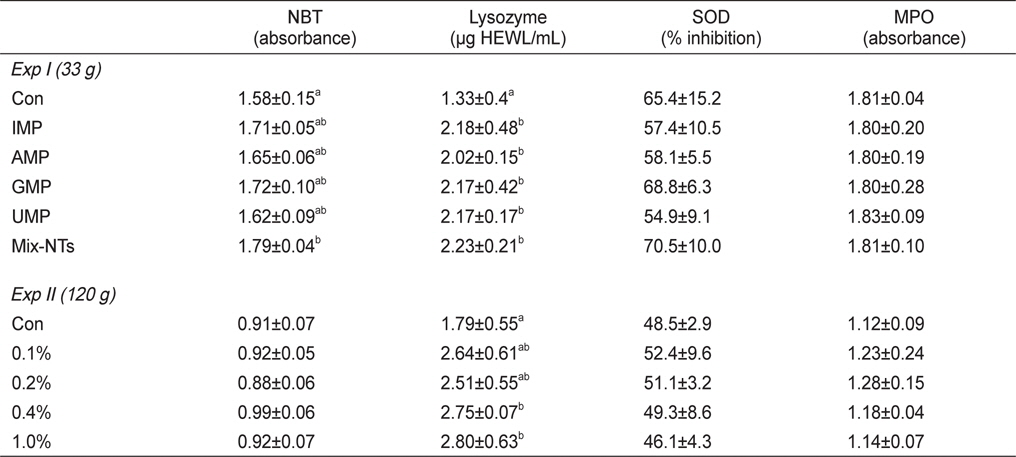
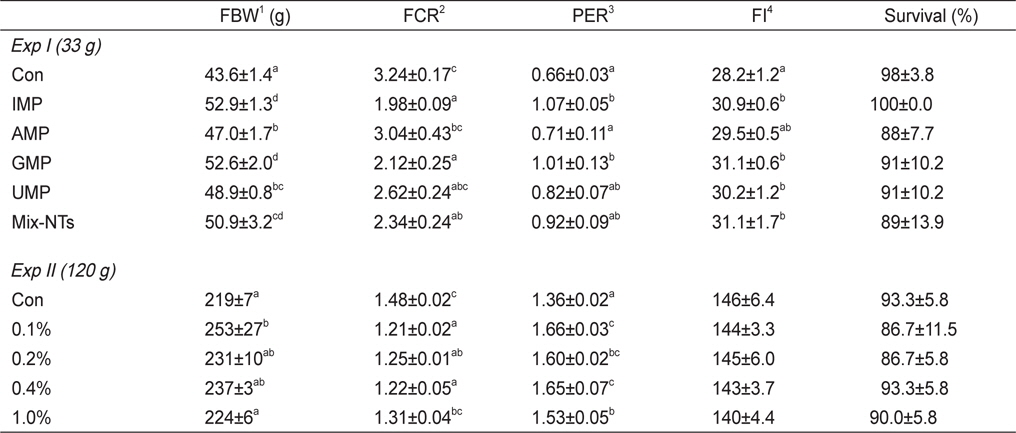
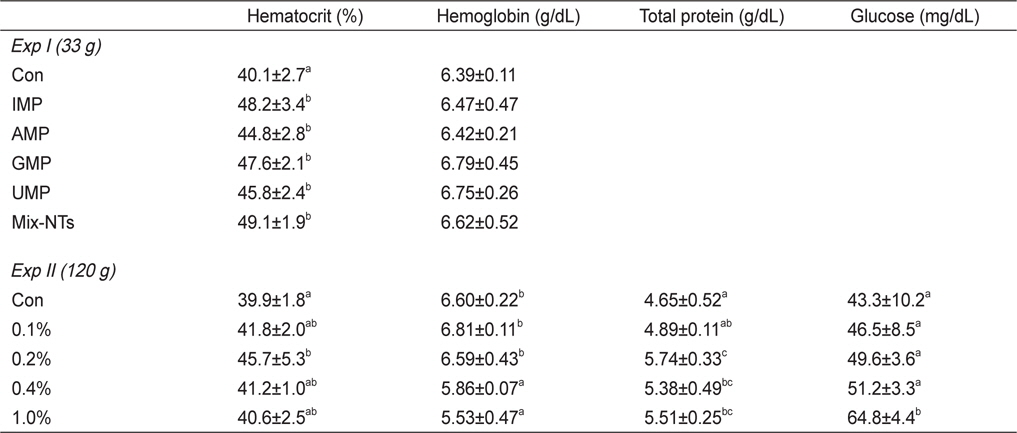
NT첨가에 따른 참돔의 성장결과는 Table 3에 나타내었다. 최종무게와 사료효율은 IMP, GMP, Mix-NTs 그룹이 대조구에 비해 유의적으로 높았고 AMP와 UMP 그룹과는 유의적인 차이가 없었다. 사료섭이율 결과에서도 NT첨가 그룹이 대조구에 비해 유의적으로 높은 값을 보였다. 생존율은 모든 그룹에서 유의적인 차이가 없었다. Ht함량은 대조구가 NT첨가구에 비해 유의적으로 낮은 수치를 보였지만, Hb함량은 모든 그룹에서 유의적인 차이가 없었다(Table 4).
Growth performance of red seabream Pagrus major fed experimental diets for 8 weeks (Exp I) and 12 weeks (Exp II)
Hematological parameters of red seabream Pagrus major fed five experimental diets experimental diets for 8 weeks (Exp I) and 12 weeks (Exp II)
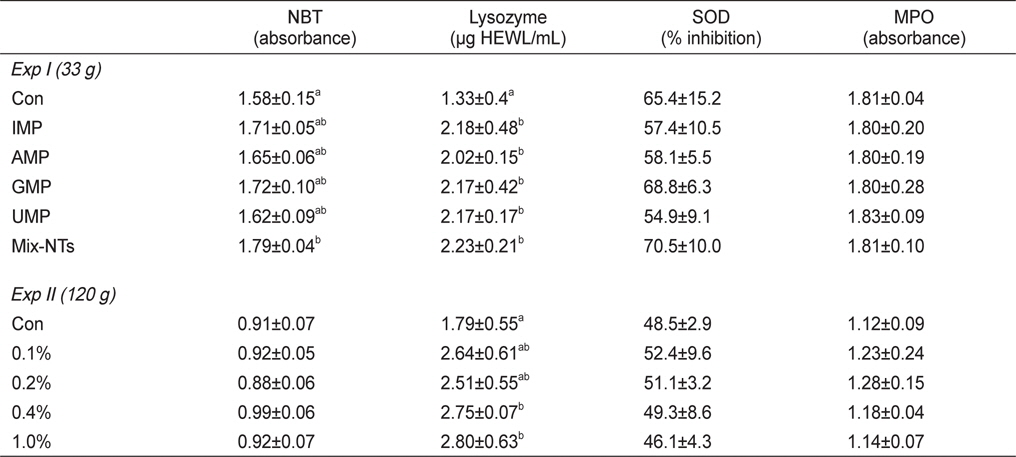
실험사료 공급에 따른 참돔의 비특이적 면역반응 결과는 Table 5에 나타내었다. NBT활성에서는 Mix-NTs그룹이 대조구에 비해 유의적으로 높은 활성을 보였지만 단일 형태로 첨가된 NT그룹과는 유의적인 차이가 없었다. Lysozyme활성은 NT가 첨가된 모든 그룹이 대조구에 비해 유의적으로 높은 활성을 보였다. SOD와 MPO활성은 모든 그룹에서 유의적인 차이는 없었다.
Nitro blue tetrazolium (NBT), lysozyme, superoxide dismutase (SOD) and myeloperoxidase (MPO) activities of red seabream Pagrus major fed experimental diets for 8 weeks (Exp I) and 12 weeks (Exp II)
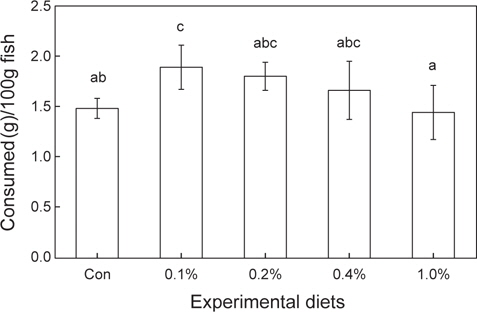
12주간의 성장실험 결과는 Table 3에 나타내었다. 0.1% 첨가그룹은 대조구와 1.0% 첨가그룹에 비해 유의적으로 높은 성장률 및 사료효율을 보였다. 생존율은 모든 실험구에서 유의적인 차이가 없었다. 사양실험 9주째 실시된 사료유인성 테스트 결과, 0.1% 첨가그룹이 대조구와 1.0% 첨가그룹에 비해 유의적으로 높은 사료섭이율을 보였다(Figure 1).
Ht함량은 0.2% 첨가그룹이 대조구에 비해 유의적으로 높은수치를 보였지만 다른 NT 그룹과는 유의적인 차이가 없었다. Hb함량은 0-0.2% 첨가그룹이 0.4-1.0% 첨가그룹에 비해 유의적으로 증가하였다(Table 4). 혈장 내 TP 함량은 0.2% 첨가그룹이 대조구와 0.1% 첨가그룹에 비해 유의적으로 높았고, glucose 함량에서는 1.0% 첨가그룹이 0-0.4% 첨가그룹에 비해 유의적으로 높은 수치를 보였다.
비특이적 면역반응 결과는 Table 5에 나타내었다. Lysozyme의 경우, 0.4-1.0% 첨가그룹이 대조구에 비해 유의적으로 높은 활성을 보였다. NBT, MPO 및 SOD활성에서는 0.1-0.2% 그룹에서 대조구에 비해 높은 활성 경향을 보였지만 유의적인 차이는 없었다.
실험에 사용된 대조사료는 참돔의 성장에 필요한 영양소를 충족시켜주었지만 대조사료를 먹인 그룹은 NT첨가그룹에 비해 성장률이 낮았다. 이번 연구결과를 통해 사료 내 NT 첨가는 치어기와 미성어기 참돔의 성장과 사료효율 증진에 도움이 될 것으로 판단된다. 실험 I의 경우, IMP 또는 Mix-NTs가 첨가된 그룹이 다른 그룹에 비해 유의적으로 높은 성장률을 보였다. Grouper (
실험 I의 사료섭이율 결과, NT첨가 그룹이 대조구에 비해 유의적으로 높은 값을 보였다. Largemouth bass (
실험 II에 사용된 실험사료는 48%의 어분을 함유하고 있다. 어분에는 약 0.2%의 NT가 포함(Carver and Walker, 1995)되어 NT가 첨가되지 않은 대조사료도 약 0.96 g/kg의 NT를 포함하고 있다. 즉, 대조사료에 1.0% (4.6 g NT/kg)의 NT를 첨가하면 약 5.5 g NT/kg사료의 농도가 된다. 따라서 미성어기 참돔 사료 내 5.5 g NT/kg 이상의 첨가는 성장률에 부정적인 영향을 미칠 것으로 판단된다.
혈액학적 분석은 어류의 건강상태 및 생리활성을 나타내는 지표로 이용되며 영양소 결핍, 양식환경, 성장단계에 따라 달라질 수 있다(Houston, 1997; Kumar et al., 2005; Garrido et al., 1990; Lim and Lee, 2009). Ht는 혈액에서 적혈구가 차지하고 있는 비중을 의미하며 영양소 결핍에 따라 수치가 감소한다. 실 험 I과 II의 경우, 대조사료를 먹인 그룹이 NT첨가 그룹에 비해 유의적으로 낮은 값을 보임으로서 NT는 어류의 정상적인 건강상태를 유지하는데 필요한 영양소라 판단된다. Hb는 철(Fe)을 포함하는 단백질로써 적혈구에서 산소를 운반하는 역할을 한다. Beluga sturgeon (
양어사료 내 NT의 첨가는 어류의 비특이적 면역반응과 질병저항성을 증가시킬 수 있다는 최근의 많은 연구결과들에 의해 주목 받기 시작했다(Burrells et al., 2001ab). 이번 연구에서도 정제된 Mix-NTs (실험 I)나 상업용 IMP (실험 II)에 의해 비특이적 면역지표인 lysozyme과 대식세포 활성이 증가된 것을 확인 할 수 있었다. Lysozyme은 특정세균이 아닌 다양한 균에 항균작용을 나타내는 효소로 어류를 포함한 대부분의 동물실험에서 비특이적 면역반응을 측정하는 항목이며(Jollès and Jollès, 1984; Grinde, 1989), 대식세포는 체내로 침입한 병원성 미생물을 가수분해하여 사멸시키는 역할을 한다. 연어를 대상으로 사료 내 NT를 농도 별로 공급하여 lysozyme 활성을 측정 하였을 때, 대조구에 비해 NT첨가 그룹이 유의적으로 높은 활성을 보였다(Tahmasebi-Kohyani et al., 2011). 이처럼 최근의 연구결과들은 사료 내 NT첨가가 어류의 면역력 증진에 효과가 있다고 보고하고 있다. Bricknell and Dalmo (2005)는 NT가 Toll-like receptors (TLRs) 유전물질을 발현시켜 면역반응을 증가시킨다고 보고하였다. TLRs는 비특이적 면역반응과 특이적 면역반응에 관여하는 유전물질로 어류에서도 TLRs 유전자가 존재한다고 보고되었다(Werling and Jungi 2003). 반면, hybrid striped bass (
치어기 참돔을 대상으로 사육실험을 진행한 결과, IMP 또는 Mix-NTs가 효율적인 사료첨가용 NT로 선택되었다. 이러한 결과를 바탕으로 IMP가 첨가된 물질이 상업화 될 수 있고, 첨가농도에 따라 미성어기 참돔에서는 성장률에 영향을 미칠 수 있음을 알 수 있었다. 따라서 정제된 형태의 NT는 약 0.15% 농도로 단일형태 또는 혼합형태로 첨가할 경우 효과가 있을 것으로 사료되며, 어분이 다량 첨가된 실용사료에서는 상업용 IMP (약 46% 순도)의 첨가농도가 약 0.2% 이하가 되어야 할 것으로 사료된다.