The effects of environmental factors, such as irradiance, daylength, salinity, and desiccation, on the growth of
대형 해조류(macroalgae)와 식물성플랑크톤을 포함하는 해양 조류(marine algae)는 지구 산소의 50-70%를 생산하고 O2 의 약 25%를 흡수하고 침적하여 탄소순환에 관여하는 것으로 알려져 있다. 홍조류인 무절산호조류는 북극에서 남극까지, 환경이 열악한 조간대 상부에서부터 차갑고 매우 약한 광이 도달하는 한계 수심(최대 268 m)까지, 광범위한 분포를 보이며 (Littler and Littler, 1985; Björk et al., 1995), “Maërl beds” (or rhodoliths)를 형성하는
다른 해조류와 마찬가지로 무절산호조류의 생존과 생장은 조도, 염분, 건조 등의 다양한 환경요인에 의해 영향을 받는 것으로 확인되었고 이들의 생장은 무게, 석회화율과 광합성율로 측정되었으며(King and Schramm, 1982; Martin and Gattuso, 2009), 각상형 산호조류의 표면적과 석회화율은 밀접한 상관 관계를 가졌다(Littler, 1973).
따라서, 본 연구는 우리나라의 갯녹음 해역에서 우점하는 무절산호조류 두 종, 납작돌잎과 진분홍딱지 배아가 1) 암조건에 대한 내성이 있고 낮은 조도에서 빠른 생장을 보이는지? 그리고 2) 저염분에 대한 내성이 약하고 건조 및 일장에 대하여 종별 특이성을 보이는지?에 대한 생리적 특성을 파악하기 위해 수행되었다.
본 연구를 위해 납작돌잎은 강원도 삼척시 원덕읍 갈남 해안(37°16´N, 129°19´E)에서 2011년 10월에, 그리고 진분홍딱지는 전북 부안군 격포 해안(35°36´N, 126°28´E)에서 11월에 채집되었으며, 현장에서 해수가 담긴 샘플통에 넣고 ice box에 담아 실험실로 운반하였다. 각 종이 피복된 작은 돌은 실험실에서 착생한 동·식물을 실험용 메스로 제거하고 여과해수(0.45μm)와 brush로 표면에 부착된 미세조류를 수회 세척하여 절단된 슬라이드글라스 조각(2.5×2.5 cm)이 바닥에 깔린 Petri dish (직경 12 cm)에 각 종이 피복된 돌을 올리고 멸균해수가 들어있는 2 L 수조에 넣어 배양기에서 포자방출을 유도하였다(Song et al., 2013). 배양기의 온도는 Song et al. (2013)에 따라서 납작돌잎은 10℃, 진분홍딱지는 20℃로 다르게 세팅하였으며 염분(34 psu)과 조도(50 μmol photon m-2 s-1)와 광주기(12:12h LD)는 동일하게 유지시켰다. 배양기에서 48 h 동안 포자 방출을 유도한 후 슬라이드 조각에 부착된 배아를 환경조건별 배아의 생장 실험에 사용하였다.
각 종의 포자가 부착된 슬라이드 조각 3-4개를 산화게르마늄 (GeO2, 5 mgL-1)이 첨가된PES 배양액(Provasoli, 1968) 이 30 mL씩 담긴 Petri dish (직경 10 cm)에 넣었다. 배아가 들어있는 Petri dish는 5개의 조도(10, 50, 80, 120, 150 μmol photon m-2 s-1), 그리고 온도(20℃), 염분(34 psu)과 광주기(12:12h LD)는 동일하게 조절된 배양기에서 14일간 배양하였다. 저조도(10 μmol photon m-2 s-1)는 Petri dish를 검은색 망으로 감싸서, 그리고 고조도(120, 150 μmol photon m-2 s-1)는 배양기 내의 광원인 형광등과 Petri dish의 거리를 조절하여 만들었으며 디지털 조도계(DX-200)로 측정한 후 Olla et al. (2000)의 방법으로 광(Lux)을 조도(μmol photon m-2 s-1로 변환(1 μmol photon m-2 s-1 = ca. 51.17 Lux)하였다. 배아는 광학현미경(Olympus BH-2, Japan) 하에서 7 일 간격으로 관찰하였으며, 디지털카메라(Canon IXUS 860IS) 촬영하여 Image J 프로그램(1.40s, National Institute of Health, Bethesda, USA)으로 실험구별로 배아 30개체의 면적을 측정하고, 상대생장률은 아래의 식으로 계산하였다(Ichiki et al., 2000). 배양액은 2일 간격으로 교환하였으며, 이때 발견된 오염물질은 유화용 붓으로 제거하였으며 조도별로 3개의 반복구를 두었다.
RGR = 100(lnA2-lnA1)/T2-T1
A1, 실험 개시 때 배아면적; A2는 측정 시 배아면적, T1, T2 는 배양 일수
암조건에 대한 2종 배아의 생존 반응을 확인하기 위하여, 위와 동일한 배양 방법으로 실험을 실시하였으며, Petri dish는 알루미늄 호일로 밀봉하여 광을 차단하였다. 배아는 21일 동안 20℃, 34 psu와 12:12h LD로 세팅된 배양기에서 배양하면서 3일 간격으로 암조건 노출기간에 따른 배아의 생존반응을 확인 하였으며 기간별로 3반복구를 두었고 반복구별로 배아 30개체의 면적을 측정하였다
일장(daylength)이 2종의 배아 생장에 미치는 영향을 확인 하기 위하여, 4개의 다른 일장(8, 12, 14, 16 h)과 동일한 온도(20℃), 염분(34 psu), 조도(50 μmol photon m-2 s-1)로 조절된 배양기에서 14일 동안 배양하였다. 배아의 생장은7일 간격으로 배아 30개체의 면적을 측정한 후 상대생장률을 계산하였으며 3개의 반복구를 두었다.
두 종의 배아 생장에 대한 염분의 영향을 확인하기 위하여, 배아가 부착된 슬라이드글라스를 PES 배양액이 담긴 Petri dish에 넣어서 14일 동안 배양 하면서 7일 간격으로 배아의 면적을 측정하여 상대생장률을 계산하였다. 실험구별로 배아 30개체의 면적을 측정하였으며 3회 반복 실험을 실시하였다. 배양기의 온도(20℃), 조도(50 μmol photon m-2 s-1) 및 광주기(12:12h LD)는 동일하게 세팅하였으며 염분은 20, 27, 34 psu로 다르게 하였다. 저염분의 실험구는 멸균해수에 1차 증류수를 첨가하여 염분계(Atago, S/Mill-E)로 확인하며 해수의 염분 농도를 낮춘 후 배양액을 만들어 사용하였다.
무절산호조류 배아의 건조에 대한 내성을 비교하기 위하여, 슬라이드글라스 조각에 부착된 포자는 실험 전에 계수하여 각각 건조 시간이 라벨 된 Petri dish에 넣어 배양액이 공급되지 않은 상태로 배양기 안에서 넣었다. 이때 배양기는 20℃, 50 μmol photon m-2 s-1과 12:12h LD로 세팅되었으며, 건조 기간은 0, 10, 20, 30, 40, 80 minute로 다르게 하였다. 배아는 건조 후에 GeO2 (5 mgL-1)가 포함된 PES 배양액(30 mL)이 담긴 Petri dish로 이동시켜서 건조시킬 때와 동일한 조건에서 3일 동안 배양하면서 배아의 회복 정도를 확인하였다. 배양 3일 후 광학현미경 하에서 회복되지 않고 사망한 배아를 계수하였고 실험 개시 전 배아 개체수와 비교하여 사망률을 계산하였다. 배아 면적의 50% 이상이 분홍색에서 하얀색으로 변한 것을 사망한 배아로 판정하였다.
조도, 일장과 염분이 납작돌잎과 진분홍딱지 배아의 생장과 건조가 배아의 사망에 미치는 영향을 파악하기 위한 통계분석은 Cochran’s test로 등분산검정(homogeneity of variances)을 실시하여 데이터의 동질성을 확인한 후, two-way ANOVA test로 유의차를 검정하였고, 평균에 대한 유의차가 발견되면 Tukey’s HSD test 방법으로 사후 검정을 실시하였다(Sokal and Rohlf, 1995). 데이터 분석을 위해 사용된 통계 프로그램은 STATISTICA version 5.0 이었다.
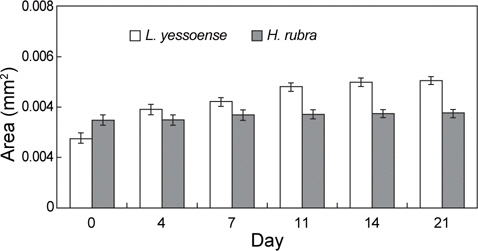
무절산호조류 포자는 1일 후 부착하였으며, 실험 개시 전에 배아 면적은 납작돌잎이 0.0027 mm2 (n=30 sporelings)였고 진분홍딱지는 0.0035 mm2 (n=30 sporelings)로서 진분홍딱지 배아가 약간 컸다. 암조건에서 납작돌잎의 일부 배아는 세포분열 없이 붉은색을 띄다가 점차 탈색되어 21일 이후에는 하얗게 사멸하였으나 생존한 배아는 분열하여 0.0050 mm2 (n=30 sporelings)까지 꾸준히 증가하였다(Fig. 1). 하지만, 반복구별 생존한 배아는 많지 않아서 3개 반복구 자료를 통합하였으며, 이로 인하여 통계처리가 불가능하였다. 한편, 진분홍딱지의 모든 배아는 세포 분열되지 않았고 배양 초기부터 하얗게 탈색된 배아가 나타나기 시작하였고 배양 21일 이후에는 대부분의 배아가 사멸하였다.
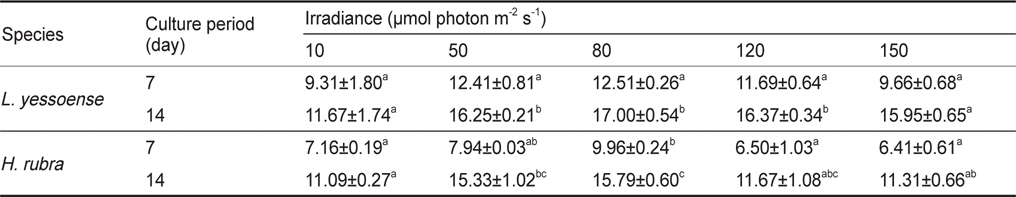
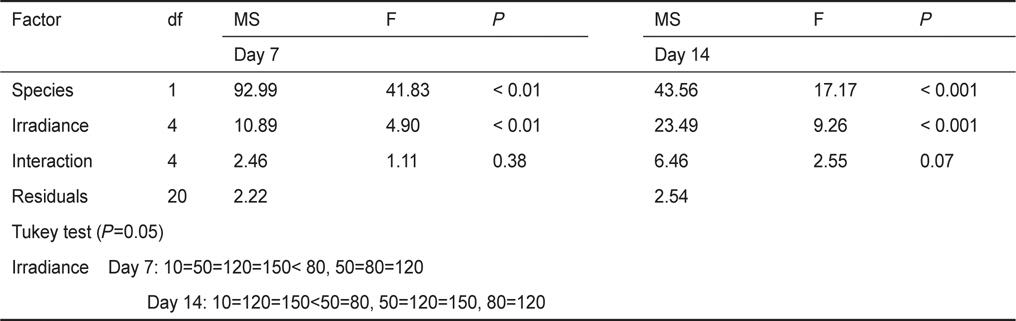
납작돌잎의 배아는 10-150 μmol photon m-2 s-1의 다양한 조도에서 생장이 가능하였으며, 배양 7일 후에 배아 면적은 0.011-0.016 mm2였고, 14일 후에는 0.015-0.030 mm2으로 80 μmol photon m-2 s-1에서 최대였다. 납작돌잎의 상대생장률은 배양 7일에 9.31-12.51% day-1, 14일에는 11.67-17.00% day-1로 80 μmol photon m-2 s-1에서 최대값을 보였다(Table 1). 납작돌잎의 조도별 상대생장률은 배양 7일 후에 차이가 없었으나, 14일 후에 유의차를 보였다(
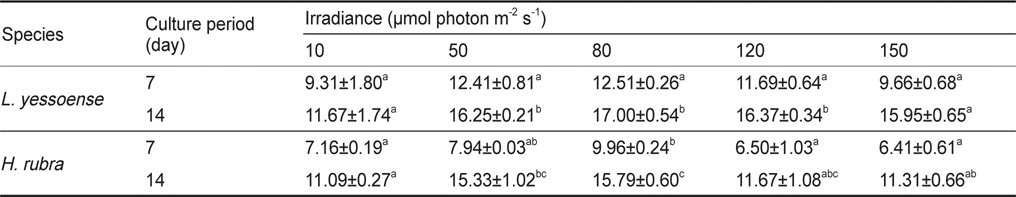
Average RGR (% day-1) of Lithophyllum yessoense and Hildenbrandia rubra sporelings grown at various irradiance levels for 7 and 14 days. Culture conditions were 20℃, 34 psu, and 12:12 h LD. Values are means ± SE (n=3 replicates)
납작돌잎 배아의 생장률은 배양 7일과 14일 후에 모두 유의차가 나타났으며, 납작돌잎이 진분홍딱지에 비해 실험조도에서 생장률에 빠른 것으로 확인되었으나, 생장을 위한 최적 조도는 80 μmol photon m-2 s-1로 동일하였다(Table 2).
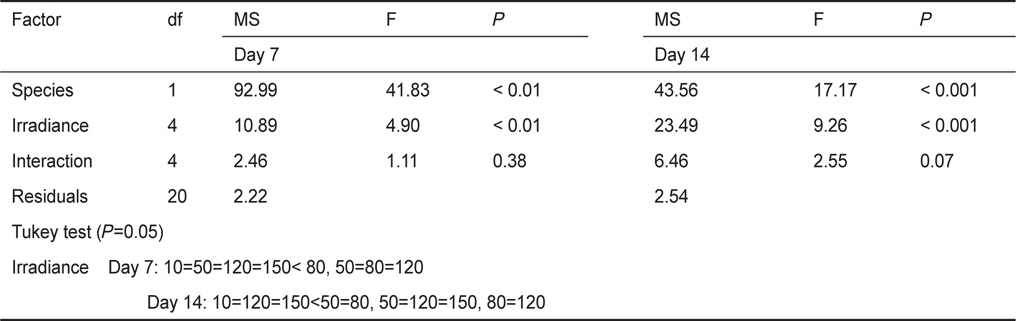
Results of two-way ANOVA and Tukey HSD tests for the effects of irradiance on RGRs (% day-1) of the two species, Lithophyllum yessoense and Hildenbrandia rubra sporelings grown at various irradiance levels
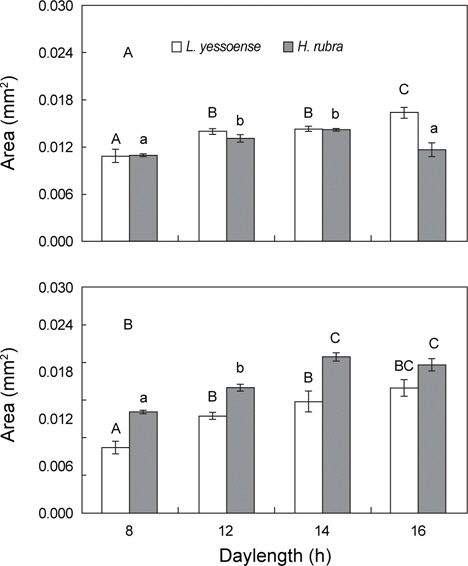
납작돌잎과 진분홍딱지의 배아는 8-16 h의 일장에서 생장하였으며, 배아 생장에 최적 일장은 납작돌잎이 16 h, 진분홍딱지가 14 h였으며 두 종 모두 단일 조건에 비해 장일 조건에서 빠른 생장을 보였다(Fig. 2A, B). 배양 7일 후에 납작돌잎은 진분홍딱지에 비해 빠른 생장을 보였으나(Two-way Anova,
납작돌잎의 배아 면적은 배양 7일 후 16 h에서 0.016 mm2로 최대였고 12, 14h와 16 h에서는 배양 초기 배아의 면적에 비해 5배 증가하였으며(Fig. 2A), 상대생장률은 9.80-12.75% day-1였다. 납작돌잎의 일장별 생장률은 배양 7일 후에 유의차를 보였으며(
진분홍딱지의 배아 면적은 배양 7 일에 14 h에서 최대였고 (0.014 mm2), 8 h에서 0.011 mm2로 최소였으며(Fig. 2A), 배아의 상대생장률은 9.89-11.74% day-1로 중일조건(12 h=14 h)에서 단·장일(8 h=16 h)에 비해 높게 나타났다(Tukey HSD test,
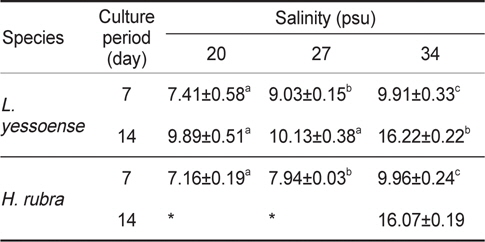
무절산호조류 두 종의 배아는 모두 배양 7일까지 20, 27과 34 psu에서 유사한 생장 패턴을 보이다가 7일 이후 저염분에서 배아의 생장은 급감한 후 일부 배아가 사멸했다. 납작돌잎의 배아 면적은 7일 후 0.008-0.011 mm2였고 상대생장률은 7일에 7.41- 9.91 % day-1로서 염분별 차이(34 psu> 27 psu > 20 psu)를 보였다(Table 3). 또한, 14일 후에 납작돌잎 배아면적은 0.011- 0.027 mm2였으며, 생장률은 9.89-16.22 % day-1로서 20 psu와 27 psu에서는 차이가 없었으나 34 psu에서 빠른 생장을 보였다(Table 3). 진분홍딱지 배아는 배양 7일까지는 모든 염분 실험구(20, 27, 34 psu)에서 생장하였고 사후검정(Tukey HSD test)의 결과는 염분별 생장률의 차이가 있음을 나타냈다(Table 3). 하 지만, 진분홍딱지 배아는 배양 11일 이후 20 psu와 27 psu에서 사멸하였다. 배양 14일 후, 생존한 배아는 34 psu에서만 관찰되었으며 이때 배아면적은 0.033 mm2였고 상대생장률은 16.07% day-1이었다(Table 3).
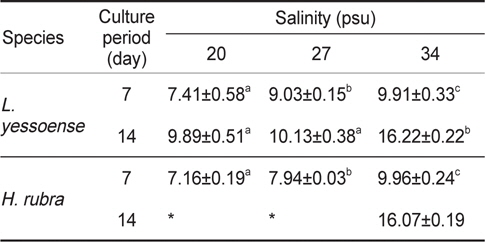
Average RGR (% day-1) of Lithophyllum yessoense and Hildenbrandia rubra sporelings grown at various salinity levels for 7 and 14 days. Culture conditions were 20℃, 50 μmol photon m-2 s-1, and 12:12 h LD. Values are means ± SE (n=3 replicates)
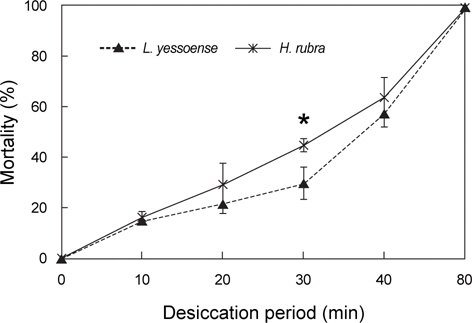
납작돌잎과 진분홍딱지 배아의 사망률은 80분의 대기 노출 후 약 99%였으며, 건조 기간에 비례하여 증가하였다(Fig. 3). 납작돌잎 배아의 사망률은 10-40분의 건조 기간에는 진분홍딱지의 배아에 비해 상대적으로 낮은 사망률을 보였으며, 이때 사망률은 납작돌잎이 15.09-57.30%였으며 진분홍딱지는 16.45- 63.55%로 확인되었다(Fig. 3). 배아단계에서 납작돌잎은 진분홍딱지에 비해 높은 사망률을 보여 건조에 대한 내성이 낮은 것으로 확인되었으나(P<0.05), 2종의 배아 사망률은 건조 30분 후에 가장 차이가 있는 것으로 나타났다(Fig. 3).
본 연구에서 납작돌잎(
또한, 납작돌잎과 진분홍딱지의 배아는 모두 단일 조건에 비해 장일 조건에서 빠른 생장을 보였으나, 최대 생장은 납작돌잎은 명기16 h에서, 진분홍딱지는 명기14 h로 종별 차이를 보였다. 일본 북해도에 서식하는 납작돌잎의 배아는 10 h와 12 h의 일장에 비해 14 h의 일장에서 빠른 생장을 보였고(Ichiki et al., 2000), Gao et al. (1993)은 유절산호조류인
납작돌잎과 진분홍딱지의 배아는 모두 저염분(실험 염분20, 27, 34 psu)에서 생장이 감소하는 패턴을 보였지만, 저염분에 대한 내성은 납작돌잎이 진분홍딱지에 비해 강한 것으로 확인 되었다. 선행연구에서 한국산 납작돌잎(
무절산호조류는 직립형 해조류와는 다르게 저서 바닥에 각상형으로 부착하여 자라며 평균해수면 아래에 주로 서식하기 때문에 건조(desiccation)에 매우 민감하게 반응한다(Wilson et al., 2004). Maërl을 형성하는
무절산호조류는 느린 생장(<1 cm yr-1)을 보이지만 자연상태에서 지속적으로 관찰되는 기능적 그룹이며, 본 연구에서 사용한 진분홍딱지의 최대생장은 1.2 mm yr-1 로서 납작돌잎 속(genus)
결론적으로 우리나라 갯녹음 해역에서 관찰되는 납작돌잎은 암조건에서 배아가 3주 이상 생존하며 진분홍딱지에 비해 염분과 건조에 대한 내성이 좋고 다른 종에 비해 빠른 생장을 보이는 것으로 확인되었다. 또한, 선행연구에서 납작돌잎은 연중 생식기집을 형성하고 포자 방출기간(1-3월 제외)이 길며, 고온과 높은 조도에서도 높은 생산성을 보이고, 표층세포의 박리를 통하여 다른 해조류 배아의 부착을 억제하고 조식동물의 유생을 착생시키는 특성(Masaki et al., 1981, 1984; Noro et al., 1983; Morse and Morse, 1984)을 가지고 있어서 갯녹음 해역에서 주로 관찰되는 것으로 사료된다. 본 연구에서 진분홍딱지는 납작돌잎에 비해 암조건, 염분, 건조와 같은 환경변화에 대한 적응력과 생장에 의한 경쟁력은 상대적으로 낮지만, 여전히 암조건과 건조 내성은 좋아서 환경변화가 심하고 부유 퇴적물이 많아 탁도가 높은 서해안에서 번무하는 것으로 사료된다. Dethier and Steneck (2001)은 진분홍딱지는 상처에 대한 재생력이 다른 종에 비해 탁월하였으며,