아르테미아(Anostraca: Artemiidae)는 소형 갑각류로써 세계 각지의 내륙 염호나 염전에 서식하며, 생존에 적합한 환경에서는 난태생(ovoviviparous)으로 번식하지만, 높은 염분도, 저 산소 환경과 같은 유해한 환경에서는 태생(oviparous)으로 번식하여 내구란을 생산한다(Clegg and Trotman, 2002; Nambu et al., 2004).
형질전환 아르테미아 생산에 성공할 경우, 첫째, 아르테미아 내구란은 쉽게 확보가 가능하므로 유전자 이식을 위한 시료의 준비 과정이 매우 용이하며, 둘째, 작은 공간에서 경제적으로 유전자가 이식된 개체의 보관이 용이하다는 장점이 있고, 셋째, 매우 짧은 생활사를 가지고 있어 수 세대에 걸친 이식 유전자의 영향을 단기간에 연구할 수 있으며, 넷째, 성체의 크기가 1 cm 정도로 작기 때문에 작은 면적으로 대량사육이 가능하다는 장점이 있고, 다섯째, 본 종이 동물성 플랑크톤으로서 거의 모든 사육어류의 초기먹이로 공급되므로 먹이사슬을 통한 외래유전자의 전이 유무를 판단할 수 있다.
리포터 유전자는 그의 유전자 산물을 분석하기 용이하여 유전자 이식 연구 시 프로모터의 기능과 활성 조사 및 유전자 이식 조건의 확립 등의 연구에 사용되어 왔다(Kim and Nam, 1994; Sin, 1997). 이러한 리포터 유전자 중 lacZ유전자는 Escherichia coli에서 유래되어 lactose 대사에 관여하는 β-galactosidase 효소를 암호화하는 유전자로서 이의 산물인 β-galactosidase는 여타 유전자 산물에 비해 분석이 용이하여 포유류(Kopp et al., 2007; Shimada et al., 2012) 뿐만 아니라 어류(Adám et al., 2000; Verri et al., 2003; Zheng et al., 2006) 및 갑각류(Arenal et al., 2004) 등 다양한 생물의 유전자 이식에 널리 사용되고 있다. 그러나 lacZ유전자는 대부분의 포유류에 내재하고 있으며, 패류 및 어류와 같은 다양한 해양생물에도 내재하고 있다고 보고되고 있어, 내재 β-galactosidase 발현 유무 및 내재와 외래 유전자에 의한 β-galactosidase의 발현 구분을 위한 연구가 선행되어야 한다(Dube et al., 2009).
본 연구에서는 아르테미아 내구란을 해양 생태계 내 외래유전자의 전이를 평가할 수 있는 형질전환 생물모델로서 개발하기 위하여 lacZ 유전자를 아르테미아 내구란에 이식하여 리포터 유전자로서의 유용성을 검토하였다.
본 실험에 사용된 아르테미아는 Argent (Argent, USA)사로부터 Artemia franciscana SFB (San Francisco Bay) strain (Lot No., BG1503C)을 구입하여 사용하였다. A. franciscana는 5 μm 미세필터로 여과한 해수(30-33 psu)를 사육수로 사용하였고, 26-28°C로 유지하면서, ‘14 hrs : 10 hrs = light : dark’ 광주기 조건에서 사육하였다. 2일에 한번씩 80-100%씩 환수하였으며, 미세조류(Dunaliella tertioleata and tetraselmis suecica)를 먹이로 공급하였다.
효율적인 유전자 도입을 위하여, NaCIO 처리 시간에 따른 A. franciscana 내구란의 난각 제거 정도 및 부화율을 조사하였다. 내구란을 10% NaOH에 1분간 담가 수화시킨 후, NaCIO 를 30초에서 10분까지 12개의 구간으로 나누어 난각 제거를 유도하였다. 처리 후 1차 증류수로 수세하여 해부현미경(Olympus, Japan)으로 난각 제거 정도를 확인하였고, 9 cm petridish(SPL, Korea)에서 24시간 동안 배양한 뒤, 부화율을 5반복으로 확인하였다.
본 실험에 사용된 도입 유전자는 Nam et al. (1998)이 유전자 이식에 사용한 바 있는 pRSV (promoter RSV)- lacZ를 사용하였다. pRSV- lacZ는 E. coli에 transformation한 뒤, LB agar 배지에서 배양하여 alkaline-lysis 방법으로 추출하여 Cleanup kit (Macrogen, Korea)를 이용하여 정제하였다. 정제된 plasmid는 TE buffer (10 mM Tris-Cl, 1 mM EDTA, pH 8.0)에 1 μg/μL 농도로 녹여 particle bombardment에 사용하였다.
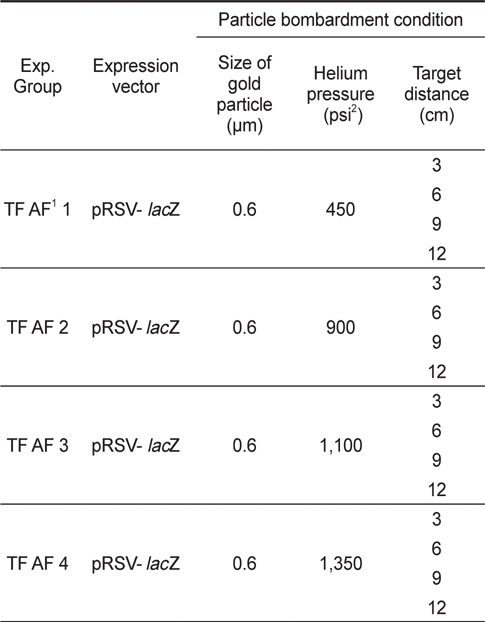
Particle bombardment는 Biolistic PDS-1000 / He Particle Delivery System (Bio-Rad, USA)을 이용하여 수행하였고, Sanford et al. (1993)의 방법론에 따라 gold particle 세척과 pRSV- lacZ로 코팅된 gold particle를 준비하였다. 난각이 제거된 내구란 약 0.05 g (0.1 g; 1.8 x 104개)을 지름 2.5 cm 크기의 여과지에 한 층으로 깔아 준 뒤, particle bombardment 처리를 하였으며, 그 처리조건은 Table 1과 같다.
Particle bombardment 처리 조건에 따른 아르테미아의 부화율을 조사하기 위해 각 실험군에서 무작위로 50알씩 3개의 50 mL tube에 나누어 담고, 여과해수 10 mL을 첨가하여 24시간 동안 배양한 후, 부화율을 측정하였다.
Particle bombardment 처리 조건 별 유전자 이식 빈도를 확인 하기 위해 PCR 분석을 수행하였다. 처리군을 배양 24시간째에 각 조건 별로 30미씩 확보한 뒤, 이들을 모아 추출한 DNA를 주형으로 PCR 분석을 수행하였다. PCR에는 PCR premix (ProFi PCR premix, Bioneer, Korea)를 사용하였으며, 프라이머는 pRSV-LacZ 에서 프로모터를 제외한 lacZ 유전자 전 부위가 증폭되도록 설계하였다[Rsv- lacZ 2F (5’-GTTGCAGATCCATGCACGTA-3’) and Rsv- lacZ 3R (5’-AGTCACGACGTTGTAAAACG-3’)]. PCR 조건은 94°C에서 2분 동안 초기 반응 후(initial-activation), 94°C에서 20초(denaturation), 58°C 에서 20초(annealing) 그리고 72°C에서 20초(extension)로 33회 수행하였다.
X-gal 염색을 위하여, A. franciscana를 1.25% glutaraldehyde에서 24시간 고정한 뒤, phosphate buffered saline (PBS)로 5분 간격으로 4회, 그리고 10분 후 2회 세척한 후, Nam et al. (1998)의 방법에 따라 X-gal staining buffer [1.2 mM 5-bromo-4-chloro-3-indolyl-beta-D-galactopyranoside, 0.1% triton X-100, 1 mM MgCl2, 6 mM K4(Fe(CN)6), 6 mM K3(Fe(CN)6) in PBS]를 첨가하여 37°C 배양기(Sanyo, Japan)에서 12시간 동안 반응시켰다. X-gal 염색 반응이 완료된 시료는 PBS로 2회 세척 한 후, 해부현미경(Olympus, Japan)으로 X-gal 염색의 유무를 관찰하였다. 또한 X-gal 염색에 미생물의 영향을 최소화 하기 위해서 항생제 chloramphenicol 20 ppm에서 배양한 A. franciscana를 이용한 X-gal 염색 실험을 수행하였다.
NaCIO 처리 시간에 따른 A. franciscana 내구란의 부화율과 particle bombardment 처리 조건에 따른 부화율은 SAS 프로그램(version 5.1.2600)에 의한 ANOVA test를 이용하여 분산 분석한 후 Duncan의 다중위 검정을 실시하였다. 데이터 값은 유의수준 5% 이내(P<0.05)로 각 평균값에 대한 유의적 차이를 조사하였다.
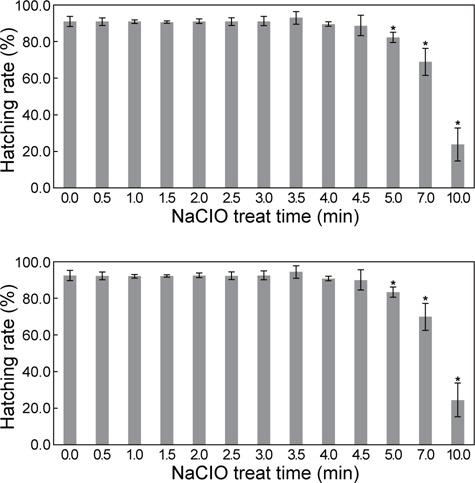
NaCIO 처리 시간에 따른 A. franciscana 내구란의 부화율은 0분에서 4분 30초 처리군까지 유의적인 차이가 없이 높게 나타 났다(88.74±5.59-93.0±3.37%). 그러나 5분 처리군부터 부화율이 낮아지기 시작하여, 10분 처리군에서는 23.9 ± 9.09%로 가장 낮게 관찰되었다(Fig. 1). 해부 현미경을 이용하여 NaCIO처리 시간에 따른 난각 제거 정도를 확인한 결과, 2분 처리군부터 50% 이상 난각이 제거된 내구란이 관찰되기 시작하여, 3분 이상의 처리군에서는 대부분 난각이 제거된 상태였으며, 5분 이상 처리군부터 폐사한 알이 관찰되었다. 따라서 A. franciscana 내구란의 난각을 제거하기 위한 적정 NaCIO 처리 시간은 부화율과 난각 제거 정도를 관찰한 결과, 3분 30초으로 확인되었다.
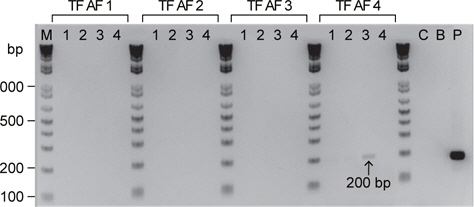
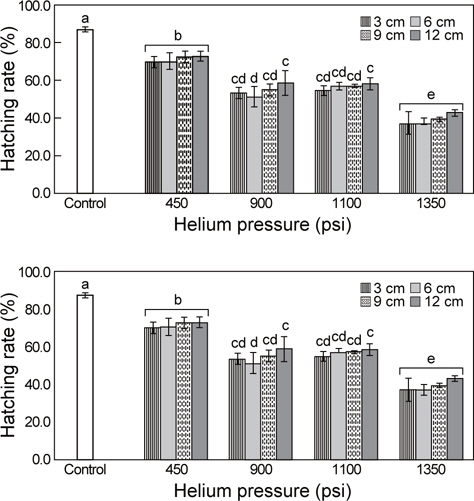
Particle bombardment 방법을 이용한 유전자 이식 실험군에 대한 PCR 분석 결과, 유전자를 9 cm 거리 (target distance)에서 1,350 psi (pound force per square inch) 헬륨가스 압력(helium pressure)으로 주입하는 조건에서만 pRSV-lacZ 유전자가 증폭 되었으며, 그 외 다른 실험군들에서는 그 증폭이 관찰되지 않았다(Fig. 2).
대조군의 부화율이 86.9 ± 1.3%인 것에 비해 TF AF 1 (transformed A. franciscana 1)은 69.7-72.6%, TF AF 2는 51.2- 58.5%, TF AF 3은 54.6-58.1%, TF AF 4에서는 37.0-42.9%로 관찰되었다. 처리군 간 부화율에서는 헬륨가스의 압력이 높아 질수록 부화율이 유의적으로 낮아졌다(P< 0.05). 또한 동일한 헬륨가스 압력조건하에서 유전자와 목표물의 거리에 따른 부화율은 유의적인 차이가 없었다(Fig. 3).
LacZ 유전자가 이식된 실험군의 발현여부를 확인하기 위해 X-gal 염색을 수행한 결과, 유전자 이식군뿐만 아니라 대조군 모두에서 염색되었다. 이에 아르테미아의 발생단계에 따른 Xgal 염색을 수행한 결과, 노플리우스 단계부터 성체까지의 전 발생단계에서 조직 전체에 강하게 발현되는 것으로 관찰되었으며(Fig. 4), 미생물의 영향을 최소화하기 위해 chloramphenicol 20 ppm에서 배양한 아르테미아 전 조직에서도 매우 진하게 Xgal 염색이 되는 것으로 관찰되었다(Fig. 5).
아르테미아 내구란에 유전자를 이식할 경우에 난각의 제거는 알의 탄력성 및 강도를 낮춰 particle bombardment를 이용한 유전자의 이식 시 효율성을 증대시킬 수 있다고 Gendreau et al. (1995)는 보고한 바 있다. 이에 난각을 제거하기 위한 방법으로 Sorgeloos et al. (1977)은 아르테미아 내구란을 담수에서 1시간 동안 포기를 하면서 수화 과정을 수행한 후, 2.12% 의 차아염소산나트륨(NaCIO)으로 7-10분 동안 처리하는 방법을 보고하였고, Moretti et al. (1999)은 내구란을 수산화나트륨(NaOH)에 담가 수화 과정을 수행한 후 NaCIO에서 20분 동안 처리하는 방법을 보고한 바 있다. 본 연구에서는 장기간의 저장액처리에 의한 수화 과정을 거치지 않고도 12%의 NaCIO로 3분 30초 처리한 실험군의 부화율이 93.0±3.37%로 높게 나타났으며, 최초처리 2분 후부터 난각이 제거되기 시작하여 5분 이후부터는 폐사되는 내구란이 관찰되었다. 이에 따라, 부화율과 난각 제거 정도를 고려하였을 때, 난각을 제거하기 위한 적정 NaCIO 처리 시간은 3분 30초로 확인되었다. 기존의 보고들은 NaCIO의 높은 독성(López-Galindo et al., 2010) 때문에 저농도의 NaCIO를 처리하여 난각을 제거하는 방법이나, 이는 시간이 많이 소요되는 단점을 가지고 있어 본 연구에서 사용된 방법이 유전자 이식을 위한 내구란의 난각 제거에 보다 효율적인 방법으로 생각된다.
리포터 유전자는 일반적으로 측정이 용이한 표현형을 가진 유전자 산물을 암호화하는 것으로, 유전자 발현, 규정 및 신호 전달과 관련된 세포 연구에 유용하며 특히, 유전자 이식 연구 시 프로모터의 기능과 활성 조사 및 유전자 이식 조건 확립 등의 연구에 사용되어 왔다(Kim and Nam, 1994; Jiang et al., 2008). 리포터 유전자 중 lacZ 유전자는 E. coli에서 유래되어, lactose 대사에 관여하는 β-galactosidase 효소를 암호화하는 유전자로, 세포 내 β-galactosidase 발현 패턴을 통한 다양한 프로모터 유전자의 특징 연구에 이용되고 있다(Kopp et al., 2007). 본 연구에서는 lacZ 유전자를 아르테미아에 이식하여 PCR 분석을 수행한 결과, 유전자를 9 cm 거리에서 1,350 psi 헬륨가스 압력으로 주입한 조건에서만lacZ 유전자가 증폭되는 것을 확인할 수 있 었다. 그러나 lacZ 유전자의 발현 분석을 위한 X-gal 염색 결과, 유전자 이식군뿐만 아니라 대조군 모두에서 진하게 염색되었다. 아르테미아는 미세조류뿐만 아니라 미생물도 먹이로 섭취 하므로 β-galactosidase 발현 분석 시에 미생물 오염에 의한 Xgal 염색의 가능성을 배제할 수 없다(Van Stappen, 1996; Kim et al. 1996). 이에 chloramphenicol 20 ppm을 첨가하여 무균상태에서 배양시킨 아르테미아를 이용하여 X-gal 염색을 수행한 결과, chloramphenicol 첨가 유무와 상관없이 모두 진하게 염색되었다. Kim et al. (1996)은 4가지 패류(참전복 Haliotis discus hannai, 참굴 Crassostrea gigas, 진주조개 Pinctada fucata martensii, 피조개 Anadara broughtonii)와 6가지 어류 (미꾸라지 Misgurnus mizolepis, 잉어 Cypinus carpio, 틸라피아 Orechromis niloticus, 문치가자미 Limanda yokohamae, 돌가자미Kareius bicoloratus, 넙치 Paralichtys olivaceus)의 근육부위를 제외한 모든 장기에서 β-galactosidase가 발현하는 것을 확인하였으며, Kim and Nam (1994)은 미꾸라지의 부화개체에서 난황, 척추, 장기 및 미병부위 등에서 β-galactosidase 발현을 확인한 바 있다. 또한 Hostetler et al. (2003)은 송사리 Oryzias latipes의 소화관에서 β-galactosidase 발현을 확인하였고, Ueno et al. (1994)은 긴꼬리 붕어 Carassius auratus grandoculis의 다양한 장기에서 β-galactosidase 발현을 보고한 바 있다. 본 연구에서도 아르테미아 전 발생단계의 모든 조직에서 β-galactosidase 활성이 관찰되어 이전의 연구결과와 일치하였다.
대부분의 포유류 세포 뿐만 아니라, 어류 및 패류 등과 같은 일부 해양생물에도 β-galactosidase 활성이 존재하기 때문에, X-gal 염색 분석 시 pH, 온도 및 고정액에 변화를 주어 내재 β-galactosidase 활성 정도를 조사한 연구가 이루어져 왔다(Jurado et al., 2004; Kopp et al., 2007; Shimada et al., 2012). Weiss et al. (1999)은 쥐(Sprague-Dawley rats)의 다양한 조직은 산성 조건에서 내재 β-galactosidase의 활성이 높아진다고 하였으며, Kopp et al. (2007)은 리소좀의 β-galactosidase 활성이 pH 4에서 가장 높다는 것을 보고한 바 있다. 또한 Kim and Nam (1994)은 미꾸라지의 β-galactosidase 활성은 pH가 증가 할수록 활성이 떨어지며, pH 4.5에서 가장 높다고 보고하였다. 그러나 이들 종과는 달리 아르테미아는 pH 7 조건에서 내재 β-galactosidase의 활성이 매우 높은 것으로 관찰되었으며, 중상 이상의 pH에서 활성을 띠는 E. coli의 β-galactosidase 활성조건과 동일한 것으로 확인되었다.
본 연구에서는LacZ 유전자를 이식하였을 때, 아르테미아 내의 β-galactosidase을 암호화하는 유전자의 염기서열이 박테리 아 유래lacZ 유전자의 염기서열과 상이하여, PCR 분석에서는 유전자가 이식된 개체에서만 lacZ 유전자가 증폭되었지만, X-gal 염색법을 이용한 발현 분석에서는 내재 β-galactosidase가 전 발생단계에서 강하게 발현되어, 유전자 이식군 뿐만 아니라 대조군에서도 염색되었다. 따라서 아르테미아의 외래 유전자 이식 시, lacZ 유전자를 리포터 유전자로 사용하는 것은 부적합한 것으로 판단된다. 이에 따라, 형질전환 아르테미아 생산을 위한 적합한 리포터 유전자의 개발이 필요할 것으로 사료된다.