일조량, 계절, 시공간에 따라 환경수 내의 용존산소량은 현저히 다른 양상을 나타낸다. 이러한 환경적 용존산소량(dissolved oxygen, DO)의 변동성은 어류의 성장, 생식 발달과 밀접한 영향을 가진다(Wagner et al. 1986, Soitamo et al. 2001). 어류는 저산소(hypoxia) 환경 조건에서 생존하기 위하여 호흡, 대사변화 및 산소 전달을 수행하는 헤모글로빈(hemo-globin) 분자의 변형 등 다양한 생리적, 생화학적 적응 과정을 거치게 된다(Shoubridge and Hochachka, 1981; Weber, 1982). 포유동물의 경우, 체내 hypoxia에 의해 높은 발현이 유도 되는 포도당 수용체(glucose transporter), 당분해 효소(glycolytic enzymes), 적혈구생성 촉진인자(erythropoietin), 트렌스페린(transferrin), 혈관내피 성장인자(vascular endothelial growth factor, VEGF) 등 40가지 이상의 유전자가 보고된 바 있다(Semenza 1999). 하지만, 포유동물과 비교하여 어류의 관련 유전자의 분리와 발현조절, 기능에 대한 연구는 상대적으로 부족한 실정이다. 포유동물에서 hypoxia 의존적인 유전자들의 전사활성은 주로 저산소증유발인자(hypoxia-inducible factor-1, HIF-1)에 의해 조절된다. HIF-1은 HIF-1α과 HIF-1β로 구성된 이형이량체(heterodimer)로서 전사활성을 조절하며, 특히 HIF-1α는 세포 내 hypoxia에 특이적으로 반응하는 전사조인자로 보고되고 있다(Wang et al. 1995, Wang and Semenza 1995). HIF-1α mRNA와 단백질은 hypoxia 가 유발될 경우 발현량이 현저히 증가하게 되며(Huang et al. 1996, Kallio et al. 1997), 반대로 정상적인 혈중 산소조건에서 HIF-1α 단백질은 26S proteasome에 의해 신속히 분해되어 낮은 수준으로 회복 되어진다(Salceda and Caro 1997, Huang et al. 1998).
최근 포유동물의 hypoxia에 의해 발현이 유도되는 단백질로서 스타니오칼신(stannio-caincin, STC1)이 보고된 바 있다. STC1은 경골어류에서 칼슘의 흡수를 억제시키는 항과잉칼슘 호르몬으로서 그 기능이 최초로 밝혀진 호르몬이다(Butkus et al. 1987, Sundell et al. 1992). 포유류 STC1은 항과잉칼슘 작용과 더불어 위암과 난소암 세포의 증식, 전이 및 종양형성에 관여하여, 마우스 난소의 성스테로이드 분비를 조절한다(Luo et al. 2004, Liu et al. 2010, He et al. 2011). STC1 상동단백질인 STC2는 포유동물에서 최초로 분리되었으며, STC-1과는 비교적 낮은 상동성(~30%)을 나타낸다(Chang and Reddel 1998, DiMattia et al. 1998, Ishibashi et al. 1998). 하지만, STC2는 유방암, 신장, 췌장암의 발달에 따라 특이적으로 발현이 증가하고, 종양 성장과 전이를 촉진한다는 점에서 STC1과 유사한 생리적 기능을 나타낸다(Bouras et al. 2002, Ieta et al. 2009, Meyer et al. 2009). 대부분의 종양 성장과 전이는 세포내 hypoxia와 소포체 스트레스(endoplasmic reticulum stress)와 밀접한 연관성을 지니고 있다. 이러한 현상은 암세포의 생존을 위한 신생혈관형성(angiogenesis)의 조건에 필수적이며, 이 과정 중 HIF-1에 의해 발현이 중재되는 다양한 유전자들이 암세포 발달에 관여된다(Koumenis et al. 2002, Koumenis and Wouters 2006). STC-1은 인두암세포주 CNE-2에서 STC-2는 난소암세포주 SKOV3에서 세포의 증식에 따른 hypoxia에 의해 발현이 증가된다고 보고된 바 있다(Yeung et al. 2005, Law and Wong 2010). STC-1과 STC-2 유전자의 프로모터 영역 내 HIF-1α 단백질의 결합영역(hypoxia response element, HRE)이 존재하며, HIF-1α에 의해 STC-1과 STC-2 유전자의 전사 활성이 유도된다(Yeung et al. 2005, Law and Wong 2010).
어류의 hypoxia에 의한 HIF α subunits (HIF-1α, -2α, -3α) 유전자, 단백질의 발현유도와 전사조절 메커니즘은 포유류의 경우와 유사하게 나타나며(Soitamo et al. 2001, Rahman and Thomas 2007, Chen et al. 2012), 그 외 hypoxia 의존적 발현 양상을 보이는 유전자들이 동정되고 있다(Ju et al. 2007, Wawrowski et al. 2011). 어류의 STC2는 복어(Takifugu rubripes), 제브라피쉬(Danio rerio), 넙치(Paralichthys olivaceus)에서 유전자가 분리되고 일부 기능이 연구되어 있지만(Luo et al. 2005, Shin and Sohn 2009), hypoxia에 의한 어류 내 생리적 작용 및 HIF-1와의 연관성 또한 명확하지 않다. 본 연구는 광염성 Oryzias dancena의 hypoxia 반응 유전자 HIF-1α mRNA 발현 및 낮은 용존산소에 따른 STC2 mRNA의 발현 변화를 분자 수준에서 밝히고자 하였다. 향후, 환경중의 용존산소 부족에 따른 항상성 유지에 필요한 생리적 조절기구를 이해하는 기초 연구가 될 것으로 사료된다.
실험어 O. dancena는 부경대학교 해양바이오신소재학과 남윤권 교수님으로부터 제공 받았다. 수컷 O. dancena(약 6월령)를 대조군(control; 15마리) 및 hypoxia 실험군(hypoxia; 15마리)으로 나누어 수용하였다. 각 사육수조(35×19×22 cm)의 수온은 25℃ 내외로 유지하였으며, 실험기간 중 사료는 공급하지 않았다. 실험 전 2일 동안 안정화를 시킨 후, hypoxia 실험군의 사육수는 질소가스(100% N2)를 주입하여 낮은 용존산소 조건을 유도하였다. 각 군의 용존산소농도와 수온은 용존산소 측정기(Hanna Instruments, Smithfield, RI, USA)를 이용하여 측정하였으며, 대조군과 hypoxia 실험군의 DO는 각각 6.8±0.5 ppm과 1.8±0.5 ppm으로 유지시켜 진행하였다. 실험 개시 1시간, 24시간, 72시간 경과시점에서 각 그룹의 실험어로부터 뇌, 아가미, 장, 간, 근육을 적출하였다(각각 5마리). 조직 적출은 실체현미경을 이용하여 수행하였으며, 각 조직은 액체질소에 급속 동결하여 total RNA를 추출하기 전까지 −80℃에 동결 보관하였다.
Total RNA는 RNeasy Mini Kit (QIAGEN, Valencia, CA, USA)로 추출하였으며, genomic DNA 제거 및 cDNA 합성은 QuantiTect Reverse Transcription Kit (QIAGEN)를 이용하여 수행하였다. 모든 조직의 cDNA는 최종농도 0.5 μg으로 정량 된 total RNA로부터 합성하였다. 각 cDNA는 qRT-PCR 분석전까지 −20℃에 동결 보관하였다.
HIF-1α, STC2 유전자 발현 분석은 quantitative real-time reverse-transcription PCR (qRT-PCR) 방법으로 조사하였다. 표적유전자 STC2는 클로닝한 O. dancena STC2 partial cDNA (GenBank Accession No. JX680809) 염기서열을 바탕으로 oligo primers를 제작하였으며(Table 1 and Fig. 1), HIF-1α (GenBank Accession No. DQ317443)와 18S ribosomal RNA (18S rRNA, GenBank Accession No. HM347347)에 대한 oligo primers는 GenBank에 등록된 염기서열을 바탕으로 Primer Express v3.0 software (Applied Biosystems, Foster City, CA, USA)를 이용하여 제작하였다(Table 1). 뇌, 아가미, 장, 간, 근육의 total RNA (0.5 μg)로부터 합성된 cDNA를 주형으로 oligo primers (10 μM), SYBR premix Ex-Taq, ROX Referance Dye II와 함께 총량 20 μL로 qRT-PCR을 수행하였다. PCR은 ABI 7500 Fast Real-Time PCR Systems (Applied Biosystems)을 이용하여 50℃에서 2분 그리고 95℃에서 10분 반응 후, two-step PCR 방법으로 95℃에서 15초, 60℃에서 1분, 총 40 cycles을 수행하였다. qRT-PCR 결과를 분석하기 전, 각 시료의 희석배수에 따른 증폭산물의 임계값(cycle threshold, Ct)을 통한 표준정량과 해리곡선 분석을 통하여 사용된 oligo primers의 표적유전자에 대한 특이성을 검증하였다. 증폭된 HIF-1α와 STC2 유전자 발현량은 ABI 7500 Sequence Detection Software V.1.3.1 (Applied Biosystems)를 이용하여 분석하였으며, 18S rRNA 유전자 발현량으로 값을 보정하였다.
각 그룹 내 15마리 개체의 표적유전자 발현에 대한 평균간의 유의성 검정은 SPSS V.18.0 통계 패키지를 이용하여 분산분석 후, post hoc Tukey test와 t-test로 분석하였다(P <0.05).
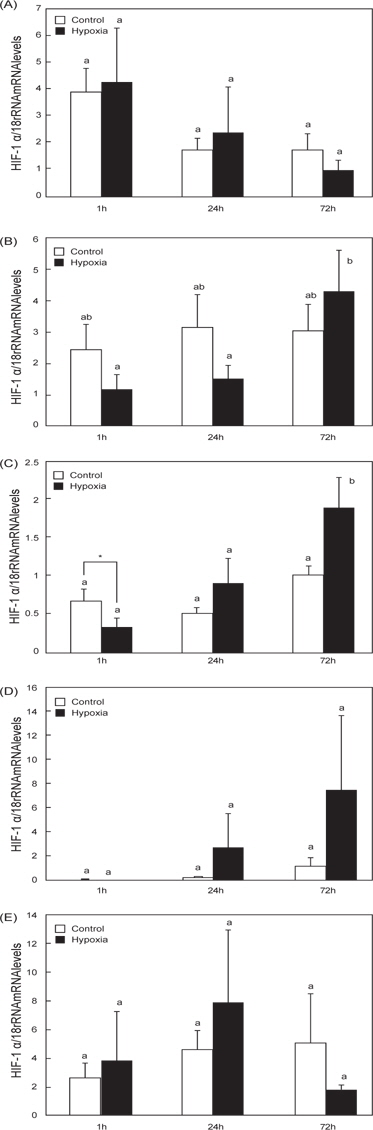
O. dancena 간의 경우, hypoxia 실험군(hypoxia) 송사리의 HIF-1αmRNA 발현은 1시간 시점에서 일시적으로 감소하는 경향을 나타낸 후, 72 시간 시점에서 발현이 유의적으로 증가하였다(Fig. 2C). Hypoxia 실험군의 아가미와 장에서 HIF-1α mRNA 발현이 경시적으로 증가하는 경향을 나타내었으나, 대조군(control)과의 유의적인 차이는 없었으며(Fig. 2B and 2D), 뇌와 근육의 경우는 두 군간의 유의적인 차이가 확인되지 않았다(Fig. 2A and 2E).
O. dancena 근육의 경우, hypoxia 유도 1 시간 시점에서 STC2 mRNA 발현이 유의적으로 증가하였으며, 72시간 시점에서 대조군 수준으로 회복되었다(Fig. 3E). 반면, 뇌의 STC2 mRNA 발현은 경시적으로 증가하였고, 이는 대조군과 hypoxia 실험군에서 공통적으로 나타났다(Fig. 3A). 대조군의 아가미, 간 및 장의 STC2 mRNA 발현도 경시적 증가 패턴을 나타내었다(Fig. 3B-3D). 특히, 아가미 조직의 STC2 mRNA는 hypoxia에 의한 유의적인 발현 변화가 나타나지 않았지만, 대조군의 증가된 STC2 mRNA 발현 수준과 비교하여 상대적으로 낮은 발현 수준을 나타내었다(Fig. 3D).
최근 송사리과에 속하는 일본송사리(O. javanicus)와 인도송사리(바다송사리, O. dancena 혹은 O. melastigma)는 새로운 동물실험모델로 주목을 받고 있는 광염성 어종이다 (Kang et al. 2008). 특히, O. dancena는 hypoxia 환경수(0.8-1.8 ppm) 에 대한 높은 적응력과 생존력을 나타내고, 어류의 hypoxia 유도 실험에 적합한 동물모델로 사용되고 있다(Yu et al. 2006). 본 연구는 qRT-PCR 분석을 통하여 hypoxia 유발에 따른 O. dancena HIF-1α와 STC-2 mRNA의 발현 변화를 조사하였다. 어류의 HIF-1α 유전자는 뇌, 심장, 신장, 비장, 간, 생식소를 포함한 다양한 조직에서 광범위하게 발현되어지는데(Ju et al. 2007, Chen et al. 2012), 담수어 Chinese sucker (Beaufortia kweichowensis)의 HIF-α subunit mRNAs (HIF-1α, HIF-2α, HIF-3α)는 특히 간에서 높게 발현되며, 이 중 HIF-1α과 HIF-3α는 HIF-2α 보다 상대적으로 높은 mRNA 발현 수준을 보였으며(Chen et al. 2012). 또한, 농어(Dicentrarchus labrax)의 HIF-1α mRNA는 다른 조직과 비교하여 간에서 높은 발현 수준이 관찰되었다(Terova et al., 2008). 하지만 조직 특이적인 HIF-1α의 발현양상 만으로는 hypoxia에 대한 HIF-1α의 발현과 조절을 이해하는 것으로는 충분하지 않다. 본 연구는 O. dancena의 간 HIF-1α mRNA가 hypoxia에 의존적으로 발현이 증가되는 경향을 확인하였다(Fig. 2). 이 결과는 이미 보고된 바 있는 O. melastigma의 경우와 일치하며(Yu et al. 2006), hypoxia에 대한 어류의 항상성에 관여하는 주된 조직이 간으로 추정된다. 어류의 경우, hypoxia에 의한 다양한 생리적, 생화학적 변화가 수반되며, 특히 대사율의 저하(Chen et al. 2012), 산소에 대한 헤모글로빈의 친화성 증가(Jensen et al. 1993), 높은 무기 호흡율(Virani and Rees 2000)을 나타낸다는 보고가 있다. Hypoxia에 의한 O. dancena 간 HIF-1α mRNA의 발현 증가는 체내 항상성 유지를 위한 대사작용의 변화가 우선적으로 일어난 것이라 사료된다.
일련의 O. dancena 유전자 클로닝 과정에서 STC2 프로모터 영역(-2397 bp) 내부에 후보 HRE 영역(-RCGTG-)을 확인하였다(Data not shown). Hypoxia에 의한 간 특이적인 HIF-1 α mRNA 발현과 일치하여 STC2 전사가 조절될 것이라는 가설을 바탕으로 hypoxia에 의한 STC2 mRNA의 발현을 조사하였다(Fig. 3). 아가미에서는 경시적으로 발현이 증가하는 대조군의 STC2 mRNA와 대조적으로 hypoxia 실험군의 STC2 mRNA 발현은 낮은 수준으로 유지되는 경향을 나타내었다(Fig. 3B). 또한, 근육에서는 hypoxia 의존적으로 STC2 mRNA 발현이 급증한 후, 경시적으로 발현이 감소하여 회복되는 경향을 나타냈다(Fig. 3E).
본 연구의 hypoxia에 의한 O. dancena STC2 mRNA의 발현 양상과 조직 반응은 HIF-1α와 이질적인 경향을 나타내었으며, 이는 STC2에 대한 전사가 HIF-1α 의존적으로 조절될 것이라는 본 연구의 가설과 상응하지 않는다. 어류 STC2는 포유동물과 달리 HIF-1α와 독립적인 발현 메커니즘에 의해 조절될 수 있으며, hypoxia에 대한 차별적인 생리 작용을 담당할 것이라 사료된다. 프로모터 내부에 HRE를 가지고 있는 글로빈 유전자의 경우, 일본송사리와 제브라피쉬는 hypoxia에 의해 서로 다른 발현양상을 나타내는데, 이는 같은 유전자라도 어류의 종에 따라 hypoxia의 반응 역가나 조절 메카니즘이 상이할 수 있다는 점을 시사한다(Wawrowski et al. 2011). 이를 명확히 하기 위해서는 STC2 전사에 대한 상위조절자의 연구와 종특이적인 발현 양상에 대한 조사가 요구된다. 포유동물의 경우, STC1과 STC2는 이온 전이, 스테로이드 호르몬 합성, 미토콘드리아의 ATP 합성을 포함하여 세포 내 작용과 생리적 기능에 대한 연구 결과가 있다(Luo et al. 2004, Luo et al. 2005, Ellard et al. 2007, Yeung et al. 2012). STC2의 과잉발현을 유도한 형질전환 마우스는 정상 개체보다 지연된 성장율과 산소 소비량의 급증, 섭이량의 증가를 나타낸다는 보고가 있으며, 이는 STC2가 호흡과 대사조절에 밀접하게 관여됨을 시사한다(Gagliardi et al. 2005). 어류는 환경수로부터 유발되는 hypoxia에 의해 체내의 다양한 생리적 변화가 유도되는데, 특히 대사율은 감소하고, 무기 호흡률은 증가시키면서 체내 항상성을 유지시킨다(Virani and Rees 2000, Chen et al. 2012). 환경수의 낮은 DO에 의한 hypoxia는 일종의 스트레스로 작용하여 어류 내 대사활동을 급증시키게 되는데, 이는 STC2에 의하여 촉발되는 효과이며 점차 체내 항상성이 유지되는 과정에서 STC2 mRNA 발현의 회복이 근육에서 나타난 것이라 사료된다. 아가미는 항상성 과정에서 호흡계를 조절하게 되는데, 무기 호흡으로의 효율적인 전환을 유도하기 위하여 STC2의 발현 수준이 hypoxia 특이적으로 낮게 유지된 것이라 사료된다. 이러한 STC2의 hypoxia에 의한 발현 특이성은 실험 조직들 중 아가미와 근육에서 국한되어 나타나게 되는데 이는 두 조직이 환경수의 영향을 직접적으로 접하는 1차적인 반응 조직으로서 나타나는 결과라고 생각된다.