The AOAC Mouse Bioassay method (MBA) has been widely used for routine monitoring of paralytic shellfish poisoning (PSP) for more than 50 years. However, this method has low sensitivity and experiences interference from other components in the extract. Also, ethical issues have been raised against the continued use of this live-mouse assay. To establish an alternative method for PSP analysis, we attempted to develop PSP analysis conditions using liquid chromatography-tandem mass spectrometry (LC-MS/MS). The LC-MS/MS analysis of reference material showed very reasonable accuracy, and the analysis time was just 15 min. However, the recovery rate of toxin spike samples using the LC-MS/MS analysis was 59.4-91.0%. We also attempted to remove the matrix effect using shellfish extracts, but recoveries of C1 and C2 did not improve. A comparison between the results of MBA and LC-MS/MS analysis revealed good correlations, with values of 0.8878 and 0.9211 for oyster and mussel matrices, respectively.
마비성패류독소는
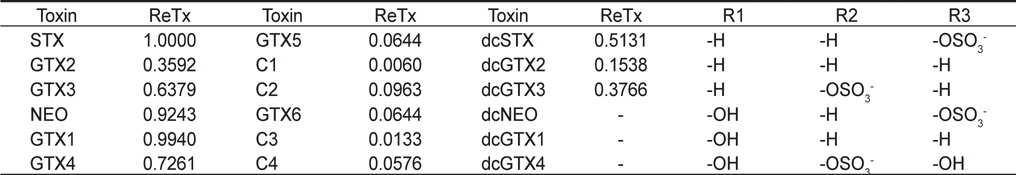
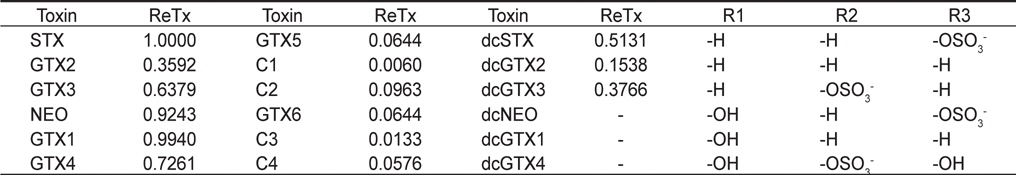
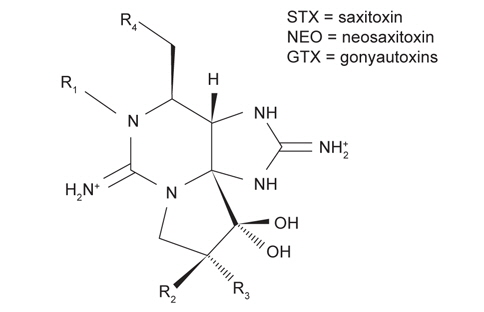
PSP (Paralytic shellfish poisoning) toxins and their relative toxicities (see Fig. 1 for structures)
한편, 마비성패류독소는 강한 염기성을 가지는 물질로 강력한 [M+H]+ 이온을 발생시켜 liquid chromatography-tandem mass spectrometry (LC-MS/MS)에서 효과적으로 검출 될 수 있다(Quilliam et al., 1989). 또한 LC-MS/MS를 이용한 분석법은 분석시간이 상대적으로 짧고 대부분의 마비성패류독소 구성 성분을 동시에 분석할 수 있는 장점이 있다.
따라서 본 연구에서는 LC-MS/MS를 이용한 시험방법을 검토하고 우리나라 시료특성에 부합되는 분석조건을 수립한 후 동 시험법에 대한 유효성 확인 및 마우스시험법과의 비교를 실시하여 모니터링과 규제를 목적으로 한 분석환경에 사용될 수 있는지 그 타당성을 검토하고자 하였다.
LC-MS/MS를 이용한 마비성패류독소의 분석을 위한 패류시료는 경남 진해만의 굴(
마비성패류독소 표준물질은 C1, C2, dcGTX2, dcGTX3, dcSTX, GTX1, GTX2, GTX3, GTX4, GTX5, NEO 및 STX (National Research Council Institute for Marine Biosciences, Halifax, NS)를 사용하였고, 추출에 사용한 hydrochloric acid (analytical grade)는 Merck (Darmstadt, Germany)에서, trichloroacetic acid (analytical grade)와 sodium hydroxide (analytical grade)는 Sigma (St. Louis, MO, USA)에서 구입하여 사용하였다. 이동상 제조에는 ammonium formate (Fluka, Buchs, Germany) 및 formic acid (Fluka, Buchs, Germany), acetonitrile (Merck, Darmstadt, Germany)을 사용하였으며, 탈 이온수는 Milli-Q system (Millipore, Bedford, MA, USA)에서 정제하여 사용하였다.
마우스시험으로 독이 없는 것이 확인된 굴(
균질화 한 시료 5 g을 칭량하여 50 mL 폴리프로필렌 시험관에 담고, 5 mL 0.1 N HCl을 가한 후 혼합하여 pH 2.0-4.0이 되도록 조정한 후 5분간 중탕하였다. 중탕한 시료를 실온까지 냉각하고 pH 2.0-4.0 범위에 있는지 확인하였으며, 5,000 rpm에서 5분간 원심분리하여 여액은 따로 모으고, 500 μL를 취하여 30% trichloroacetic acid 25 μL를 가하고 혼합하여 8,000 rpm에서 5분간 원심분리하였다. 상등액을 모아 1.0 M sodium hydroxide를 30 μL 가하여 trichloroacetic acid를 중화한 다음 다시 8,000 rpm에서 5분간 원심분리 한 다음 상등액은 0.2 μm syringe fileter (MFS-25; Advantec, Dublin, CA, USA)로 여과하여 기기분석에 사용하였다.
또한, 마우스시험법과의 비교를 위하여 마비성패류독소가 검출되었던 굴과 진주담치 각각 50개의 시료를 선별하여 위와 동일한 전처리 과정을 거쳐 LC-MS/MS 분석에 사용하였다.
LC-MS/MS를 이용한 마비성패류독소 분석법 확립을 위하여 TSQ Quantum discovery triple-quadrupole mass spectrometer (Thermo electron, Finnigan, San Jose, CA, USA)와 Surveyor MS Pump plus (Thermo electron, Finnigan, San Jose, CA, USA)를 사용하였고, column은 TSK Gel-amide-80 column (5 μm, 0.2×25 cm; Tosoh Bioscience, Tokyo, Japan)을 사용하였다.
LC분리를 위한 이동상 A와 B는 ammonium formate와 formic acid의 최종농도가 각각 2.0 mM과 3.6 mM이 되도록 탈이온수 및 95% acetonitrile에 95:5 비율로 희석한 용액을 사용하였다. A용액과 B용액의 비율 75 : 25로 조정한 이동상을 flow rate 0.2 mL/min으로 흘리면서 총 분석시간을 15분으로 유지하였다. 질량분석은 electrospray ionization (ESI)법으로 하였다.
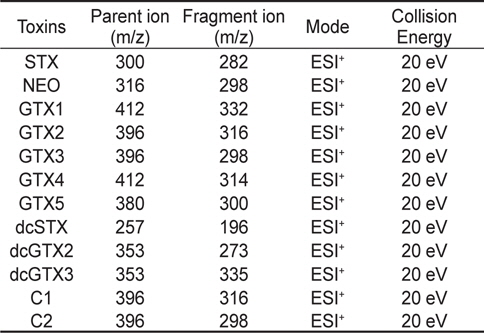
마비성패류독소 검출을 위한 MS/MS parameters는 Table 2에 나타내었다. Quadrupole type의 mass에서 SRM (Selected Reaction Monitoring)법 및 positive mode를 사용하였으며, spray voltage는 5.0 kv, capillary temperature는 350℃, sheath gas 17 (Arb) 및 aux gas는 19 (Arb)로 설정하였고, collision energy는 모든 독소가 20 eV로 동일하였다.
[Table 2.] Mass spectrometry (MS/MS) parameters
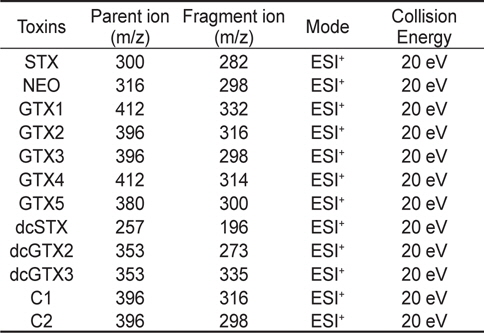
Mass spectrometry (MS/MS) parameters
분석조건의 유효성 시험은 최적의 분석조건에서 각 독소의 농도가 0.1, 0.5, 1.0 μg/g이 되도록 표준용액을 각각 조제하고 LC-MS/MS로 분석하였다.
분석기기의 검출한계(LOD; limit of detection)는 신호대 잡음비(S/N)가 >3으로 하였으며, 정량한계(LOQ; limit of quantification)는 LOD×3일 때의 농도로 구하였다.
시험방법의 정확도(accuracy)와 정밀성(precision)는 3 가지 농도로 조제한 표준물질을 이용하여 일내(intra-day) 및 일간(inter-day) 반복시험을 1일 5회 및 5일간 1회/1일로 실시하였다.
또한, 회수율 측정을 위하여 독이 없는 것으로 확인된 굴 및 진주담치 시료에 12종의 표준물질을 최종 1.0 μg/g 농도가 되도록 첨가하여 위의 방법과 동일한 방법으로 추출한 뒤 기기분석에 사용하였다.
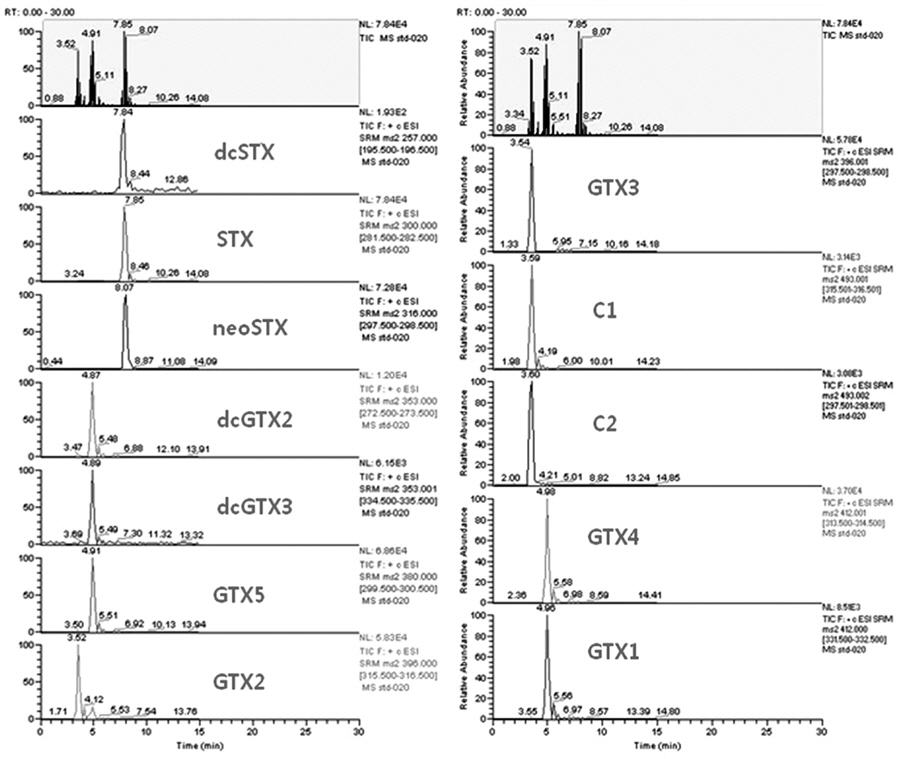
LC-MS/MS법을 이용하여 마비성패류독소를 구성하는 성분 중 12종의 표준물질 혼합용액을 분석한 결과 모든 독소가 8분 이내에서 분리되었다(Fig. 2).
대부분의 액체크로마토그래피와 형광검출법을 조합한 분석에서는 이동상에서 전하를 가진 마비성패류독소 성분의 유지를 위하여 heptanesulfonic acid, heptafluorobutyric acid 및 tetrabutylammonium sulfate등의 이온쌍 시약이 사용된다(Oshima, 1995). 이와 같은 시약들은 MS/MS 시스템의 이온 소스(ion source)를 오염시키고, 이온화를 억제시키는 등의 방해작용을 한다. 또한 C toxins은 STXs 그룹이나 GTXs 그룹과 다른 전하를 가지기 때문에 다른 조건에서 따로 분리하여야 하는 단점이 있다. 본 연구에서는 MS/MS와 HILIC (Hydrophilic interaction liquid chromatograpy)를 결합하여 분석에 사용하였으며, HILIC은 극성화합물의 분리에 매우 유용한 방법이다(Alpert, 1990). 이 방법에서는 친수성인 컬럼과 이동상의 상호작용에 의해 물질이 분리되기 때문에 이온쌍 시약이 포함된 이 동상을 사용하지 않아 이온화 효율을 감소시키지 않고, 빠른시간 안에 선택적으로 마비성패류독소 성분들을 동시에 분석할 수 있다는 장점이 있다(Dell’Aversano et al., 2005).
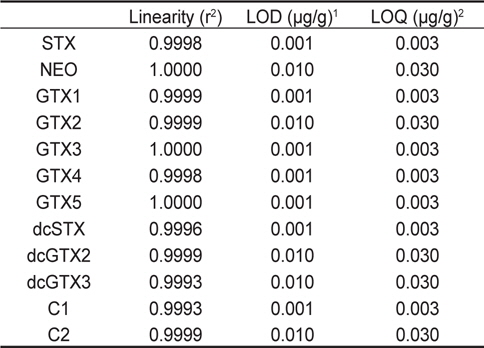
시험방법의 검증을 위하여 0.1-1.0 μg/g 범위의 표준물질을 사용하여 5 회 반복 측정 후 구한 검량선의 직선성은 12종의 표준물질 모두 r2=0.9993 이상이었다. 각 표준물질의 검출한계(detection limit) 는 독소마다 차이가 있었는데, S/N (signal to noise)비가 3:1인 표준물질의 peak를 기준으로 측정하였다. STX, GTX1, GTX3, GTX4, GTX5, dcSTX, C1 등의 독소는 0.001 μg/g이었으며, NEO, GTX2, dcGTX2, dcGTX3, C2 등의 독소는 0.01 μg/g이었다. 또한, 정량한계는 검출한계의 3배로 계산하였다(Table 3).
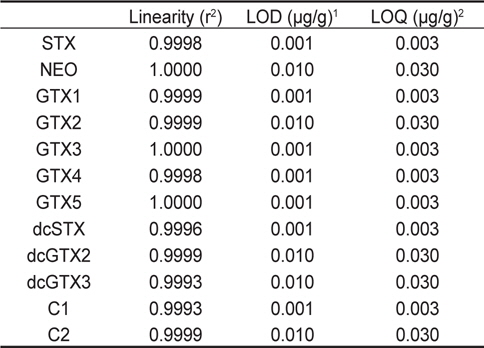
Estimated limit of detection (LOD) and limit of quantification (LOQ) for individual toxin (n=5)
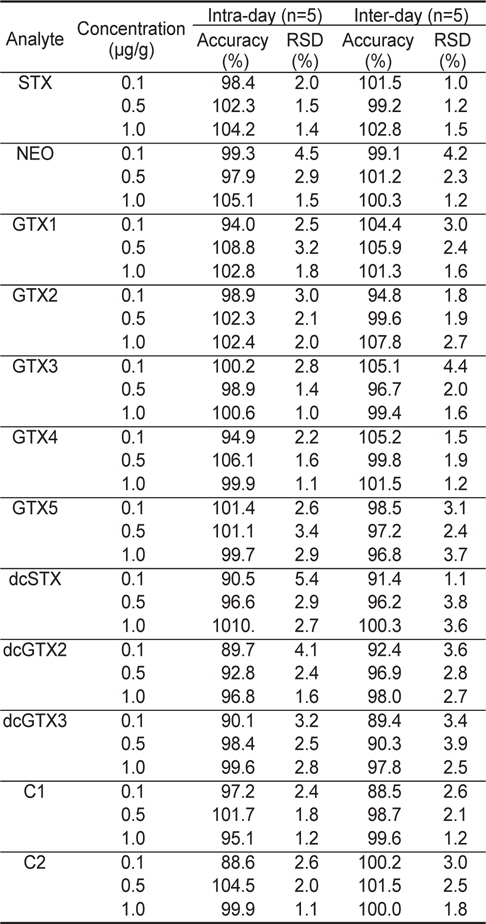
또한 본 분석법의 정확성(accuracy)와 정밀성(precision)를 확인하기 위하여 일내(intra-day) 및 일간(inter-day) 반복시험을 실시하였다.
3가지 농도의 각 독소성분 표준물질에 대하여 1일 5회 및 5일간 1회/1일로 반복시험을 실시한 결과, 분석법의 일내 정확성 및 정밀성은 각각 88.6%-106.1%의 정확성과 1.0-5.4%의 정밀성을 나타내었다. 또한, 일간 정확성 및 정밀성은 5일간 반복하여 구하였으며, 각각 88.5%-105.9%의 정확성과 1.0%-4.4%의 정밀성을 나타내었다(Table 4).
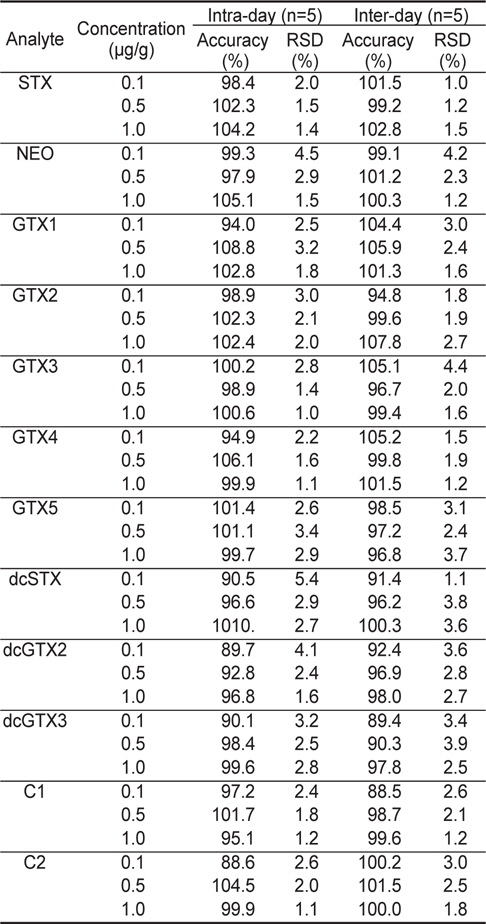
Intra-day and inter-day accuracy and precision for STXs & GTXs and C toxins analyzed by LC-MS/MS method
Codex (2008)에서는 첨가한 표준물질의 농도가 0.1-10 μg/g 범위에서는 80-110%, 0.01 μg/g에서는 60-115% 및 0.001 μg/g에서는 40-120%의 정확성을 요구하고 있으며, 본 시험 방법은 이에 부합되는 것으로 확인되었다.
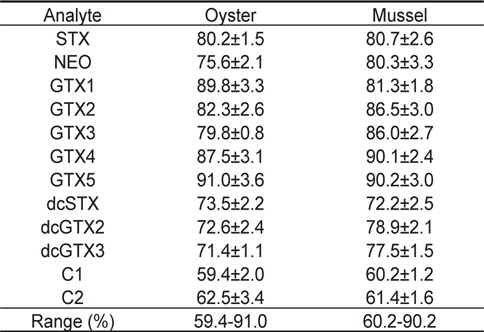
마비성패류독소에 오염되지 않은 굴과 진주담치 시료에 각 독소를 일정농도 첨가한 시료를 각각 5개씩 제조한 후, 분석하였을 때의 회수율은 Table 5에 나타내었다. 품종에 따른 회수율은 굴에서는 59.4%-91.0%, 진주담치에서는 60.2%-90.2%의 범위를 보였다. 굴 및 진주담치에서는 특히 C1, C2등의 C toxins이 다른 독소들에 비해 낮은 비율로 나타났는데, 이것은 전처리 과정에서 미처 제거되지 않은 염에 의한 방해 때문인 것으로 사료된다. Dell’Aversano et al. (2005)는 LC-MS/MS를 이용하여 진주담치 시료에서 마비성패류독소를 분석한 결과 C toxins이 다른 독소들에 비하여 낮게 검출되었다고 하였다. 조추출물에 포함된 염은 부분적으로 C toxins의 이온화를 억제할 수 있다(Dell’Aversano et al., 2005). 그러나, C toxins 이외의 다른 성분들은 굴과 진주담치에서 모두 양호한 수준으로 확인되었다. 본 연구에서 낮은 회수율을 보인 독소들에 대하여는 향후 이를 개선하는 연구가 필요할 것으로 사료된다.
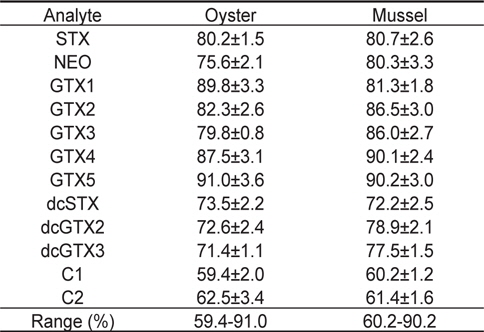
Recovery (%) of toxins in the different matrix by the extraction and purification method (n=5, 1.0 μg/g)
>
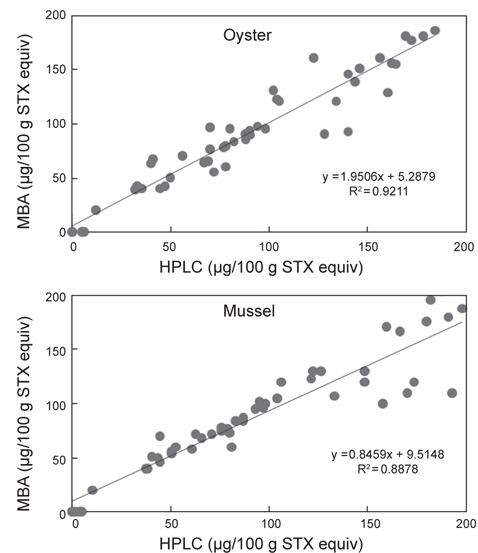
마우스 시험법과 LC-MS/MS에 의한 분석결과 비교
마비성패류독소의 허용기준치인 80 μg/100 g의 농도가 포함되도록 마우스시험법에서 불검출부터 200 μg/100 g STX equiv.로 검출되었던 굴과 진주담치 시료를 각각 50개씩 선별하여 위의 방법으로 전처리하고 LC-MS/MS로 12종의 개별독소를 분석한 후 독량을 saxitoxin당량으로 변환시켜 상관관계를 확인하였다. 본 연구에서 상관계수(r2)는 굴에서는 0.9211, 진주담치에서 0.8878로 의미있는 상관관계를 나타내었다(Fig. 3). 기기를 사용한 분석법은 동물시험법에서 방해물질로 작용하는 carbamate와 같은 신경독소와 유기인계 살충제에 영향을 받지 않는 점과 blank 시료에 대한 false positive 결과를 배제할 수 있는 점 등의 특이성을 가지고 있다(Van de Riet et al., 2009).
LC-MS/MS를 이용한 마비성패류독소의 분석은 동물시험법으로는 알아낼 수 없는 시료 중 마비성패류독소 구성성분을 밝힐 수 있고, 많은 독소를 동시에 분석할 수 있다는 장점이 있다. 본 연구에서의 결과는 마비성패류독소의 원인 플랑크톤과 패류 중 독소 구성성분의 비교에 적용하여 독성 프로파일을 밝히고, 나아가 우리나라 마비성패류독소 관리를 위한 대안으로 활용될 수 있을 것이라 판단된다.