This study was conducted to determine the physiological and histological characteristics of starry flounder
강도다리는 북태평양 연안에 서식하며 기수와 담수지역에도 서식이 가능한 광염성 어류로 비교적 저수온에서도 생존이 가능하다(Orcutt, 1950; Kramer et al., 1995). 국내에서 종묘생산기술이 개발된 2006년 이후 동해 울진해역에 자원증강의 목적으로 지속적으로 방류되어 왔다(Kim et al., 2013). 방류 시 가장 중요하게 고려되어야 할 사항은 자연환경에 대한 적응력으로서 대부분의 어류는 공급된 먹이에 수동적으로 적응되어 먹이 포획 능력을 획득하기 까지는 상당기간이 소요되므로 먹이 섭취가 원활하지 못하게 된다. 이때 어류는 생리생태학적으로 단기간 변화된 환경에 적응하면서 체내에 축적되어있는 에너지를 소비하며 절식기간에 대응하게 된다(Mustafa and Mittal, 1982; Weatherley and Gill, 1987; Lee et al., 1999; Woo, 2005; Hur et al., 2006), 위와 같이 생리생화학적 변화 이외에도 인위적으로 생산된 양식어종이 바다로 방류된 이후에 자연환경에 적응하기 위하여 형태학적 변화를 갖는다는 연구결과가 있으며(Kim et al., 2013), 먹이절식 후 재 섭취 시 성장에 미치는 영향에 관한 연구들이 양식 주요어종인 챠넬메기
본 연구에서는 이러한 다양한 지표를 활용하여 강도다리 절식기간 동안의 생리생화학적 그리고 조직학적 변화를 조사하고, 다시 먹이 섭취가 이루어진 후에 회복이 되는 과정을 파악하여향후 양식 강도다리의 방류 후 자연에서의 적응과정을 조사하여 자원조성을 위한 기초자료로 활용하고자 하였다.
강원도 고성군의 소재한 개인 양식장에서 생산한 강도다리
형태학적 측정 후 헤파린을 처리한 주사기로 강도다리 미부동맥에서 혈액을 채취하여 혈액자동분석기(Beringer Mannheim, Reflotron kit)로 6 개의 항목, total protein (TP), cholesterol (CHO), triglyceride (TG), albumin (ALB), globulin (GLO), glucose (GLU)을 분석 하였으며 측정 결과는 평균값과 표준오차(mean±standard error)로 유효숫자 두 자리까지 표시하였다. 혈액을 채취한 후 등지느러미 밑부분의 근육조직을 이용하여 핵산분석을 실시하고, 내장을 분리하여 체중에 대한 간의 무게 비율로 간중량 지수(LSI; liver somatic index)를 계산하였다. 또한 절식 및 먹이 재 공급에 따른 간의 조직변화를 조사하기 위하여 두 가지 방법으로 샘플을 하였다. 65일간 절식구의 간조직 일부를 Bouin’s solution에 넣어 고정한 후 자동포매기 (tissue processor, Leika, Germany)로 탈수과정을 거쳐 파라핀에 고정한 후 6 μm 절편을 만들고 hematoxylin-eosin 염색을하여 장시간 절식에 의한 조직변화를 검사하였으며, 먹이를 재공급하고 최종 65일째에 모든 실험구에서 간조직 샘플을 취하여 재 공급 시간이 간조직 변화에 미치는 영향을 조사하였다.
핵산함량의 측정은 Belchier et al. (2004)의 방법에 따라 근육조직을 동결 건조한 후(-50℃, 24 hr), 무게를 측정하여 Tris-ethylenediaminetetraacetic acid (TE; 5 mM Tris-HCl, 0.5 mM EDTA, pH 8)+0.01% SDA (Sodium dodecyl acrylamide, Merck, Germany) 용액을 500 μL에 넣고 진동마쇄기 (Tissue lyser, Qiagen)로 15분간 분쇄를 하여 4℃, 6000 rpm 으로 원심분리 후 상등액을 100 μL 분주하고, 20 μL RNase와 ethidium bromide (EtBr)을 첨가하여 emission 355 nm, excitation 590 nm에서 microplate reader (Varioskan FL, Thermo Sci., USA)로 측정을 하였다. 각 RNA와 DNA는 μg/mg건중량으로 환산하였고 이들의 비를 R/D ratio로 나타내었다.
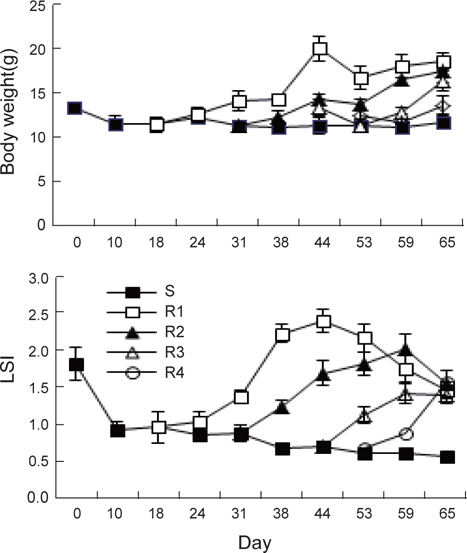
절식 및 먹이 재 공급에 의한 각 회복단계별 체중과 간중량 지수(LSI)의 변화는 Fig. 1과 같다. 실험시작 시 체중 13.4±0.5 g에서 지속적인 절식을 할 경우65일 후에도 11.9±0.7 g으로 13% 정도 감소하는 것으로 나타났다. 이는 실험 시 수온이 4-9°C로 활동성이 적고 저수온에 강한 강도다리가 먹이를 섭취할 수 없는 환경에서 생존을 위한 에너지소비를 극소화 한 것이 원인으로 추정되며, 실험기간 중에 강도다리의 움직임이 거의 없고 외부 자극에도 반응을 하지 않았던 관찰 결과와 일치한다고 할 수 있다. 체중은 먹이를 재 공급한 후 현저히 증가하여 실험 65일째 회복기간이 가장 긴 R1은 18.7±1.1 g, R2는 17.6±1.2 g, R3는 16.5±1.1 g, 그리고 가장 회복기간이 짧았던 R4는 13.7±1.1 g이였다. 65일째 각 실험구의 최종 무게를 통계학적으로 분석한 결과(ANOVA, Statistika 5.0) 절식구인 S 실험구의 강도다리 체중은 모든 회복실험구인 R1, R2, R3및 R4와 유의적인 차이(
체중에 대한 간중량의 비율로 산출한 간중량 지수의 변화를 Fig. 1에서 보면, 실험초기 1.82±0.22%에서 S실험구는 절식 10일 후 0.93±0.10%로 급격히 감소하고, 그 이후에는 서서히 감소하여 65일째에는 0.57±0.04%에 달하였다. 가장 높은 간중량지수는 2주간의 절식 후 먹이공급이 가장 빨랐던 R1에서 실험 44일째에 2.40±0.16%였고, R2는 먹이 공급 28일 후인 실험 59일째에 2.02±0.16%, R3는 21일 먹이섭취 후 실험 65일째에 1.41±0.12%, 가장 회복기간이 짧았던 R4는 먹이 공급 12일 후인 실험 65일에 1.57±0.08%였다. R1과 R2 실험구에서는 최고의 값을 보인 이후에는 서서히 감소하여 실험 종료시 기인 65일째에 각각 1,46과 1.56%로 측정되어 R3와 R4가 유사한 값을 보였다. 동일한 크기의 강도다리를 지속적으로 65일간 먹이를 공급한 경우 최종 크기가 19.3±2.5 g이며 간중량 지수가 1.5±0.2% 인 것을 고려하면 2주간 절식 후 먹이를 재 공급한 실험구(R1)에서는 정상에 가깝게 회복이 되는 것으로 조사되었다(data not shown).
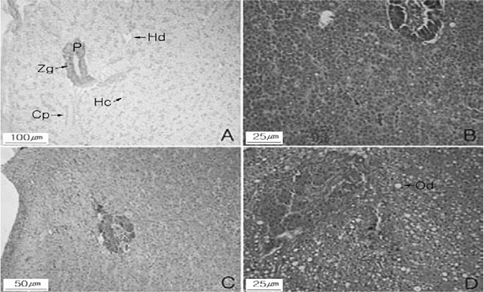
조직학적 검사결과 강도다리의 간 속에는 Fig. 2에서와 같이 췌장을 함께 관찰할 수 있다. 다각형 간세포는 둥근 형태로 다수의 간세포들을 갖는 간세포삭의 구분이 가능하며, 간세포삭사이에서는 모세혈관이 확인되었다. 췌장은 해부학적으로 독립된 기관이 아니라 간의 일부를 덮고 있는 지방조직에 함몰되어 있고, 마름모꼴 또는 피라미드의 외분비선세포를 가지며 이들의 세포질은 호염기성이나 정단부에는 호산성의 효소원 과립을 다수 함유하고 있다(Fig.2 A). 38일 후 절식구의 간의 조직은 간세포 내 핵의 응축, 모세혈관의 팽창과 췌장 효소원 과립들이 감소된 상태이며 췌장 외분비선 상피세포들의 핵들이 응축되는 형태를 보였다(Fig. 2. B). 65일 후 절식구의 간세포 내핵은 매우 응축되어 있고 췌장 효소원 과립들의 감소를 관찰할수 있으며(Fig. 2. C), 일부 개체는 공포상의 지질성 과립들과 함께 췌장 외분비선 상피세포들의 괴사현상을 보였다(Fig. 2. D).
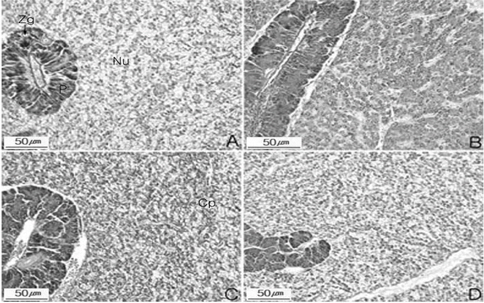
먹이를 2주 간격으로 재 공급한 후 간 조직을 분석한 Fig. 3에서 보면, R1 단계의 간 조직은 불규칙적인 간 세포삭 내 간세포의 팽창, 췌장 효소원 과립의 감소 및 모세혈관 팽창 등을 미약하게 보여주는 병변 초기 현상을 보였으나, 사료투여 3주차부터 본래의 정상적인 형태를 보여주었다(Fig. 3. A). R2에서는 사료투여하기 직전 간세포 및모세혈관의 팽창과 췌장 효소원 과립 등의 중기 병변 현상을 관찰하였으며, 5주 이후 사료투여를 한 결과 간세포, 모세혈관 및 췌장 효소원 등의 간 조직은 더 나빠지지는 않았으나 본래의 상태를 보여주지 못하였다(Fig. 3.B). R3의 간 조직은 간세포끼리의 응집, 췌장 효소원 과립의 감소와 모세혈관의 팽창을 볼 수 있었다(Fig. 3. C). R4의 간 조직은 R3와 비슷한 조직 형태를 관찰 할 수 있었다(Fig. 3. D). 간중량 지수와 조직학적 검사를 종합하여 보면 실험 65일째 각 실험구마다 간중량 지수가 1.41-1.57%로 유사한 비로 나타나 간의 회복상태가 유사하다 추정할 수 있으나 조직분석 결과 회복기간이 짧았던 R3와 R4는 간세포끼리의 응집, 췌장 효소원 과립의 감소와 모세혈관의 팽창이 일어나 완전히 회복이 되지 않음을 알 수 있어 절식 후에는 Fig. 3에서와 같이 최소 3주 정도 먹이를 섭취하여야 실험 시작 시 상태에 도달 할 수 있는 것으로 조사되었다.
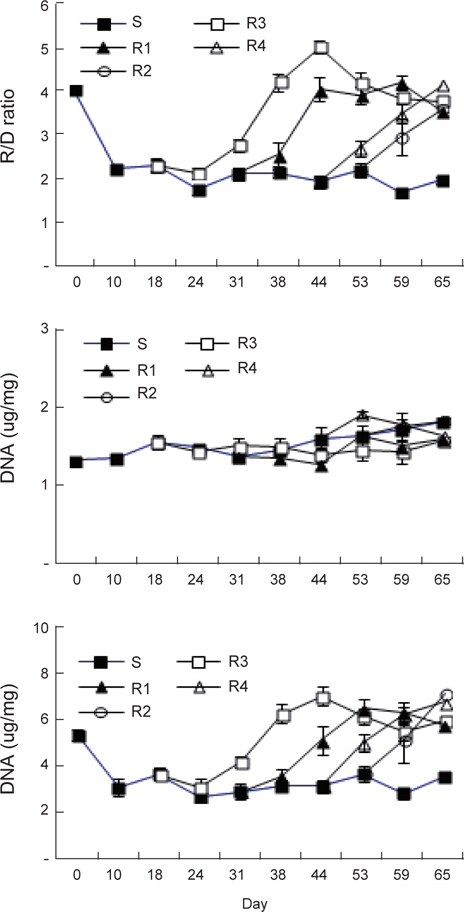
장기간 절식 및 2주간격으로 먹이를 재 공급한 강도다리의 근육 내 핵산함량 및 비의 변화는 Fig. 4와 같다. RNA/DNA비는 실험시작 시S 실험구의 4.02±0.10에서 10일간의 절식기간 후 2.24±0.09로 급격히 감소하였으며 그 이후 지속적인 절식에도 비교적 일정한 값을 유지하며 65일째 1.97±0.09로 감소하였다. RNA/DNA비로 본 건강도는 R1은 2주간의 절식 후 26일 동안 먹이를 섭취한 실험 44일째 5.0±0.20와 R2에서4주간의 절식 후35일간 먹이를 섭취한 실험 59일째의4.2±0.20과 큰 차이를 보여 건강도는 절식기간이 좀 더 짧았던 것이 회복이 빠르게 진행이 되는 것으로 나타났다. RNA함량은 RNA/DNA 비와 동일한 변화 양상을 보였으며, 실험초기5.31±0.21 μg/mg에서 S 실험구는 65일째 3.50±0.24 μg/mg으로 지속적으로 감소하였다. 반면 다른 실험구는 먹이가 재 공급되면 증가하는 경향을 보였는데R1 실험구는 26일 동안 먹이를 섭취한 실험44일째 6.98±0.42 μg/mg, R2 실험구는 먹이 재 공급 22일 후인 실험 53일째 6.46±0.63 μg/mg로 증가하였다. 그러나 그 이후는 다시 두 실험구 모두 RNA 함량의 비가 다시 감소하여 각각 3.78±0.09 μg/mg와 3.54±0.11 μg/mg에 이르렀고 R3와 R4는 각각 실험 65일째에 6.71±0.34 μg/mg와 7.09±0.96 μg/ mg로 조사되었다. 위와 같이RNA양과 RNA/DNA 비에서 특이한 점은 최고값을 기록한 이후 회복이 빨랐던 실험구에서 모두 값이 다시 감소한 것으로 장기간 절식에 대한 보상작용으로 에너지 축적을 위한 먹이섭취가 과잉으로 일어나고 일정기간이 지나면 다시 정상으로 회복이 되어가는 과정으로 판단되었다. DNA함량은 실험 초기에 1.32±0.08 μg/mg에서 S 실험구는 점차 증가하여 실험 65일째 1.81±0.15 μg/mg이었다. R1은 DNA 함량의 큰 변화를 보이지 않고 1.42-1.56 μg/mg의 농도를 유지하였으며, R2 실험구는 먹이 재 공급 21일째 1.63±0.07 μg/mg까지 증가한 후 다시 감소하는 경향을 보였다. R3는 먹이 재 공급 15일까지 1.78±0.05 μg/mg까지 증가 후 다시 감소 하였고, R4는 먹이공급 12일까지 1.82±0.18 μg/mg로 증가하였다. DNA 함량의 변화는 R4, R3, R2, R1 순으로 절식기간이 길어질수록 높은 값을 보였다. 이는 극한 환경에서 생존을 위하여 남아 있는 에너지가 신속하게 DNA를 합성하기 위해 집중된다는 Raae et al. (1988)의 연구결과와 동일한 결과로 나타났다.
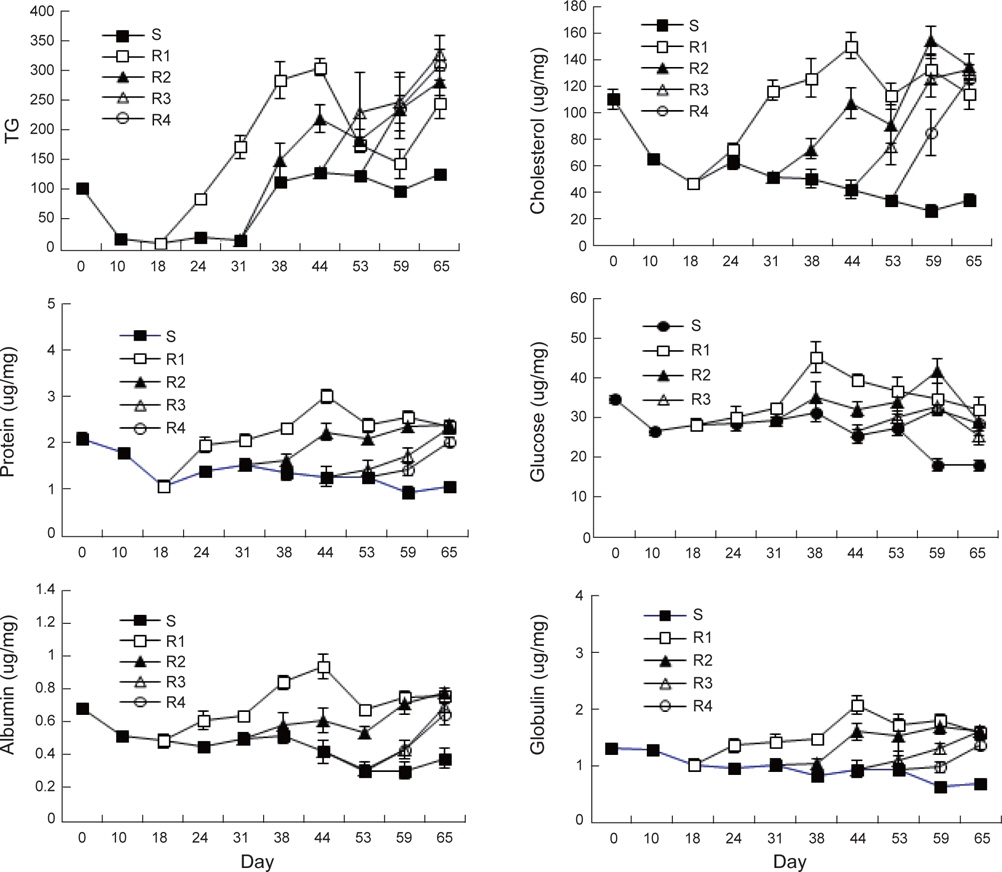
절식과 먹이 재 공급에 따른 강도다리 혈중 생화학적 특성은 Fig. 5와 같다. 장기간 절식시 TG는 실험 시작 시 101±1.4 mg/ dL에서 10일째 16.7±1.6 mg/dL로 급격히 감소하였고 그 후 31일까지 일정하게 유지되다가 38일째 다시 112.7±4.9 mg/ dL로 증가하였다. R1 실험구의 강도다리 혈액에서는 TG의 농도가 먹이공급과 동시에 급격히 증가하여 실험 44일째에는 최고 304.7±14.6 mg/dL였으나 그 후 먹이를 지속적으로 섭취함에도 불구하고 최종 실험 65일째에는 245.3 mg/dL로 감소하였다. R2 실험구에서도 먹이 공급과 동시에 혈중 농도가 증가하기 시작하여 실험 44일째 280.5 mg/dL까지 이르렀다. R3에서는 21일간 먹이를 섭취한 실험 44일째327.8 mg/dL, R4에서는 21일 동안 먹이를 섭취한 실험 65일째에 308.8 mg/dL의 농도를 보였다. 중성지방인 TG 는 에너지 저장원이며, 극성지방인 cholesterol과 phospholipids는 세포막 내 구조를 형성하고있어 생물의 크기를 나타내기도 한다. TG의 농도는 담수종인 Climbing perch
지속적으로 먹이를 공급하지 않은S실험구에서 CHO는 실험시작 시 110.0±7.3 mg/dL에서 지속적으로 감소하여 65일째에는 34.1±4.4 mg/dL에 이른 반면 R1과 R2 실험구에서는 2주와 4주간의 절식 후 실험 44일과 59일에 각각 150.3±10.3 과 154.6±10.5 mg/dL의 최고 값을 보였다. R3와 R4 실험구는 최종 실험일인 65일째 각각 133.0±10.4 mg/dL 과 126.0±9.7 mg/dL로 증가하였다. 먹이부족으로 인한 절식에 대한 내성은체내 지질함량이 중요한 역할을 담당하여 절식 시 에너지원으로 이용이 시작되며 그 후 단백질 이화작용이 따르게 된다. 지방분해능력의 저하는 에너지 요구에 의하여 단백질 이화작용을 촉진하며 그로 인하여 체중감소, 대량폐사, 각 기관의 기능저하로 이어지게 된다(Love, 1980). 이와 같이 본 연구에서 절식기간 동안 콜레스테롤의 감소가 실험초기보다 65일 후에는 69.1%로 크게 일어나 다른 혈액 바이오마커보다 감소폭이 큰것으로 조사되었다.
실험초기 혈중 TP는 2.1±0.13 mg/dL였으며 절식구인 S 실험구는 최종 65일째 1.08±0.11 mg/dL로 감소하였다. R1 실험구에서는 먹이 재 공급 26일 후인 실험 44일째 최고 값인 3.02±0.15 mg/dL로 증가한 이후 서서히 감소하여 실험 65일에는 2.36±0.09 mg/dL이었다. 4주간의 절식 후 먹이를 공급한 R2는 실험 44일째에 2.22±0.20 mg/dL 였고 일시적으로 감소한 이후 실험시작 65일에 2.39±0.10 mg/dL로증가하였다. R3와 R4는 먹이공급 후 지속적으로 증가하여 실험시작 65일째 각각 2.32±0.06 mg/dL, 2.03±0.10 mg/dL에 이르렀다. 실험 기간 중 혈중 TP 감소는48.8% 였는데 CHO의 감소비율인 69.1%보다 작게 나타났다. 이와 같은 연구결과는 다수 발표 되었는데 단백질이 가장 늦게 절식에 대응하기 위한 에너지원으로 사용된다는 결과와 일치하였다(Hung et al., 1997 )
ALB는 S 실험구에서 초기에 0.68±0.03 mg/dL이었으나 지속적으로 감소하여 65일째 0.38±0.06 mg/dL에 달하였다. R1은 먹이공급 26일이 지난 실험 44일째에 0.93±0.07 mg/dL까지 증가하였으나 그 후 지속적으로 0.76±0.03 mg/dL까지 감소하였다. R2, R3, R4는 증감을 반복하면서 실험 65째에 각각 0.78±0.03 mg/dL, 0.69±0.03 mg/dL 그리고 0.68±0.07 mg/dL로 증가하였다.
혈중GLO은 1.32±0.08 mg/dL에서 지속적으로 감소하여 65일째 0.69±0.1 mg/dL에 도달하였다. R1 실험구는 먹이공급 26일째 최고 값인 2.08±0.17 mg/dL을 보이다가 이후 지속적으로 감소하여 실험 65일째에는 1.60±0.08 mg/dL을 기록하였다. R2 실험구는 먹이공급 28일 후인 44일째에 1.70±0.15 mg/dL의 농도를 보였으며, 그 후 감소하여 실험시작 65일째 1.61±0.08 mg/dL로 감소하였다. R3와 R4는 최종 실험일 까지 1.63±0.05 mg/dL와 1.38±0.09 mg/dL로 증가함을 보였다. 실험 기간 중 혈중 ALB 및 GLO은 각각 44.7% 및 47.1%로 혈중 TP 감소 비율과 유사하였다.
혈중 GLU는 많은 조직에서 필수적인 에너지원으로 사용하며 특히 절식기간에 간에 저장되어 있던 glycogen이 glucose로 전환이 되어 혈액으로 유출되기에 초기에 일시적인 감소가 일어난 이후에도 비교적 일정하게 유지된다는 점이 알려져 있다(Gillis and Ballantyne, 1996). 본 연구에서도 초기에 35.0 mg/dL에서 절식 10일 후 26.7 mg/dL까지 감소하였으나 절식 기간이 지날수록 오히려 증가하여 38일째는 31.8 mg/dL까지 재상승하였으며 그 이후 급속히 감소하여 65일째 18.22±1.28 mg/dL까지 달하였다. 이는 많은 에너지가 TG와 CHO가 사용된 이후 급격히 에너지원으로 GLU가 사용이 되어 급격한 감 소가 일어난 것으로 파악되었다. R1 실험구는 먹이공급 20일 경과된 실험 38일째 45.65±3.99 mg/dL로 증가한 후 감소하여 65일째에는 32.22±3.36 mg/dL이었다. 최대농도는R2 에서 42.07±3.0 mg/dL, R3에서 33.17±1.74 mg/dL, R4에서는 32.45±1.52 mg/dL로 분석되었다. 절식기간이 짧고 먹이섭취기간이 길었던 순서대로 GLU의 최대농도가 더 컸으며, 최고 값을 기록한 후 시간이 경과할수록 농도가 모두 감소하였다.
본 연구에서 절식과 먹이 재 공급 후 생리•조직학적 특성을 종합 분석한 결과, 2주간의 절식은 회복능력이 빨라 먹이를 재 공급한 후 약 3-4주를 경과하면 실험 초기의 상태로 회복이 가능한 것으로 파악이 되었다. 또한 장시간 절식에 대한 보상작용으로 TG를 제외하고 체중, 간의 무게 증가, RNA/DNA 비로 평가한 건강도 및 혈액학적 특성이 일시적인 최대 건강상태를 보인후 다시 감소하여 일정한 값을 유지하는 것으로 조사되었다. 절식기간이 긴 경우 생리생화학적 지표가 동일한 수치를 보여도 조직학적 검사결과는 회복의 차이를 볼 수 있다. 그러므로 향후 강도다리의 방류 시에는 실험초기의 상태를 보인 절식기간인 2주 이내에 먹이섭취가 일어날 수 있도록 방류지역의 먹이량 조사, 방류직전의 자연먹이에 대한 적응능력을 향상시키는 등 다양한 방법으로 자연 환경에 대한 적응력을 높이는 것이 필요한 것으로 사료되었다.