The purpose of this study was to determine how an ornamental fish, such as the fighting fish,
어류 및 갑각류의 종묘생산에 있어서 먹이생물은 자연 수역의 요각류를 야간 조명을 이용해 수집 후 크기별로 선별하여 사용하게 되었다(Hirano, 1966). 알테미아는 생활사가 밝혀지고(Heath, 1924) 야외에서 수집된 이들의 유성생식란(cyst)의 건조 및 보관 기술의 확립으로 인해 로티퍼 보다 앞서 1920년대부터 알테미아는 해산 종묘생산에 이용되게 되었다. 반면 로티퍼는 뱀장어 양식장에서의 물변화의 원인생물에서 유용 먹이생물로 종묘생산에 이용되기에 이르렀다. 그러나 담수에서 발견된 로티퍼와 염호에서 생산되는 알테미아는 담수에서 보다 해수산 종묘생산에 이용하기 위한 연구가 주로 이루어졌다(Watanabe et al. 1978; Klein et al., 1980). 이러한 이유로 인해 해산 어류의 자치어 사육에 있어 로티퍼와 알테미아는 없어서는 안될 중요한 위치를 차지하고 있는 것이 현실이다. 또한 해수산 먹이 생물의 이용은 현재에 이르러 자어의 영양과 각종 약물의 경구 투여를 가능하게 하는 micro (또는 bio) 캡슐의 역할까지 기술 개발이 이루어져 있다(Oka, 1980; McEvoy et al., 1996; Coutteau and Mourente, 1997; Yoshimatsu et al., 1997; Park and Brown, 2002).
담수산 종묘생산에는 첫 먹이 공급 단계에서 부화 후 개구 시의 형태 및 생리적 차이로 해수산 종묘에 비해 먹이생물의 필요성이 적기 때문에 Nam et al., (1999)에서와 같이 배합사료를 개구 시부터 이용하고 있다. 그렇지만 잉어와 붕어의 종묘생산에서는 봄철 식물성 부유생물의 대량번식에 따라 자연 발생된 물벼룩을 이용하고 있지만 계획적인 인공 종묘생산 방법이라고 할 수 없다.
더군다나 담수산 관상어 사육에서는 로티퍼 개발 전 단계의 수산 양식어류 자치어 사육시의 달걀노른자를 갈아서 먹이는 방법(Kasahara et al., 1963)에서 벗어나지 못하고, 초기 자어 및 치어를 위한 반죽사료를 자체 제작하여 공급하는 방식을 취하고 있는 실정이다. 이 때문에 관상업계의 종묘생산은 양식어가 자체의 많은 시행착오를 거쳐야만 가능한 것으로 알려져 왔으며, 특히 우리나라에서 인위적인 배양에 의한 먹이생물 이용은 찾아보기 힘들다.
따라서 Kestemont and Awaïss (1989)의 연구보고를 바탕으로 관상어 계의 담수산 로티퍼 이용 확대를 위해 관상어 중 비교적 번식이 쉬운 종인 베타,
실험에 사용된 베타는 부화 후 2일째의 난황을 모두 흡수한 자어(전장 3.67±0.10 mm)이었다. 사육수 내 로티퍼,
베타는 등지느러미와 꼬리지느러미가 발달하는 열대성 관상어이기 때문에 측정항목을 전장, 꼬리지느러미 및 체고로 하였으며 26℃, 300 lx (L:D=16:8) 환경에서 먹이는 매일 아침에 1회 공급하였고, 모든 실험은 동시에 얻을 수 있는 베타 알의 수를 고려하여 2 회 반복하였다. 모든 실험의 사육수의 환수는 1일 1회 바닥 청소와 함께 30-50%를 실시하였다.
실험에 사용된 베타는 난황 흡수 후 2일째의 자어(전장 3.28±0.10 mm)였으며, 1 L 비이커(사육수 800 mL)에 10마리씩 수용하였다. 배양수 내 로티퍼 밀도를 달리하여(10, 20, 30 및 40 개체/mL) 공급한 것으로 7 일간 사육하였다. 7일 경과 후 모든 개체의 계측을 통해 자료를 얻었다. 첫 먹이 공급 단계 자어의 먹이종류별 성장 실험 조건은 로티퍼 공급밀도별 실험과 동일하다. 먹이로는 삶은 달걀노른자와 로티퍼를 각각 공급하였으며, 공급량은 각각 0.03 g/일과 20 rotifer/mL/일의 량으로 공급하다가 실험 5 일째부터 양을 늘려서 각각 0.05 g과 34 rotifer/mL/일로 공급하였다. 실험은 1 L 비이커(사육수 800 mL)에서 7 일간 사육하였다.
로티퍼로 사육된 부화 16일째의 치자어(전장 7.4±0.20 mm, 건중량 1.6±0.52 mg)를 대상으로 1 L 비이커(사육수 800 mL)에 6마리씩 수용하여 실험하였다. 실험은 넙치용 배합사료(250 μm, 이화유지),
통계처리는 SPSS (Ver 12.0)를 사용하여 t-test와 일원배치 분산분석(one-way ANOVA test)을 실시한 후 Duncan의 다중검정(Duncan, 1955)으로 처리 평균 간의 유의성을 검증하였다.
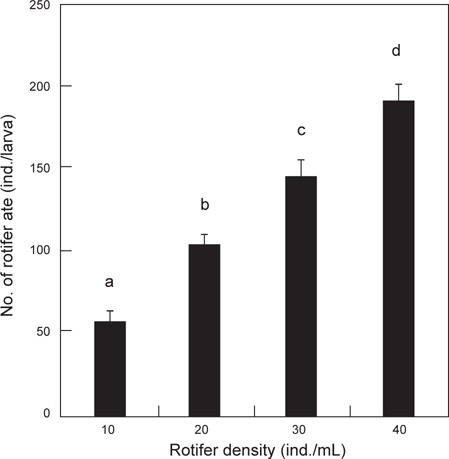
난황 흡수 후 베타 자어의 사육수 내 로티퍼 밀도에 따른 일간 섭취량은 Fig. 1에 나타내었다. 일일 베타 자어의 로티퍼 섭취량에 있어서 10 rotifer/mL 실험구에서는 한 마리당 57 로티퍼를 포식한 것으로 조사되었으며, 40 개체/mL 실험구에서는 191 로티퍼로 가장 많이 포식하여, mL 당 로티퍼의 밀도가 높아질수록 로티퍼 섭취량은 유의적으로 증가하였다(
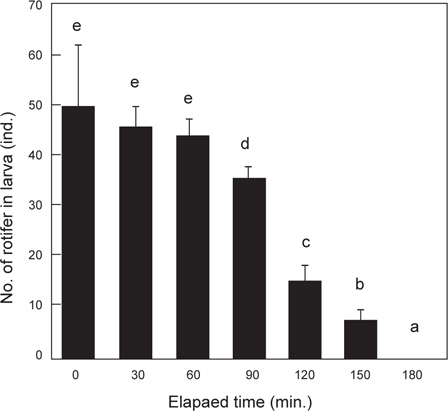
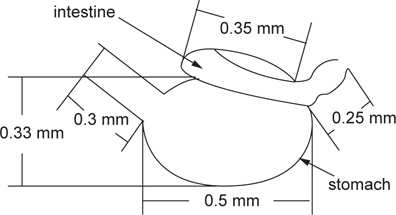
베타의 로티퍼 섭취 후 소화에 소요되는 시간을 측정하기 위한 위와 장의 절개 후 내용물의 검경 결과는 Fig. 2에 나타내었다. 1 시간 동안 30 rotifer/mL에서 포식시킨 직후의 위와 장에서 평균 49.8 로티퍼가 확인되었으며, 최대 67 로티퍼까지 포식하였다. 이후 1시간까지는 위와 장내 로티퍼 수의 변화는 없었다. 1시간 30분이 경과했을 때, 장을 지나 직장 내 분(糞)이 확인되었고, 2시간 경과했을 때 위 내 로티퍼와 직장 내 분은 확인 할 수 있었으나, 장내 로티퍼는 확인 할 수 없었다. 2시간 30분부터 장 내 로티퍼가 다시 확인되었고, 3시간 후에는 1마리에서 분이 확인되었지만, 나머지 개체에서는 위와 장내의 로티퍼는 확인할 수 없었다.
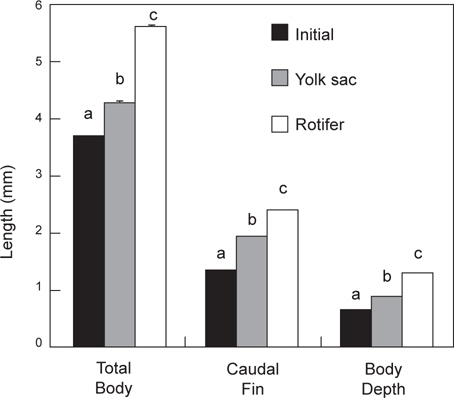
난황흡수 후 베타 자어의 먹이종류별 체성장은 Fig. 3에 나타내었다. 실험 시작할 때의 전장, 꼬리지느러미길이 및 체고는 각각 3.7±0.002 mm, 1.3±0.001 mm 및 0.6±0.001 mm로 조사되었다. 모든 측정 항목에 있어서 로티퍼 공급구는 삶은 달걀노른자 공급구보다 높아서 전장은 5.6±0.013 mm, 꼬리지느러미 길이는 2.4±0.004 mm 그리고, 체고는 1.3±0.003 mm로 조사되었으며(
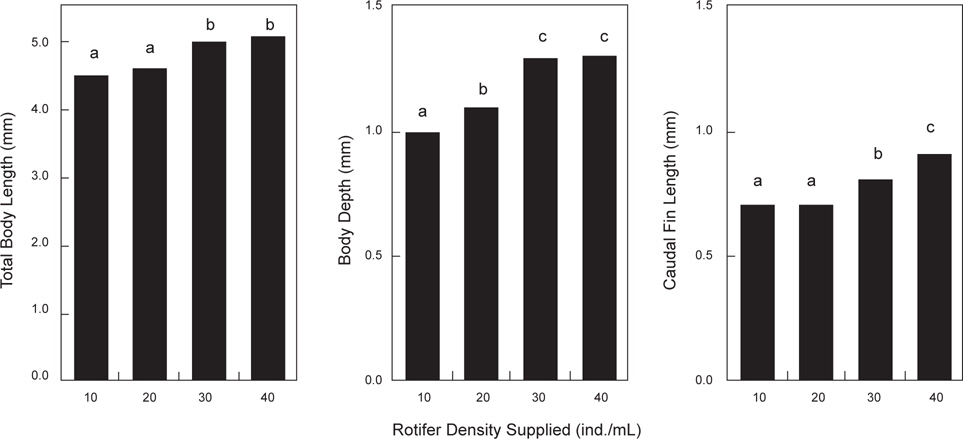
부화 직후의 베타 자어의 로티퍼 공급 밀도별 체성장은 Fig. 4에 나타내었다. 실험시작 시의 자어의 크기는 부화 직후의 로티퍼 공급밀도 실험과 같으며, 실험종료시의 크기는 전장이 40 rotifer/mL의 밀도구에서 5.1±0.01 mm로 가장 높게 나타났지만(
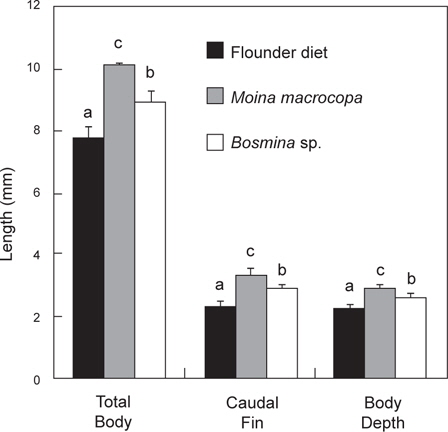
먹이 전환기 베타 자어의 공급 먹이를 달리하였을 때의 체성장은 Fig. 5에 나타내었다. 최초 자어의 크기는 전장이 7.4±0.20 mm, 꼬리지느러미길이가 2.4±0.12 mm 그리고 체고가 2.2±0.14 mm이었다. 실험 종료 후의 전장은
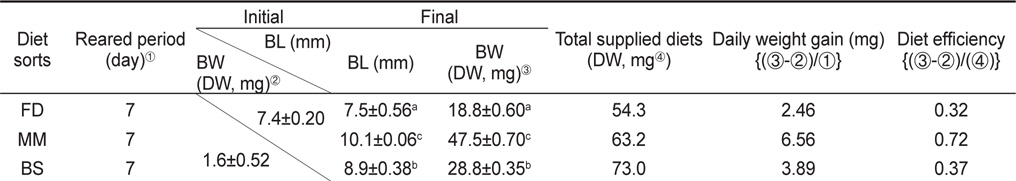
먹이 전환기 베타 자어의 체중량 변화와 먹이효율은 Table 1에 나타내었다. 총 실험 기간 7 일 동안의 증중량을 나타낸 것으로 최초 전장은 7.4±0.20 mm, 건중량은 1.6±0.52 mg으로 조사되었다. 실험 종료 시에는
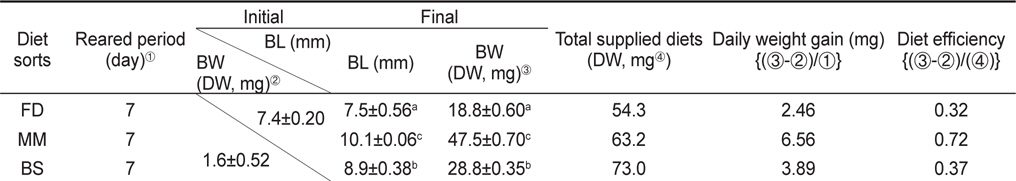
The somatic growth, daily weight gain and diet efficiency on water flea Moina macrocopa level fighting fish Betta splendens on the different diets
베타와 같은 열대어들의 번식에는 수산양식의 로티퍼 개발 단계 전의 달걀노른자(Kasahara et al., 1963)와 자체 제작한 반죽사료(햄벅)을 이용하는데 갓 부화한 베타의 입 폭은 약 570 μm이며(미발표자료), 개구 시 예상 높이는 150 μm에 달해 Kang et al. (1997)과 Kwon (2001)에서 밝힌 담수산 로티퍼,
Fukucho (1976)와 Gatesoupe and Robin (1982)은 해산어류인 돌돔과 농어를 각각 대상으로 로티퍼 섭취량을 조사하였는데, 돌돔은 실험기간 동안 성장함에 따라 일간 섭취량이 많아져 15-125 개체를 섭취하였으며, 농어는 4-17 개체를 섭취하는 것으로 보고하였으며, 특히, Fukucho (1976)는 위 내용물의 반수 감소시간을 최초 2시간 30분으로 성장함에 따라 짧아져서 1시간 30분에 이르는 것으로 보고하였다. 그러나 10% 감소시간은 보다 더 길어져 최초 7시간이 걸리는 것으로 보고하였다. 초기 위를 가지지 않는 해산 어류에서의 이와 같은 경향과는 많은 차이를 보이는 담수산 어류의 실험에 있어서는 모래무지과의 모샘치 후기 자어(평균 4.8 mm) 가 성장함에 따라서 2500-5500 개체의 많은 섭취량을 보여 해산 어류의 보고와 상당한 차이를 보였다(Kestemont and Awaïss., 1989). 또한 본 실험에 있어서는 알테미아를 실험에 사용하지는 않았지만, Gatesoupe and Robin (1982)의 농어는 10 개체 이상의 섭취량을 보였고, Abe and Uno (1963)의 복섬은 부화 때부터 알테미아를 공급했기 때문에 최초 3 개체에서 성장함에 따라 30 개체 이상의 일일 알테미아 섭취량과 사육밀도에 따른 섭취량의 차이를 보고하였다. 이와 같은 보고들을 바탕으로 실험한 결과, 베타 자어의 사육수 내 초기 로티퍼 밀도별 일일 로티퍼 섭취량은 사육수 내 로티퍼의 밀도가 높아질수록 많아져 최고 일일 191 개체의 섭취량을 보였다. 또한, 베타 자어의 소화가능시간은 본 실험에서는 1시간 동안의 섭취량이 최대 67 개체(평균 49.8 개체, Fig. 6에서와 같이 베타 자어의 위 내 로티퍼 최대 예상 수용량은 55-65 개체)의 포식개체를 확인 할 수 있었다. 그러나 2시간 경과 후 장 내 로티퍼가 없었던 것을 확인 할 수 있었던 것과 위 내 로티퍼 잔류수로 보아 난황 흡수 후 2 일령되는 베타 자어는 1회에 로티퍼 약 34 개체를 소화 시킬 수 있었다. 그 소화 시간은 포식 1 시간 후부터 본격적으로 이루어지고, 1시간 이내에 34개체를 소화하며, 이 후 위 내 로티퍼가 장으로 이동하는 것으로 관찰되었다. 따라서 일일 로티퍼 총 공급량(SD)은 한 마리당 1회 섭취량(DD)에 일조시간(TI) 내 소화가능시간(TD)을 나눈 값을 곱해주면 배양수 내 mL당 로티퍼 공급량이 계산된다. 식(1)에서 0.65는 mL당 공급 로티퍼 개체수 (30 rotifer/mL) 보다 1시간 동안 약 150%를 포식한 것을 의미한다.
SD : Rotifer quantity supplied during a day (ind.)
DD : Number of rotifer digested per once (ind.)
TI : Hour of illumination (hr)
TD : Hour digested of rotifer in a time (hr)
VM : Volume of medium (mL)
또한 이를 통해 하루 동안 소화가능 개체수를 유추할 수 있는데,
ND = Number of digestible rotifer during a day
TI = Times of illumination
TD = A time digested
NF = Number of rotifer digested per once
식 (2)에 따라 계산을 하면 일조시간(TI)은 여름 일조시간 16시간, 로티퍼 소화 소요시간(TD)은 2 시간, 그리고 1 회 로티퍼 소화 개체수(NF)를 34 로티퍼로 보았을 때, 1 일 베타 후기자어의 로티퍼 소화가능 개체수는 272 rotifer/day가 된다.
따라서 공식(1)의 결과로 여름철(L:D=16:8) 베타 자어를 위한 공급량은 100 mL 당 베타 자어를 5마리 수용하여 사육하였을 때, mL당 로티퍼 17.68 개체를 최소한 공급하여야 양호한 성장을 기대 할 수 있을 것으로 판단된다.
Cruz and James (1989)는 틸라피아에서 로티퍼와 병행한 배합사료 실험에서 로티퍼의 공급은 수중 유리 암모니아 농도를 증가시키지만, 4일간 로티퍼를 공급하고 이 후 배합사료를 공급한 경우, 생존률에는 차이가 없었지만 성장률에 있어서는 가장 좋은 결과를 보고하였다. 또한 먹이 내 지방산 함량과 영양 강화를 통한 성장률 향상 보고가 있다(Işik et al., 1999; Opstad et al., 1989). 일반 사육장에서 사용하고 있는 달걀노른자를 이용한 본 연구의 실험구에서는 로티퍼 공급구보다 모든 체성장에 있어 낮게 나타났다. 이는 달걀노른자로 인한 수질의 악화와 Fig. 6에서 보이는 것과 같이 장의 형태와 같이 베타의 육식성을 고려해 본다면 영양학적으로는 보충해 줄 수는 있지만, 기호성 측면에 있어서는 적당하지 않았던 것으로 판단된다.
Lubzens et al. (1987)와 Kestemont and Awaïss (1989)는 로티퍼의 공급 밀도와 자어의 성장은 비례하고, milkfish에서는 자어의 밀도가 높을수록 더욱 좋은 성장을 보이는 것으로 보고하였다(Hagiwara et al., 1996). 또한 30 L 배양수조에 로티퍼 공급량이 일일 300 mg (로티퍼,
본 실험에 있어서는 베타의 전장과 체고에 있어서는 공급밀도가 30 개체/mL 이상의 로티퍼 밀도에서 성장이 좋았으며 로티퍼의 공급밀도가 높아질수록 꼬리지느러미의 성장은 보다 빠른 것이 관찰되었다. 그리고 10 rotifer/mL의 공급밀도에서의 개체별 체성장의 차이가 큰 “숙성이”가 나타난 것은 mL 당 10개체의 로티퍼 공급은 베타 후기 자어의 사육에는 양적으로 부족했기 때문으로 판단된다. 또한 먹이전환기 베타 치어의 성장은
따라서 로티퍼는 숙성이가 생기지 않으면서 체성장이 양호한 30-40 rotifer/mL의 밀도로 공급하여 사육하고, 성장함에 따라서 증중량과 먹이효율이 가장 좋은