The quality and quantity of food organisms in fish seed production are important. The marine microalgae
해양미세조류는 어패류 양식을 위한 Rotifer와 같은 동물성 플랑크톤의 먹이생물로 이용되고(Hur and Kim, 1988), 연료, 비타민,
최근 국내 어류 종묘생산에 있어서 기술적인 면에서는 비약적인 발전을 거듭하여 종묘생산 대상 종은 매년 증가하고 있다. 그러나, 아직 고급어류 종묘 생산시 대량폐사를 수반하는 초기 감모와 관련된 먹이생물의 영양가 평가 등에 관해서는 해결해야 할 부분이 많이 남아 있다. 어류 종묘생산에 있어서 먹이생물의 질적 선택과 양적 확보는 종묘생산의 성패를 좌우하기 때문에 먹이생물에 관한 연구는 대단히 중요하다. 해산어류의 성장에는 먹이생물의 지방성분이 중요한 역할을 하는데 이 먹이생물의 지방성분에 영향을 미치는 것은 지질의 종류(Lipid class)와 지방산조성이다. 즉, 먹이생물의 지방조성은 종묘의 지방조성과 성장에 크게 영향을 주며, 특히 오메가-3고도불포화지방산이 어류의 필수지방산인 것이 증명된 이래 많은 연구자들이 먹이생물에 함유된 오메가-3지방산의 함량을 어류 자치어의 영양가를 결정짓는 척도로 삼고 있다(Watanabe, 1982). 최근에는 먹이생물중의 지방산 종류뿐만 아니라 지질class중에서 sterol 함량도 중요시되고 있다(Teshima and Patterson, 1981). 국내에서도 최근 연안의 자원조성을 위한 방류용 종묘생산이 활발히 진행되고 있으며, 바리과 어류와 참치 같은 고급어종의 종묘생산이 시도되고 있다. 이에 따라 먹이생물의 질적인 평가는 중요성이 더해가고 있다.
따라서 본 연구는 먹이생물 배양현장에서 초기 먹이생물로서 중요하게 이용되고 있고 아직도 해수산 chlorella로 불려지고 있는 해양미세조류인
본 실험에 사용된 해양미세조류
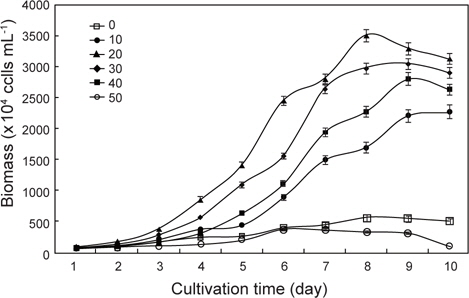
실험배양 조건으로서 온도는 20±1℃, 광주기는 18L: 6D, 주간의 조도는 6,000-8,000 Lux로 유지하였고, Air는 0.20 μm sterilized air filter (Advantec mfs, Inc. Japan)를 통해 공급하였다. 염분농도는 여과해수와 증류수를 이용하여 0, 10, 20, 30, 40 그리고 50 psu로 실시하였다. 실험에 사용한 배지는 Table 1에 나타낸 바와 같이 F/2배지 (Guillard and Ryther, 1962)를 사용하였으며, 121℃에서 20분간 고압멸균하였다. 초기 접종밀도는 100×104 cells/mL로 10일간 3반복으로 배양하였고, 매일 동일한 시간에 Haemacytometer로 3회 반복 계수하여 평균 세포수를 측정하였으며, 배양이 완료된 배양액은 4℃의 고속원심분리기(UNION 32R, Hanil Science Industrial Co., Ltd. Korea)에서 3,000 rpm으로 25분간 원심분리한 후, 배양액은 버리고 세포만 회수하여 동결 건조하였다.
[Table 1.] Chemical compositions of F/2 medium

Chemical compositions of F/2 medium
총 지질 추출은 Bligh and Dyer (1959) 방법에 준하였다. 균 체 중에 지질 추출 시료를 비커에 5 g 취하여 세포분쇄기(Homogenizer AM-12, Nihonseiki Kaisha Ltd. Tokyo, Japan)에서 15,000 rpm으로 5분간 분쇄한 후, Chloroform : Methanol (2:1, v/v) 혼합한 추출 용매를 시료의 2 배량 넣어 하루 동안 방치하였다. 다음날 chloroform 층만을 분리하기 위하여 둥근 플라스크 위에 깔때기를 놓고, 여과지를 깔아 그 위에 Na2SO4를 넣어 서서히 chloroform층만 흘러내리게 하였다. 분리된 chloroform층은 진공회전농축기(Rotavapor R-114, BUCHI)를 사용하여 40℃이하에서 용매를 완전히 증발시킨 후, 추출된 총 지질의 무게를 측정하였다. 모든 작업은 질소 기류 하에서 행하였다.
총 지질의 극성 지질과 비극성 지질의 분획은 Juaneda and Rocquelin (1985)방법에 준하여, SEP-PAK silica cartridge (Waters Association, Milford, MA)를 사용하였다. 추출된 지질 100 mg을 넣은 후, 1차적으로 극성용매인 chloroform 10 mL를 천천히 주사기로 주입한 후, 2차적으로 chloroform : methanol (49:1, v/v)로 혼합한 용매 10 mL 주입하여 극성 지질을 분리하였다. SEP-PAK silica cartridge에 남아있는 비극성 지질을 얻기 위해 다른 둥근 플라스크를 놓고 비극성 용매인 methanol을 20 mL를 천천히 주입하여 비극성지질을 분리하였다.
시료 일정량과 내부표준물질(C23:0 methyl ester) 1 mL (1 mg C23:0)를 cap tube에 취하고, 0.5 N NaOH-methanol 용액 1.5 mL 넣고, 100℃에서 8분간 가열하여 검화하였다. 방냉 후 12% BF3-methanol 2 mL 넣고, 다시 100℃에서 11분간 가열하여 methylester화 하였다. 약 30-40℃로 냉각한 후, Iso-octane 1 mL를 첨가하고 30초간 Vortex mixer로 혼합하였다. 즉시 5 mL의 포화식염수를 가한 다음 흔들어 방치하여 iso-octane층이 분리되도록 하였다. iso-octane층을 시료 병(4 mL)에 옮긴 후, 이를 지방산 methylester 시료로 하였다. 지방산 분석에 사용하는 GLC는 OmegawaxTM-320 (bonded polyglycol phase) capillary column (30 m×0.32 mm×0.25 μm, I.D., SUPELCO, Supelco Park, PA, USA)를 장착한 Autosystem XL (Perkin Elmer, USA)를 이용하였다. Column 온도 185-230℃, Injector 온도 250℃, Detector 온도 270℃ 그리고 Carrier gas는 He (1.0 kg/cm2)을 사용하였고, 이때 Split ratio은 1:50였다. 지방산의 분석은 동일조건에서 분석한 표준품의 ECL과 비교하여 동정하였고, 지방산 표준품은 14:0, 16:0, 18:1, 18:2, 18:3, 20:0, 22:1, 24:0 (Sigma Chemical Co., St. Louis, Mo, USA)과 GC-MS로 동정된 menhaden oil을 사용하였다.
모든 자료는 SPSS (12.0) 프로그램을 이용하여 분산분석 (one-way ANOVA)을 실시하여 Duncan’s multiple range test (Duncan, 1955)로 평균간의 유의성(
염분농도 0, 10, 20, 30, 40 그리고 50 psu에서
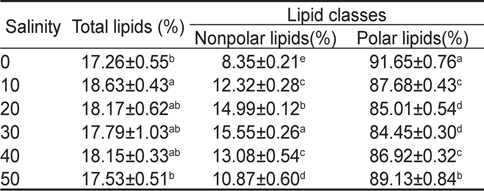
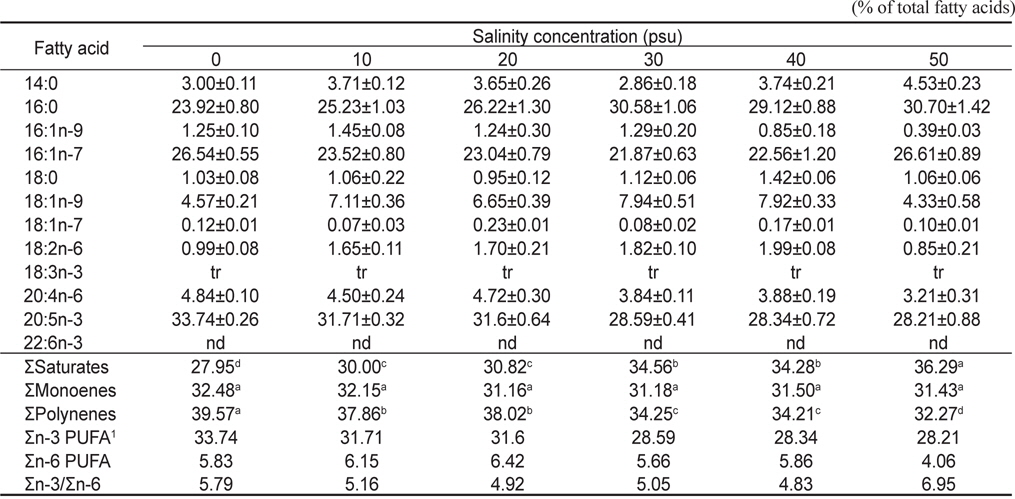
염분농도에 따른 총 지질 함량은 Table 2에 나타낸 바와 같이 0, 10, 20, 30, 40, 그리고 50 psu구에서 각각 17.26. 18.63, 18.17, 17.79, 18.15 그리고 17.53%로 나타났으며 0 psu와 50 psu를 제외한 10, 20, 30 40 psu에서는 유의차가 없는 것으로 나타났다. 중성지질의 경우 30 psu구에서는 총지질의 15.55%로 가장 높게 나타났으나 염분농도가 40과 50 psu로 높아질수록 각각 13.08%와 10.87%로 낮아지는 경향을 보였다(
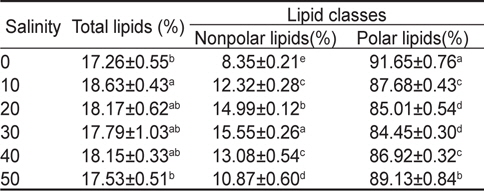
Percent compositions of the nonpolar lipids and polar lipids in different salinity of Nannochloropsis oculata
극성지질의 함량은 자연해수의 염분농도와 가장 비슷한 30 psu구에서 총 지질의 84.45%로 가장 낮게 나타났으며 20 psu구에서 85.01%로 유의적인 차이는 보이지 않았다(
지질의 종류(lipid class)는 최적 성장 염분도인 20 psu에서 중성지질이 14.99%인데 비해서 극성지질이 85.01%로
염분농도에 따른
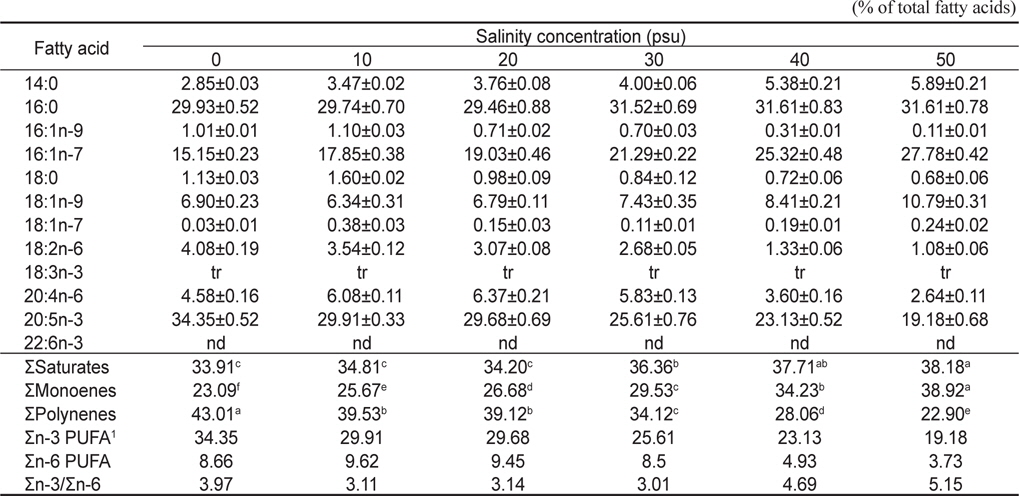
[Table 3.] Total fatty acid compositions of Nannochloropsis oculata cultured for 7 days
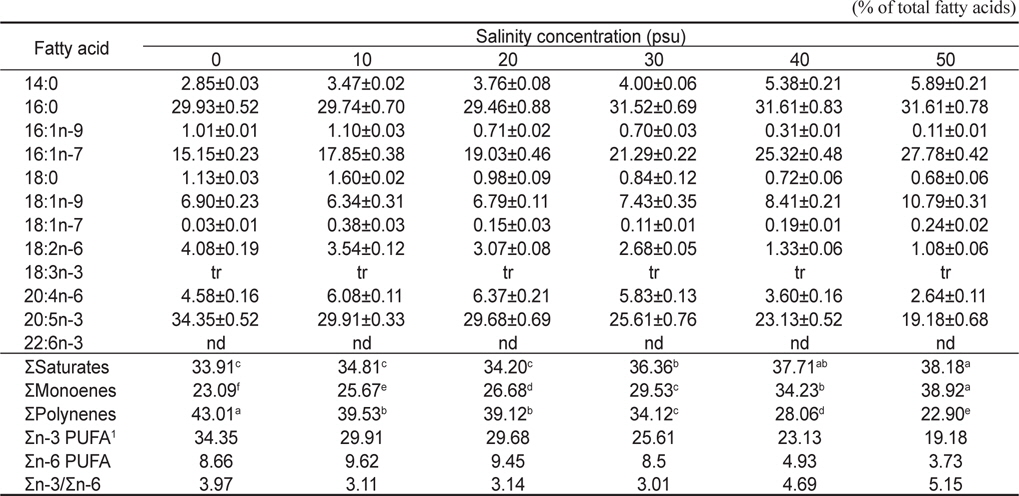
Total fatty acid compositions of Nannochloropsis oculata cultured for 7 days
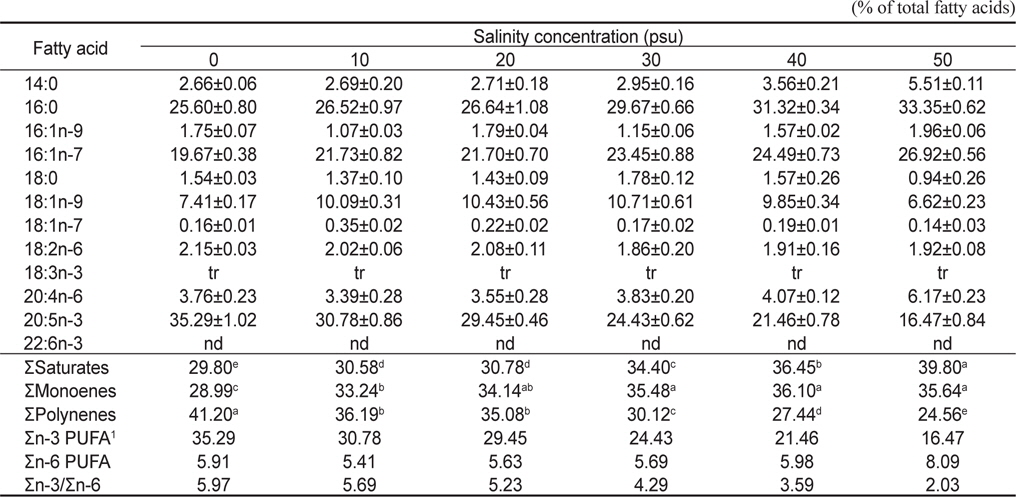
오메가-3 계열의 경우 염분농도가 가장 낮은 0 psu구에서 34.35%로 가장 높았고, 염분농도가 10, 20, 30, 40 그리고 50 psu로 높아질수록 각각 29.91, 29.68, 25.61, 23.13 그리고 19.18%로 감소하는 것으로 나타났다(
염분농도에 따른
염분농도에 따른
[Table 4.] Nonpolar lipid compositions of Nannochloropsis oculata cultured for 7 days
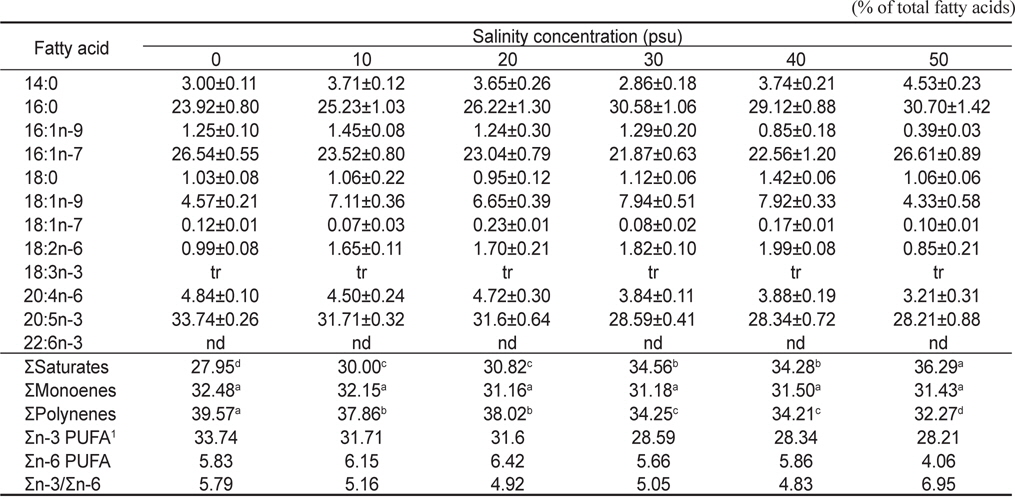
Nonpolar lipid compositions of Nannochloropsis oculata cultured for 7 days
특히, 16:0의 경우는 0, 10, 20, 30, 40 그리고 50 psu에서 각각 23.92, 25.23, 26.22, 30.58, 29.12, 그리고 30.70%로 염분농도가 높아질수록 증가하는 것으로 나타났다(
염분농도에 따른
[Table 5.] Polar lipid compositions of Nannochloropsis oculata cultured for 7 days
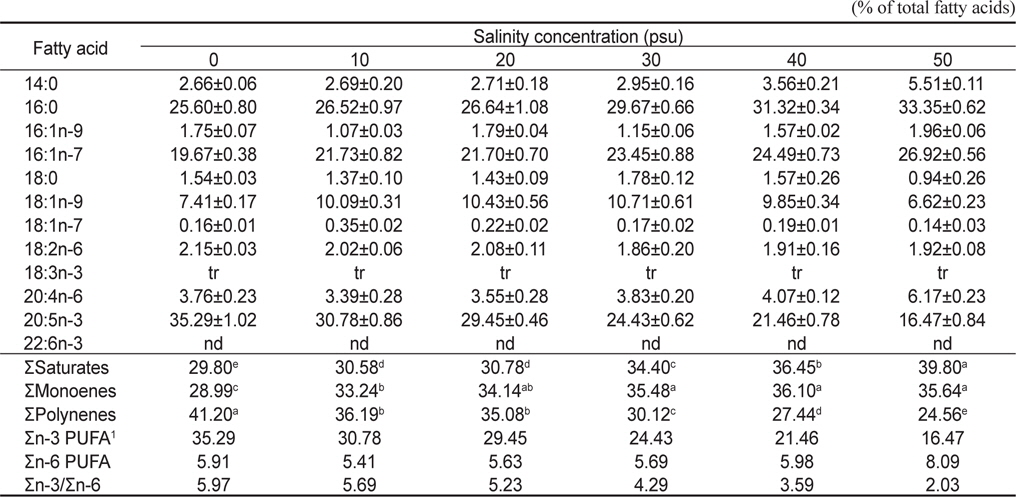
Polar lipid compositions of Nannochloropsis oculata cultured for 7 days
이상의 결과를 종합하면
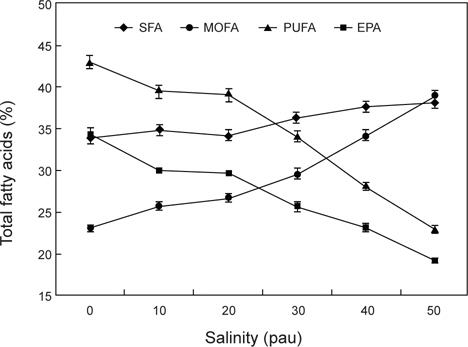
염분농도에 따른 총지질의 지방산 조성은 Fig. 2에 나타낸 바와 같이 포화지방산은 염분농도의 증감에 상관없이 33.91-38.18% 범위로서 변화가 없었는데 비해서 MOFA (monounsaturated fatty acid)와 PUFA (polyunsaturated fatty acid)는 현저한 변화를 가져왔다. 변화의 상태도 달라서 MOFA는 염분 농도가 증가함에 따라 증가하였지만, PUFA는 오히려 감소하는 역상관 관계를 나타냈다. Table 3에 의하면 염분농도 20 psu의 총 지질의 지방산 조성에서 16:0, 16:1n-7와 20:5n-3 (EPA)가 전체지방산의 78% 이상으로 대부분을 차지하고 있다. 이는 Eustigmatophycea 속하는
염분농도의 증가가 오메가-3 고도불포화지방산의 대표 지방산인 EPA의 합성을 억제하는 것으로 나타났다. 미세조류의 지 방산 조성에 영향을 미치는 환경인자로서 염분외에 온도가 있다. 많은 미세조류는 온도가 내려감에 따라서 포화지방산에 대 한 고도불포화지방산의 비율을 증가시켜서 환경변화에 대한 적응을 하는 것(Ackman et al., 1968; Mortersen et al., 1988; James et. al., 1989; Thomson et al., 1992; Renaud et al., 1995; Oliveria et al., 1999)과는 다른 현상이 나타났기 때문에 염분이 지방산 합성에 미치는 메카니즘은 수온과는 다를 수 있는 가능성을 내포하고 있다.
지금까지 미세조류에 있어서 지방산의 역할은 생체막의 기능과 대사기능에 주요한 기능을 하는 것으로 알려져 있다. 지방산의 불포화도 증가는 생체막 유동성의 항상성을 유지하여 환경변화에 대응하는 기능을 갖도록 되어 있다. 염분농도의 증가는 미세조류 세포내 삼투압을 증가시키기 때문에 glycerol농도의 증가(세포외 삼투압의 80%수준)를 일으킨다(Ben-Amotz and Avron, 1973). 그러나, 이러한 일반적인 현상과는 달리 고농도의 염분에서 배양한
극성지질의 경우에는 Table 5에 나타낸 바와 같이 SFA는 29.80-39.80%으로 큰 유의차를 나타냈으며, MOFA는 28.99-36.10%으로 변하였으며, PUFA는 27.44-41.20%으로 현저한 변화를 가져왔다. 이러한 변화는 PUFA의 대표적인 지방산인 EPA가 16.47-35.29%로 크게 감소하는 것을 그대로 반영하였다.
이상의 고찰을 종합하면 염분농도 증가에 따른 총 지질 중의 PUFA의 현저한 감소 현상이 일어났으며, 이러한 감소 원인은 비극성 지질이 아닌 극성지질의 지방산조성에 의해 감소 되는것으로 나타났다. 이러한 극성지질의 감소 원인 지방산은 오메가-3 고도불포화지방산인 EPA이었다. 이는 어류에 있어서 환경온도가 하강함에 따라 인지질에서 불포화도가 증가하는 것 은 생체막 체액의 “항상성 유지”를 위한 수단으로 이해하여 왔으나(Hazel, 1984; Dutta et al., 1985), 본 연구결과에서는 수온 이 지방산의 변화에 미치는 영향과는 다르게 나타났다. 이러한 차이점에 대해서는 미세조류의 극성지질은 인지질과 당지질로 구성되어 있고, 당지질의 함량이 더 높기 때문에 이들 지질class 중의 어느 쪽 지질이 더 크게 영향을 받았는지에 대해서는 향후의 연구가 필요하다.
해산어류의 종묘생산은 해양미세조류, 동물성플랑크톤(Rotifer), 자치어의 먹이시스템으로 이루어진다. 미세조류는 환경영 향인자에 대하여 지방산 조성이 많이 달라진다(Brank and Gillard 1981; Thompson et al., 1992; Park et al. 2012). 해양미세조류인