The brown alga
다시마(
간은 인체의 모든 대사기능의 중심이 되며, 외부로부터 투여 되거나 체내에서 생성된 물질들을 대사하여 해독작용에 관여하는데, 독성물질의 축적 등으로 인해 간세포가 손상을 입으면 결국 인체기능의 치명적인 손상을 가져오는 것으로 알려져 있다(Grub et al., 2000). 대표적인 간 독성 물질 중 하나인 사염화탄소(Carbon tetrachloride, CCl4)는 동물에게 경구 및 복강내로 투여 시 생체막의 불포화 지방산을 공격하여 지질의 산화, 단백질의 변성 등을 초래하여 급성 독성을 유발한다고 알려져 있다(Robbins, 1987). 사염화탄소는 간세포의 microsome에서 NADPH-cytochrome P-450 electron transport chain에 의해 대사되어 carbon-chlorine 결합이 trichloromethyl radical (CCl3) 과 chlorine radical (Cl-)과 같은 활성산소종을 생성한다. Trichloromethyl radical은 산소분자와 반응하여Trichloromethyl peroxy radical (CCl3OO-)로 산화되고, 이는 세포막의 인지질인 polyenoic fatty acid의 methyl carbon을 공격하여 지질과산화를 야기한다(Recknagel, 1976). 이때 항산화계의 수준을 초과하여 제거되지 못하면 산화적 스트레스 상태가 유발되어 DNA 변형과 기능상실에 의하여 간세포 손상 및 사멸과정에 관여하게 된다(Fridovich, 1978).
이러한 독성물질로부터 간 손상을 방지하고 간을 보호할 수 있는 천연물이나 천연소재 개발을 위한 다양한 연구가 수행되고 있다(Han et al., 1995; Park et al., 1991).
이를 바탕으로 본 연구에서는 사염화탄소로 유도된 간 손상 흰쥐에 대한 다시마 추출물의 간 보호효과를 혈청 수준 및 단백질 발현 수준에서 살펴보고자 하였다.
본 실험에 사용된 다시마는 부산시 기장군 대변항 다시마 양식장에서 채취한 것을 구입하였으며 이를 수세, 정선, 탈수과정을 거쳐 동결건조기로 건조하였다. 건조된 다시마는 균질화하여 분말을 사용하였으며, 다시마 추출물(
실험용 동물은 체중 150±10 g의 5주령 Sparaue Dawley계웅성 rat을 샘타코(SAMTAKO Co., LTD, Gyeonggio-do, Korea)로부터 구입하여 사용하였으며, 각 1마리씩 일정한 조건 (온도 20±2℃, 습도 50±5%, 12시간 명암주기)의 사육실에서 stainless cage에 분리하여 7일간 적응시킨 후 실험에 사용하였다.
실험동물은 4개의 군으로 분류하여 10마리를 한군으로 사용 하였다. 정상군(CON)과 대조군(CCl4)은 mouse용 고형사료와 물을 제한 없이 공급하였으며, 10일간 생리식염수 1.5 mL/rat을 경구 투여하였다. 다시마 추출물 투여군은 다시마 추출물 건조 분말을 150, 300 mg/kg B.W. 용량으로 생리식염수에 용해하여 10일간 경구 투여하였다.
시료의 최종 투여 3시간 후, 대조군을 제외한 실험군은 사염화탄소를 1 mL/kg B.W.의 용량으로 1회 복강 투여하여 급성간 손상을 유발시키고 24시간 후에 희생시켰다. 실험동물은 ethyl ether로 흡입 마취시킨 뒤 단두하여 채혈하고 원심분리 (2,500×g, 4℃, 20 min) 하여 상층액을 시료로 사용하였다. 적출한 간 조직은 액체질소로 급속동결시켜 -70℃에 보관한 것을 시료로 사용하였다.
사염화탄소로 유도된 간 손상에 SJE 처리 시 간 손상 지표인자인 GOT/GPT 활성을 확인하기 위해 Reitman-Frankel의 방법에 따라 조제된 아산제약 kit (ASAN PHARM. Co., LTD., Seoul, Korea)를 사용하여 측정하였다. GOT/GPT 기질액을 시험관에 넣고 37℃에서 5분간 방치한 뒤 혈청 10 μL를 넣어 잘 혼합한 다음, 37℃에서 GOT는 60분, GPT는 30분간 방치하였다. 정색시약 100 μL를 첨가하여 실온에서 20분 방치하고 0.4N NaOH용액 1 mL를 가하여 실온에서 10분간 방치한 후에, ELISA reader (Benchmaker, Bio-Rad, Richmond, CA, USA)를 사용하여 505 nm에서 흡광도를 측정하였다.
>
간 조직의 Glutathion (GSH) 함량 측정
사염화탄소로 유도된 간 손상에 SJE 처리 시 간 조직 중의 GSH 함량에 어떠한 영향을 미치는 지 glutathione assay kit (Sigma- Aldrich Co. LLC., MO, USA)를 사용하여 측정하였다. 먼저 간조직을 얼음 위에서 세절한 뒤 0.5 g을 5% 5-sulfosalicylic acid 용액으로 homogenizer를 이용하여 4℃에서 균질화 하였다. 이 균질액을 4℃에서 5분간 방치 후 10,000×
>
간 조직의 Superoxide dismutase (SOD) 활성 측정
사염화탄소로 유도된 간 손상에 SJE 처리 시 간 조직 중의 SOD 함량에 어떠한 영향을 미치는 지 superoxide dismutase assay kit (Cayman Chemical Co., MI, USA)를 사용하여 측정하였다. 먼저 간조직을 얼음 위에서 세절한 뒤 0.5 g을 extraction buffer (20 mM HEPES, pH 7.2, 1 mM EGTA, 210mM mannitol, 70 mM sucrose) 용액으로 homogenizer를 이용하여 4℃에서 균질화 하였다. 이 균질액을 4℃에서 5분간 방치 후 10,000×
사염화탄소로 유도된 간 손상에 SJE 처리 시 간 조직 중의 CAT 함량에 어떠한 영향을 미치는 지 catalase assay kit (Cayman Chemical Co., MI, USA)를 사용하여 측정하였다. 먼저 간조직을 얼음 위에서 세절한 뒤 0.5 g을 extraction buffer (50 mM potassium phosphate, pH 7.0, 1 mM EDTA) 용액으로 4℃에서 균질화 하였다. 이 균질액을 4℃에서 5분간 방치 후 10,000×
사염화탄소로 유도된 간 손상에 SJE 처리 시 단백질 발현 변화에 어떠한 영향을 미치는 지 확인하였다.
0.1 mg의 간 조직에 RIPA extraction buffer (50 mM Tris-HCl, pH 7.4, 150 mM NaCl, 1% NP-40, 1 mM EDTA, 1 mM NaF, 1 mM Na3VO4, 1 μg/mL aprotinin, 1 μg/mL leupeptin, 1μg/mL pepstatin, 1 mM PMSF, 0.25% sodium deoxycholate)를 첨가하여 homogenizer하였다. 이를 원심분리(12,000×
실험분석 결과는 평균과 표준편차(mean±S.D.)로 나타내었으며, SPSS 10.0 (Statistical Package for Social Science, SPSS Inc., IL, USA)를 사용하여 Oneway-ANOVA test로 검증한 후, 유의적인 차이가 있는 항목에 대하여
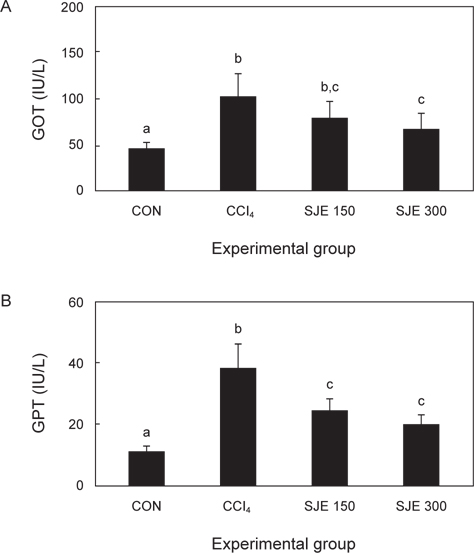
사염화탄소 투여에 따른 간세포 손상의 정도를 확인하기 위해 혈청 중의 GOT와 GPT의 양을 측정하였다. GOT 활성도는 대조군와 비교하여 볼 때 사염화탄소 단독 투여군은 유의성 있게 증가하였으며, SJE 150, 300군은 CCl4군에 비하여 농도 의존적으로 감소하였다. GPT의 활성 또한 대조군에 비하여 CCl4군은 유의적으로 증가하였고, SJE 150, 300군은 CCl4군에 비하여 GPT의 활성이 감소하였다(Fig. 1).
Carbon tetrachloride, thioacetamide, dimethyl nitrosamine 및 allyl alcohol 등 간독성 물질의 급성투여로 간질환이 유발되는 경우 간 손상으로 인한 간세포의 괴사와 간조직의 파괴가 진행됨에 따라 혈중으로 aminotransferase가 유리되어 높은 활성치를 보이는 것으로 알려져 있다(Balaze et al., 1961; Reitman and Flankel, 1957).
사염화탄소와 갈파래로부터 추출된 푸코이단(ULF) 투여 시의 간 독성 보호효과를 확인한 결과, CCl4군의 경우 대조군에 비하여 간 장애 유발로 인해 GOT와 GPT 효소 활성이 약 3.3배, 3.7배 증가하였고, 시료군인 ULF군은 대조군과 비교 하였을 때 29.8%, 48.2% 감소하는 것으로 나타났다(Nam et al., 2007).
본 연구에서도 CCl4군에서 혈청 GOT 및 GPT 활성이 대조군에 비해 높은 수치를 보여주었는데, 이는 사염화탄소 투여로 급성 간장 장애가 유도되었음을 보여주는 것이다. 또한, 150 mg/kg, 300 mg/kg의 다시마 추출물과 사염화탄소를 함께 투여한 실험군에서는 사염화탄소 투여군에 비해서 GOT, GPT 효소 활성이 회복되어 다시마 추출물이 간 손상에 대한 보호 효과를 가지는 것으로 여겨진다.
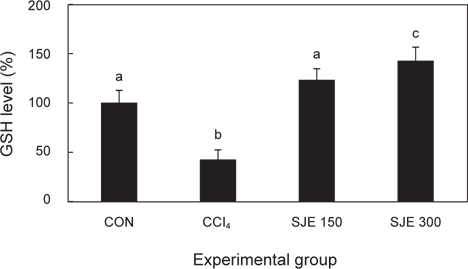
사염화탄소로 인한 급성 간 손상에 다시마 추출물이 어떠한 영향을 미치는 지 간 조직 내 GSH 함량을 측정하였다. 그 결과, CCl4 군에서 대조군보다 유의적으로 감소하였으며, SJE 150, 300군에서는 CCl4로 유발된 간 손상에 의해 감소된 GSH 함량이 농도 의존적으로 증가되는 것을 확인하였다(Fig. 2).
GSH는 Glutathione peroxidase (GPX) 및 Glutathione Stransferase (GST) 항산화 효소의 기질로 이용되면서 반응성이 큰 유독한 대사물질을 제거하는데 상당한 역할을 하는 것으로 알려져 있다(Hayes et al., 2000). 생체 내 활성소거제로 GSH는 GPX에 의해 과산화수소를 제거하면서 glutathione disulfide (GSSG)는 GSH로 환원되어 항산화 효소의 기질로 이용되면서 세포를 보호하는 역할을 하는 것으로 알려져 있다. 이러한 GSSG의 형성은 지질 과산화 정도나 조직 손상의 유발과 직접 관련이 있는 것으로 알려져 있다(Vendemiale et al. 1989). 특히 GSH가 혈액으로 유출될 때 간의 세포괴사가 시작되므로(Hidaka et al., 2007), GSH는 CCl4에 의해 유도된 간독성 대사물질을 줄이는데 중요한 역할을 한다.
사염화탄소로 유도된 간 손상 유발 쥐에
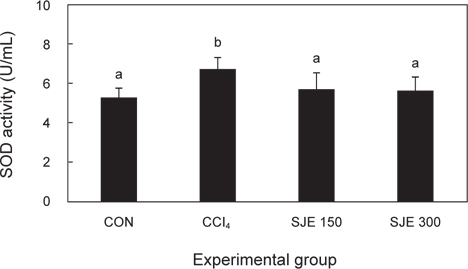
사염화탄소로 인한 급성 간 손상에 다시마 추출물이 어떠한 영향을 미치는 지 간 조직 내 superoxide radical 소거 효소인 SOD의 함량을 측정하였다. 그 결과, CCl4 군에서 대조군보다 유의적으로 증가하였으며, SJE 150, 300군에서는 CCl4로 유발된 간 손상에 의해 증가된 SOD 함량이 유의적으로 감소되는 것을 확인하였다(Fig. 3).
SOD는 mitochondria에 존재하며 superoxide radical 을 보다 반응성이 약한 hydrogen peroxide (H2O2)로 전환시키는 생체 내의 항산화 방어기구 중 하나로 알려져 있다(Crapo et al., 1978).
SOD 효소의 활성은 감소하는 경우도 있는 반면(Jung et al., 2004), 사염화탄소 처리 후 증가하는 것으로도 알려져 있다. 사염화탄소를 투여하여 간 손상을 유도하고 오미자 schizandrin C 유도체 biphenyldimethyl dicarboxylate (DDB) 혼합제제인 DWP-04 (DDB : selenium yeast : glutathione = 31.1 : 6.8: 62.1 , w/w%) 의 효능을 확인한 연구에서 SOD가 사염화탄소의 투여로 다소 증가되었으나, DWP-04 혼합제 투여로 정상군과 비슷한 경향을 나타내었다(Park et al., 2005). 또 부추녹즙에 항산화 및 항생물질의 효과를 입증하기 위한 실험에서도 SOD의 활성이 사염화탄소 투여로 대조군에 비하여 증가되었으나, 부추녹즙과 사염화탄소 병합투여로 SOD 활성은 사염화탄소 투여군에 비하여 유의한 감소효과를 나타내었다고 하였다(Lee, 2001).
본 연구결과도 대조군에 비하여 사염화탄소 투여로 간세포에 손상이 유발되어 SOD 효소 활성이 증가하였는데, 이는 사염화탄소 투여로 증가된 활성산소를 소거하려는 생리적 적응 현상으로 여겨진다. SJE 150, 300군의 SOD 활성이 CCl4군에 비해 감소한 것은 다시마 추출물이 활성산소의 생성 억제에 관여하는 것으로 여겨진다.
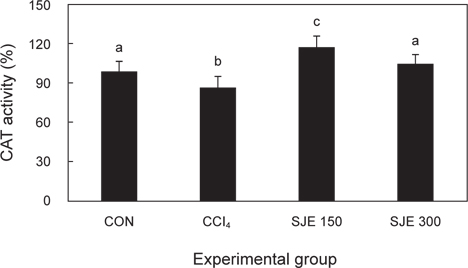
사염화탄소로 인한 급성 간 손상에 다시마 추출물이 어떠한 영향을 미치는 지 간 조직 내 CAT 활성을 측정하였다. CCl4군에서 대조군에 비해 유의적으로 감소하였으며, SJE 150, 300군에서 유의적으로 증가하는 것을 확인하였다(Fig. 4).
CAT는 세포 내 peroxisome에 주로 분포하며, 체내의 지방 자동산화 및 유기물의 산화로 생성된 H2O2를 물(H2O)과 산소(O2)로 분해하여 무독화 시키는 효소로 알려져 있다(Sunde and Hoekstra, 1980).
간 조직중의 항산화능 관련 연구에서 CAT 활성은 CCl4군이 대조군에 비하여 유의적으로 감소하였고, 마늘을 투여한 실험군에서는 CCl4군에 비하여 높게 나타났다고 하였다(Lee, 2010). 또, 사염화탄소로 간독성을 유발한 쥐에 산수유 추출물 처리 시 대조군에 비해 CCl4군에서 유의적으로 CAT의 활성이 감소하였으며, 산수유 추출물을 처리한 군에서는 CAT 활성이 증가하였다고 하였다(Ha et al., 2007).
이러한 결과를 바탕으로 사염화탄소로 유도된 간독성 유발 쥐에 다시마 추출물의 투여는 CAT 효소를 활성화시켜 사염화탄소 투여로 인한 H2O2의 함량을 감소시켜 생체 내 조직을 보호하는 것으로 여겨진다.
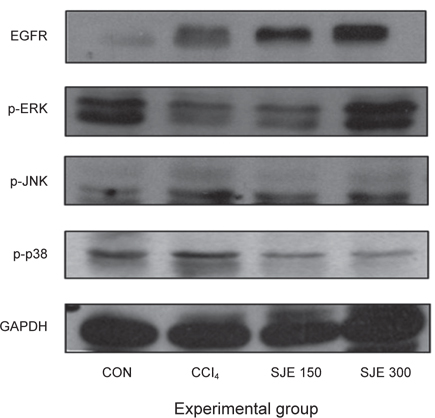
간세포의 손상 및 사멸과정에는 다양한 신호전달계가 관여한다. 사염화탄소로 유도된 간 독성의 발현은 세포 증식 작용에 있어서 중요한 신호전달 체계로 epidermal growth factor receptor (EGFR)은 세포증식 및 분화에 관여하고(Raper et al., 1987), 산화적 손상에 의한 세포사멸에 mitogen-activated protein kinase (MAPK) pathway의 활성화 경로를 거쳐 간세포의 사멸 유도과정에 영향을 미친다고 알려져 있다(Heo, 2005; Jang and Surh, 2002). 이러한 결과는 사염화탄소에 의한 간세포의 작용기전에 EGFR과 extracellular signal-regulated kinases (ERK), p38, c-Jun N-terminal kinases (JNK) 등의 활성에 영향을 줄 수 있을 것으로 보여 Western blot을 수행하였다. 그 결과, EGFR과 phospho-ERK의 발현은 CCl4군에서 감소하였고, SJE군에서 증가하는 것으로 나타났다. 반면, phospho-JNK 및 phosphop38의 발현은 대조군에 비해 CCl4군에서 증가하였고, SJE군에서 감소되는 것으로 나타났다(Fig. 5).
활성산소종은 세포증식, 분화, 사멸 등에 관여하는 MAPK pathway를 조절하는 것으로 알려져 있다(Sano et al., 2001). MAPK pathway는 3가지 kinase, 즉 ERK, JNK 및 p38 kinase으로 구성되어 있으며, 이 효소들이 활성화되면 세포에 다양한 반응들이 나타나게 된다. ERK는 다양한 성장인자들에 대한 세포의 분열이나 증식에 관련이 있는 반면에, JNK 및 p38는 세포 사멸의 유도와 관련되어 있는 것으로 알려져 있다(Gujral et al., 2001; Kolch, 2005).
사염화탄소 처리 시 EGFR과 phospho-ERK 발현 억제로 간세포 성장은 억제 되었고, JNK 및 p38 발현의 증가로 세포사멸에 관여하는 것을 확인하였다. SJE 투여 시 EGFR과 phospho-ERK 발현의 증가는 세포생존에 관여한 것으로 생각되며, p38 과 JNK의 인산화가 감소됨으로써 세포사멸을 저해하는 것으로 여겨진다. 이와 같이 사염화탄소 투여 시 산화적 손상을 유도하였고, 다시마 추출물인 SJE는 EGFR과 MAPK 활성을 조절하여 사염화탄소로 유도된 간세포의 세포사멸을 저해하는 것으로 보여진다.
이상으로 확인된 결과들을 종합해 보면, 다시마 추출물은 사염화탄소로 유도된 급성 간 손상에 혈청 중의 GOT와 GPT 효소 활성을 회복시켰다. 그리고, 간 조직중의 GSH, SOD 함량의 감소로 활성산소의 생성을 억제하였으며, CAT 활성을 증가시켜 생체 내 조직을 보호하는 것으로 나타났다. 또한, 다시마 추출물 처리 시 간 세포의 손상 및 사멸에 관여하는 EGFR과 phospho-ERK의 발현을 증가시켰고, phospho-JNK 및 phospho-p38의 발현을 억제시키는 것으로 나타났다. 따라서, 사염화탄소로 인한 급성 간 손상 시 다시마 추출물이 간 기능 개선에 도움을 줄 수 있을 것으로 여겨진다.