A protease inhibitor from fish eggs was fractionated using chromatographic methods. The fractionation efficiency was evaluated in terms of specific inhibitory activity (SIA, U/mg), purity (fold), total inhibitory activity (TIA, U), and recovery (%). The protease inhibitor (PI) from egg extracts of skipjack tuna (ST
우리나라에서 생산되는 성게, 명태, 대구, 연어 및 청어 알은 대부분이 알젓의 형태로 제조되어 판매가 되고 있을 뿐이며, 수산물 가공 중 발생하는 알의 양이 가장 많은 어종인 가다랑어 및 황다랑어 알의 경우, 전어체 중량의 1.5-3.0%를 차지하며, 식용소재로서 효율적으로 이용되지 못하고 가축 및 애완동물의 사료로 이용되거나 대부분 폐기되고 있는 실정이다(Heu et al., 2006; Intarasirisawat et al., 2011). 따라서 이의 식품소재 및 유용성분으로서의 이용을 위한 연구보고로는, 어류 알의 성분특성 및 이용에 관하여 숭어 알의 지질특성(Joe and Jo, 1993) 및 가공(Joe, 1991)에 관한 연구, 명란젓의 shelf-life 연장에 관한 연구(Kim, 1996), 대구 알(Park et al., 1983), 연어 알(Kim et al., 1988), 성게 알(Shimada and Ogura, 1990), 붕메기 알(Eun et al., 1994) 및 은어 알(Jeong et al., 2000)의 식품성분에 관한 연구, 가다랑어 및 황다랑어 알의 식품성분(Heu et al., 2006) 및 다랑어류 알의 화학조성(Intarasirisawat et al., 2011) 등과 같이 다양하게 시도되었다. 또한 어류 알의 protease inhibitor와 같은 유효성분의 이용에 관하여는 가다랑어 알(Jung et al., 2003) 및 연어 알(Shina et al., 2002)로부터 lectin의 분리, 정제 및 특성에 관한 연구, 청어(Oda et al., 1998), 잉어(Tsai et al., 1996), 연어(Yamashita and Konagaya, 1991) 및 명태(Ustadi et al., 2005)알 의 protease inhibitors를 분리 정제하여 그 특성을 검토한 바 있다. 특히, 식품산업에서 protease inhibitor를 응용한 대표적인 연구로는 An et al. (1996)이 수산 및 축산 식품의 선도유지, 조직감 개선 및 surimi 산업에의 응용 등을 시도하였다.
Surimi 제조 시 사용하는 시판 food-grade protease inhibitor에는 egg white powder, whey protein concentrate, beef plasma protein, 그리고 potato extract 등이 있으나(Hamann, et al., 1990 ; Kang and Lanier, 1999 ; Morrissey et al., 1993), 이들 protease inhibitor의 효과는 surimi 제조를 위한 원료 어종에 따라 차이가 있어 egg white powder와 beef plasma protein이 주로 사용(Kang and Lanier, 1999; Morrissey et al., 1993)되고 있다. 현재 축산식품 소재는 광우병, 조류 독감 등에 노출되어 있어 건강을 우려하는 소비자와 특정 종교 신도들의 경우 축산 식품 소재에서 유래되는 egg white powder 및 beef plasma protein의 이용을 꺼려하고 있다. 이러한 일면에서 볼 때 조류독감 및 광우병의 위험성이 없는 수산식품 소재로부터 food grade용의 protease inhibitor의 개발이 절실한 실정이다.
앞서의 연구를 통해 8종의 어류 알에서 protease inhibitor의 분포가 확인되었으며(Ji et al., 2011), 어류 알 추출물로부터 protease inhibitor의 단백질 용해도 차이에 의한 분획을 통하여 분획효율에 대해 검토 한 바 있다(Kim et al., 2013). 본 연구에서는 가다랑어
실험에 사용한 3 종류의 어류 알은 가다랑어(ST, Skipjack tuna) 및 황다랑어(YT, Yellowfin tuna) 알은 경상남도 창원시 소재 (주) 동원산업에서 동결상태로 분양받았고, 대조구로서 사용한 명태(AP, Alaska pollock) 알은 부산광역시 사하구 소재 블루오션 (주)에서 동결상태로 분양받았다. 분양 받은 3 종류의 어류 알은 초저온 냉동고 (-70℃)에 보관하여 두고 실험에 사용하였다.
>
Target proteases, 기질 및 buffer
어류 알 crude extracts (CE)로부터 protease inhibitor 획분의 분획을 사용한 sephadex G-50 gel matrix와 DEAE-sepharose CL-6B anion exchange resin, 저해활성 분포를 살펴보기 위한 target protease로는 serine protease인 trypsin와 이의 합성기질인 BAPNA (Nα-benzoyl-L-arginine-p-nitroanilide)은 Sigma-Aldrich Co. (St. Louis, MO, USA)에서 구입하여 시용하였으며, 그 외 시약은 분석급으로 구입하여 사용하였다.
효소활성 측정을 위해 사용한 0.1 M Tris-HCl buffer (pH 9.0)는 Dawson et al. (1986)의 방법에 따라 조제하였다.
어류 알 CE 및 분획물의 단백질 농도는 Lowry et al. (1951)의 비색법에 따라 bovine serum albumin을 표준 단백질로 하여 구한 검량곡선으로부터 측정하였다.
어류 알 crude extracts는 냉동상태의 시료를 부분해동 및 마쇄한 다음, 마쇄한 어류 알(100 g)에 대하여 3배 (v/w)의 탈 이온수를 각각 가하고, 혼합한 후, 1시간 간격으로 교반(20℃, 6 시간)하여 추출하였다(Kim et al., 2013).
Serine protease인 trypsin 활성은 기질로 BAPNA를 사용하여 Ji et al. (2011)의 방법에 따라 측정하였다. 먼저, BAPNA 기질을 사용하여 측정한 trypsin 활성은 일정량(30 μL)의 0.1% trypsin 용액에 0.6 mM BAPNA기질이 용해되어 있는 0.1 M Tris-HCl buffer (pH 9.0) 3 mL를 혼합 및 반응(40℃, 1 hr) 시킨 다음, 반응액에 0.3 mL의 33% acetic acid를 가하여 반응 정지를 시킨 후, 410 nm에서 흡광도(U-2900, UV-VIS spectrophotometer, Hitachi, Tokyo, Japan)를 측정하였다. 이때의 trypsin 활성 (U/mg)은 1분 동안 1 mg의 효소(단백질)가 변화시키는 흡광도 0.1 digit을 1 U/mg으로 나타내었다. 어류 알 CE의 target protease에 대한 상대 저해활성(RIA, relative inhibitory activity, %)은 이상에서 측정한 target protease의 어류 알 CE 및 분획물의 무첨가 대조구 활성(C) 및 첨가 활성(A)을 이용하여 다음과 같은 방법으로 산출하였다.
RIA (%) = 〔(C-A) / C〕× 100
또한, 이때 어류 알 CE 및 분획물의 target protease에 대한 저해활성(SIA, specific inhibitory activity, U/mg)은 1 mg 단백질이 1분 동안 각 비효소활성(enzymatic activity, U/mg) 1 U/mg을 감소시키는 것으로 나타내었다.
>
어류 알 CE로부터 protease inhibitor의 분획
가다랑어(ST), 황다랑어(YT) 및 명태(AP) 알의 CE로부터 protease inhibitor의 분획은 gel filtration chromatography 분획법 및 anion exchange chromatography 분획법)에 의하여 실시하였다. 각 분획방법 별 fraction의 저해활성은 target protease인 trypsin에 대해 BAPNA 기질을 사용하여 측정함으로써 그 효과를 검정하였다.
먼저, 단백질 분자량의 차이에 따른 어류 알 CE의 분획은 5 mL의 CE를 0.1 M NaCl을 함유하는 10 mM sodium phosphate buffer (pH 7.0)로 평형화 시킨 Sephadex G-50 column(i.d. 1.6 x 95 cm)에 주입하고, 일정한 유속(40 mL/hr)으로, 용출(3 mL/tube) 시켜, 이를 9 회 반복 실시하였다. Chromatogram 상의 단백질 농도 측정은 280 nm에서의 흡광도로 나타내었으며, BAPNA 기질을 사용하여 trypsin에 대한 저해활성(%)을 보인 fraction을 분획한 다음, 이를 농축 및 투석하여 총 저해활성 및 회수율을 통해 분획효율을 검정하였다.
한편, 이온강도 차이에 의한 어류 알 CE의 분획은 10 mM sodium phosphate buffer (pH 7.0)로 미리 평형화 시킨 DEAE-sepharose CL-6B (Anion, Sigma-Aldrich Co., USA)로 충전한 column (i.d. 2.6 x 20 cm)에 CE (40-55 mL)를 주입하여, 10 mM sodium phosphate buffer (pH 7.0)로 용출시키면서 단백질을 흡착시켰다. 다음으로 0-1.0 M NaCl 용액을 함유하는 10 mM sodium phosphate buffer (pH 7.0)를 사용하여 농도구배법으로 용출(30 mL/hr, 3 mL/tube) 하였다. Chromatogram 상의 단백질 농도 측정은 280 nm에서의 흡광도로 나타내었으며, BAPNA 기질을 사용하여 trypsin에 대한 저해활성(%)을 보인 fraction을 분획한 다음 이를 농축 및 투석하여 총 저해활성 및 회수율을 통해 분획효율을 검정하였다.
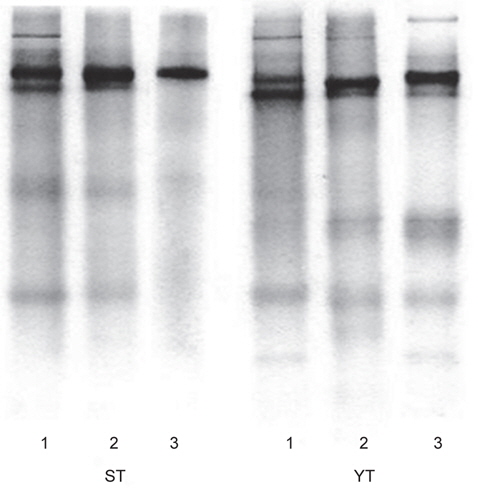
어류 알 CE 및 각 fractions의 분획효과 검정을 위하여 native-polyacrylamide gel electrophoresis (PAGE) 시료는 각 분획 시료 0.4 mL에 0.1 mL의 sample buffer (62.5 mM Tris-HCl, pH 6.8)를 혼합하여 전기영동용 시료로 사용하였다. Walker (2002)의 방법에 따라, 10% Mini-PROTEANⓇ TGX™ Precast gel (Bio-Rad Lab. Inc., USA)을 Mini-PROTEAN Tetra cell (Bio-Rad Lab. Inc., USA)에 장착한 한 다음, 일정량(5-10 μL)의 시료를 주입하고, gel (10 well)당 10 mA의 전류로 전기영동을 실시하였다. 전기영동이 완료된 gel은 coomassie brilliant blue R-250 용액으로 염색한 후, acetic acid, methanol 및 탈이온수 (1:2:7, v/v/v) 혼합용액으로 탈색하였다.
산업적 응용을 위한 기초 실험으로서, 앞서의 연구(Kim et al., 2013)에서 우수한 분획 효과를 보인 40-80% 포화 ammonium sulfate 분획의 fractions을 대상으로 Sephadex G-50 column (i.d. 1.6 x 95 cm)을 이용하여 gel filtration을 실시하고, 총 저해활성 및 회수율을 통해 연속분획효율을 검정하였다.
>
Gel filtration chromatography로 분획한 fraction의 저해활성 비교
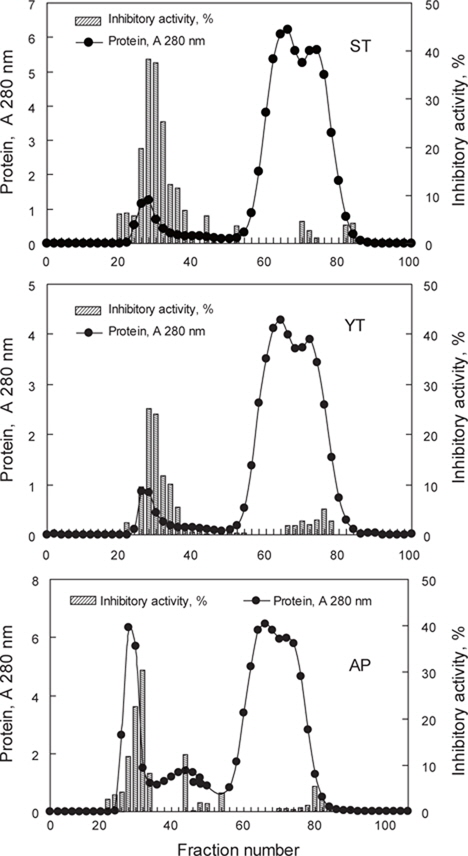
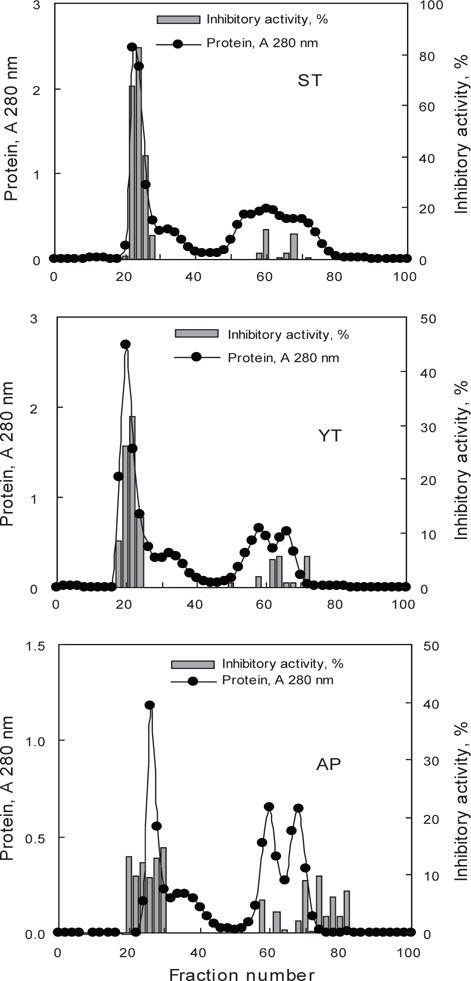
어류 알의 protease inhibitor를 효율적으로 분획할 목적으로 가다랑어, 황다랑어 및 명태 알 CE로부터 분자량의 크기에 따른 분획을 Sephadex G-50 column (i.d. 1.6 x 95 cm)을 사용하여 분획한 chromatogram은 Fig. 1과 같다. 3종의 어류 알의 CE 모두 fraction No. 22-36 (분자량 30-50 kDa 범위)에서 trypsin 저해활성을 나타내는 fraction이 용출되었다. Chromatogram 상의 trypsin 저해활성(RIA, %)은 가다랑어(ST)가 약 20-40%의 저해활성 분포를 보였으며, 황다랑어(YT)는 약 15-25%, 그리고 명태 (AP)의 경우, 15-30%의 저해활성 분포를 나타내었다.
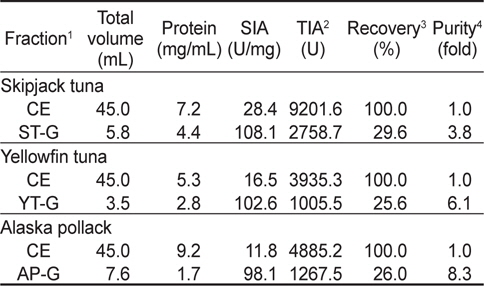
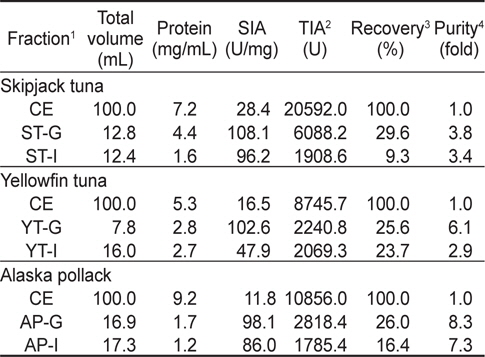
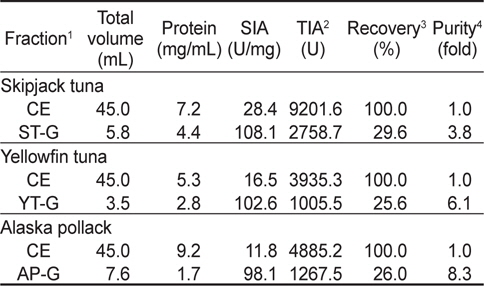
가다랑어, 황다랑어 및 명태 알 CE로부터 gel filtration chromatography를 9회 실시하여 분획 농축한 fraction의 trypsin에 대한 total inhibitory activity (TIA, U), specific inhibitory activity (SIA, U/mg), 정제도(fold)와 회수율(%)은 Table 1과 같다. 이들 fraction의 trypsin (BAPNA 기질)에 대한 SIA (U/mg) 및 TIA (U)는 가다랑어(ST-G)가 각각 108.1 U/mg 및 2758.7 U로서 CE (각각 28.4 U/mg 및 9,201.6 U)에 비하여 3.8배의 정제도와 29.6%의 회수율을 나타내어 가장 높았고, 다음으로 명태가 각각 98.1 U/mg 및 1,267.5 U로서 CE (각각 11.8 U/mg 및 4,885.2 U)에 비해 8.3배의 정제도가 증가하였으며, 이때의 회수율은 26.0%이었다. 황다랑어(YT-G)의 경우는 102.6 U/mg 및 1,005.5 U로서 CE (각각 16.5 U/mg 및 3,935.3 U)에 비하여 정제도는 6.1배로 증가하였고, 이때의 회수율은 25.6%이었다.
Trypsin inhibitory activities of fractions obtained from crude extracts of skipjack tuna K. pelamis, yellowfin tuna T. albacares and Alaska pollock T. chalcogramma eggs by the gel filtration chromatography toward BAPNA as a substrate
이상 결과로 미루어 보아 Sephadex G-50 gel filtration chromatography를 이용한 3종의 어류 알의 CE로부터 protease inhibitor의 분획은 25-30% 수준의 회수율 보여 회수율 고려한다면, 적적한 분획방법이 아닌 것으로 판단되나, 정제도 측면에서는 오히려 3.8-8.3배의 정제도를 나타냄으로써 상대적으로 순도가 높은 획분을 얻고자 한다면, 분획방법으로서 유용한 수단이 될 수 있으리라 판단되었다.
Gel filtration chromatography 분획방법은 용액 중 단백질의 분자량 크기에 따른 분획이므로 분획효과 및 반복처리에 따른 재현성이 우수하며, 연속처리가 가능한 점, 저온에서 분획과정이 이루어지기 때문에 비교적 단백질의 변성 가능성이 낮고, 분획에 사용되는 염의 농도(0.6% 미만)가 생리식염수의 농도(0.9% 내외) 보다 낮아 별도의 투석과정을 거칠 필요가 없다는 점 등과 같은 장점이 있으나, gel filtration matrix가 고가인 점, 분획효과를 높이기 위해 가늘고 긴 column을 사용하여야 한다는 점, 1회 처리량이 적다는 점, 상온에서의 단백질변성을 최소화하기 위해 저온에서 실행하여야 하는 점, 경우에 따라 fraction의 농축과정이 필요한 점 등과 같은 단점도 있다. 이러한 일면에서, 단백질 분자량 크기에 따른 분획방법은 재현성과 연속처리가 가능한 점, 분획 후 별도의 처리(탈염 및 농축)가 최소화되는 점에서 단백질 유용자원의 분획에 효과적이라고 할 수 있으나, 대량처리를 위한 산업화 공정의 개발이 필요할 것으로 생각된다(Preneta, 1989; Heu and Ahn, 1999; Kim et al., 2008).
>
Anion exchange chromatography로 분획한 fraction의 저해활성
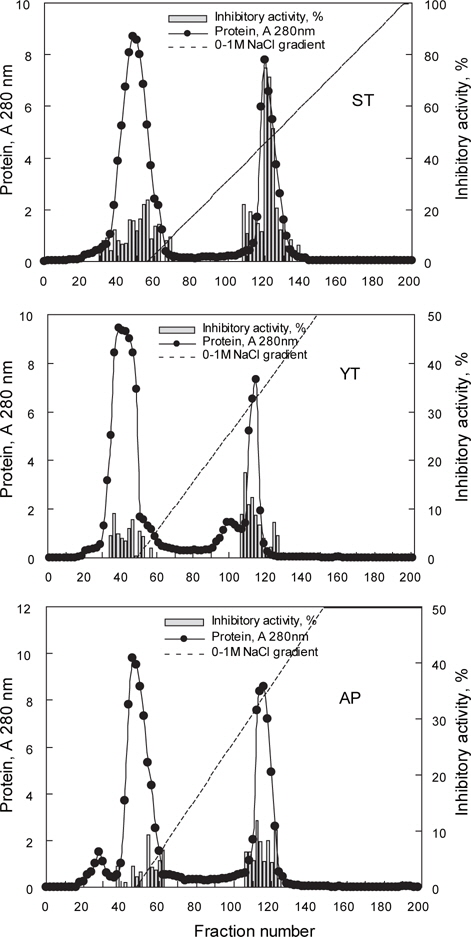
어류 알의 protease inhibitor를 효율적으로 분획할 목적으로 가다랑어, 황다랑어 및 명태 알 CE (45-55 mL)를 DEAE-Sepharose CL-6B anion exchange 수지를 충진한 column (i.d. 2.6 x 20 cm)에 흡착시킨 다음, 비흡착 fraction과 흡착 단백질을 NaCl 용액에 의한 이온 강도별로 분획한 fraction의 anion exchange chromatogram은 Fig. 2와 같다. 가다랑어(ST-I)는 NaCl 농도 0.4-0.5 M 범위(fraction No. 116-128)에서, 황다랑어(YT-I)는 NaCl 농도 0.55-0.7 M 범위(fraction No. 106-118)에서, 명태(AP-I)는 NaCl 농도 0.6-0.7 M 범위(fraction No. 108-122)에서 trypsin에 대한 저해활성을 나타내는 fraction이 용출되었다. Chromatogram 상의 trypsin 저해활성(RIA, %)은 가다랑어가 약 30-70%의 저해활성 분포를 보였으며, 황다랑어는 약 10-20%, 그리고 명태의 경우, 5-10%의 저해활성 분포를 나타내었다.
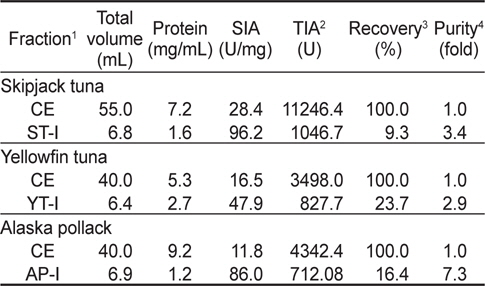
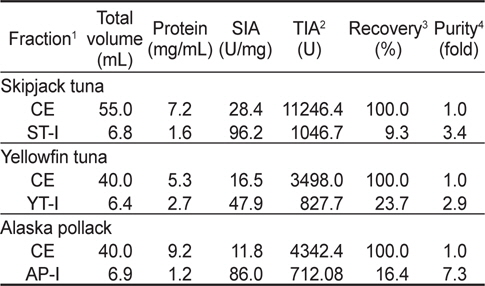
이온교환 수지를 통하여 3 종의 어류 알 CE로부터 분획한 fraction들의 trypsin (BAPNA 기질)에 대한 저해활성과 회수율을 측정한 결과는 Table 2와 같다. Fraction들의 SIA (U/mg) 및 TIA (U)는 가다랑어(ST-I)가 각각 96.2 U/mg 및 1,046.7 U로 가장 높았고, 다음으로 황다랑어(YT-I, 47.9 U/mg 및 827.7 U) 및 명태(AP-I, 86.0 U/mg 및 712.1 U)의 순이었다. 그러나, 어류 알 CE로부터 분획된 fraction의 정제도(fold)와 회수율(%)은 SIA 및 TIA와는 달리 가다랑어(ST-I)의 경우 각각 3.4배 및 9.3%로 가장 낮았고, 다음으로 명태(AP-I, 7.3배 및 16.4%) 및 황다랑어 알(YT-I, 2.9배 및 23.7%)의 순으로 높았다.
Trypsin inhibitory activities of fractions obtained from crude extracts of skipjack tuna K. pelamis, yellowfin tuna T. albacares and Alaska pollock T. chalcogramma eggs by the anion exchange chromatography toward BAPNA as a substrate
이상의 결과로 미루어 보아 DEAE-Sepharose CL-6B anion exchange resin을 이용한 이온교환 크로마토그래피에 의해 3종의 어류 알 CE로부터 protease inhibitor를 분획하고자 하는 경우, NaCl 농도 0.4-0.7 M 범위에서 fraction을 분획하는 것이 적절하리라 판단되었다.
Ion exchange chromatography 분획법은 acetone이나 ammonium sulfate 분획법과 같이 CE로부터 사용되는 ion exchange matrix의 양에 비례하여 1회에 대량처리가 가능한 점, 단백질의 하전 차이에 따른 분획이므로 분획효과가 뛰어나다는 점, 비교적 단시간에 처리가 가능하다는 점, 사용한 ion exchange matrix는 regeneration과정을 거쳐 반복사용이 가능한 점, 비교적 단백질의 변성 가능성이 적은 점 등과 같은 장점이 있다. 하지만, ion exchange chromatography 분획법은 ion exchange matrix가 고가인 점, 하전에 의한 분획방법이므로 분획을 위하여 각기 이온강도를 달리하면서 사용하여야 하는 점, 상온에서의 단백질 변성을 최소화하기 위해 저온에서 실행하여야 하는 점, 1회 처리 후 재사용을 위해 ion exchange matrix의 regeneration과정을 거쳐야 하는 점, 분획 후 이온강도의 차이를 위해 사용한 염이 각 fraction에 함께 존재하므로 탈염조작이 필요한 점, 경우에 따라 fraction의 농축과정이 필요한 점 등과 같은 단점이 있다. 따라서, ion exchange matrix를 이용한 분획방법은 회분식(batch 식)으로 분획의 경우, 상온에서 비교적 단시간에 이용 가능하며, 용해도 차이에 의한 분획방법 보다 분획효과가 좋은 점 등이 있지만, 탈염 및 농축을 위한 방안이 반드시 마련되어야 한다(Roe, 1989).
어류 알 CE, gel (ST-G 및 YT-G) 및 anion exchange chromatography (ST-I 및 YT-I)에 의한 fractions의 native-PAGE 전기영동 결과는 Fig 3과 같다. 먼저 가다랑어 (
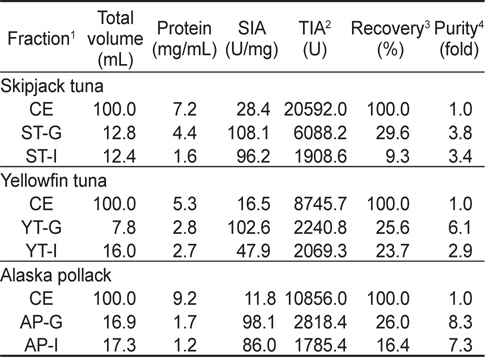
3종의 어류 알 CE로부터 gel filtration 및 anion exchange chromatography를 통해 분획한 protease inhibitor fraction들의 total inhibitory activity (TIA, U) 및 회수율(%) 등을 상호 비교(분획을 위하여 사용한 CE의 total volume을 100 mL로 환산)하여 나타낸 결과는 Table 3과 같다. 가다랑어 알의 경우, ST-G 및 ST-I의 TIA (U)는 각각 6,088.2 및 1,908.6 U 였으며, ST-CE (20,592.0 U)에 대한 회수율은 각각 29.6 및 9.3%로서 gel filtration이 anion exchange chromatography법에 비하여 회수율은 좋은 반면, 정제도에서는 차이가 없었다. 황다랑어 알의 경우, YT-G 및 YT-I의 TIA (U)는 각각 2,240.8 및 2,069.3 U였으며, YT-CE (8,745.7 U)에 대한 회수율이 각각 25.6 및 23.7 %로서 단백질 분자의 크기(size)나 하전(net charge) 차이에 따른 chromatography법간의 차이는 인정되지 않았다. 다만, 정제도 및 SIA (U/mg)에 있어서 YT-G가 YT-I에 비해 2배 가량 높은 것으로 나타났다. 명태 알의 경우, AP-G 및 AP-I의 TIA (U)는 각각 2,818.4 및 1,785.4 U 였으며, AP-CE (10,856.0 U)에 대한 회수율은 26.0 및 16.4%로서 약 10% 내외의 차이를 보였다. 이상의 결과로 어류 알 CE로부터 protease inhibitor를 chromatography법을 이용하여 분획하고자 하는 경우, 회수율 측면에서 gel filtration 법(25.6-29.6%)이 anion exchange chromatography법 (9.3-23.7%)에 비하여 3종의 어류 알 모두에서 일정한 회수율을 나타냄으로써 보다 효과적인 분획방법이라 판단되었다. 앞서의 연구(Kim et al., 2013)의 단백질 용해도 차이에 의한 분획방법에서 우수한 분획 효과를 나타낸 ammonium sulfate (AS) 40-80% 포화 농도 획분을 대상으로 gel filtration법을 적용한 연속분획을 통한 어류 알 protease inhibitor의 기초분획공정 확립을 위한 실험을 진행하였다.
Comparison of trypsin inhibitory activities of fractions obtained from crude extracts of skipjack tuna K. pelamis, yellowfin tuna T. albacares and Alaska pollock T. chalcogramma eggs by different chromatographic methods toward BAPNA as a substrate
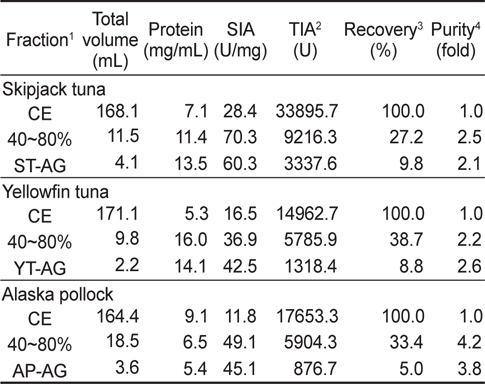
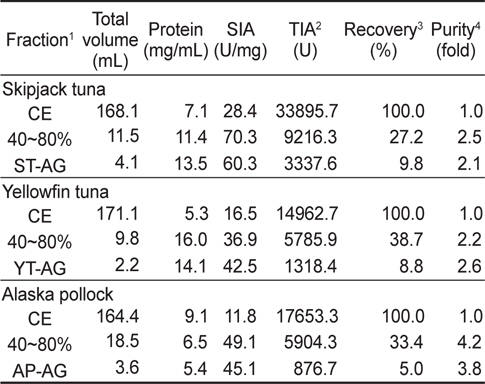
어류 알 CE로부터 ammonium sulfate (AS) 40-80% 포화 농도 획분을 대상으로 gel filtration 법을 적용한 연속분획을 통하여 어류 알 protease inhibitor의 기초 분획공정 확립을 위한 실험의 결과를 Fig. 4 및 Table 4에 나타내었다. 3종의 어류 알 AS 40-80% fractions의 Sephadex G-50 gel filtration 결과(Fig. 4)는 Fig. 1의 결과와 유사한 chromatogram을 나타내어 30-50 kDa의 획분에서 protease inhibitors가 용출되었으며, chromatogram 상의 저해활성은 가다랑어가 40-80%로 가장 강한 활성을 나타내었고, 황다랑어(10-35%) 그리고 명태(10-15%) 순이었다. 이들 획분을 모아 농축하여 회수율(%) 및 정제도(fold)에 대하여 상호 비교하여 연속분획공정의 분획효과에 대해 검토하였다(Table 4). 먼저, AS 40-80% fractions의 TIA (U)는 각각 가다랑어 (ST)는 9,216.3 U, 황다랑어(YT)는 5,785.9 U 그리고 명태(AP)는 5,904.3 U로서 각 어류 알 CE에 대하여 각각 27.2, 38.7 및 33.4%의 회수율을 나타내어, 어류 알 CE의 gel filtration fractions (Table 1, 25.6-29.6%)보다는 우수한 것으로 나타났다. 이들 획분을 gel filtration을 통해 연속처리 한 fractions의 회수율이 각 어류 알 CE에 대해 ST-AG가 9.8%, YT-AG는 8.8% 그리고 AP-AG는 5.0%로 10% 미만의 회수율을 보임으로써 AS fraction에서 gel filtration 과정 중에 단백질 변성과 protease inhibitor의 분획과정 중의 유실로 인한 상당한 저해활성 손실이 있음이 확인되었다. 아울러 분획물의 SIA (U/mg) 및 정제도에서도 황다랑어를 제외하고는 감소하는 경향을 보였으며, 황다랑어의 경우도 2.2에서 2.6배로 정제도가 크게 개선되지 않음으로써 ammonium sulfate 분획 및 gel filtration을 연속분획 공정은 정제 및 분획효과가 거의 없는 것으로 나타났다.
Trypsin inhibitory activities of fractions obtained from crude extracts of skipjack tuna K. pelamis, yellowfin tuna T. albacares and Alaska pollock T. chalcogramma eggs by serial fractionation with salting-out and gel filtration for industrial utilization toward BAPNA as a substrate
따라서, 앞서의 연구(Kim et al., 2013)과 본 실험의 결과를 토대로 최적의 분획 공정의 확립 및 개발을 위하여는 대량처리 및 분획이 가능한 ammonium sulfate의 장점과 단백질 분자량의 크기에 따른 분획효과와 연속처리가 가능한 gel filtration의 장점을 동시에 충족시키면서 단백질 변성을 최소화하는 단시간 내에 처리 가능한 분획 방법이 요구된다. 이에 이상의 장점을 충족하는 방법으로서 앞으로의 연구에서는 ultrafiltration system을 통한 분획 공정을 개발 확립하고자 한다.