The marine microalgae
미세조류는 다양한 영양소 및 생리활성물질을 함유하고 있어 여러 산업에 널리 이용되고 있다(Park et al., 2010). 또한 최근 지구 온난화의 주범인 이산화탄소의 저감과 화석연료를 대체할 바이오에너지 생산에 미세조류의 광합성 기작 이용성이 더욱 광범위해지고 있다(Oh et al., 2003).
일반적으로 미세조류의 성장에 영향을 미치는 환경적 요인으로는 수온, 염분, pH, 이산화탄소 및 광 조건 등으로 알려져 있다(Park et al., 2010). 하지만 이러한 환경적 요인 중에서도 광 관련 인자는 무엇보다도 중요하게 고려되어야 할 사항이다. 특히 빛의 파장은 미세조류의 양적 및 질적 변화를 줄 수 있기 때문에 광원의 선택은 인위적인 미세조류 배양을 위해 반드시 고려되어야 한다(Rocha et al., 2003; Mouget et al., 2004; Sánchez-Saavedra and Voltolina, 2006).
한편 차세대 에너지절약형의 대체 광원인 발광다이오드(Light Emitting Diode, LED)는 가시광선대의 파장을 모두 구현할 수 있어 미세조류 배양에 매우 유익한 것으로 보고되어 있다(Das et al., 2011). 이러한 LED는 다른 발광체보다 수명이 길고, 낮은 소비전력(수 V) 및 빠른 반응시간(백열전구 대비 1×106배) 특성으로 친환경적이며, 열 발생이 없는 장점까지 지니고 있다(Oh et al., 2007). 하지만 현재까지도 실외 개방형에서 미세조류를 배양할 때에는 주로 태양광이 이용되고, 실내 밀폐형에서는 형광등이 많이 사용되고 있다. 형광등은 LED 광원에 비해 높은 유지비용 및 과도한 열발생으로 인해 배양효율 및 경제성이 낮은 것으로 인식되고 있어 이에 따른 문제점 개선이 필요하다. LED는 해당 미세조류의 광합성에 필요한 특정 파장만 공급하여 빛의 이용 효율성을 높여 주어 유용 미세조류의 대량배양에 효율적인 광원으로 인정받고 있다.
따라서 본 연구에서는 광원으로 다양한 LED를 이용하여 유용 미세조류의 하나인
LED 광원에 따른 미세조류의 배양
실험에 이용된
실험구는 각각의 칸막이가 설치된 천막에 파장이 다른 5개(460 nm, LB; 520 nm, LG; 580 nm, LY; 630 nm, LR; 복합파장, LW)의 180 W LED 램프(WFLL180, Wisepower Inc., Korea)를 배양수조 표면 30 cm 높이로 고정시켜 설치하였으며, 전력소비가 동일한 180 W 메탈 핼라이드 램프(MH, HSL-MH175W, Hwasung Inc., Korea)를 함께 두어 16L:8D의 광주기로 3회 반복 실험하였다. 이 때 각각의 파장은 분광기(LI-1400, LI-COR, Inc., USA)를 통해 측정하였다.
배양일수에 따른 성장을 알아보고자 건조중량(g/L) 값을 구하였다. 건조중량은 GF/C 여과지(47 mm, WhatmanTM, UK)를 이용하여 50 mL의 배양수를 여과하고 증류수로 남아있는 염을 녹인 후 100℃에서 1시간 동안 건조하여 무게를 매일 측정하여 구하였다. 또한 매일 세포수를 확인하여 배양일수 경과에 따른 상대성장률(Specific growth rate, SGR) 값을 Rico-Martinez and Dodson (1992)의 방법에 따라 구하였다.
Total carotenoid와 chlorophyll a 분석
Total carotenoid와 chlorophyll a는 Wellburn (1994) 방법에 따라 분석하였다. 각 실험구에서 배양되고 있는
Chlorophyll a (Ca) = 16.72A666 − 9.16A653 Chlorophyll b (Cb) = 34.09A653 − 15.28A666 Total carotenoid = 1000A470 − 1.63Ca − 104.96Cb / 221
여기서 A 밑에 아래첨자는 각각의 흡광도이며, Ca 및 Cb는 chlorophyll a, b 값을 의미한다.
지방산 분석
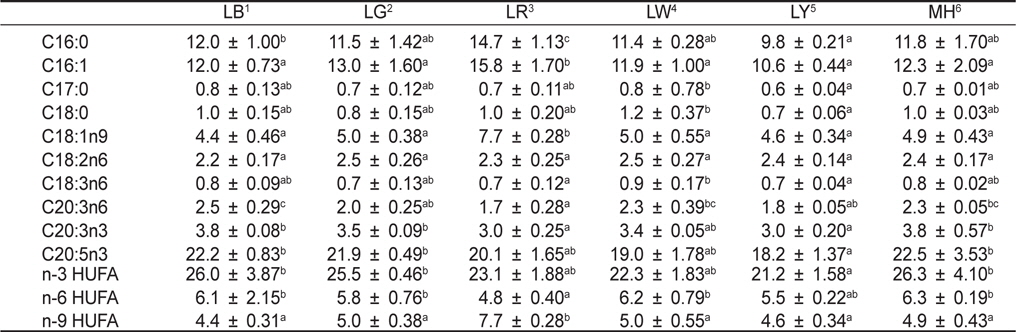
각 실험구별로 배양된 미세조류의 수확은 원심분리기(SORVALL ST16R, Thermo, Germany)를 이용하여 5,000 rpm에서 15분 동안 원심분리하여 분석 시까지 −80℃에서 보관하였다. 지방산 분석은 Parrish (1987) 방법에 따라 지질을 추출하여 Morrison and Smith (1964)의 방법에 따라 BF3-methanol을 이용하여 지방산을 메틸레이션(methylation) 하였다. 메틸레이션된 지방산은 capillary column (OMEGAWAX 250, SupelcoTM, USA)이 장착된 gas chromatography (HP6890 plus, Agilent, USA)로 분석하였다. 그리고 gas chromatograph에 의한 각각의 지방산 peak는 Supelco 37 Component FAME mix (SupelcoTM, 100 mg Nrat 18919-1AMP, USA)로 동정하여 정량화하였다.
아미노산 분석
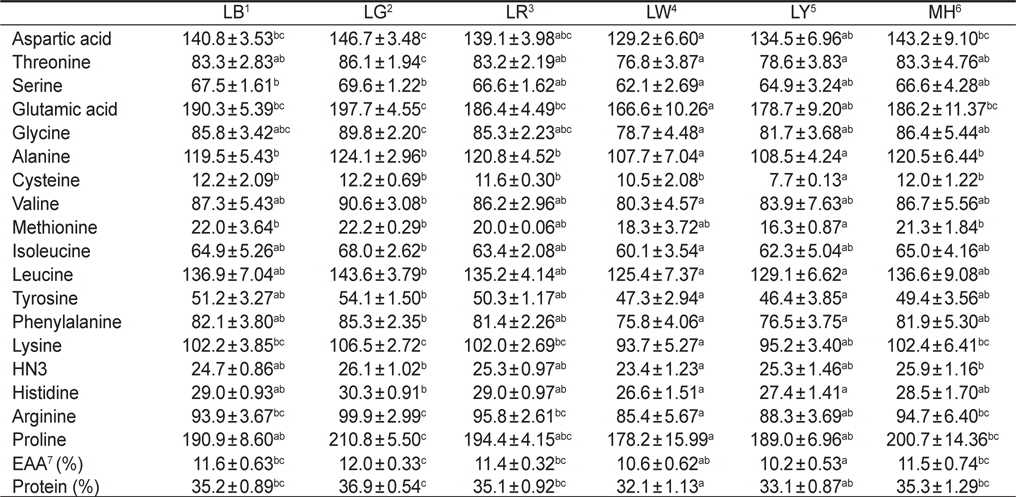
아미노산 분석을 위해 동결 건조된 각각의 샘플을 15 mL 유리 시험관에 10 mg 가량으로 정량하고, 6 N HCl을 첨가하여 120℃에서 22시간동안 가수분해시켰다. 6 N HCl이 완전히 증발된 후 0.02 N HCl을 5 mL 정량하여 넣고 구성아미노산을 녹였다. 이 후 0.45 μm filter를 이용하여 녹아있는 아미노산을 1.8 mL vial에 1 mL 이상이 되도록 담아 아미노산 분석기(L-8800, Hitachi, Japan)를 이용하여 분석하였다.
각기 다른 광원에 따른 미세조류의 성장률, total carotenoid, chlorophyll a, 아미노산 및 지방산 함량의 평균은 Duncan (1955)의 다중검정 후 SPSS program을 이용하여 one-way ANOVA test에 의한 평균 간의 유의성을 유의수준 95%로 처리하였다.
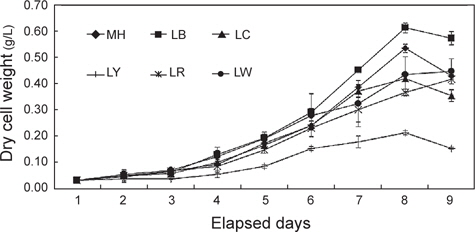
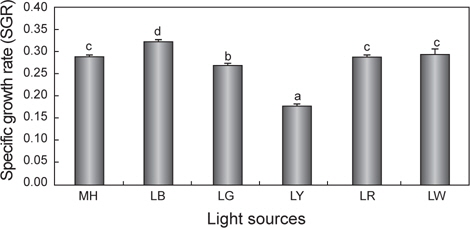
세포성장에 따른 건조중량과 상대성장률(SGR)을 Fig. 1과 2에 나타내었다. 배양 3일까지는 모든 실험구간에서 차이 없이 성장하였으나 4일째부터는 유의적인 차이가 나타나기 시작했다. LR를 제외한 모든 실험구는 배양 8일째 최고 건조중량(g/L)의 값을 보이는 것으로 조사되었다. 그 중에서도 LB는 0.61 g/L로 가장 높은 값을 보였으며, 그 뒤로 MH가 0.53 g/L으로 높게 나타났다. 반면, LY는 0.21 g/L로 유의적으로 가장 낮은 값을 보였다(
>
Chlorophyll a와 total carotenoid의 변화
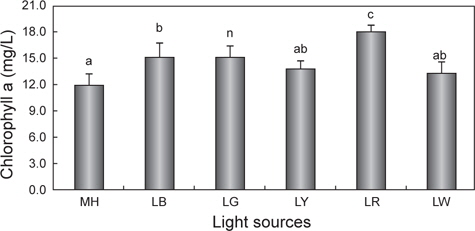
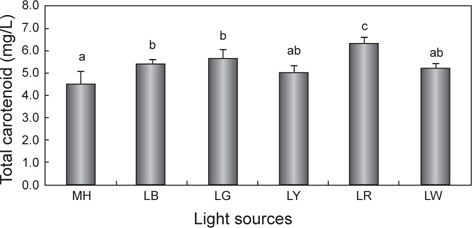
광원에 따른 chlorophyll a와 total carotenoid 함량의 변화를 Fig. 3과 4에 나타내었다. Chlorophyll a의 평균값은 LR에서 18.0 mg/L으로 유의적으로 가장 높았으며(
광원에 따른
[Table 1.] Fatty acids (ug/mg dry matter) of Nannochloropsis sp. at various light sources*
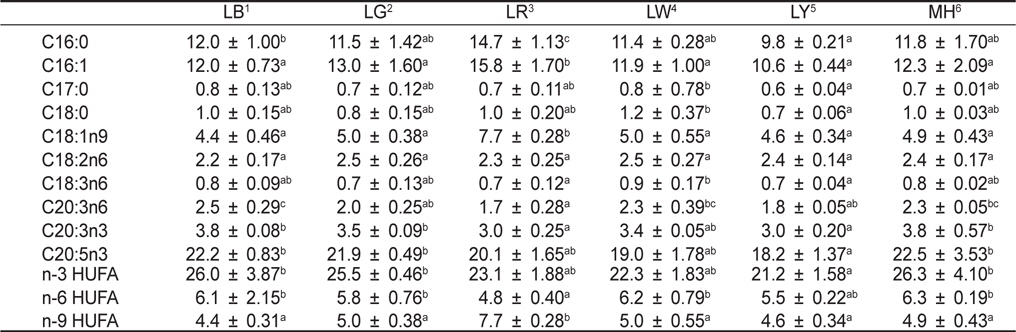
Fatty acids (ug/mg dry matter) of Nannochloropsis sp. at various light sources*
한편 실험구에 따른 아미노산 함량 변화는Table 2에 나타내었다. 실험구간을 비교했을 때, 필수아미노산 및 비필수아미노산의 함량이 실험구간마다 뚜렷한 경향은 보이지 않았다. 하지만 LED 파장에 따라 필수아미노산 및 비필수아미노산의 함량 변화에는 유의적으로 영향을 준 것으로 나타났다. 특히 모든 필수아미노산(threonine, valine, methionine, isoleucine, leucine, phenylalanine 및 lysine)은 LG에서 유의적으로 가장 높게 나타났다(
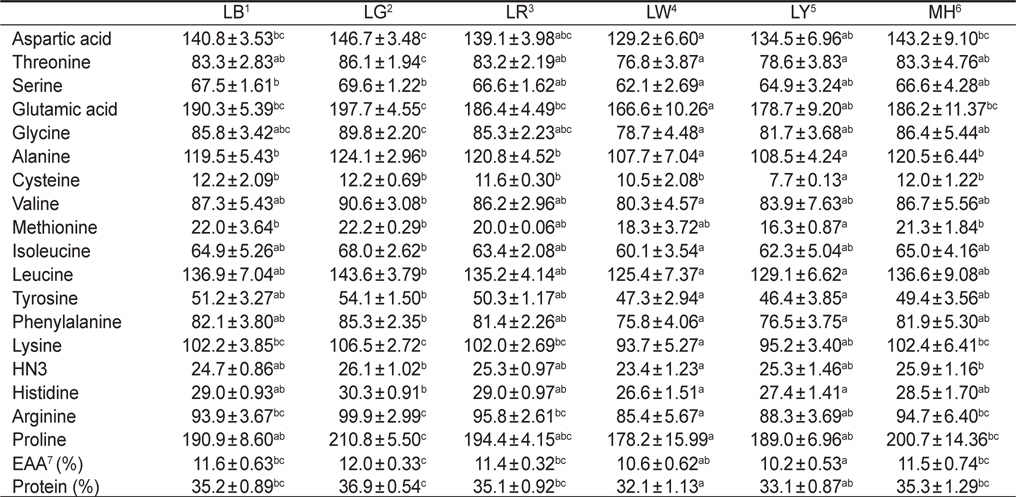
Amino acid compositions (ng/mg dry matter) of Nannochloropsis sp. at various light sources*
미세조류는 세포성장을 위해 빛을 광 촉매제로 이용하며, 미세조류 종간의 상대성장률은 빛의 파장, 광도 등의 광질에 의해 영향을 받게 된다(Wang et al., 2007). LED는 특정파장과 다양한 파장을 조합하여 낮은 전력소비량으로 미세조류를 배양하는데 이용할 수 있다(Oh et al., 2007). 따라서 본 연구에서는 LED가 유용 미세조류 중에 하나인
본 연구결과, 파장이 각기 다른 LED 광원을 가지고
이처럼 blue 파장에서 미세조류의 성장이 높은 이유로는 무기영양염에 있는 탄소원의 흡수율 증가(Schofield et al., 1996; Klenell et al., 2004), 세포 내 동화작용 및 대사 작용의 차이(Wallen and Geen, 1971; Ruyters, 1984), 광합성 유도 유전자 전사 및 효소활동의 차이(Das et al., 2011)에 의한 것이라 할 수 있다. 본 연구에서도 blue 파장의 LED 광원에서 높은 성장과 상대성장률을 보였는데, 이는 위에서 언급한 이유들에 의한 복합적인 요인때문이라 판단되어진다.
물론 모든 미세조류가 blue 파장에서 성장이 좋은 것만은 아니다. 각기 다른 미세조류들이 선호하는 빛 파장에는 분명 차이가 있기 때문이다. Wallen and Geen (1971)에 의하면,
한편 세포성장에 따른 건조중량과 상대성장률이 가장 높았던 LB를 제외하면 LW, LR 및 LG가 다음 그룹으로 높게 나타났다. 본 실험에 사용된 white 광원인 LW는 RGB 조합(red, green, blue)의 LED 램프로 세 가지 파장의 색이 혼합되어 나타나는 색이다(Bang and Kim, 2012). Schofield et al. (1990)에 의하면,
다만 yellow LED인 LY에서는 건조중량 및 상대성장률이 낮은 경향을 보여
한편 최근에 태양광 및 형광등을 대체할 광원으로 메탈 핼라이드 램프가 주목을 받고 있으며, 실제 이를 통해 미세조류를 배양하여 생산성이 증가한다는 연구결과도 발표되어 있다(Ruangdej and Fukami, 2004). 메탈 핼라이드 램프는 수명이 6,000-9,000시간으로 길고, 태양광에 가까운 백색광을 내는 장점을 지니고 있기에 본 연구에서도
>
Chlorophyll a와 total carotenoid의 함량 변화
광합성에 의해 축적되는 미세조류의 색소 함량 및 축적할 수 있는 생합성 능력은 환경요인에 의해 달라진다고 하였으며, 그중에서도 빛의 파장은 매우 밀접한 관계에 있다고 하였다(Rocha et al., 2003, Mouget et al., 2004). 실제 Sánchez-Saavedra et al. (1996a, b)는 빛 파장에 의해 미세조류
한편 현재까지도 다양한 산업분야에서 biomass와 함께 carotenoid는 유용한 색소로 인식되어 현장 적용 연구가 이루어지고 있다(Mogedas et al., 2009; Lamers et al., 2010). 본 연구결과, carotenoid 함량은 chlorophyll a 함량과 같은 경향 (LR >LG >LB >LY≧LW≧MH)을 보여 red 파장의 LED에서 가장 높았다. 이처럼 성장과 색소함량에 대한 LED 광원의 불일치는 빛에 의해 높은 스트레스를 받을 경우에는 세포수의 감소와 함께 성장률 저하로 이어지고(Lamers et al., 2010; Shariati and Hadi, 2011), 스트레스 환경 조건에서 세포분열을 행하는 동안에는 최대한 빛 흡수의 양을 많이 하려는 방어기작이 작용하여 세포 당 carotenoid 축적률은 오히려 향상된다는 것으로 설명할 수 있다(Shariati and Hadi, 2011). 이러한 blue 파장은 자외선에 가까운 단파장이므로 성장보다는 스트레스에 대한 대사작용이 촉진되어 세포성장은 저해된다(Ben et al., 1989). 또한 Mogedas et al. (2009)의 광합성활성광(400-700 nm)에 UV-A (320-400 nm)를 보충해 주는 실험에서 carotenoid 축적량은 UV-A를 비춰주지 않은 대조구에 비해 약 2배 정도 높아졌다. 이는 UV 광원에 따른 산화 스트레스에 의한 미세조류의 반응기작 때문이라고 하였다(Mogedas et al., 2009). 본 연구에서도 성장이 다소 낮았던 LR, LG 및 LY와 같은 광원은
미세조류에서 생산되는 지방산의 양적 및 질적 가치는 배양 환경조건들에 의해 결정된다(Pratoomyot et al., 2005). 여러 환경조건들 중에서도 Yoshioka et al. (2012) 및 Das et al. (2011)는 빛 광원에 따른 지방산 조성 및 함량 변화에 중요성을 강조하였다. 특히, EPA 및 DHA와 같은 고도불포화지방산은 체내에서 합성이 될 수 없는 필수지방산으로 이와 같은 지방산 함량을 높이기 위한 연구가 진행되고 있다(Guihéneuf et al., 2009; Das et al., 2011; Yoshioka et al., 2012). Yoshioka et al. (2012)는
한편 단백질원으로서 사용하고자 하는 물질의 영양성 평가는 그것의 구성 아미노산 조성 및 함량과 관련이 있으며, 미세조류를 단백질원으로서 활용하는데 필수 아미노산의 함량은 높을수록 효율적이다(Webb and Chu, 1983). 이러한 측면에서 본 연구의 결과는 각기 다른 광원에 따라 구성아미노산 및 필수아미노산 함량의 변화가 나타났기 때문에 목적 물질의 극대화를 위해서는 최적의 광질로 배양을 행해야 한다는 사실을 확인할 수 있었다. 모든 필수아미노산의 총량은 green 파장의 LG에서 유의적으로 가장 높았다. 이러한 이유로는 단백질 합성을 위한 구성아미노산의 증가는 green이나 blue 파장대와 같은 단파장에서 보다 자극을 받게 되며, 이에 더욱 활발하게 합성하기 때문이다(Wallen and Geen, 1971).
이상의 모든 결과를 종합해 볼 때, 빛 파장 및 광원에 따라 성장, 색소(chlorophyll a, carotenoid), 아미노산 및 지방산 함량이 각기 다르게 나타난다는 것을 확인할 수 있었다. 하지만 단순 세포 성장만을 고려한다면 blue LED에서