Inordinate stress causes disorders of various systems in humans and activates defense mechanisms to maintain homeostasis in the body. Sleep is a vital, highly organized process regulated by complex systems of neuronal networks and neurotransmitters. Sleep is an essential biological process whose underlying regulating involves numerous anatomical structures and biochemical substances that can be compromised by stress and by the immune system. Gamma-amino butyric acid (GABA) is the main inhibitory neurotransmitter of the central nervous system, and activation of GABAA receptors is known to favor sleep. This study was conducted to evaluate the possible application of
현대 사회의 발전은 인류에게 풍요로움이라는 혜택을 안겨 주었지만 일상생활에서 경험하는 다양한 사건이 스트레스 요인으로 작용하며, 이러한 상황에 적응하기 위해 더 많은 스트레스를 받게 된다. 과도한 스트레스는 인간에게 장∙단기적 장애를 유발하며 이러한 장애 중 하나가 수면장애의 형태로 나타날 수 있다. 인간 수명에 있어서 1/3은 수면을 취하는 시간으로 건강 유지 및 정신적 안정에 있어 수면의 중요성은 매우 높다. 이와 더불어 정상적 수면자가 비정상적 수면자에 비해 사소한 생활사건의 빈도가 낮고(Weller et al., 1993), 스트레스가 적은 기간에는 수면량이 증가하고 스트레스가 많은 기간에는 수면량이 감소하는 경향을 보인다는 연구결과도 있다(Hick and Garcia, 1987). 미국의 정신질환분류편람인 Diagnostic and Statistical Manual of Mental Disorders, 4th edition (DSM-IV) 에서는 “대부분의 불면증은 심리, 사회 및 의학적 스트레스를 받을 때 급성으로 생긴다”라고 설명하고 있으며, 실제 불면증 환자들 중 78%가 스트레스가 불면증을 유발하였다고 보고하고 있다(Bastien et al., 2004). 이처럼 정상적인 수면을 유지하는 것은 인간을 포함한 고등 동물들에서 성장과 발달, 정서적인 건강, 그리고 면연력 유지 등의 기본적인 기능을 유지하는데 필수적이다.
수면 장애, 즉 불면증의 치료를 위해서는 의학계에서는 단기적 불면증 환자의 경우 벤조디아핀제, 비벤조디아핀제와 같은 약물치료를 사용하고 있다(Szabadi, 2006). 이들 약물의 약리학적 기능은 벤조디아핀제의 경우 이온채널을 통해 억제성 염소이온의 흐름을 증가시키는 gamma-amino butyric acid (GABA)의 기능을 증진시킨다(McKernan and Whiting, 1996; Gallopin et al., 2004). 벤조디이아제핀은 총 수면시간과 수면의 연속성을 증진시키지만, 낮 동안의 졸림이나 전향적 기억상실증을 유발하고 심각한 신체적 의존과 남용의 가능성이 있는 것으로 보고되고 있다(Bressler and Bahl, 2003; Zhdanova, 2004; Krueger, 1999). 비벤조디아제핀계 수면제 중 가장 잘 알려져 있는 졸피뎀은 수면잠복기를 줄이며 총 수면시간을 늘려 수면 중 깨는 것을 감소시키는 것으로 알려져 있다. 하지만 이들을 복용한 직후 후향적 기억상실이 관찰되기도 하며, 이는 α1 GABAA 수용체에 결합하면서 생기는 약리학적 결과로 생각된다(Roehrs et al., 1994; Sherin et al., 1998).
이처럼 스트레스로 인한 신체적 이상 중 하나로 나타나는 수면장애에 대한 치료를 위한 접근으로 약물치료를 시행하고 있으나, 이는 다양한 부작용과 신체적 적응에 따른 약물 오남용을 야기 시킬 수 있다. 이러한 이유로 미국 등의 선진국에서는 수면 촉진물질로는 알려져 있는 아데노신(Adenosine), 아세틸콜린(acetyl choline), 세로토닌(serotonin, 5-hydroxytryptamine), 멜라토닌(melatonin, N-acetyl-5-methoxy-tryptamine), GABA 등을 중심으로 천연의 수면유도 보조제를 개발하고자 하는 연구를 꾸준히 수행 중이다. 수면유도와 관련된 호르몬이며 송과선(pineal gland)에서 분비되는 멜라토닌과 세로토닌은 신경전달물질로서 작용하는 물질이다. 멜라토닌의 경우 망막으로부터의 전달되는 빛에 의해 멜라토닌합성효소(NAT)의 활성이 저해되므로 암기에 높고 명기에 낮은 변동을 보인다(Lee et al., 2001). 세로토닌 또한 신경전달물질로서 멜라토닌과 같이 트립토판을 원료의 측면에서 연구가 많이 진행되고 있는 물질이다(Leventhal et al., 2003; Oh and Oh, 2003; Oh and Oh, 2004). 멜라토닌, 세로토닌과 유사한 신경전달물질로서 GABA는 발견 초기에는 식물과 미생물대사 산물로 알려졌었지만 그 후, GABA가 포유류의 중추신경계에 필수구성요소로 알려지면서 활발한 연구가 진행되기 시작한 물질 중 하나이다(Kang and Oh, 2007). GABA의 기능으로는 뇌 조직에 주로 존재하는 GABA-receptor가 리간드로 작용하는 GABA와 결합하여 억제성 신경전달물질로서 작용하며, GABA 양이 증가되면 정서적 안정과 항정신불안증, 항경련 효과와 혈압상승 억제 효과가 있음이 알려져 있다 (Mody et al., 1994; Abe et al., 1995). 반대로 부족할 경우에는 뇌조직의 기능적 장애로 돌발적인 의식상실, 경련 등의 감각장애를 일으키는 간질을 유발시킨다고 알려져 있다(Kang and Oh, 2007).
굴은 GABA의 전구물질인 글루탐산(glutamic acid)을 다량(4.8%/dry base; w/w)함유하고, 국내외적으로 항산화활성, 간기능 개선 및 심혈관계 효능물질로써 보고되어온 천연 아미노산인 타우린(taurine)을 다량(4.2% / dry base; w/w 기준) 함유하고 있다. 그리고, 다시마는 GABA의 전구물질인 글루탐산(glutamic acid)을 고농도(5% / dry base 기준)함유하고, 국내 외적으로 심혈관계 효능물질로써 보고되어온 기능성 해조 다당류인 후코이단(fucoidan, 함황당)을 함유한 안정성이 확보된 원료 물질이다.
본 연구에서는 현대인들의 대다수가 한번씩 경험했을 스트레스로 인한 수면장애에 대한 치료 보조제적 수단으로 해양생물인 굴과 다시마의 발효로 통해 생산된 GABA가 수면유도 호르몬에도 영향을 줄 것이라는 것에 주목하여 스트레스로 인한 긴장완화와 수면유도 증진에 대한 기능성에 대해 연구함으로써 굴∙다시마 발효 추출물에 함유된 GABA를 스트레스로 인한 긴장 완화 및 수면유도 기능성 식품소재로서 활용하기 위한 탐색과 기초자료를 확보하고자 한다.
다시마는 2012년 10월에 부산광역시 소재 서진기장영어조합법인에서 구입하여 사용하였고, 굴은 2012년 11월에 경상남도 통영산 굴을 구입하여 사용하였다.
마우스 대식세포(RAW 264.7)는 ATCC (No. TIb-71, USA)에서 분양 받았고, Penicilline/Streptomycine, fetal bovine serum 및 DMEM은 Invitrogen (GIBCOBRL, USA)에서 구입하였으며 각 실험에 필요한 3-(4,5-dimethylthiozol-2-ly)-2,5-diphebyltetrazolium bromide, Lipopolysaccharide (LPS), sulfanilamide, N-(1-naphthyl)-ethylene-diamine dihydrochloride, H3PO4는 Sigma-Aldrich Co. (St. Louis, USA)에서 구입하여 사용 하였다. 기타 다른 모든 시약은 analytical grade를 사용하였다.
다시마 추출물은 수세, 탈염, 분쇄공정을 거쳐 적당한 크기로 분쇄한 다음 여기에 16배의 물(w/v)을 첨가하고, 80℃에서 30분간 열수 추출한 다음 20 mesh 망으로 걸러 제조하였다.
굴 추출물은 상업용 가수분해효소(Alcalase)로 40ºC, 1시간 동안 효소 분해한 이후 60ºC, 1시간 동안 효소를 실활 시킨 이후 원심 분리하여 제조하였다.
굴∙다시마 발효분말(fermented sea tangle and oyster powder, FSO)은 다시마 추출액 45% (w/v), 굴 추출액 45% (w/v), yeast extracts 4 % (w/v), glucose 4% (w/v)를 각각 혼합하고, 멸균 (121℃에서 30분) 및 균주(2%
FSO의 DPPH (1,1-diphenyl-2-picrylhydrazyl) 라디칼에 대한 소거 활성은 Nanjo et al. (1996)의 방법에 따라 측정하였다. 시료 30 μL에 60 μM DPPH (1,1-diphenyl-2-picrylhydrazyl) 용액 30 μL를 혼합 후 반응액을 100 μL quartz capillary tube에 옮겨 2분 후 electron spin resonance (ESR) spectrometer (JES-FA, JEOL Ltd, Tokyo, Japan)로 측정하였다. 실험조건은 magnetic field, 336.5±5 mT; power, 5 mW; modulation frequency, 9.41 GHz; amplitude, 1×1,000; sweep time, 30 s; temperature, 298 K. 이었다. DPPH radical 소거능은 H와 H0의 상대적인 radical signal peak 높이의 차이에 의하여 계산하였다.
Radical scavenging activity (%) = (1 - H/H0) × 100
Superoxide dismutase (SOD) activity
FSO의 superoxide radical은 Zhao et al. (2006)에 따라 시료 10 μL에 0.3 mM riboflavin 10 μL, 1.6 mM EDTA 10 μL, 800 mM DMPO 10 μL를 첨가 한 후 365 nm의 UV lamp에서 1분 동안 조사하였다. 반응물을 quartz capillary tube에 옮긴 후 ESR spectrometer를 이용하여 분석하였으며 실험조건은 다음과 같다. 즉, magnetic field, 336.5±5 mT; power, 10 mW; modulation frequency, 9.41 GHz; amplitude, 1×1,000; sweep time, 30 s; temperature, 298 K. superoxide radical 소거능은 H와 H0의 상대적인 radical signal peak를 이용하는 수식에 의해 계산하였다.
Radical scavenging activity (%) = (1 - H/H0) × 100
마우스 대식세포를 pencillin (100 units/mL)/ streptomycin (100 μg/mL) solution과 10% fetal bovine serum이 포함된 DMEM 배지를 사용하여 5% CO2, 37℃ incubator (Forma series II, Thermo, USA)에서 배양하여 사용하였다.
24 well plate에 마우스 대식세포주 5×105개를 분주하고, 4시간 뒤에 새로운 배지로 교체한 후 일정농도(2.5, 5.0, 10.0, mg/mL)의 시료를 24시간 동안 처리하였다. 3-(4,5-dimethylthiozol-2-ly)-2,5-diphebyltetrazolium bromide (0.1 mg/mL)를 각 well에 처리하여 4시간 동안 배양한 후 형성된 insoluble formazan을 DMSO에 녹이고 ELISA reader (Wallac 1420, BMS, USA)를 통해 540 nm에서 흡광도를 측정 하였다.
Viability (%) = (반응군의 흡광도/대조군의 흡광도) × 100
Cell base NO assay
24 well plate에 마우스 대식세포주 5×105개를 분주하고, 4시간 뒤에 새로운 배지로 교체한 후 일정농도 (2.5, 5.0, 10.0, mg/mL)의 시료를 1시간 동안 전치리한 다음 LPS를 1 μg/mL로 16시간 동안 처리하였다. 이어서 세포배양 상층액 100 μL를 96 well에 분취하고, Griess 용액(1% sulfanilamide/0.1% N-(1-naphthyl)-ethylenediamine dihydrochloride/2.5% H3PO4) 100 μL를 첨가한 다음 5분간 반응 후 ELISA reader (Wallac 1420, BMS, USA)를 통해 540 nm에서 흡광도를 측정하였다.
Inhibition (%) = 1-[(반응군의 흡광도-색보정군의 흡광도)/대조군의 흡광도]×100
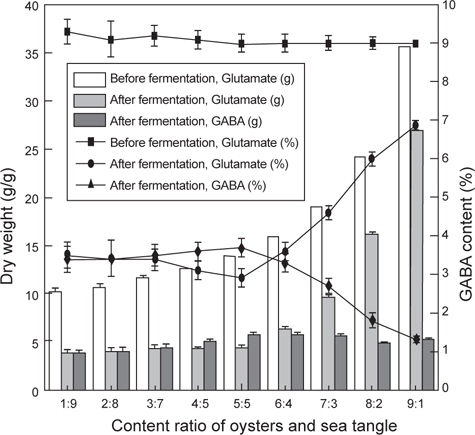
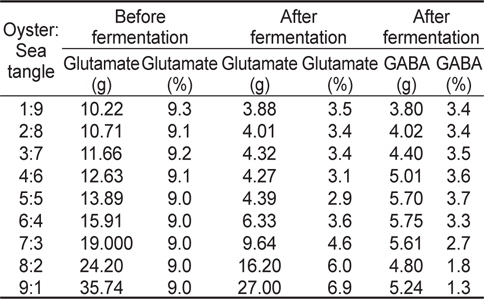
스트레스에 인한 긴장 완화와 수면 증진에 효과가 있는 FSO의 제조를 위해서 굴과 다시마 추출물을 각각 다른 농도를 넣어 유산균 발효 시 최대 GABA 생산량을 비교 분석하였고, 그 결과는 Fig. 1과 Table 1에 나타내었다. 굴과 다시마 추출액의 농도는 각각 1:9 비율에서 9:1 비율까지 배지 조성 성분에 함유 시켰으며 그 결과 굴과 다시마의 함량이 5:5인 비율에서 잔존 글루탐산 함량 2.9%이며 GABA 생산량은 3.7%로 확인되어 굴과 다시마 추출액의 최적 함량비는 1:1로 판단되었다.
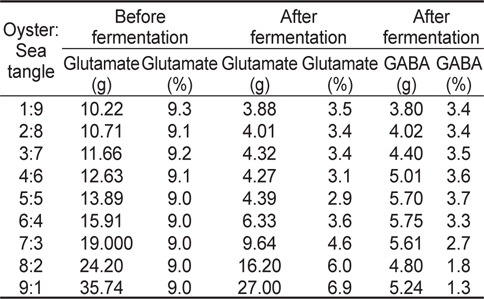
Change in GABA and glutamate concentration in fermented sea tangle Saccharina japonica and oyster Crassostrea gigas with Lactobacillus brevis BJ20
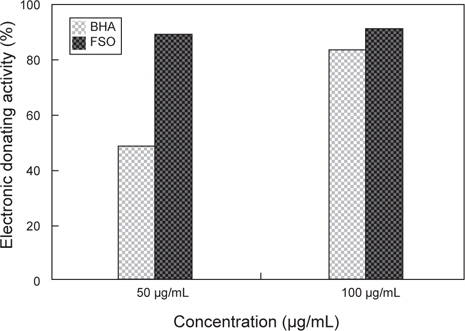
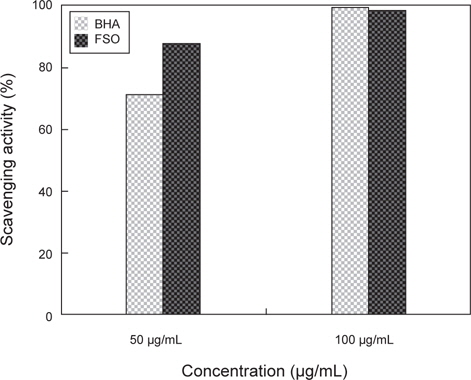
상업적으로 시판되고 있는 항산화제인 BHA (butylated hydroxyanisole)과 FSO을 대상으로 ESR spectrometer를 이용하여 DPPH radical scavenging activity를 실험한 결과는 Fig. 2와 같다. Positive control인 BHA (butylated hydroxyanisole)의 경우 50 μg/mL와 100 μg/mL의 농도에서 각각 48.7%, 86.5%의 활성을 나타내었고, FSO의 경우에는 각각 89.7%, 91%로 확인되었다. 상용화된 항산화제인 BHA와 FSO의 DPPH radical 소거능 비교 시 적은 농도에서 FSO의 DPPH radical 소거능이 월등이 뛰어난 것으로 분석되며 FSO만의 농도에 따른 DPPH radical 소거능의 비교 시 50 μg/mL와 100 μg/mL의 농도 차이에 따른 소거능은 큰 변화가 없었다. 따라서, FSO는 50 μg/mL 농도에서 DPPH radical 소거능이 가장 우수한 것으로 판단되며, 상용화된 BHA 보다 소거능이 아주 우수하다고 판단된다. 이러한 결과는, 미생물에 의한 발효로 항산화 활성을 가지는 것으로 알려진 페놀 화합물이 증가하기 때문(Song et al., 2011)인 것으로 판단된다. 이는 다시마 추출액을 대상으로 한 Eom et al. (2010)의 연구와 Bae and Kim (2010)의 연구에서 유산균, 곰팡이, 효모 발효에 의해 DPPH radical 소거활성이 증가한다는 연구 결과와도 같은 경향을 나타내고 있다.
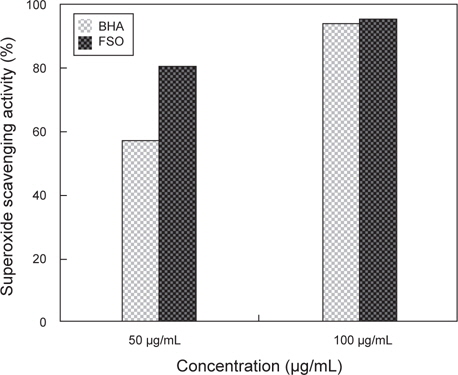
세포들은 대사과정, 외부환경에 의한 스트레스 등에 의해 세포 내에서 활성산소는 끊임없이 생성된다. 이러한 활성산소는 핵산과 단백질 등의 생체 고분자 물질과 반응하여 세포 이상을 유발시키는 물질 중에 하나이다. 또한 활성산소와 지질이 반응하면 과산화 지질이 생성되어 세포벽 이상을 야기 시키며 사람 등의 고등 동물에게는 혈관벽이나 세포막의 구조가 파괴되어 조직이 손상된다고 알려져 있다 (Masaki et al., 1995). 이러한 활성산소에 대한 보호 효과를 측정하기 위해서 FSO의 활성산소 제거 능을 측정하였고, 그 결과는 Fig. 3에 나타내었다. 활성산소 제거능은 positive control인 BHA의 경우 50 μg/mL와 100 μg/mL의 농도에서 각각 56.4%, 83.5%이었고, FSO의 경우 각각 80.2%, 93.4%로 확인되었다. BHA와 FSO의 활성산소 제거능의 비교 시 FSO가 superoxide radical 소거능이 뛰어난 것으로 분석되며 FSO만의 농도에 따른 SDO 활성은 농도 차이에 따른 변화가 없었다. 따라서 SOD radical scavenging 효과는 DPPH radical 소거능과 같이 FSO 50 μg/mL에서 가장 높은 활성을 가지는 것으로 판단된다.
Xanthine oxidase는 퓨린 염기의 대사과정에 있어서 매우 중요한 효소로서 hypoxanthine을 xanthine으로 산화 시키고 나아가 xanthine을 uric acid로 최종 산화시킨다. 이러한 일련의 반응 과정 중에 인체에 유해한 과산화수소를 생성하며 과산화수소는 또 다시 superoxide radical과 같은 활성산소 종으로 변화하기 때문에 xanthine oxidase의 저해활성은 항산화 활성을 측정하는 또 다른 지표이기도 하다. GABA 생성 FSO의 항산화능을 xanthine oxidase inhibitory assay로 검토한 결과는 Fig. 4와 같다. Xanthine oxidase inhibitory assay로 살펴 본 결과 항산화능은 GABA 생성 FSO가 88.1%, 다시마 추출액은 89% (Lee et al., 2010)이며, 상업적 항산화제로 많이 이용되고 있는 대조군인 BHA의 71.3%에 비하여 약 17%가 높아, xanthine oxidase inhibitory가 아주 우수하다고 판단된다.
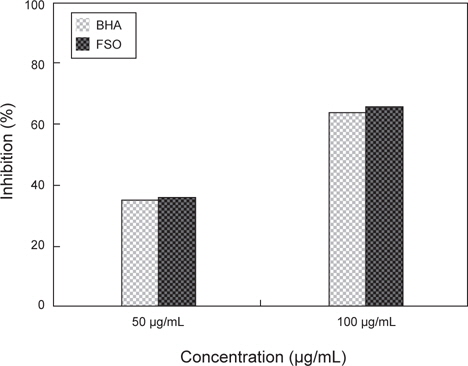
Nitric oxide는 체내에서 중요한 signal molecules로 알려져 있으며 일반적으로 외부의 염증 반응에 의한 면역반응 중에 inducible nitric oxide synthase (iNOS)의 발현에 의하여 생성된다. 또한 과량의 nitric oxide가 발생할 시 혈관을 손상시키는 것으로 알려져 있으며 superoxide radical과 반응하여 더욱 독성이 강한 peroxynitrite로 생성되어 체내 조직을 손상시키는 것으로 알려져 있다. FSO의 항산화능을 nitric oxide scavenging assay로 검토한 결과는 Fig. 5와 같다. GABA 생성 FSO의 항산화능을 nitric oxide scavenging assay로 살펴 본 결과 항산화능은 GABA 생성 유산균 첨가 다시마∙굴 발효물이 36.1%로 상업적 항산화제로 많이 이용되고 있는 대조군인 BHA의 63.9%에 비하여 낮아, nitric oxide 소거능은 기존 항산화제에 비하여 낮다고 판단된다.
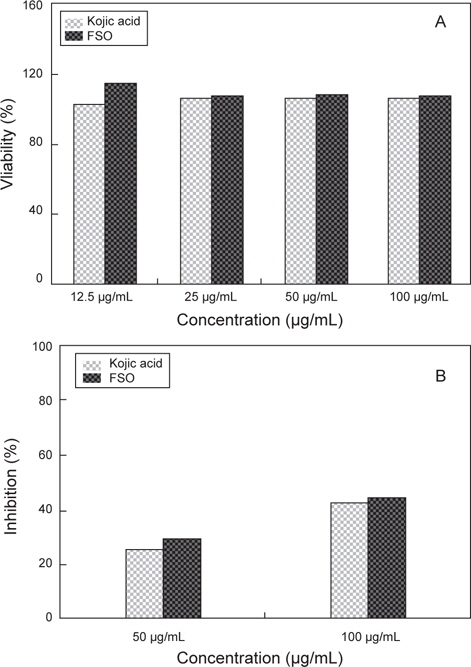
FSO의 세포독성에 대해 조사하기 위하여 MTT assay 시행하였고, 이에 대한 결과는 Fig. 6A에 나타내었다. Positive control인 kojic acid의 경우 12.5 μg/mL, 25 μg/mL, 50 μg/mL과 100 μg/mL에서 세포 생존률은 각 농도에 따른 약 102.3%로 나타났으며, FSO의 경우도 세포 생존율에서 있어 kojic acid와 큰 차이점을 보이지 않았다. FSO 농도에 따른 세포 생존율은 12.5 μg/mL일 때 115.4%, 25 μg/mL의 경우 105.1%, 50 μg/mL의 경우 105% 및 100 μg/mL의 경우 104.2%로 농도에 관계없이 거의 일정한 세포 생존율을 보였다. FSO의 마우스 대식세포에 대하여 세포독성이 없는 것으로 나타났으며 오히려 세포의 증식을 촉진하였다.
FSO의 항염증 실험에 대한 결과를 알아 보기 위해서 다양한 해조류 추출액의 항산화 활성 및 항염증에 대한 활성 보고를 참고하였으며(Ryu and Kim, 2006), 항염증 실험에 진행하기 위하여 MTT assay에서 세포 독성을 나타내지 않는 농도인 50 및 100 μg/mL에서 FSO 항염증 활성을 조사하였다. FSO의 세포보호 효과 (cell protective effect)를 항염증 활성의 지표로서 측정되는 세포 내 NO 생성 정도로 측정한 결과는 Fig. 6B와 같다. Positive control로써 Kojic acid의 항염증 활성능은 50 μg/mL과 100 μg/mL 일 때 각각 25.3%와 44.5% 였으며, 다시마 추출액의 항염증 활성능은 200 μg/mL 일 때 32.6% 였다 (Choi et al., 2008). FSO의 LPS에 의해 유도된 NO의 생성 정도의 억제율은 50 μg/mL의 경우 29.1 %이며, 100 μg/mL의 경우 48.1%로 positive control인 kojic acid보다 높은 수준을 보이긴 하지만 큰 차이는 없었으며 전체적으로 억제율은 낮았다.