The active antifouling compounds coumarin and its derivatives were isolated from the cinnamon tree
해수 및 담수 환경에서 생물의 부착현상은 인공구조물이나 배의 선체, 발전소와 공장의 냉각장치, 양식장의 그물 등에 부착하게 되어 시설물의 기능저하를 일으키며 기술적, 경제적 손실을 야기시킨다(Callow and Edyvean, 1990). 부착방지를 위해 기존에 주석을 함유한 방오제를 사용하여 왔으나 국제해사기구(International Maritime Organization) (IMO, 2001)의 사용규제로 Igarol, dichlofluanid, diuron등과 같은 물질이 대체 물질으로서 사용되고 있다(Voulvoulis et al.2000; Yamada 2007; Cresswell et al. 2006). 그러나 최근의 연구에 따르면 이들 물질 또한 비표적 생물에 대한 독성을 지니며 한국연안에서도 오염이 확인되고 있다. Irgarol과 diuron의 경우식물에 대한 강한 독성과(Fernández-Alba et al. 2002), 성게에 대한 배아독성(embryotoxicity)를 나타내며(Manzo et al., 2006), dichlofluanid의 경우 발암성을 나타내는 것으로 보고되고 있다(Fernández-Alba et al. 2002). 또한 Lee et al. (2010)의 연구에 의하면 한국연안에서의 Irgarol의 오염은 2006년도 조사에서는 23.80 ng/L였으며 2009년의 경우는 67.64 ng/L로 증가하였고 dichlofluanid는 61.69 ng/L에서 74.79 ng/L로 오염도가 증가하고 있는 것으로 보고되었다.
따라서 본 연구는 이들 물질을 대체 할 수 있는 새로운 방오제의 개발을 목적으로 실시하였고, 그 대상으로 주변에서 흔한 육상식물 추출물을 탐색하였다. 70여종의 식물 추출물을 파래포자를 대상으로 방오효능을 탐색 한 결과, 계피 추출물에서 가장 좋은 효능을 확인 하였다. 계피는 녹나무과(Lauraceae)의 식물로 250종이 보고되고 있으며 인도, 중국, 스리랑카, 베트남, 호주 등에 분포하는 것으로 알려져 있다(Prasad et al. 2009). 계피로부터 coumarins, cinnamaldehyde, cinnamon oil, diterpenoids, polyphenols, cinnamic acid 등의 물질이 분리되어 보고되었으며, 이들 물질과 그 유도체는 항균활성과 노화방지 효능 등의 다양한 생리활성을 가지는 것으로 보고되었다. 일례로 cinnamon oil은 노화방지 효능을 보이며(Gende et al. 2008; Faix et al. 2009), cinnamic aldehyde는 항균효과(Kim et al. 2004), cinnamon diterpene은 엘러지 억제효과를 보인다(Nohara et al. 1985). 또한 계피 추출물은 경련억제, 항궤양, 담즙분비촉진, 진통효과, 항균, 해열, 지방분해효과등의 효능이 보고되어 있다(Cralg 1999).
계피에서 많은 물질이 분리되어 다양한 효능이 보고되고 있지만 방오효능이 알려진 물질은 cinnamic acid 뿐으로 transcinnamic acid는 갈파래(
계피는 베트남산의
분리된 물질은 high resolution fast atom bombardment mass spectrometer (HR-FABMS, JMS HX 110; JEOL,Japan)를 이용하여 질량분석을 실시하였다. 핵자기공명분석(nuclear magnetic resonance: NMR)은 JNM-ECP 600 NMR spectrometer (JEOL)을 이용하였으며 용매는 methanol-
물질의 부착방지 효능은 대표적인 연성 부착생물인 구멍갈파래(
부착방지 물질의 분리를 위해 계피(건중량17.6 g)로부터 추출물 1.09 g을 얻었고 silica gel chromatography와 역상 HPLC를 이용하여 분리하였다. 먼저 silica gel chromatography로 분리한 결과 9개의 분획구를 얻었고 그 중 파래포자를 대상으로 한 실험에서 부착억제 효능을 나타내는 2개의 분획구를 확인하였다. 분획구6은 ethyl acetate : methanol (4: 1)을 전개용매로 하였고, 포자 부착억제에 대한 4.6 μg/mL의 EC50 값을 나타내었다. 이 분획구는 다른 분획구에 비해 가장 높은 활성이 보였으며 91 mg을 얻었다. 분획구7 (126 mg)은 ethyl acetate : methanol (1: 1)를 전개용매로 하였고 포자 부착억제에 대한 5.3 μg/mL의 EC50 값을 나타내었다. 분획구6은 HPLC를 통해 2차 분리를 실시하였고 30% acetonitrile을 이용한 isocratic조건에서 4개의 활성물질 peak를 확인하였다. 각 물질 peak는 29, 35, 45, 75분에서 나타났으며, 물질의 양은 각각 18.4, 6.3, 9.8, 14.7 mg 이었다.
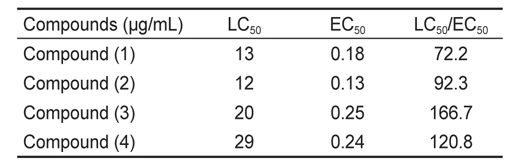
본 실험에서 계피에서 추출한 각 활성물질의 방오효능을 측정한 결과, 파래 포자의 부착방지 효능에서는 EC50 값은 0.13-0.25 μg/mL로 나타났으며 LC50 값은 12 - 29 μg/mL였다. 그 중 물질 (2)는 가장 낮은 EC50값을 보였고 효능 계수는 92.3이었다(Table 1).
[Table 1.] Inhibition of zoospores settlement of Ulva pertusa by coumarin and its derivatives
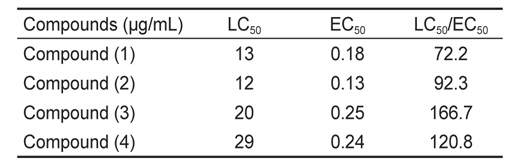
Inhibition of zoospores settlement of Ulva pertusa by coumarin and its derivatives
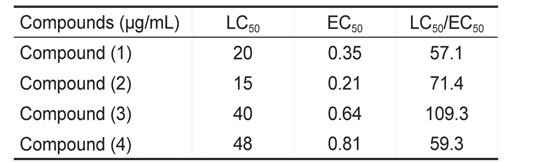
또한 미세조류 부착방지 효능에서는 EC50 값은 0.21-0.81 μg/mL로 나타났으며 LC50 값은 15-48 μg/mL였다. 그 중 물질 (2)가 가장 낮은 EC50값을 보였고 효능계수는 71.4로 가장 우수하였다(Table 2).
[Table 2.] Inhibition of diatom settlement of Navicula annexa by coumarin and its derivatives
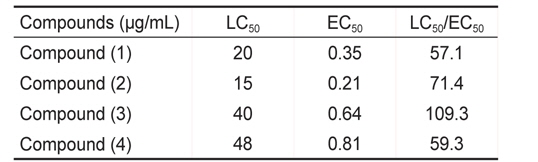
Inhibition of diatom settlement of Navicula annexa by coumarin and its derivatives
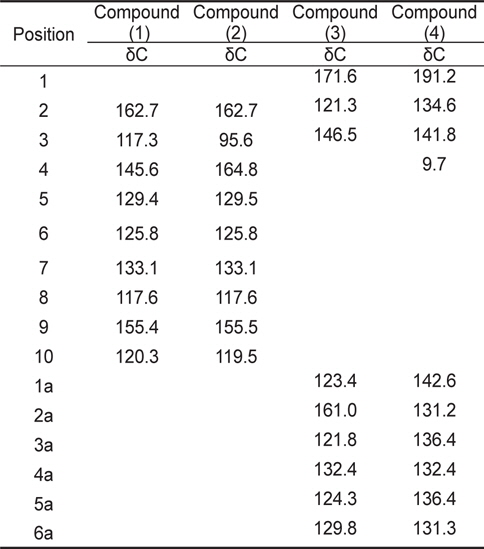
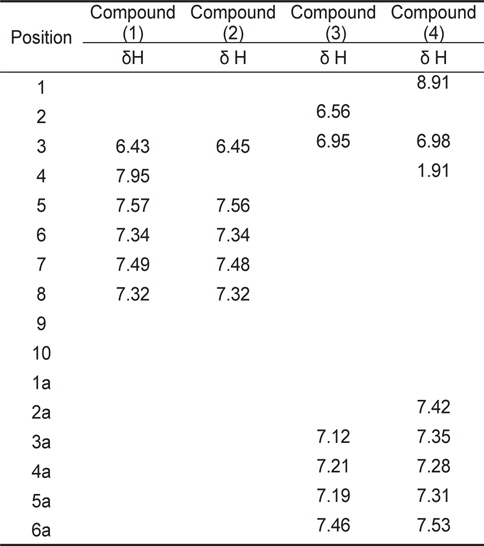
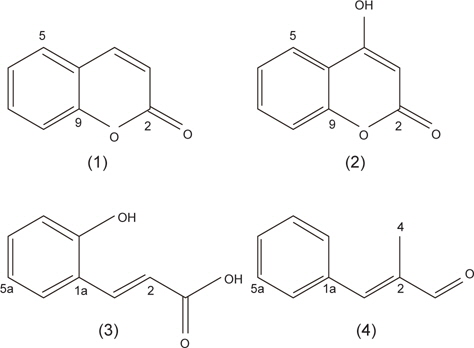
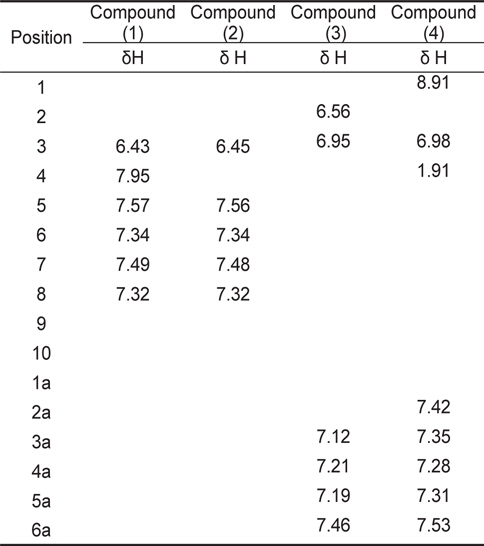
계피추출물의 분획구6에서 분리한 4개의 활성물질은 NMR과 HR-MS로 분석한 결과, 물질은 각각 coumarin (1), hydroxylcoumarin (2), coumaric acid (3), cinnamaldehyde (4)로 확인되었고 분석결과는 Table3과 Table 4에 나타내었다. 물질 (1)은 HR-FABMS 질량분석결과 146.1024 ([M+H]+)로 분자량은 145로 나타났으며,1H-NMR과 13C-NMR을 통해 분자식은 C9H6O2인것으로 확인되었다.1H-NMR에서는 6개의 signal을 확인하였고 그것은 각 δ 6.43 (H-3: 1H, d), 7.95 (H-4: 1H, d), 7.57 (H-5: 1H), 7.34 (H-6, 1H), 7.49 (H-7: 1H), 7.32 (H-8: 1H)이었다. 13C-NMR에서는 9개의 signal을 확인하였고 δ 162.7 (C-2), δ 117.3 (C-3), 145.6 (C-4), 129.4 (C-5), 125.8 (C-6), 133.1 (C-7), 117.6 (C-8), 155.4 (C-9), 120.3 (C-10)이었다. NMR 분석 결과와 Günther et al. (1975)이 보고한 문헌의 자료를 비교한 결과, 물질(1)은 coumarin으로 확인되었다(Fig.1-1).
[Table 3.] 13C -NMR spectral data for coumarin and its derivatives
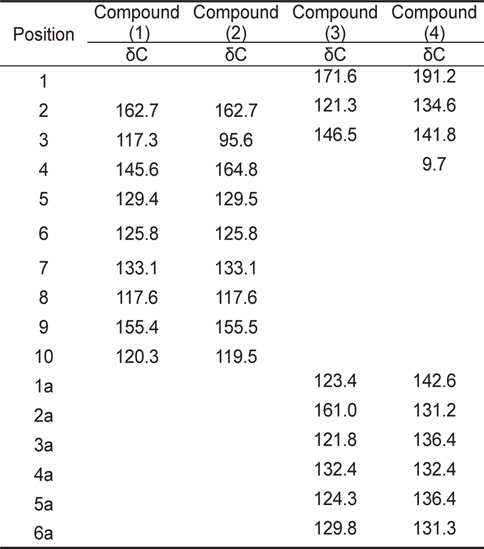
13C -NMR spectral data for coumarin and its derivatives
[Table 4.] 1H - NMR spectral data for coumarin and derivatives
1H - NMR spectral data for coumarin and derivatives
물질 (2)는 질량분석결과 162.0974 ([M+H]+)로 분자량은 165였으며 1H-NMR과 13C-NMR을 통한 분자식은 C9H6O3이었다. 1H-NMR에서는 δ 6.45 (H-3: 1H, d), 7.56 (H-5: 1H), 7.34 (H-6, 1H), 7.48 (H-7: 1H), 7.32(H-8: 1H)등의 5개의 signal을 나타내었고,13C-NMR에서는 δ 162.7 (C-2), 95.6 (C-3), 164.8 (C-4), 129.5 (C-5), 125.8 (C-6), 133.1 (C-7), 117.6 (C-8), 155.5 (C-9), 119.5 (C-10)의 9개의 signal을 나타내었다. NMR의 분석 결과와 Günther et al. (1975)이 보고한 문헌의 자료를 비교한 결과 물질(2)은 hydroxylcoumarin으로 확인되었다(Fig.1-2).
물질 (3)은 질량분석결과 164.1187 ([M+H]+)이며 분자량은 163이었으며, 1H-NMR과 13C-NMR을 통해 분자식은 C9H8O3로 나타났다. 1H-NMR에서는 6개의 signal을 확인하였고 그것은 각 δ 6.56 (H-2: 1H), 6.95 (H-3: 1H), 7.12 (H-3a, 1H), 7.21 (H-4a: 1H), 7.19 (H-5a: 1H), 7.46 (H-6a: 1H)이었다. 13C-NMR에서는 δ 171.6 (C-1), 121.3 (C-2), 146.5 (C-3), 123.4 (C-1a), 161.0 (C-2a), 121.8 (C-3a), 132.4 (C-4a), 124.3 (C-5a), 129.8 (C-6a)의 9개의 signal을 확인하였다. Hoff et al. (1994)이 보고한 문헌의 자료와 비교한 결과, 물질(3)은 coumaric acid로 확인되었다(Fig. 1-3).
물질(4)는 질량분석결과 146.1346([M+H]+)으로 분자량은 145이며 분자식은 C10H10O인것으로 확인되었다.1H-NMR에서는 δ 8.91 (H-1: OH), 6.98 (H-3: 1H), 1.91 (H-4, 3H), 7.42 (H-2a: 1H), 7.35 (H-3a: 1H), 7.28 (H-4a: 1H), 7.31 (H-5a: 1H), 7.53 (H-6a: 1H) 등의 8개의 signal을 확인하였고,13CNMR에서는 δ 191.2 (C-1), 134.6 (C-2), 141.8 (C-3), 9.7 (C-4), 142.6 (C-1a), 131.2 (C-2a), 136.4 (C-3a), 132.4 (C-4a), 136.4 (C-5a), 131.3 (C-6a)로 10개의 signal을 확인하였다. SubashBabu et al. (2007)이 보고한 문헌의 자료와 비교한 결과, 물질(4)은 cinnamaldehyde로 확인되었다(Fig. 1-4).
Coumarin은 benzopyrone 그룹의 물질로 벤젠고리와 pyrone고리로 구성되며 많은 식물에서 분리가 보고되고 있다. 이것은 essential oils, cinnamon barkoil, cassia leaf oil, lavender oil 등에서 많이 발견되고(Lacy and O’Kennedy 2004), 그 유도체들은
본 연구에서 계피로부터 분리된 물질의 방오효능은 방오 효능계수로 나타내었고, 상용되고 있는 Irgarol의 효능계수가 15이하인 반면 coumarin과 그 유도체들은 최소 72.3 이상으로 친환경의 방오제로의 가능성을 보여주는 값이다. 방오효능의 결과, coumarin과 hydroxylcoumarin은 coumaric acid와 cinnamaldehyde보다 더 효과가 뛰어나며, 이것은 close ring이 open ring보다 방오효능에서는 더 효과가 있는 것으로 보여진다.
수중환경에서 생물 부착의 초기과정은 부착성 미세조류와 해조류 포자와 같은 연성생물이 주를 이루고, 이들은 polymer를 분비하고 biofilm을 형성한다. 무척추동물의 유생은 이들의 polymer와 biofilm을 인식하여 2차적인 부착이 일어나게 된다(Wieczorek and Todd, 1998). 따라서 초기 연성 생물의 부착을 억제하는 것은 수중환경에서 생물의 부착을 막을 수 있는 가장 효과적인 방법이 될 것이다(Cho, 2012).
본 연구의 효능검증에는 대표적인 연성 부착생물인