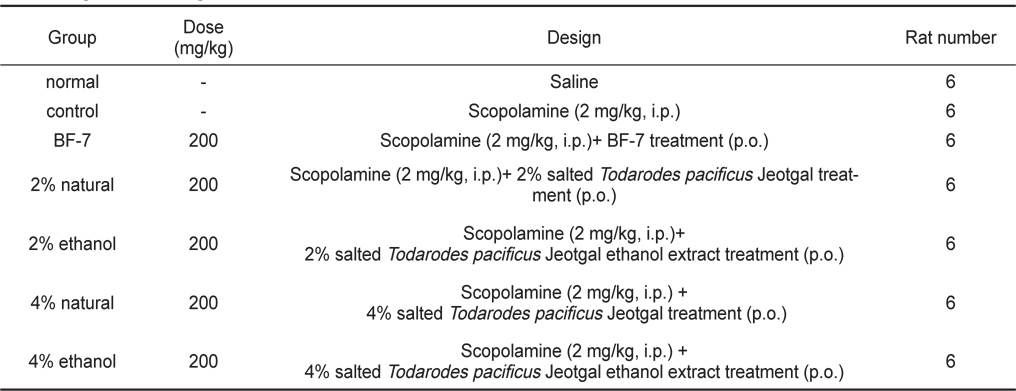
We investigated the effect low salt (2 or 4% salt) concentrations jeotgal made from
기억력이란 주어진 정보를 받아들여 뇌 속에 저장했다가 필요한 때에 끄집어내는 능력을 말한다. 정보가 감각기관을 통하여 저장되는 감각기억, 현재의 정보들을 처리하는 짧은 기간 동안의 단기기억, 나중에 재생되도록 비교적 영구히 저장되는 장기 기억으로 나눌 수 있다(Bartus, 2002).
Alzheimer’s disease 환자의 뇌는 여러 종류의 신경손상이 일어나는데, 특히 콜린성 신경의 손상이 가장 심각하며 이는 학습능력, 기억력, 인지력의 저하와 관련 있다(Bartus et al., 1982;Colve et al., 1983).
뇌조직의 콜린계의 활성 감소가 기억력 저하의 중요한 원인중의 하나로(Chang et al., 1992), 뇌조직의 신경세포에서 choline과 acetyl Co A는 acetyl-transferase에 의해 acetylcholine으로 되고 acetylcholine은 acetylcholinesterase (AChE)에 의해 acetate와 choline으로 분해되는 과정에서 계속적인 acetylcholinesterase의 작용으로 acetylcholine의 양이 감소 시 기억력 저하가 일어난다(Choi et al., 2004; Clarke et al., 2007).
항무스카린 성 효과가 있는 scopolamine은 muscarinic acetylcholine receptor, 특히 Ml receptor의 길항제로서 작용한다. scopolamine은 acetylcholinesterase의 활성을 증가시켜 신경접합부에 있는 acetylcholine을 분해하여 단기간 동안 기억력을 감소시킨다. 이런 특성 때문에 scopolamine은 동물시험에서 기억력 저하를 유발한 후 기억력 개선 연구에 많이 사용되고 있다 (Davies and Maloney, 1976; Dawson et al., 1991).
현재까지 AChE 억제제로 tacrine, donepezil, rivastigimine, galatamine 등이 알츠하이머병의 치료제로 개발되어 왔으나 (Davis et al., 1992; Rogers et al., 1998; Rosler et al., 1999) 약물의 복용에 따른 부작용도 간과할 수 없다.
한편 건강기능식품으로 알려진 BF-7은 치매의 원인물질인 베타아밀로이드의 독성을 효과적으로 억제하여 생체 대사과정에서 발생하는 활성기산소로 인한 두뇌의 산화 스트레스를 감소 시키며 기억과 관련이 있는 뇌 구조체의 손상을 회복시킴이 보고되었다(Kim et al., 2010).
젓갈은 일반적으로 어패류의 근육, 내장, 생식소 등을 원료로 하여 다량의 식염을 가해 어체 내 존재하는 단백질 분해효소에 의한 단백질, 펩타이드 등의 분해와 숙성 중 관여하는 미생물에 의한 풍미생성 등에 의해 제조되는 우리나라 전통 발효 식품이다(Park et al., 2002). 우리나라에서는 강원도 지역에서 주로 오징어 젓갈이 제조되어 전승되어 왔으나, 현대에는 공장에서 생산하여 판매하는 양이 증대되고 있다.
대부분은 젓갈은 장기보존을 목적으로 가공 중에 대량의 식염을 첨가하기 때문에 짠맛이 강하여 대사증후군을 유발하는 원인이 될 가능성 있다.
본 연구에서는 식염의 농도를 조절한 저염 오징어 젓갈의 기억력 감퇴 예방 및 개선제의 기능성 소재로서 개발 가능성을 조사하기 위해 scopolamine으로 기억력을 감퇴시킨 동물 모델을 사용하여 기억력 개선 효과에 대하여 살펴 보았다.
실험재료인 저염 오징어(
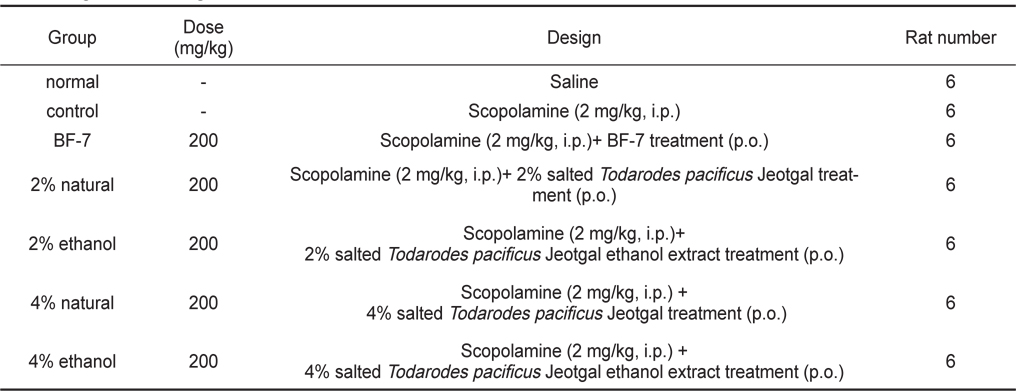
본 시험에 사용한 Sprague-Dawley (SD)계 체중 180±10 g 수컷 쥐는 효창사이언스㈜ (대구, 한국)로부터 분양 받아 경성대학교 약학대학교 동물사에서 일주일간 검역과 순화·사육을 거친 건강한 동물로 사육환경을 온도 22±3℃, 상대습도 50±10%, 조명시간 12시간(07:00-19:00)로 설정하여 실시하였다. Table 1과 같이 각 군당 6마리씩 7군으로 나누어 실험하였으며, 대조군으로는 control군(negative control)과 BF-7군 (positive control), 시료섭취군(2% natural ~ 4% ethanol)에는 scopolamine을 투여 하였다. 사료는 실험동물용 고형사료 (효창사이언스㈜)를 사용하였으며 음수는 자유 섭취시켰다. 해부전 24시간 동안에는 물만 주고 절식하였다. 이때 효소활성의 일중변동을 고려하여 실험동물을 일정시간(오전 10:00-12:00) 내에 처치하였다.
[Table 1.] Experimental design
Experimental design
시료물질은 체중 당 200 mg/kg이 되도록 3주간 경구투여 하였으며, 기억손상을 유발하기 위해 인지시험 30 분전에 scopolamine (Sigma-Aldrich Co., USA)을 몸무게 1 kg당 2 mg이 되도록 복강투여 하였다. 기억손상 유발을 위해 인지시험 30분전에 대조군과 시료물질 투여군에 scopolamine hydrobromide를 2 mg/kg용량으로 복강투여하였다.
수중미로실험은 Morris의 방법(Morris, 1984) 에 따라 디자인 하였다. 수중미로측정 장치는 공간학습 및 기억력을 측정하는 장비로서 지름이 140 cm, 높이가 45 cm인 원형수조 안에 물을 약 70% 채우고 우유를 넣어 안이 들여다 보이지 않도록 하였다. 지름이 15 cm, 높이가 35 cm인 원형 플랫폼을 수면 아래1.5cm가 되도록 물 높이를 조절하였으며, 물의 온도는 21~ 32℃ 가 되도록 하였다. 미로주위를 어둡게 하고 50 W 빛을 비춰주고 video camera로 monitor 하였다. - Training trial: 백서를 수조에 넣어서 플랫폼에 도달하는 시간을 90초 동안 하였다. 흰쥐가 90초 내에 플랫폼을 찾지 못하면 꺼내어 플랫폼에 올려놓고 15초 동안 방치한 후, 30초 뒤에 흰쥐를 수조에 넣고 플랫폼에 도달하는 시간을 기록하였다. 1일 2회씩(오전, 오후로 나누어 실시) 실시하며 백서가 15초 내에 플랫폼에 도달하게 되면 training trial이 완료된 것으로 간주하였다. - Test trial: training이 완료된 흰쥐에 정상군(normal군), control군(scopolamine 2 mg/kg 단독 투여군) 그리고 BF-7군(scopolamine과 BF-7, 100 mg/kg를 모두 투여한 군) 및 오징어젓갈을 소금 농도 및 추출용매를 달리한 시료 군으로 나누어 각 군에 대하여escape time을 측정하였다. 1일 2회씩 5일 동안 측정하였으며, 측정방법은 training trial 방법과 동일하며 최대 측정시간은 90 초로 하였다.
수동회피시험은 설치류의 working memory ability를 측정하는 방법(Van der Zee et al., 2004) 에 따라 측정하였다. 시험물질의 기억력 손상 예방 효과를 알아보기 위하여 scopolamine 2mg/kg 투여 30 분 후 수동회피시험을 실시하였다. 측정기기는 shuttle box (50×15×40 cm, electric grid floor, Ugo, Italy)를 이용하였으며, 상자는 칸막이 문(connecting guillotine door; 10×10 cm)으로 반이 나누어져 25×15 cm의 방을 이루고 있으며, 각방을 20 W 전구로 조명할 수 있도록 하였다. 본 실험은 소음이 60 dB 이하이고, 조명을 어둡게 한 방에서 실험을 하였다. 칸막이로 나누어진 방 2개중 한쪽(방 A)에 흰쥐를 넣고 1500 Lux의 조명을 켜면서 칸막이를 열어 주었으며, 백서가 방안을 여기저기 살피다가 조명이 없는 건너편 방(방 B)으로 들어가게 될 때 자동적으로 칸막이가 닫히게 장치하였다. 불을 켜면서 칸막이가 열릴 때부터 칸막이가 닫힐 때까지의 잠재시간을 측정하였다. 학습시험(training trial)을 5 회 반복하여 백서가 방 B로 넘어가면 불이 꺼진 상태에서 3 mA의 전류를 방밑의 stainless grid를 통해 3 초 동안 흘려 전기쇼크(foot-shock)을 가했으며, 어두운 방과 전기쇼크(foot-shock)과의 관계를 인식시켰다. 24 시간 후 문이 열려도 밝은 방에 머무는 시간, 즉 쇼크실 도달시간(step-through latency time: 머무름 시간)을 최대 300 초(cut-off time)까지 측정하였다.
실험 식이 투여 3 주 후 최종일에 실험동물을 12 시간 이상 절식시킨 후, CO2로 마취 시 켜 복부 대동맥으로부터 채혈하였다. 얻어진 혈액은 약 30 분간 실온에서 방치시킨 후 3,000 rpm에서 15분간 원심 분리하여 혈청을 얻어 혈청생화학분석에 사용하였다. 분리된 혈액 상층액은 혈청생화학기(Rochu Ltd., Basel, Switzerland)로 aspartate aminotransferase (AST), alanine aminotransferase (ALT)를 분석하였다. 수중미로시험 종료 후 실험동물의 뇌조직은 적출하고 10배의 homogenization buffer (12.5 mM sodium phosphate buffer pH 7.0, 400 mM NaCl)로 균질화하여 1,000×g에서 10분간 원심분리 한 후 상등액 일부를 효소원으로 사용하였다.
>
뇌조직의 아세틸콜린에스테라제(acetylcholinesterase)활성 측정
아세틸콜린에스테라제 활성은 acetylcholine iodide를 기질로 사용하는 Ellman et al. (1961)을 변형하여 분석하였다. 0.1M phosphate buffer (pH 8.0) 2.6 mL, 10 mM Ellman’s 용액 (10 mM 5,5’-dithio-bis-2-nitrobenzoic acid, 15 mM sodium bicarbonate) 100 μL, 효소원 0.2 mL를 cuvette에 넣고 410 nm에서 흡광도를 측정한 후, 75 mM acetylcholine iodide (Sigma-Aldrich Co.) 20 μL를 첨가하여 410 nm에서 2분간 흡광도 변화를 측정하여 계산하였다.
>
아세틸콜린에스테라제(acetylcholinesterase) 활성저해효과
효소활성저해효과는 시료 검액 대신 동량의 완충용액을 넣은 대조군의 흡광도(C.T)와 시료검액을 넣어준 실험군의 흡광도(S.T)를 이용하여 측정하였다. 3회 반복 실험한 후 효소활성저해율(inhibition)은 아래 식에 따라 산출하였다. * Inhibition (%) = 100 – [(S.T/C.T) × 100]
아세틸콜린 함량 측정은 Hestrin의 방법(Hestrin, 1949)에 의하여 alkaline hydroxylamine을 가진 σ-acyl 유도물의 반응을 기초로 측정하였다. 뇌 균질액 50 μL를 1% hydroxylamine 50μL를 첨가하여 혼합한 후 FeCl3 (10% in 0.1 N HCl) 500 μL를 첨가한 다음 흡광도(540 nm)를 측정하여 아세틸콜린 함량을 측정하였다.
뇌조직의 총 단백질 함량은 Lowry의 방법(Lowry et al., 1951)에 준하여 bovine serum albumin (Sigma-Aldrich Co.)을 표준품으로 하여 측정하였다.
>
뇌조직의 GABA (gamma-aminobutyric acid) 함량측정
뇌조직의 GABA 함량은 HPLC (Agilent 1100 series HPLC, Agilent, USA) 를 이용하여 Clarke의 방법(Clarke et al., 2007)을 변형하여 분석하였다. Scopolamine유도 치매 백서에서 뇌 조직을 분리하여 무게를 측정한 후, 0.1 M citric acid, 0.1 M sodium phosphate monobasic, 5.6 mM octane sulfonic acid와 10% (v/v) methanol에 용해시킨 10 μM EDTA를 함유한 homogenizing buffer (pH 2.8)를 시료무게의 6배 volume으로 희석한 후 균질화 시킨 용액을 4℃, 12,000 rpm에서 15분간 원심 분리하여 상등액을 얻었다.
100 μL 상등액을 900 μL의 0.1 M borate buffer (pH 9.5), 200μL 10 mM potassium cyanide용액, 200 μL의 6 mM 2,3 naphthalene dicarboxaldehyde를 첨가한 뒤 voltex (voltex-2 genie, scientific industries, USA)로 잘 섞은 후, 0.45 μM PVDF membrane으로 여과 한 뒤 빛을 차단시킨 상태에서 10 μL 을 HPLC에 injection하여 fluorescence detector로 excitation 420nm, emission 489 nm에서 측정하였다.
이동상으로는 0.1% 아세트산, 아세트니트릴과 메탄올을 사용하였으며 총 분리시간은 10분으로 하여 분리되도록 하였다. 이동상의 유속은 0.5 mL/min으로 하고, 컬럼 온도는 20℃ 로하였다.
통계적 검정은 SPSS통계 프로그램을 이용하여 수행하였으며,
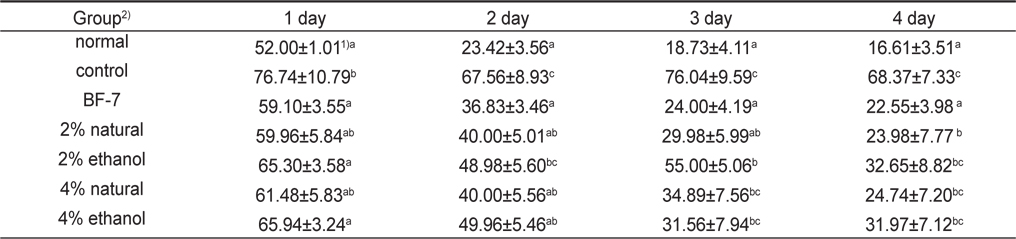
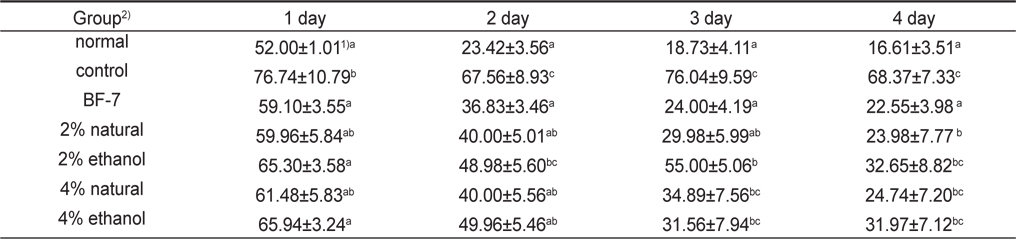
Scopolamine으로 기억손상을 유발한 백서의 소금함량에 따른 오징어젓갈 시료를 처리하였을 때 효과를 해마 의존적 공간학습 능력을 평가하는 Morris water maze test를 실행하여 Table 2와 Fig. 1에 나타내었다.
Effect of the low salts squid Todarodes pacificus Jeotgal on scopolamine-induced memory impairment mice in Morris water maze test during 4 days of training trial session
하루 2번씩 4일간 인지훈련을 실시한 결과, scopolamine처리한 control군은 수중미로 상의 platform의 위치를 찾아가는 escape latency 시간이 감소하지 않아 scopolamine으로 기억 손상을 유발시킨 많은 치매모델 실험과 유사한 결과를 보여주어 장기기억(long-term memory) 손상이 제대로 유도된 것을 확인할 수 있었다(Kim et al., 2007; Rispoli et al., 2004; Lu et al., 2007).
한편 positive control로 투여한 BF-7군의 경우 치매훈련 2일째부터 scopolamine 에 의한 기억손상이 유의적으로 회복된 것을 확인할 수 있었으며, 실험 마지막 날에는 오징어젓갈 시료 투여군 모두 BF-7군과 비슷한 escape latency 시간으로 회복되어 scopolamine투여군 보다 유의적인 개선효과를 보였다(Table 2,
Morris water maze test에서 escape latency 감소는 장기기억과 관련된 학습능력을 나타내는 것으로, control군을 제외한 시료 섭취한 모든 군에서4일간의 인지훈련기간 동안 수중미로상의 platform의 위치를 인지하고 반복되는 연속적인 훈련을 통해 공간 지각능력을 확실하게 기억하고 있음을 확인할 수 있었다.
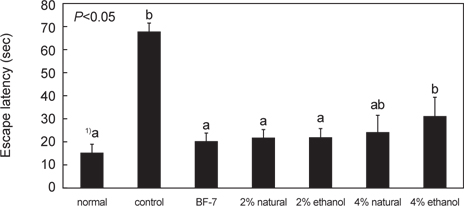
훈련 5일째 platform을 제거한 probe test 결과는 Fig. 1에 나타내었다. Control군은 68.83±7.23 초로 다른 실험 군 보다 유의적으로 escape latency 시간이 길었다. Normal군 15.61±3.40초, BF-7 투여한 군의 20.50±3.98 초로 escape 시간이 가장 많이 감소하였으며, 2% 소금함량 오징어젓갈 원재료 투여 군과 ethanol추출물을 투여한 군에서 시간이 유의하게 감소한 경향을 확인할 수 있었다. 이를 보아 2% 소금함량의 오징어 젓갈 투여가 scopolamine으로 유도한 치매 흰쥐의 장기기억 개선에 효과가 뛰어난 것으로 나타났다.
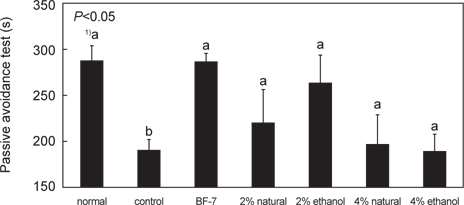
Scopolamine (2 mg/kg, i.p.)을 투여한 기억력 감퇴 동물모델을 이용하여 오징어 젓갈시료가 기억력 손상을 억제하여 주는 효과가 있는지 여부를 수동회피 측정 장치(shuttle box, Ugo, Italy) 를 이용하여 확인하였다(Fig. 2). 수동회피시험은 설치류의 working memory ability를 측정하는 방법(Van der Zee et al., 2004)으로 해마에서 조건화된 기억과 변연계와 연관 있는 기억에 관한 영향을 측정하기 위해 주로 사용된다. 수중미로시험이 공간기억력 및 장기기억력 정도를 측정하는 시험에 반해 수동회피시험은 단기 기억력의 정도를 측정시험으로 알려져 있다(Lozenzini et al., 1996).
Scopolamine (2 mg/kg, i.p.)의 투여에 의한 기억력 손상 여부를 확인한 결과 scopolamine 으로 기억이 손상된 control군은 기억시험에서 latency time이 190.00±16.26초로 normal군의 288.67±19.73초에 대하여 통계적으로 유의성 있게 감소하였다(
한편 BF-7 투여군에서는 285.90±9.73 초로 normal군과 latency time이 비슷하였으며, 젓갈 시료 투여군에서는 2% 소금 함량 오징어 젓갈 원재료 투여군과 ethanol 추출물 투여한 군에서 각각 219.00±37.70, 263.67±28.88초로, 4% 소금함량 오징어 젓갈 투여군의 195.00±33.65, 188.33±17.95초보다 latency time이 조금 더 긴 것을 확인할 수 있었다. 이는 오징어젓갈 섭취로 인하여 전체적으로 기억 손상이 개선되는 것을 살펴 볼 수 있었으며, 특히 2% 소금함량 오징어 젓갈을 투여한 군이 4% 소금함량 오징어 젓갈 투여군에 비하여 콜린성 신경계에 학습과 기억력을 회복시킨 것으로 사료된다. Malcangio et al. (1989)은 scopolamine을 이용한 기억력 감퇴 동물모델에서도 taurine 을 섭취시킨 후, 수동회피 실험을 진행하였을 때 latency time이 정상군 수준으로 회복됨을 확인할 수 있었다. 이와 같이 단기 기억력 정도를 측정하는 수동회피 시험에서 오징어젓갈 투여로 콜린성 신경계 작용을 통한 학습 및 기억력 회복에 크게 도움을 주는 것으로 확인되었다.
>
뇌조직의 아세틸콜린에스테라제(acetylcholinesterase, AChE) 활성 측정
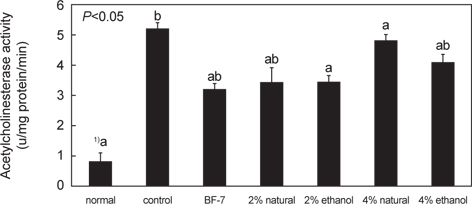
오징어 젓갈이 scopolamine으로 유도된 치매 유발 백서의 아세틸콜린에스테라제 활성억제에 미치는 효과는 Fig. 3과 같다. Scopolamine에 의해 기억이 손상된 control군의 경우 5.27±0.01 U/mg protein/min로 정상군인 0.81±0.05 U/mg protein/min에 비해서 AChE 효소 활성이 약 6.7배 증가하는 것을 확인할 수 있었다. 이것은 치매환자 치료에 있어 AChE 효소 활성을 저해시켜 아세틸콜린 농도를 증가시키는 보고(Yan and Wang, 2012)와 일치하는 결과로, AChE 효소의 활성이 감소한다는 사실은 그 만큼 신경 전달이 원활하게 이루어짐을 의미한다.
한편 BF-7의 경우 3.23±0.06 U/mg protein/min로 활성이 측정되었으며, 2% 소금함량의 오징어젓갈 투여군의 경우 각각 3.45±0.48, 3.45±0.08 U/mg protein/min로 4% 소금함량의 오징어젓갈 투여군4.88±0.06, 4.12±0.012 U/mg protein/min에 비하여 활성억제 정도가 BF-7 투여군 수준으로 낮아짐을 확인할 수 있었다. 이 결과를 통하여 볼 때, 오징어 젓갈은 BF-7과 같이 acetylcholinesterase inhibitior와 같이 신경접합부에 있는 acetylcholine을 분해하는 acetylcholiesterase 활성을 억제하여 acetylcholine의 활성을 촉진하므로 기억과 학습개선에 효과가 있는 것으로 사료된다(Dawson and Iversen, 1993; Giacobini, 2004).
>
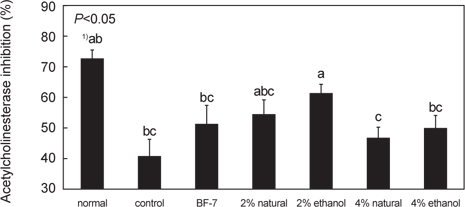
아세틸콜린에스테라제(acetylcholinesterase, AChE) 활성저해효과
아세틸콜린에스테라제의 효소반응은 신경계에서 신호전달의 신속성이 요구된다. 이러한 빠른 효소반응은 생물학적 기질을 이용하여
>
아세틸콜린(acetylcholine, ACh) 함량 측정
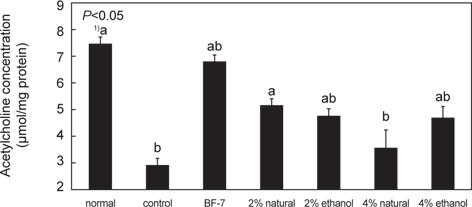
아세틸콜린은 모든 신경세포에서 발견되는 신경전달물질로서 중추신경계의 콜린성 시스템과 관계가 깊다. 아세틸콜린은 acetyl Co A와 choline acetyltransferase (ChAT)의 효소 작용으로 합성되며, 아세틸콜린에스테라제의 작용으로 acetate와 choline으로 분해된다. 콜린성 신경계의 붕괴는 초기 알츠하이머 질환의 주요 원인으로 알려져 있다(Woolf, 1997). Scopolamine은 항콜린성 제제로 시냅스에서 acetylcholine의 활성을 감소시키는 약물로 기억손상을 일으켜 노인성 중추신경 장애와 관련된 연구에 많이 활용되는 약물로 알려져 있다(Wesnes et al., 1991). 아세틸콜린 생성에 미치는 오징어 젓갈시료의 효과는 Fig. 5에 제시하였다. Control군의 아세틸콜린 함량은 2.51±0.25 μmol/mg protein으로 normal군의 7.51±0.70μmol/mg protein과 비교하여 약 33 % 감소하였다. 이것은 기억손상을 일으키는 scopolamine 투여에 의해 아세틸콜린의 함량이 감소함을 확인할 수 있었다.
한편 2% 소금함량 오징어 젓갈 원재료를 처리한 군에서 아세틸콜린 함량이 5.12±0.13 μmol/mg protein, ethanol추출물을 섭취한 군은 4.75±0.26 μmol/mg protein 으로 나타났다.
이는 오징어 젓갈 투여로 인해 전체적으로 아세틸콜린의 함량이 control 군보다 높아짐을 확인할 수 있었으며, 4% 소금함량 오징어젓갈 섭취한 군의 3.56±0.64, 4.71±0.34 μmol/mg protein에 비하여 normal군에 가까운 수치를 나타내었다. 즉, 노인성 치매에서 아세틸콜린 함량이 감소한다는 보고를 고려했을 때 오징어 젓갈의 급여는 노인성 치매의 예방에 도움이 될 것으로 예상된다.
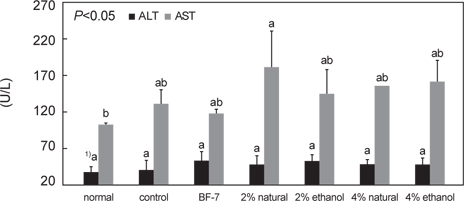
치매 유도 약물로 사용된 scopolamine의 독성 및 시료 섭취로 인한 영향을 검사하기 위하여 AST와 ALT 수치를 serum에서 생화학적 분석을 통해 살펴 본 결과가 Fig. 6이다.
AST 수치의 경우, control군에서 130.53±28.51 U/L 이었으며, 2% 소금함량의 오징어 젓갈을 투여한 군에서 181.00±73.23 U/L로 나타났다. 이는 SD-rat의 정상 AST수치 범위 안에 들었으며, 각 군간의 유의성은 없었다. ALT 수치 또한 normal군과 control간의 차이가 많이 나지 않았으며, 2% 젓갈을 투여한 군에서 51.93±9.87 U/L로 가장 높은 수치를 나타냈으나, 모두 실험동물의 ALT 정상 수치 범위 안에 들었다 (Kwon et al, 2009). 이와 같이 간 독성은 젓갈 투여 및 positive control로 사용된 BF-7투여의 경우에도 별다른 영향은 없는 것으로 확인되었다.
>
뇌조직 중 gamma-aminobutyric acid (GABA) 함량
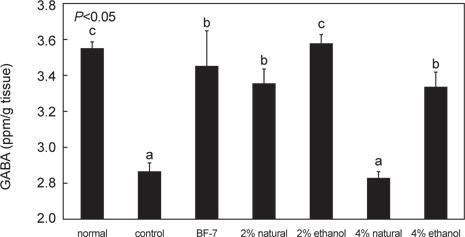
뇌조직 중 GABA 함량을 분석한 결과를 Fig. 7에 나타내었다. GABA는 자연계에 널리 분포하는 비단백질 구성 아미노산으로서, 사람에 있어서는 신경계, 혈액에 함유되어 있으나, 대부분은 뇌의 골수에 존재하여 신경전달 물질인 acetylcholine 을 증가시키고 뇌기능을 촉진시키는 등의 생리작용뿐 아니라 혈압 저하 작용, 이뇨작용, 항산화 작용, 성장 호르몬의 분비 조절에도 관여하며, 통증 완화에도 효과가 있는 것으로 알려져 있다 (Chang et al., 1992; Krogsgaard, 1989; Leventhal et al., 2003; Park et al., 2002; Shelp et al., 1999).
GABA함량은 2% 소금함량 오징어젓갈 투여 군의 경우 원재료, ethanol추출물에서 각각 3.34±0.08, 3.57±0.05 ppm/g tissue로 나타났으며, 4% 소금함량 오징어 젓갈 투여 군의 경우에는 이보다 낮은 2.83±0.03, 3.32±0.09 ppm/g tissue이었다. 이는 전체적으로 오징어 젓갈 시료를 투여한 군들 전체에서 BF-7 투여군 3.44±0.20 ppm/g tissue과 유사한 수준의 GABA함량을 보였으며, 특히 2% 소금함량의 오징어젓갈 ethanol추출물의 경우 정상군 수준으로 높은 GABA함량을 나타내었다. 이 결과는 Lee et al. (2010)의 보고와도 일치하였다.
본 실험은 쥐에게 식염농도가 다른 오징어 젓갈을 급여하여 scopolamine을 투여한 후 기억·학습 장애를 유발하여 실험동물의 학습수행 개선과 관련 효소의 억제에 미치는 효과를 규명하고자 하였다.
Scopolamine으로 기억을 손상시킨 실험동물의 학습수행개선과 뇌조직의 아세틸콜린에스테라제 억제 및 아세틸콜린 함량을 평가한 결과, 특히 2% 소금함량의 오징어 젓갈 투여로 scopolamine (2 mg/kg, i.p.) 으로 유발된 기억손상 동물모델의 morris water maze 시험에서 인지훈련이 반복될수록 escape latency 시간이 감소 폭이 큰 것을 확인할 수 있었다.
수동회피시험 결과 오징어 젓갈을 투여한 모든 군에서 latency time이 증가하였으며, 특히 2% 소금함량의 오징어 젓갈 ethanol투여 군에서 BF-7군과 유의한 결과를 보였다. BF-7은 치매의 원인물질인 베타아밀로이드의 독성을 효과적으로 억제하는 것으로 알려져 있다(Kim et al., 2010).
뇌조직의 아세틸콜린에스테라제 활성 또한 행동실험과 유사한 결과를 나타내었다. 오징어 젓갈시료 투여에 따라 scopolamine을 투여한 control군과 비교하여 유의적으로 아세틸콜린에스테라제 활성이 감소하였으며, 특히 2% 소금함량 오징어 젓갈 투여 군이 4% 소금함량 오징어젓갈 투여 군에 비하여 활성이 증가함을 확인할 수 있었다. 뇌 조직 아세틸콜린 함량 또한 scopolamine을 투여한 control군과 비교하여, 오징어 젓갈시료를 투여한 전체 군에서 유의적으로 아세틸콜린 합성이 증가하는 경향을 보였다. 특히 오징어젓갈 제조 시 소금의 함량과도 상관관계를 나타내어 2% 소금함량 오징어 젓갈 투여 군에서 유의적인 결과를 나타내었다.
GABA함량 측정 결과, 오징어 젓갈 시료를 투여한 군들 전체에서 positive control과 비슷한 GABA함량을 보였으며, 특히 오징어 젓갈 원재료, ethanol추출물에서 높은 함량을 확인할 수 있었고, 2% 소금함량에서 4% 소금함량보다 더 유의성 있는 결과를 나타내었다.
이로 미루어 볼 때, 저염 오징어 젓갈시료의 투여는 장·단기 기억 활성 촉진, 아세틸콜린에스테라제 활성 억제, 아세틸콜린 함량 증가 등으로 콜린성 신경계를 자극하며 기억 및 학습증진에 효과적으로 작용하여, 뇌의 GABA함량에도 영향을 주는 것으로 사료된다.