This study aimed to find an optimal diluent and cryoprotective agent (CPA) during cryopreservation of common Korean bitterling
묵납자루(
어류 정자의 냉동보존에 관한 연구는 Blaxter (1953)가 청어(
본 연구에서는 한국의 고유어종이며 멸종위기 종인 묵납자루의 종 보존 및 인공종묘생산 기술개발을 위한 연구의 일환으로 묵납자루 정자의 냉동보존 시 적정 희석액 및 CPA를 알아보고자, 희석액 종류 및 CPA별 묵납자루 정자에 미치는 독성 및 냉동보존 효과를 조사하였다.
실험에 사용한 묵납자루 정액은 국립수산과학원 내수면연구센터에서 증식·보존을 위해 사육중인 전장 6.9±3.0 cm, 체중 4.9±0.5 g의 수컷 40마리로부터 채취하였다. 실험어로부터 정액을 채취하기 이전에 배설물에 의한 정액 오염을 방지하기 위하여 채정 24시간 전부터 절식시켰으며, 실험어를 100 ppm MS-222로 마취한 다음 복부를 부드럽게 압박하여 채정하였다.
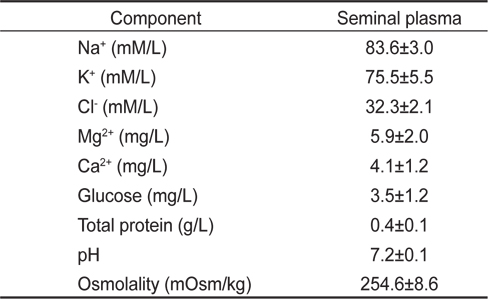
채취한 정액 중 일부는 정액의 화학적 특성을 알아보기 위하여 원심분리(4℃, 12,000 rpm, 20분) 하였으며, 원심분리하여 얻은 정장은 분석 전까지 초저온 냉동고(-80℃)에 보관하였다. 정장의 Na+, K+, Cl-, Ca2+, Mg2+, glucose 및 total protein (TP) 농도는 건식임상화학자동분석장치(Fuji Dri-chem 3500i, Japan) 를 이용하여 분석하였으며, pH와 삼투질농도는 각각 pH측정기(DE/Docu-pH plus, Sartorius, USA)와 삼투질농도 측정기(Vapro 5520, WESCOR Co., USA)로 분석하였다.
희석액 종류 및 CPA별 묵납자루 정자의 독성평가와 냉동보존 효과를 비교하기 위하여 희석액으로 기존 잉어과 어류의 정자냉동보존 연구에서 효과가 좋았던 Kurokura et al. (1984)의 잉어 인공정장(artificial seminal plasma, ASP; 0.44 g NaCl, 0.62 g KCl, 0.022 g CaCl2, 0.008 g MgCl2, 0.02 g NaHCO3, DW 100 mL; pH 7.56±0.2, osmolality 276±2 mOsm/kg; 희석액 I)과 어류의 정자냉동보존에서 희석액으로 많이 쓰이는 300 mM glycose (5.4048 g glycose, 증류수 100 mL; pH 6.13±0.1, osmolality 312±2 mOsm/kg; 희석액 II)를 사용하였다. CPA는 어류의 정자냉동보존 연구에서 가장 많이 사용되는 dimethyl sulfoxide (DMSO), ethylene glycol (EG), methanol 및 glycerol, 농도는 10%로 하였다. 희석액 종류 및 CPA별 묵납자루 정자에 미치는 독성을 평가하기 위하여 각각의 희석액과 CPA가 첨가된 용액에 정액을 100:1로 넣고 정자의 생존율 및 운동성을 측정하였다. 정자의 생존율은 광학현미경으로 각각 3회 반복 관찰하여 전체 정자수에 대한 살아있는 정자수의 비율로 생존율을 산정하였다. 정자의 운동성은 정자운동성 관찰용 slide glass (Teflon Printed Glass Slide; 21 wells; diameter of each well, 4 mm; Funakoshi Co., Japan) 위에 정액을 2 μL씩 분주하여 cover slide 없이 광학현미경으로 관찰하였다. 정자의 운동성은 Table 1의 운동지수에 따라 점수를 부여하고, 각각의 운동점수와 운동정자의 비율에 따라 Strüssmann et al. (1994)의 방법을 변형하여 정자활성지수(sperm activity index, SAI)로 나타내었다.
[Table 1.] Numerical index for the evaluation of sperm activity index (SAI)

Numerical index for the evaluation of sperm activity index (SAI)
희석액 종류 및 CPA별로 묵납자루 정자의 냉동보존 효과를 비교하기 위하여 각각의 희석액과 CPA가 첨가된 용액에 정액을 20:1의 비율로 희석하여 3분간 평형시간을 준 다음, 0.25 mL straw에 봉입하였다. 이 후 각 straw를 액체질소 증기(-76℃)로 3분간 1차 냉각 한 다음, 액체질소(-196℃)에 바로 넣어 급속 냉각하였다. 희석액 종류 및 CPA별로 냉동된 각각의 정액 straw를 액체질소에 보존 30일 후에 25℃의 항온수조에서 30초간 급속 해동한 다음 정자의 생존율 및 운동성을 측정·비교하였다.
모든 실험은 3반복으로 진행하였으며, 측정값은 평균±표준오차로 나타내었다. 유의차는 SPSS-통계패키지(version 12.0)를 이용하여 Independent samples t-test와 one-way ANOVA-test로 검정하였으며, 집단간 다중비교는 Duncan's multiple range test에 의해 검증하였다(
묵납자루 정액을 원심분리하여 얻은 정장의 화학적 특성은 Table 2에 나타내었다. 정장의 Na+, K+ 및 Cl- 농도는 각각 83.6±3.0, 75.5±5.5, 32.3±2.1 mM/L, Mg2+ 및 Ca2+ 농도는 각각 5.9±2.0, 4.1±1.2 mg/L로 나타났다. 정장의 glucose와 TP는 각각 3.5±1.2 mg/L, 0.4±0.1 g/L 이었으며, pH와 삼투 질농도는 각각 7.2±0.1과 254.6±8.6 mOsm/kg로 나타났다.
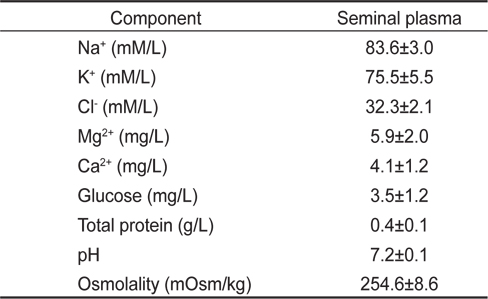
Biochemical properties in seminal plasma of common Korean bitterling Acheilognathus signifer (n=10)
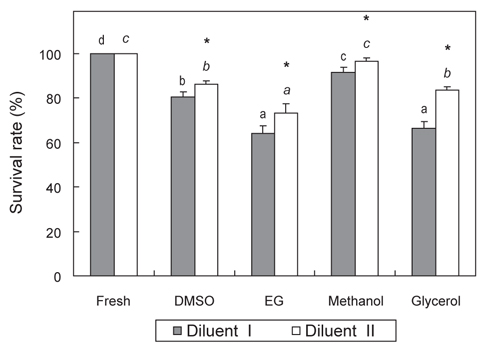
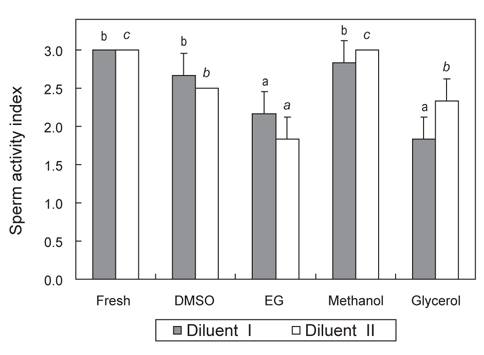
희석액 종류 및 CPA별 독성이 묵납자루 정자의 생존율 및 운동성에 미치는 영향을 조사한 결과, Fig. 1과 2에 나타내었다. CPA가 첨가되지 않은 희석액 I·II에 침지한 묵납자루 정자의 생존율과 SAI는 모두 100%, 3.0으로 Fresh 정자와 동일하였다. 희석액 I에 10%의 DMSO, EG, methanol 및 glycerol이 각각 첨가된 용액에 침지한 묵납자루 정자의 생존율은 각각 80.3±2.5, 64.0±3.6, 91.7±2.1 및 66.3±3.2%로 methanol에 침지한 묵납자루 정자의 생존율이 다른 CPA에 침지한 정자 보다 유의하게 높았다(
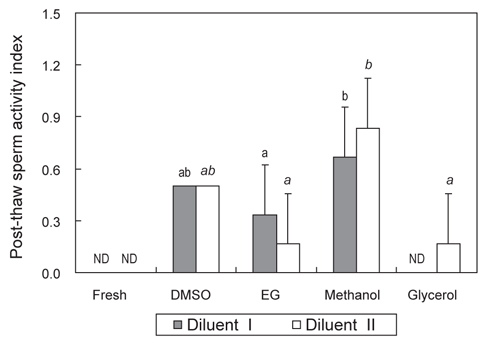
희석액 종류 및 CPA별로 냉동보존 한 묵납자루 정자의 해동 후 생존율 및 운동성은 Fig. 3과 4에 나타내었다.
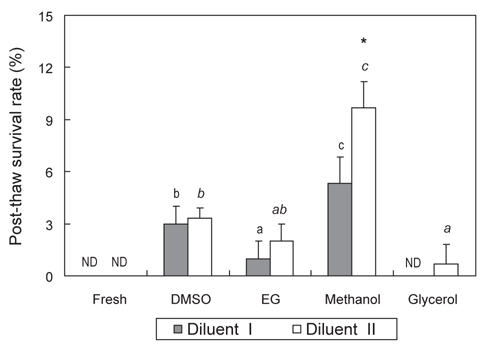
CPA가 첨가되지 않은 희석액 I·II에 침지한 묵납자루 정자의 냉동/해동 후 생존율과 SAI는 모두 0 이였다. 희석액 I과 10%의 DMSO, EG, methanol 및 glycerol을 사용하여 냉동보존 한 묵납자루 정자의 해동 후 생존율은 각각 3.0±1.0, 1.0±1.0, 5.3±1.5 및 0.0±0.0%로 methanol을 사용하여 냉동보존 한 해동 정자의 생존율은 다른 CPA를 사용하여 냉동보존 한 해동 정자 보다 유의하게 높았다(
정장의 물리·화학적 특성에 관한 지식은 어류의 번식능력을 평가하거나 수정기구를 이해하는데 중요한 기준이 된다(De Kruger et al., 1984). 많은 연구자들의 보고에 의하면 해수어류의 정장 Na+ 농도는 150-165 mM/L (Chang et al., 1997; Lim et al., 2007, Jeong et al., 2012), 담수어류의 정장 Na+ 농도는 62-96 mM/L (Morisawa et al., 1983; Morisawa, 1985; Alavi et al., 2004)로 묵납자루의 정장 Na+ 농도는 일반적인 담수어류의 정장 Na+ 농도 범위에 속하였다. 이외에 K+, Cl-, Mg2+ 및 Ca2+ 등 다른 이온의 농도 역시 일반적인 담수어류의 범위에 속하였다. 해수어류의 정장 삼투질농도는 강도다리(
정자의 냉동보존 효과에 영향을 미치는 주된 요인으로는 희석액, CPA, 평형시간, 냉동률 및 해동온도 등이 있으며, 이 중 희석액은 정자의 냉동보존 과정에서 첫 번째로 확인해야 할 항목이다. 일반적으로 수산동물의 정자는 체내에서 체외로 방출되면 수분에서 수십분 내에 운동성을 상실하게 되는데, 희석액은 정자의 활성을 억제하여 냉동보존 전·후로 생존율과 운동성을 유지하는 역할을 한다(Ohta and Izawa, 1996). 그러나 종마다 적정 희석액의 종류와 농도가 달라 인공정장(artificial seminal plasma, ASP), glucose, Ringer's solution, MFRS (marine fish Ringer's solution), sucrose 등 여러 가지 희석액을 농도를 달리하여 사용하고 있다. CPA는 정자의 냉동보존 시 가장 중요한 요소로 세포내 삼투질농도와 빙결정형성 등을 완화·조절하는 역할을 한다(Jamiseon, 1991). 따라서 CPA는 중성물질이어야 하며, 친수성이 강하고, 세포막에 대한 투과성이 높고, 세포에 대한 독성이 적어야 한다(Kuwano and Saga, 2000). 그러나 각 어종의 정자는 CPA의 종류에 따라 종 특이성을 보이기 때문에 모든 어류에서 공통적으로 사용할 수 있는 CPA는 아직 밝혀진 바 없으며, CPA가 세포 냉동시 세포를 보호하는 자세한 기구에 관해서도 아직 알려지지 않고 있다(Kho, 2007). 따라서 어류 정자의 냉동보존 시 적정 CPA 종류 및 농도를 찾는 것은 매우 중요하다.
본 연구에서 희석액 종류 및 CPA별 독성이 묵납자루 정자의 생존율 및 운동성에 미치는 영향을 알아보기 위하여 독성을 평가한 결과, methanol에 노출시킨 묵납자루 정자의 생존율 및 운동성은 대조구와 큰 차이를 보이지 않았다. 따라서 methanol의 독성은 묵납자루 정자에 큰 영향을 미치지 않는 것으로 판단된다. 그러나 EG와 glycerol에 노출시킨 묵납자루 정자는 대조구에 비해 생존율과 운동성이 유의하게 감소하여, 이들의 독성은 묵납자루의 정자에 영향을 미치는 것으로 판단된다. 또한 본 연구에서 희석액 I (잉어 ASP) 보다 희석액 II (300 mM glucose)에 첨가한 CPA의 독성이 유의하게 낮았다. Gwo et al. (1991)은 정자의 냉동보존을 위한 희석액으로는 sodium choloride, glucose 및 sucrose와 같은 간단한 조성의 희석액이 유리하다고 하였고, Chang et al. (1997)은 당질이 포함된 희석액은 정자 세포막의 인지질을 안정시켜 보존효과를 높인다고 보고하였다. 따라서 본 연구에서 사용한 희석액 II는 정자의 활성을 억제시키는 역할뿐만 아니라, CPA의 독성으로부터 정자를 보호한 것으로 추정된다.
많은 연구자들은 어류의 정자냉동보존 시 DMSO가 다른 CPA보다 냉동보존 효과가 좋은 것으로 보고하였다(Ciereszko and Dabrowski, 1993; Lim et al., 2007; Jeong et al., 2012). 그러나 CPA는 종 특이적인 경향이 강하기 때문에 모든 어류에서 획일적으로 사용될 수 있는 CPA는 아직 구명되지 않았다. 본 연구에서 묵납자루 정자의 냉동보존 시 DMSO는 EG나 glycerol보다 냉동보존 효과가 좋았다. 그러나 methanol을 사용하여 냉동보존 한 묵납자루 정자의 해동 후 생존율 및 SAI는 DMSO보다 유의하게 높게 나타나, methanol이 묵납자루 정자의 냉동보존 시 적정 CPA로 판단된다. 묵납자루와 비슷한 칼납자루 정자를 냉동보존 한 Ohta et al. (2001)의 연구에서도 10% methanol을 사용하였을 때 다른 CPA 보다 해동 정자의 운동성이 높았다고 보고하였다. 이 외에도 산천어 (
Lim et al. (2008)은 어종별 적정 CPA는 동일한 종이라 할지라도 CPA와 희석액의 조합 또는 냉동방법에 따라 달라질 수 있다고 하였다. 따라서 적정 CPA 선택을 위해서는 CPA의 효과에 영향을 미치는 여러 가지 요인들을 종합적으로 검토하여야 한다. 본 연구에서 묵납자루 정자의 냉동보존 시 희석액은 300mM glucose, CPA는 10% methanol을 사용하였을 때 가장 좋은 냉동보존 효과를 나타내었다. 그러나 본 연구에서 사용한 냉동보존 조건 및 방법이 최적이라고 판단하기에는 여러 가지 변수가 많다. 따라서 묵납자루 정자의 냉동보존 시 적정 희석액, CPA, 평형시간, 냉동률 및 해동온도 등 여러 가지 요인에 대한 보다 세부적인 연구가 더 필요할 것으로 사료된다.
본 연구는 국립수산과학원 수산시험연구과제인 수산생물 종 보존 및 복원 연구 기술 개발(과제번호: RP-2014-AQ-001)의 연구비 지원에 의해 수행되었습니다.