에드와드병의 원인균인 Edwardsiella tarda (E. tarda)는 수중 및 정상어의 장내에 상재해 있지만 고밀도 양식에 의한 물리적 스트레스를 비롯하여 사육환경 악화, 먹이경쟁, 생활공간의 협소, 수산약제의 사용, 저수온 및 고수온 등에 의해 많은 스트레스 조건 하에서 기회성 감염균으로서 각종 양식 어류에 감염되어 경제적으로 많은 손실을 초래하고 있다(Kanai et al., 1988; Bang et al., 1992). 특히 넙치 양식에서 가장 많은 피해를 주는 에드와드병의 발병 증상으로는 복부팽창 및 탈장 등의 증상이 있으며 주로 고수온기에 많이 나타나는 질병이다(Kusuda and Kawai, 1998). 현재 본 질병은 화학적 치료와 관련된 오염 및 다양한 항생제 내성균의 출현 때문에 어류양식에 있어서 예방 및 치료가 더욱 어려워지고 있다(Chinabut and Puttinaowarat, 2005). 따라서 기존의 질병예방 및 치료의 문제점에 대한 대책으로 친환경적인 bacteriophage (phage)나 Bacillus subtilis (B. subtilis)와 같은 probiotics에 대한 관심과 연구가 점차 증가되고 있는 실정이다(Salminen et al., 1999; Park et al., 2000).
Phage는 숙주세포인 세균에 감염하여 숙주세포의 생체 기능을 이용하여 증식하는 바이러스로서 자연계에 널리 분포하고 있다(Carlton, 1999). Phage는 1915년 Twort와 1917년 d’Herelle에 의해서 최초로 발견되었으며(Sulakvelidze et al., 2001) 1980년도에는 phage의 임상실험이 성공하였다(Smith and Huggins, 1980; Smith and Huggins, 1982). 이후 동물의 세균성 질병에 대한 phage치료가 가능하다는 연구가 많이 보고 되었으며(Soothill, 1992; Soothill, 1994; Merril et al., 1996; Barrow et al., 1998) 또한 어류의 세균성 질병에 대한 phage치료연구도 상당수 보고 되었다(Rodgers et al., 1981; Stevenson and Airdrie, 1984; Park et al., 2000).
Probiotics는 숙주의 건강에 유익한 효과를 나타내는 살아있는 미생물로서 다양한 종류의 정상 장내 세균총에서 병원성 세균에 대해 증식을 억제하는 항균력이 있는 것으로 알려져 있으므로 정상 장내 세균총의 균형을 유지하고 병원성 세균의 증식을 억제하는데 중요한 역할을 담당한다(Shahani and Ayebo, 1980; Fuller, 1989). 이러한 probiotics의 유용한 효과는 주로 사람과 가축에 대한 실험보고 내용이 대부분을 차지하고 있으나(Tournut, 1989) 어류와 다른 수생생물에서도 선천적 면역반응 향상과 병원성 미생물을 억제시키는 것으로 연구보고 되고있다(Burr et al., 2005; Wang et al., 2008; Nayak, 2010; Cha et al., 2012). 수산양식에서 사용되는 probiotics로는 Lactobacillus sp., Bacillus sp., Saccharomyces sp. 및 Enterococcus sp. 등이 있다(Kumar et al., 2008). Probiotics가 첨가된 사료공급 시장내 해로운 균의 번식을 억제하고(Perdigon et al., 1990), 장내 미생물 형성에 영향을 미쳐(Shahani and Ayebo, 1980) 장내 독소 제거에 의해 장 질환을 억제할 뿐만 아니라 비특이적 면역기능 강화(Shida et al., 1980) 등 여러가지 다양하고도 유익한 효과들이 나타난다는 연구결과가 보고되었다(Nayak et al., 2007; Kumar et al., 2008; Aly et al., 2008; Cutting, 2011; Cha et al., 2012).
그러므로 본 연구에서는 항생제 대체제를 개발하기 위한 기초적인 자료로서 E. tarda 에 대한 phage를 자체적으로 분리하여 phage의 항균효과를 확인한 후 probiotics와의 혼합투여가 어류의 모델로서 나일 틸라피아(Oreochromis niloticus)의 선천적 면역반응과 항균 효과에 미치는 영향을 조사함으로써 에드와드병에 대한 예방 및 치료 대책의 가능성을 확보하고자 하였다.
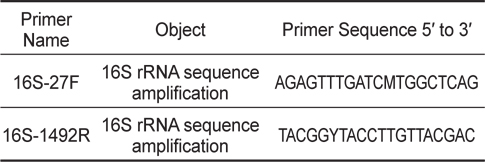
숙성된 김치를 Luria Bertani (LB) broth 에 넣고 37℃에서 24시간 배양한 후 멸균된 생리식염수 (Phosphate Buffered Saline, pH 9.2, PBS)로 1:10 단계희석하고 LB agar에 도말하여 B. subtilis와 유사한 형태 집락 5가지를 분리하였다. 분리된 균들은 E. tarda에 대한 항균효과를 측정한 후 가장 효과가 좋은 균주를 16S rRNA gene을 이용하여 B. subtilis임을 입증하였다. DNA sequencing에 사용된 B. subtilis의 16S rRNA gene에 대한 universal primer는 Table 1에 나타내었다.
본 연구에서 사용한 E. tarda (KCTC 12267)는 Korean Collection for Type Culture (KCTC)에서 분리 보존하고 있던 균주를 분양 받았다. 분양 받은 균주는 brain heart infusion (BHI) broth 와 Salmonella shigella (SS) agar를 이용하여 2차 계대배양 한 후 사용하였다.
우리나라의 서해안 및 남해안에 위치한 100여 군데의 양식장에서 수집된 물 sample로부터 본 연구실에서 분리된 E. tarda의 특이 phage를 사용하였다(Lee et al., 2011).
본 연구에서는 기초사료로 (주)카길애그리퓨리나 양어용 부상사료를 사용하였다. 기초사료의 영양성분은 34%, 조지방 6%, 조회분 15%, 조섬유 5%, 칼슘 0.8% 및 인 0.8% 로서 실험에 사용된 사료는 기초사료를 포함하여 총 4가지로 제조하여 사용하였다. 첫 번째 사료는 B. subtilis (2×108 CFU/g)와 phage (3×107 PFU/g)를 혼합하여 첨가하고 호기성 조건으로 37℃ incubator에서 2일 간 발효시킨 후 건조하여 사용하였다. 두 번째 사료는 B. subtilis (2×108 CFU/g)를 첨가하여 호기성 조건으로 37℃ incubator에서 2일간 발효시킨 후 건조하여 사용하였다. 세 번째 사료는 phage (3×107 PFU/g)만 첨가하여 건조시킨 후 사용하였다. 네 번째 사료는 대조 군으로서 기초사료에 B. subtilis와 phage를 첨가하였을 때 사용되었던 동일부피의 BHI를 첨가한 후 동일 조건에서 건조시킨 후 사용하였다. 모든 사료는 발효와 동시에 자연 건조된 상태로 플라스틱 지퍼백에 넣어 사료공급 전까지 4℃에서 보관한 후 실험에 사용하였다.
군산대학교 부속양식장으로부터 평균체중이 100±12 g의 나일 틸라피아(Oreochromis niloticus) 200마리를 분양 받았다. 분양 받은 틸라피아를 1 ton의 원형수조에 수온 23-25℃에서 1주일간 순치 시킨 후 실험에 사용하였다.
B. subtilis와 phage가 나일 틸라피아의 선천적 면역반응에 미치는 영향을 조사하기 위해 2가지 방법으로 실험을 수행하였다. 1차 실험은 B. subtilis와 phage가 혼합된 첨가사료(B+P)를 급이 하는 group, B. subtilis 첨가사료(B)만 급이 하는 group, phage 첨가사료(P)만 급이 하는 group 및 기초사료(C)만 급이 하는 대조군의 4개 group으로 나누어 80 L 수조에 group 당 각각 13마리씩 수용하였다. 각각 제조된 사료는 14일간 공급 하였으며 sample은 사료공급 7일 및 14일째에 수집하였다. 2차 실험은 B+P공급 시 나일 틸라피아의 선천적 면역반응이 어느 정도의 기간 동안 유지되는지 알아보기 위해 수행되었다. 총 4개의 group으로 나누어 80 L 수조에 각각 13마리씩 수용하였다. 첫 번째 group은 B+P를 14일간 공급하였으며 두 번째 group은 B+P를 4일간만 공급하고 실험종료 시까지 사료를 공급하지 않았다. 두 개의 대조군 group도 BHI만 처리한 C를 같은 방법으로 공급하였다. Sample은 사료공급 4, 8, 10일 및 14일째에 각각 수집하였다.
혈청 수집을 위해 틸라피아의 미병부에서 혈액을 채취하였다. 혈액은 4℃에서 24시간 동안 응고시킨 후 1,000×g에서 3분간 원심분리 하여 혈청을 분리하였다. 분리된 혈청은 lysozyme 활성과 alternative complement pathway (ACH50) 활성 분석에 사용하였다. 백혈구 수집을 위해 틸라피아를 개복하여 지방층과 막을 제거한 후 순수한 두신만을 적출하였다. 적출한 두신을 nylon mesh위에서 눌러 백혈구를 유출하였고 Histopaque-1077 (Sigma)을 이용하여 2,500×g에서 30분간 원심분리 하여 분리된 buffy-coat 부근에서 백혈구만을 순수 분리하였다. 분리된 백혈구는 혈구계산판을 이용하여 계수하였다. 백혈구의 세포 수는 106 cell/mL로 Dulbecco's Modified Eagle's Medium (DMEM, Gibco)용액에 부유시켜 respiratory burst 활성 분석에 사용하였다.
백혈구 식세포 작용의 respiratory burst 활성은 Secombes (1990)의 방법에 따라 nitroblue tetrazolium (NBT, Sigma)을 사용하여 분석하였다. 백혈구를 96 well plate에 200 μL씩 분주한 후 120×g 에서 5분간 원심분리 하였다. PBS로 2회 washing한 후 phorbol myristate acetate (PMA, 1 μg/mL)를 첨가한 NBT (1 mg/mL)를 각각 100 μL씩 첨가하여 25℃에서 1시간 동안 배양하였다. 배양 후 70% methanol로 고정하고 PBS로 2회 washing한 후 2 M KOH 120 μL와 dimethyl sulfoxide (DMSO, Sigma)를 첨가하였다. 첨가 후 Microplate reader기 (Sunrise, TECAN) 620 nm에서 흡광도를 측정하였다.
혈청의 lysozyme 활성은 Sheikhzadeh et al. (2012)의 방법을 응용하여 분석하였다. 96 well plate에 0.2 M citrate phosphate buffer (pH 5.8)에 2 mg/mL의 Micrococcus lysodeikticus (Sigma)를 부유시킨 용액을 well당 75 μL와 혈청 25 μL를 분주하여 반응시켜 30초 후부터 4분 30초까지 감소하는 흡광도의 양을 Microplate reader기 405 nm에서 측정하였다. 이때 1 unit은 분당 0.001의 흡광도가 감소하는 양으로 표현하였다.
ACH50은 Yano (1992)의 방법을 이용하여 분석하였다. 토끼의 혈액을 귀의 정맥혈관에서 채취하여 Histopaque-1077을 이용하여 적혈구만을 분리하였다. 분리된 토끼의 적혈구를 PBS로 2회 washing한 후 0.01 M EGTA-Mg-Gelatin veronal buffer (EGTA-Mg-GVB)로 희석하여 1×108 cell/mL의 농도로 조절하여 사용하였다. 틸라피아의 혈청을 EGTA-Mg-GVB로 1:20의 농도로 희석한 후 96well plate에 well당 200, 150, 125, 100, 75 μL씩 분주하고 EGTA-Mg-GVB로 각각의 well의 총량이 200 μL가 되도록 맞추어주었다. 그 다음 분리된 토끼 적혈구(1×108 cell/mL)를 각각의 well에 100 μL씩 분주하여 25℃ incubator에서 1시간 동안 반응시킨 후 120×g에서 5분간 원심분리 한 다음 각각의 well에서 상청액 100 μL씩을 채취하여 Micro plate reader 405 nm에서 분석하였다. ACH50 value (Unit/mL) = 1/K × 혈청 희석 배수 × 0.5
나일 틸라피아의 E. tarda 인위적 감염 시 B. subtilis와 phage가 생체 내에서 미치는 항균효과를 알아보기 위해 2가지 방법으로 실험을 수행하였다. 1차 실험은 4개의 group으로 나누어 80 L 수조에 각각 13마리씩 수용하였다. B+P, B, P 및 C를 각각의 group에 4일간 공급한 후 1일간 절식시켜 E. tarda (1×107 CFU/mL)를 틸라피아의 복강에 주사하였다. 주사 이후 14일 동안 각각의 사료를 공급하였다. 주사 후 0, 7, 14일째에 각각 group에서 4마리씩 모든 장기를 적출하였다. 적출된 장기에 멸균된 PBS 1 mL을 혼합해서 균질화한 후 거즈를 이용해서 1,000×g로 원심분리 하여 착즙 하였다. 그 후 착즙부유액을 멸균된 PBS로 1:10 단계희석 하여 SS agar에 평판도말법으로 E. tarda의 생균수를 측정하였다.
2차 실험은 1차 실험과 마찬가지로 4개의 group으로 나누어 80 L 수조에 틸라피아를 각각 13마리씩 수용한 후 2개의 group은 B+P와 C를 각각 4일간 공급하여 1일간 절식시킨 후 E. tarda (1×107 CFU/mL)를 복강에 주사하고 사료를 공급하지 않았다. 나머지 2개의 group은 이전 group과 동일한 조건에서 10일 동안 각각의 사료를 공급하였다. C를 공급하고 E. tarda 주사 후 10일간 사료를 공급하거나 하지 않은 2개의 group을 대조군으로 설정하였다. 모든 group에서 주사 후 4, 6일 및 10일째에 각각 3마리씩 모든 장기를 적출하여 1차 실험과 같은 방법으로 측정하였다.
데이터를 평균과 표준편차(Mean±S.D.)로 표현하여 PRIMER (Mc Graw-Hill, Inc., ver. 1.5)의 one way analysis of variance를 이용하여 측정하였다. Student-Newman-Keuls test로 각 group사이의 유의성을 검정하였으며 P<0.05일 경우 유의성이 있는 것으로 간주하였다.
본 연구에서는 다양한 항생제 내성균의 출현과 같은 기존의 질병예방 및 치료의 문제점에 대한 대책으로 관심이 높아진 친환경적인 phage와 probiotics의 일종인 B. subtilis가 혼합된 첨가사료를 이용하여 나일 틸라피아의 선천적 면역반응과 에드와드증의 원인균인 E. tarda에 대한 항균효과가 증강되는지에 대한 조사를 수행하였다.
김치에서 분리된 균주를 16S rRNA universal primer로 F, 5’-AGAGTTTGATCMTGGCTCAG-3’, R, 5’-TACGGYTACCTTGTTACGAC-3’을 이용한 염기 서열 분석 결과 Genbank에 등록된 accession number JF496383.1인 B. subtilis의 16S ribosomal RNA gene과 100% 상동성을 나타내었다(Baek et al., 2013).
식세포작용에 의해서 생기는 중간대사 산물인 활성산소(O2-)와 같은 reactive oxygen species (ROS)는 강력한 살균 효과가 있는 것으로 알려져 있으며(Ellis, 1999) lysozyme은 peptidoglycan이라는 세균의 세포벽 성분을 분해하는 작용을 가지고 있으며 이외에도 옵소닌, 항바이러스 항암작용 등에도 관여를 하는 것으로서 보고 되어있다(Jolles and Jolles, 1984). 그리고 보체의 alternative pathways는 세균, 진균, 바이러스 및 기생충등에 대한 어류의 강력한 선천적 방어기작으로 보고 되어있다(Müller-Eberhard, 1988).
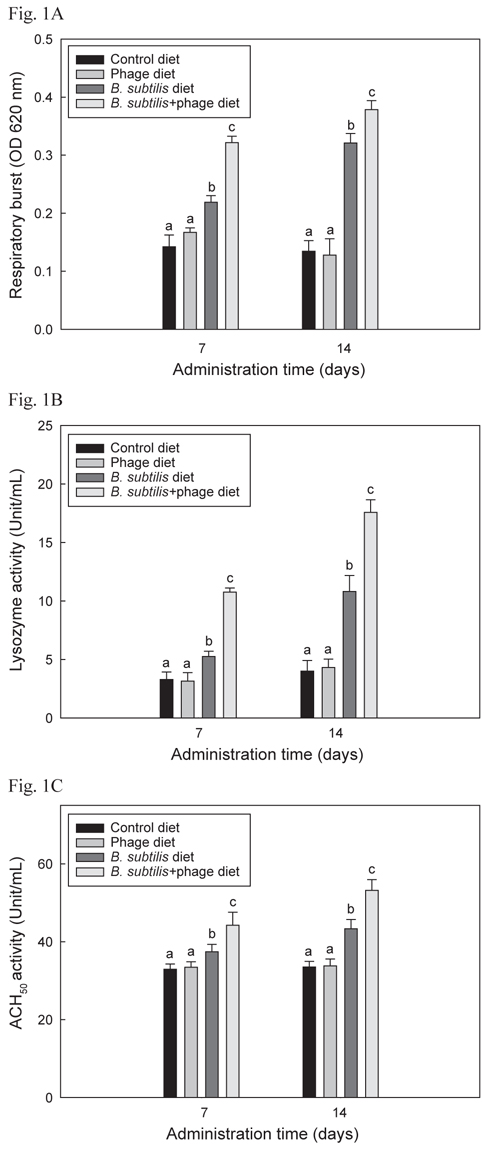
B+P, B, P 및 C를 4개의 group에 각각 14일간 공급한 후 선천적 면역반응 1차 실험의 respiratory burst, lysozyme 및 ACH50활성 결과는 Fig. 1 A, B 및 C에 각각 나타내었으며 모두 유사한 결과들을 보였다. B+P를 공급한 group이 C, P 및 B를 공급한 group에 비해 사료공급 후 7일 및 14일 째 모두 respiratory burst, lysozyme 및 ACH50 활성이 유의성 있게 증가(P<0.05)되었다. B를 공급한 group은 대조군 및 P를 공급한 group에 비해 7일 및 14일 째 모두 유의적으로 높은(P<0.05) 수치를 보였으나 B+P를 공급한 group 보다는 낮은 수치를 나타내었다. P만 급여한 group은 대조군 group과 유의적인 차이가 없었다(P>0.05).
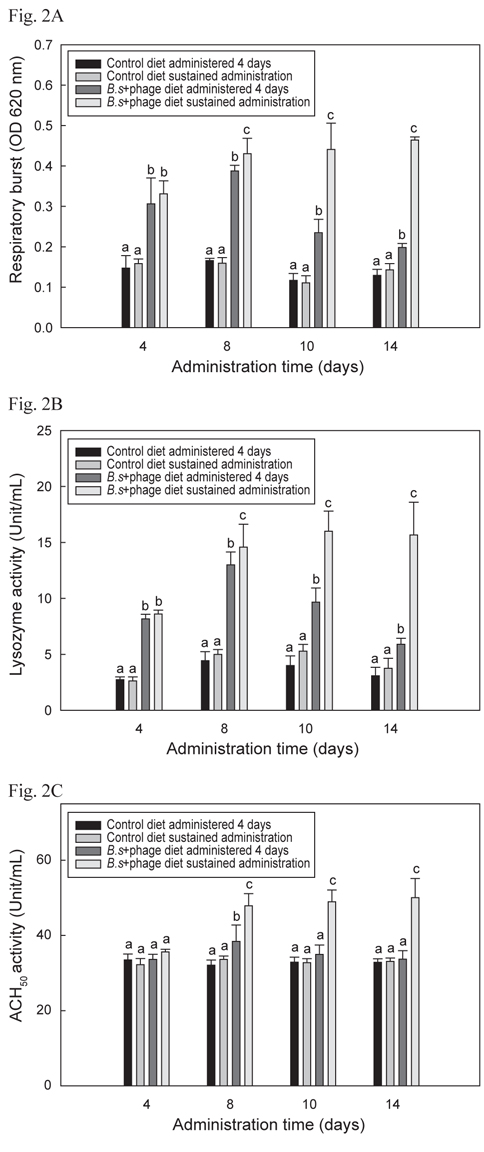
B+P공급 시 나일 틸라피아의 선천적 면역반응이 어느 정도의 기간 동안 유지되는지 알아보기 위해 수행한 선천적 면역의 활성 결과는 Fig. 2 A, B 및 C에서 나타내었으며 모두 유사한 결과들을 보였다. B+P를 14일간 지속적으로 공급한 group이 다른 group들에 비해 8일째부터 14일째까지 respiratory burst, lysozyme 및 ACH50 활성이 유의성 있게 높게 증가(P<0.05)되었다. B+P를 4일 간만 공급한 group의 respiratory burst, lysozyme 활성은 8일째까지는 대조군 group들에 비해 높은 값을 보였으나 10일째부터는 점차적으로 수치가 떨어지는 것이 확인되었으며 ACH50 활성은 8일째에만 대조군 group들에 비해 유의성 있게 높은(P<0.05) 수치를 보였다. 기초사료를 공급한 2개의 대조군 group간의 유의적인 차이는 없었다(P>0.05). 이와 같은 결과는 이전의 연구들에서도 B. subtilis 첨가사료를 공급하였을 때 도미(Salinas et al., 2005), 나일 틸라피아(Aly et al., 2008), 무지개송어(Panigrahi et al., 2007), 잉어과 어류(Kumar et al., 2008) 등에서 respiratory burst, lysozyme 및 ACH50 활성이 향상되었다고 보고된 내용과 일치하였다. 그러나 어류에서 probiotics가 어떠한 메커니즘에 의해 선천적 면역반응을 향상 시키는 지에 대한 정확한 메커니즘은 보고되어 있지 않다. Abraham et al. (2007)도 생균제가 어류의 생존능력과 면역력을 향상시킬 수 있다고 보고 하였지만 그 메커니즘에 대한 정확한 해답은 제시하지 못하였다. 이전의 연구에서는 B. subtilis와 prebiotics인 inulin, chitosan 및 fructooligosaccharide 등이 혼합된 첨가사료를 공급하여 어류의 선천적 면역반응이 향상되었다는 보고(Zhang et al., 2010; Geng et al., 2011; Cerezuela et al., 2012)는 되어 있지만 B. subtilis와 phage를 혼합투여 했을시 선천적 면역반응에 미치는 영향 등에 관련된 연구는 아직까지 보고 되지 않았다. 본 연구의 결과 phage 자체로는 틸라피아의 선천적 면역기능을 증가시키지는 못하였지만 생균제와 혼합투여 되었을 시 생균제만 투여되었을 때보다 유의적 상승효과 (P<0.05)가 나타났다. 그러나 어떻게 B. subtilis와 phage가 혼합투여 되었을 때 단독으로 처리되었을 때보다 선천적 면역기능이 상승되는지에 대한 추가적인 연구가 요구된다.
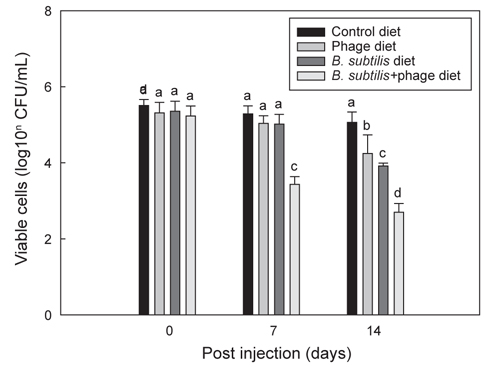
Fig. 3는 B와 P 각각 및 B+P를 급이한 각 group의 틸라피아에 E. tarda를 복강 주사한 후 14일 동안 지속적으로 각 group에 해당되는 사료를 급이 한 후 나타나는 항균효과를 보여준다. B+P를 공급한 group은 E. tarda (1×107 CFU/mL) 복강주사 이후 7일 및 14일째에 다른 group에 비해 E. tarda에 대해 유의적으로 가장 높은(P<0.05) 항균효과를 보였다. B 자체만을 공급한 group은 14일째에 대조군 및 P를 공급한 group에 비해 E. tarda에 대한 유의성 있는 (P<0.05) 상승된 항균효과를 보였으나 B+P를 공급한 group 보다는 낮은 항균효과를 나타내었다. 동일 어종인 나일 틸라피아를 대상으로 한 다른 연구에서도(Aly et al., 2008) B. subtilis를 공급한 group에서 대조군에 비해 Aeromonas hydrophila와 Pseudomonas fluorescens에 대한 저항성이 향상되었다고 보고되었다. P 자체만을 공급한 group은 14시간째에 대조군 group보다 높은 유의성 있는(P<0.05) 항균효과 차이를 나타냈다. 이전의 연구에서도 phage를 첨가한 사료를 방어와 은어에게 공급하였을 때 Lactococcus garvieae와 Pseudomonas plecoglossicida에 대한 각각의 저항성이 향상 되었다고 보고되었다(Park et al., 2000). 이러한 결과는 phage 자체가 틸라피아의 생체 내에서 E. tarda에 대한 항균력을 나타내는 것으로 추정할 수 있다. 한편으로 B+P를 공급한 group에서는 대조군은 물론 B 또는 P만을 급여한 group보다 높은 항균 효과를 보였다. 이러한 향상된 항균효과는 본 연구에서 분석한 선천적 면역반응의 증가와 밀접한 연관이 있을 것으로 추정된다. 다른 많은 연구에서도 B. subtilis가 첨가된 사료를 어류(Qi et al., 2009; Nayak, 2010; Sun et al., 2010; Merrifield et al., 2010)와 새우(Li et al., 2009; Tseng et al., 2009)에 공급하였을때 세포성 및 체액성 면역기능이 향상되어 세균 및 바이러스 등에 대한 저항성이 향상되었다고 보고되었다. 그러나 B+P를 공급하였을 때 어떠한 메커니즘에 의해 phage가 B. subtilis를 도와 선천적 면역기능과 더불어 항균력을 상승시키는 지에 대한 추가적인 연구가 필요하다.
Fig. 4는 B+P를 급이한 틸라피아에 E. tarda를 투여한 후 10일까지 지속적으로 B+P를 급이한 group과 일반사료만을 급이한 group에서 나타나는 항균효과에 대한 차이를 보여주고 있다. E. tarda (1×107 CFU/mL) 복강주사 이후 B+P를 지속적으로 급여한 group이 4일부터 10일까지 다른 group에 비해 유의적으로 가장 높은(P<0.05) 항균효과를 보였다. 그러나 B+P를 4일 간만 공급한 group은 E. tarda 주사 이후 4일째에 대조군 group들에 비해 높은 항균효과를 보였으나 4일 이후부터는 일수에 상관없이 항균효과의 차이는 크게 나지 않았다. 기초사료를 공급한 2개의 대조군 group 각각은 E. tarda에 대해 유의적인 차이를 나타내지 않았다(P>0.05). E. tarda를 복강주사 한 이후 4일에서 10일까지의 결과를 통해 B+P를 지속적으로 공급한 group이 B를 4일 간만 공급한 group보다 높은 항균효과가 있다는 것을 확인하였다. 그러나 이번 연구결과만으로는 질병감염 이후에 probiotics와 phage를 지속적으로 공급해야만 병원균에 대한 치료가 가능하다고 단정하기에는 어려움이 있다. 틸라피아를 대상으로 한 다른 연구에서는 B. subtilis 첨가사료를 1-2개월간 공급한 후 질병에 대한 저항성 실험을 수행하였기 때문에(Aly et al., 2008) 추후에는 E. tarda 복강주사 이전에 사료를 장기간 공급하여 주사 이전까지만 사료를 공급한 group과 주사 이후에도 지속적으로 해당사료를 공급한 group간의 차이를 비교하는 추가적인 연구가 수행되어야 할 것이다.
결론적으로 본 연구에서는 B+P공급이 B 및 P공급 보다 나일틸라피아의 선천적 면역반응과 E. tarda에 대한 항균효과를 향상시켰다. 이러한 결과들은 B. subtilis와 phage를 혼합한 사료 첨가제가 어류의 각종 세균성 질병의 예방은 물론 치료를 위한 항생제 대체제로서 충분한 가능성이 있음을 암시해 주고 있다.