Two neuropeptides were purified from the acidified tube feet extract of the starfish
1962년 낙지의 타액선으로부터 신경성 펩타이드인 eledoisin이 발견된 이후(Erspamer and Anastasi, 1962), 무척추동물에서부터 척추동물에 이르기까지 다양한 생물의 조직으로부터 신경성 펩타이드가 발견되고 있다(Argiolas and Melis, 2013; Hoyle, 1998). Eledoisin은 tachykinin-related peptides (TRPs) family에 속하는 펩타이드로(Holmgren and Jensen, 2001), TRPs family는 척추동물에서 발견된 tachykinin과 유사한 서열을 가지고 있으며(Schoofs et al., 1990), 다양한 무척추동물에서 발견되었다(Nässel, 1999). 신경성 펩타이드는 생체내의 신호전달물질로서 신경계, 면역계에서 신호전달 및 조절역할을 하며, 비 펩타이드성 transmitter인 acetylcholine (ACh)과 함께 방출된다고 알려져 있다(Pfefferbaum et al., 1979; Krieger, 1983). 이들은 평활근의 운동조절, 혈관의 수축 및 이완, 통증전달 및 혈압조절 등의 역할을 담당하고 있다(Zadina et al., 1986). 평활근 조절 작용에 대한 연구는 척추동물뿐만 아니라 연체동물의 경우에 있어서도 catch relaxing peptide를 중심으로 활발히 이루어 지고 있다.
해양 무척추 극피동물 중 해삼(
불가사리는 불가사리과의 극피동물에 속하는 해양 저서생물로(Paine, 1971), 아무르 불가사리는 우리나라 근해에 서식하는 외래종으로, 섭식능력과 번식력, 재생력이 강하여 양식장 및 연안 생태계에 위협적인 대상으로 주목 받고 있다. 특히 아무르 불가사리는 양식장의 어패류나 갑각류, 동종의 극피동물을 섭식하는 것으로 알려져 있어 외래 불가사리 중에서도 해적 불가사리로 알려져 있다(Kang et al., 2000; Kim, 1969). 따라서 본 연구에서는 우리나라 연근해에 서식하여 생태계에 위험의 대상이 되는 미 이용 아무르 불가사리의 추출물로부터 별 불가사리(
아무르 불가사리(
시료의 추출을 위해 사용된 glacial acetic acid와 정제에 사용된 HPLC용 물과 acetonitrile (CH3CN)은 J.T. Baker사(Avantor performance materials, PA, USA)에서 구입하였다. 수축 활성 측정 시 사용되는 약물인 acetylcholine chloride (ACh)는 Sigma-Aldrich사(MO, USA)에서 구입하였고, dithiolthreitol (DTT)는 BIO-RAD사(Bio-Rad Laboratories, Inc., CA, USA)에서 구입하였다. 그 외의 모든 시약은 특급시약을 사용하셨다.
동결된 조직을 1% acetic acid와 1:4 (v/v)으로 섞은 뒤, 100℃에서 5분간 끓여 불가사리 유래 단백질 분해 효소를 불활성화 시키고, 곧바로 얼음에 보관하여 충분히 냉각시킨 후에 homogenizer (T10 basic ULTRA-TURRAX, IKA, USA)를 사용하여 조직을 파쇄하였다. 각각의 산 추출물은 4℃에서 25분 동안 13,000×g으로 원심분리(VS-21SMT, Vision Scientific, Buchon, Korea)한 후에 상층액을 취하였다. 각각 추출물의 1/200에 해당하는 양을 사용하여 별 불가사리 DRM에 대한 수축 활성을 측정하였다.
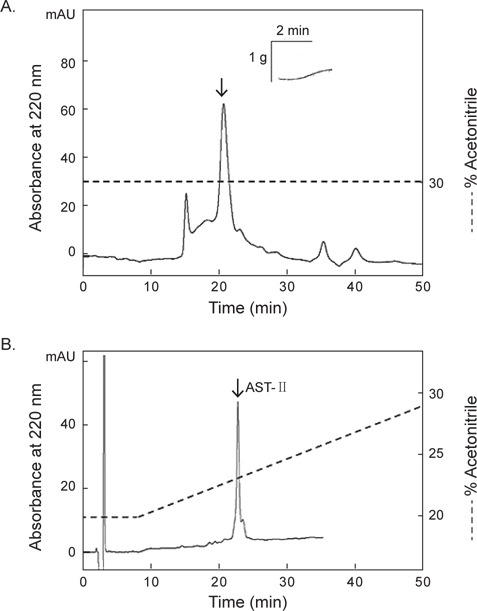
별 불가사리 DRM 및 졸복 장관 평활근에 대해 수축 활성을 나타낸 아무르불가사리 관족 추출물을 사용하여, 근육 수축 활성 펩타이드를 HPLC (Agilent 1100, CA, USA)를 이용하여 분리·정제하였다. 먼저 0.1% TFA를 포함한 5% CH3CN (pH 2.2)으로 평형화 시킨 CAPCELL PAK C18 column (4.6×250 mm, Shiseido, Japan)에 시료를 주입한 후, 다음과 같은 조건으로 분리를 진행하였다: gradient, 5→65% CH3CN (60 min); 유속, 1.0 mL/min; 파장, 220 nm. 분리된 분획은 불가사리 DRM에 대한 수축 활성을 측정한 결과, 약 19분과 26분에 해당하는 2개의 분획에서 수축 활성을 나타내었다.
먼저 19분대 활성 분획은 첫 번째 단계와 동일한 C18 column을 사용하여 정제하였으며, 분리조건은 다음과 같다: gradient, 12→22% CH3CN (50 min); 유속, 1 mL/min; 파장, 220 nm. 그리고 26분대 활성 분획은 Superdex Peptide HR 10/300 GL column (10×300 mm, GE Healthcare Life Sciences, Sweden)을 이용하여 30% CH3CN의 등용매(isocratic) 조건으로 활성을 나타내는 분획을 분리하였으며, 최종적으로 활성 분획은 동일한 C18 column을 사용하여 정제하였으며, 분리조건은 다음과 같다: gradient, 20→30% CH3CN (50 min); 유속, 1 mL/min; 파장, 220 nm.
55 mM Mg2+ artificial sea water (인공해수, ASW)내에서 별 불가사리의 eye spot을 제거한 후 배면과 복면을 분리하여 배면을 뒤집으면, 5개 팔을 따라 중앙을 가로지르는 DRM을 mess로 분리한 후, 10 mm정도의 단편으로 만든다. 인공해수의 조성은 다음과 같다: MgCl2.6H2O 55 mM, NaCl 445 mM, KCl 10 mM, CaCl2.2H2O 10 mM, Glucose 10 mM, Tris-HCl 10 mM (pH 7.8). 준비된 각 단편들은 반응조 지지대에 고정시키고, 위쪽은 physiography system (NECSanei, Tokyo, Japan)의 isometric transducer에 연결하여 반응조에 공기를 주입시켜 15분 간격으로 완충용액을 교체하면서 90분간 평형화하였다. 별 불가사리 DRM 조직의 tension이 1.0 g이 유지되면 acetylcholine (ACh) 10-6 M을 투여하여 활성화하였다. 이후 아무르 불가사리 추출물을 반응조에 투여, 수축활성을 측정한 결과를 physiography상에 기록하였다. 본 연구에서 사용한 아무르 불가사리 조직 추출물과 정제단계에서 분리된 분획을 50 μL의 인공해수에 녹여 활성측정에 사용하였다.
어류 평활근에 대한 아무르 불가사리 조직 추출물의 근 수축활성을 알아보기 위해 먼저 졸복의 중추신경을 절단하여 복부를 절개한 후, 항문으로부터 1 cm 정도 위쪽의 장관을 약 2.0-3.0 cm 길이로 적출하였다. 모세혈관 및 지방을 제거한 후, 장관의 길이가 약 1.0 cm가 되도록 단편을 만들었다. 이 과정은 buffer상에서 행하였으며, buffer조성은 다음과 같다: NaCl 165 mM, KCl 3 mM, MgSO4∙7H2O 1.25 mM, NaHCO3 2 mM, CaCl2.2H2O 1.5 mM, Glucose 10 mM (pH 7.4). 준비된 장관 표본은 2 mL의 반응조에 고정시키고 위쪽은 isometric transducer에 연결하여 1.5 g의 장력을 준 뒤, 반응조에 공기를 주입시켜 15분 간격으로 완충용액을 교체하면서 60분간 실온에서 안정화시킨 후 0.1 μM을 투여하여 조직을 활성화하였다. 이후 아무르 불가사리 추출물을 반응조에 투여, 수축활성을 측정한 결과를 physiography상에 기록하였다.
>
DTT 처리에 의한 disulfide bond 확인
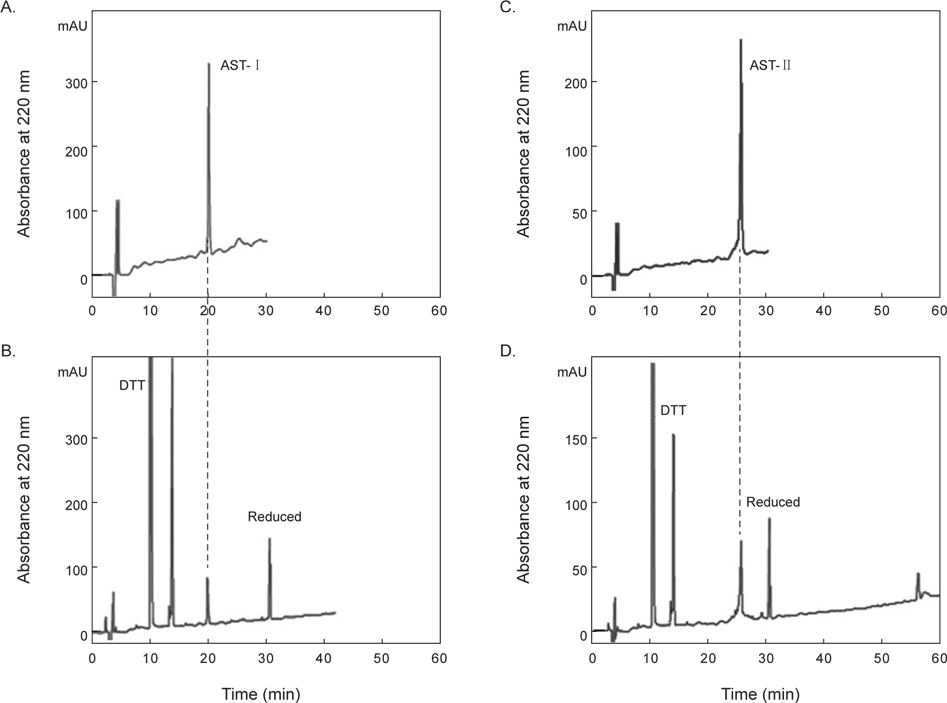
활성 물질 내에 disulfide (S-S) bond의 존재 유무를 확인하기 위해, cysteine에 의한 S-S bond를 환원시키는 DTT를 처리하여 AST-I 및 AST-II의 retention time의 변화 여부를 관찰하였다. 먼저 0.01 M DTT와 분리한 활성물질을 1:4의 비율로 37℃에서 1시간 동안 반응 시킨 후, 동일한 C18 column에 주입하여 retention time의 변화를 확인하였다.
최종적으로 정제된 활성 물질의 정확한 분자량을 측정하기 위해 한국기초과학지원연구원에 있는 UltrafleXtreme MALDI-Time of Flight (TOF)/TOF mass spectrometer equipped with a pulsed smartbeam II (355 nm Nd:YAG laser, repetition rate 1 kHz) (Bruker Daltonics, Billerica, MA, USA)를 사용하여 측정하였다. Matrix는 α–cyano-4-hydroxycinamic acid를 사용하였으며, standard로는 calmix 2를 사용하였다.
모든 실험은 3회 반복한 평균치로 나타내었으며, 유의성 검증은 GraphPad Prism 5.0 for Window를 사용하여 ANOVA test로 검증한 후,
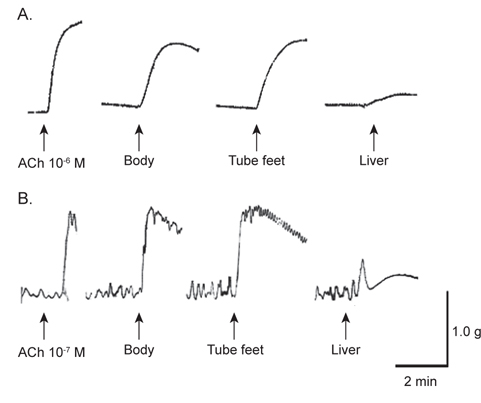
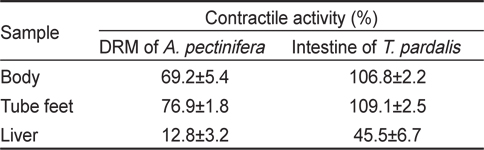
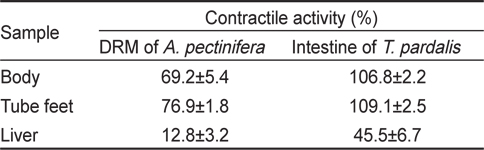
아무르 불가사리 초산추출물의 별 불가사리 DRM과 졸복 장관 평활근에 대한 수축활성을 측정하였다. 그 결과, 별 불가사리 DRM에 대해서 10-6 M ACh 투여군의 수축반응을 100%로 보았을 때, 아무르 불가사리 관족, 껍질 및 간 추출물 투여군 모두 수축 활성을 나타내었다(Fig. 1A, Table 1). 그 중에서 관족 추출물이 76.9%로 강한 수축반응을 나타내었으며, 껍질 추출물이 69.2%, 간 추출물이 12.8%의 순으로 활성을 나타내었다.
The contractile activity of various tissues' extracts of the starfish Asteria amurensis on the smooth muscle of the other organisms
다음으로 졸복 장관 평활근에 대해서 아무르 불가사리 추출물들의 수축활성을 조사하였다(Fig. 1B). 수축활성은 10-7 M ACh 투여군에서 일으킨 수축력을 100%로 하여 상대적인 수축력으로 계산하였다. 별 불가사리 DRM에 대한 반응 결과와 유사하게 졸복 장관 평활근에 대해서도 관족, 껍질 및 간 추출물들은 모두 수축 활성을 나타내었다. 관족 추출물은 109.1%, 껍질 추출물 106.8%, 간 추출물이 45.5%의 수축활성을 나타내었다. 따라서 이들 추출물 중 가장 큰 활성을 나타낸 관족 추출물을 이용하여 근 수축 활성 펩타이드를 정제하였다. 관족은 먹이사냥을 위한 이동 및 다른 물체의 표면에 부착하기 위한 도구로 사용될 뿐만 아니라 아가미의 보조역할의 기능도 지니고 있다. 이와 같은 관족의 움직임은 water vascular system (수관계)와 연관 되어 있어 수압에 의해 병낭(ampulla)이 받는 압력이 증가하면 병낭 근육이 수축되어 관족이 늘어나게 되고, 병낭 근육이 이완되면 관족은 짧아지게 된다. 아마도 이러한 역할을 담당하고 있는 관족이 다른 조직의 추출물보다 보다 다양한 종류의 신경전달물질을 내포하고 있기 때문에 관족 추출물에서 가장 큰 수축반응을 나타내는 것으로 사료된다.
>
별 불가사리 DRM에 대한 수축성 펩타이드의 정제 및 수축 활성 측정
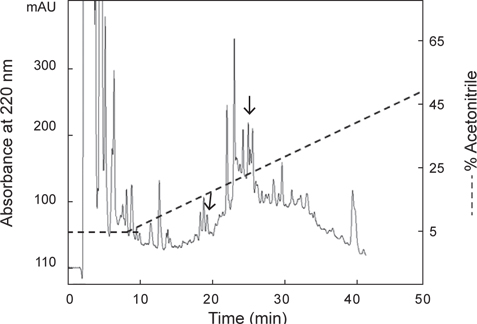
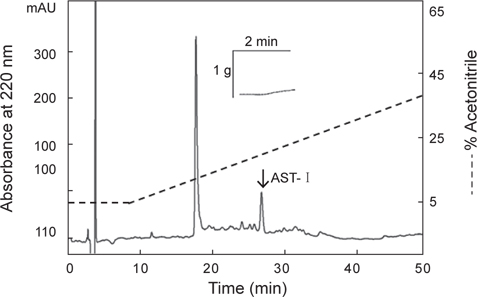
아무르 불가사리 관족 추출물을 정제하기 위해 먼저 CAPCELL PAK C18 column (4.6×250 mm, shishaido, Japan)을 이용하여 부분 정제하였으며, 분리된 분획들은 별 불가사리 DRM에 대해 수축활성을 측정하였다. 그 결과 column에 결합하는 성질을 갖는 두 분획물(약 19분대와 26분대 분획)에서만 수축활성을 나타내었으며(Fig. 2), 이들 분획물을 분리·정제하였다. 먼저 19분대 분획물은 동일한 C18 column에서 12→22% CH3CN의 농도 구배 조건으로 분리하였으며(Fig. 3), 약 13%와 15% CH3CN에서 2개의 물질을 분리하였다. 약 13%에 해당하는 분획은 별 불가사리 DRM에 대해 활성을 나타내지 않았으나, 15%에 해당하는 분획물은 활성을 나타내었다. 이 물질을 AST-I이라 명명하였다.
첫 번째 정제단계에서 26분대에 활성을 지닌 분획물을 정제하기 위해 크기별 제외 column (size-exclusion column) 인 superdex peptide HR 10/300 GL column (10×300 mm)을 사용하여 30% CH3CN에 등용매 조건으로 정제한 결과, 4개의 분획으로 분리되었다(Fig. 4A). 그 중에서 약 21분대 분획물에서 별 불가사리 DRM에 대해 수축활성을 나타내었다. 이 활성 물질은 최종적으로 동일한 C18 column에서 20→30% CH3CN의 농도구배 조건에서 정제하였으며, 약 22%에 해당하는 물질을 정제하였다(Fig. 4B). 이 물질을 AST-II라 명명하였다.
>
DTT 처리에 의한 disulfide 결합 확인 및 분자량 측정
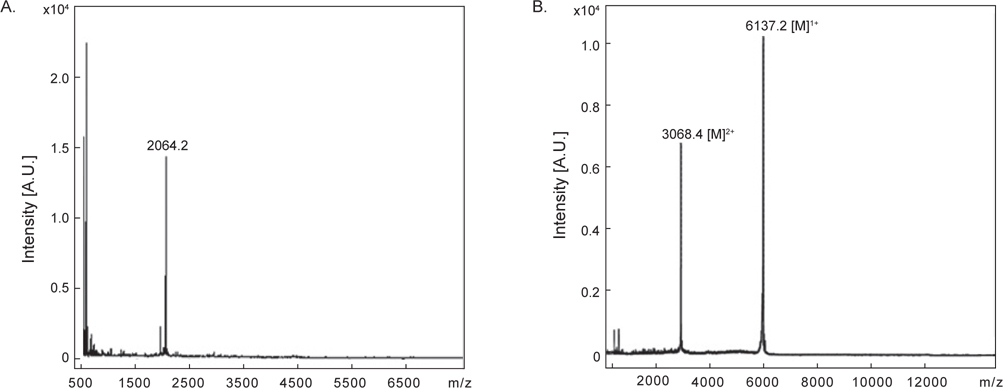
정제된 AST-I과 AST-II의 내에 disulfide (S-S) 결합 존재 유무를 확인하기 위해 DTT를 처리한 것과 처리하지 않은 물질을 CAPCELL PAK C18 column (4.6×250 mm)을 사용하여 각각 5→65% CH3CN (30 min)의 농도 구배 조건에서 분리하였다. DTT를 처리하지 않은 AST-I은 약 20분에서 peak가 용출되었다(Fig. 5A). 반면에 DTT를 처리한 AST-I의 경우는 약 10.1분과 14분에서 각각 DTT에 해당하는 peak가 나왔고, 약 32분에서 DTT에 의해 환원된 새로운 peak가 용출되었다(Fig. 5B). DTT를 처리하지 않은 AST-II은 약 26분에서 peak가 용출되었으며(Fig 5C), DTT를 처리한 AST-II의 경우는 AST-I과 같은 용출 시간대에 DTT에 해당하는 peak와 함께 약 31분대에 DTT에 의해 환원된 새로운 peak가 용출되어 나왔다(Fig. 5D). 이러한 결과는 AST-I과 AST-II의 일차 구조에 S-S 결합이 존재하므로 DTT에 의해 S-S 결합이 환원되어 천연물에 해당하는 물질은 양이 줄어들고 다른 물질이 형성되었음을 의미한다. 최종적으로 정제된 AST-I과 AST-II의 정확한 분자량을 측정하기 위해 MALDI-TOF mass spectrometer를 이용하여 분석하였다. 이들 물질의 분자량을 측정한 결과, AST-I은 2064.2 Da (Fig. 6A), AST-II는 6137.2 Da (Fig. 6B)로 나타났다. 이들 결과로부터 AST-I 및 AST-II는 S-S 결합을 포함하고 있으며, 각각 약 20개 및 약 55개 정도의 아미노산으로 구성된 물질로 추정할 수 있었다.
극피동물인 해삼(