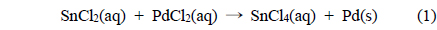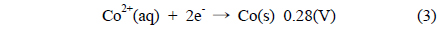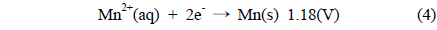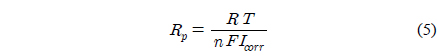The quaternary alloy (Co/Ni/P/Mn) coatings were prepared using electroless plating on the polypropylene. Compositions of the quaternary alloys (Co/Ni/P/Mn) were controlled by the amount of agents. The composition by EDS, morphology with SEM, film thickness, and surface electrical resistance of the samples were measured. Higher phosphorous content samples give larger electric resistance, thus a relationship is admitted between P content and electric resistance. The corrosivity of the coatings were evaluated by electrochemical methods in the 3.5 wt% NaCl and 5.0 wt% H2SO4 solutions, respectively. It was concluded that phosphorous addition enhances resistivity in the corrosion.
1946년 Brenner 와 Riddel에 의해 발견된 무전해도금은 우수한 마모저항 높은 경도, 부식저항, 우수한 전기적 성질 때문에 많은 연구자에 의해 연구가 이루어졌다 [1-10]. 무전해 Ni-P(니켈 - 인) 도금의 성질을 확장하기 위하여 다른 금속의 성분을 첨가하여 세가지 성분을 가진 무전해 도금에 관한 기술도 많이 이루어졌으며 세 번째 금속성분으로 텅스텐 [11], 크롬[12], 몰리브덴[13], 구리[14], 주석[15]등이 첨가되었다. 이외에도 4개의 성분을 가진 무전해 도금에 관한 연구도 이루어졌다 . 예를 들면 Ni-Sn-Cu-P[16], Ni-W-Cu-P[17], Fe-Mo- W-B[18], Ni-Re-P-Zn, Ni-Re-P-Sn, Ni-Re-P-W[19], Ni-Fe-P-B[20], Ni-Sn-Cu-P[21]이 있다. 희토류 금속은 도금의 성능에 비하여 매우 비싸 비경제적이다. 본 연구에서는 비용이 저렴하고 성능이 우수한 Co, Ni, P, Mn 등의 금속을 함유하는 4 성분의 금속코팅을 폴리머 표면에 도금하였다. 무전해 도금에 관한 많은 발표 자료에도 불구하고, 본 연구의 Co/Ni/P/Mn 을 폴리프로필렌 위에 도금한 결과는 아직 발견하지 못하였다. 본 연구에서는 이와 같은 4 성분계 (Co/Ni/P/Mn) 금속 도금에 대한 연구를 수행하기 위해 무전해 도금법을 이용하여 고분자 표면에 도금막을 형성하였다. 사용된 고분자는 상용 고분자인 폴리프로필렌을 사용하였으며, Co/Ni/P/Mn 도금막의 표면구조를 분석하기 위해 전자주사현미경 (scanning electron microscopy, SEM) 을, 성분분석을 위해 에너지 분산형 분 석기 (energy dispersive spectroscopy, EDS) 를 이용하였다. 또한 도금된 박막의 전기저항을 측정하였다. 또 부식성을 측정하기 위하여 3.5 wt% 의 NaCl(염화나트륨) 용액과 5.0 wt% 의 H2SO4(황산) 용액을 사용하여 전기화학적 방법으로 내식성을 측정하였다. 본 연구에서는 시약의 초기 조성을 달리함으로 도금되는 금속의 조성을 조절하였고, 이로 인해 부식저항과 전기저항 표면 모습이 달라짐을 확인하고 비교하였다
고분자 (폴리프로필렌) 표면에 금속을 도금하기 위해 전처리 과정을 실시하였다 . 먼저 고분자 표면에 부착된 유기불순 물을 제거하기 위해 Na3PO4(20 g) 와 Na2CO3(40g)을 1L의 증류수에 녹인 용액에 10시간 동안 교반 후 증류수로 세척하였다. 표면 식각 과정으로서 크롬산 용액 (CrO3 200g 과 95% H2SO4 200g 포함) 1L 에서 1시간 동안 식각 후 증류수로 세척하고, 고분자 표면에 존재하는 Cr6+를 제거하기 위해 95% 염산 용액으로 중화 처리하였다 . 그 이후 증류수로 세척하여 기본적인 폴리프로필렌의 샘플을 준비하였다.
도금을 실시하기 위해 고분자 표면에 촉매인 Pd를 흡착시키는 공정이 필요하다. 이를 위해 200g SnCl2와 95% 염산 100mL를 증류수와 혼합하여 총 1L의 용액을 만들고, 이 용액에 위에서 전처리된 고분자인 폴리프로필렌을 투입하여 교반한 후 증류수로 깨끗이 세척한다 . 이 과정에서 식각된 고분자 표면에 SnCl2가 흡착되게 된다. 다음에는 2.5g의 PdCl2와 95% 염산 25mL 에 증류수를 첨가하여 만들어진 1L의 용액에 앞서 SnCl2가 흡착된 고분자를 투입함으로써 표면에 Pd 금속촉매를 흡착시킨다 . 마지막으로 증류수 세척으로 마무리한다 . 이 때 주어지는 반응식은 다음과 같다 .
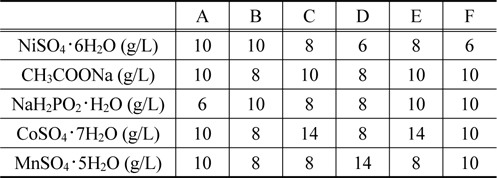
무전해 도금을 위해 도금욕조를 제조하였고, NiSO4・ 6H2O, CH3COONa, NaHP2O2・ H2O, CoSO4・ 7H2O, MnSO4・ 5H2O, 총 5가지 물질을 사용하였다 . 도금욕 조성은 Table 1에 나타내었 고 도금된 샘플을 차례로 번호를 붙여 샘플 A부터 샘플 F까지 6가지로 분류하였다 . 제조된 도금욕조에 Pd가 흡착 처리된 폴리프로필렌을 투입하여 48시간 동안 상온에서 무전해도금을 실시하였고, 도금된 폴리프로필렌은 증류수 세척과 건조를 거쳐 분석하였다 .
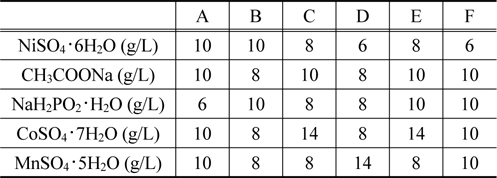
Bath compositions
무전해 도금을 통해 형성된 Co/Ni/P/Mn 도금막의 표면구조를 확인하기 위해 SEM (JSM-6390, JEOL) 을 사용하였다. 도금막의 두께는 도금하기 전의 금속과 도금후의 금속 무게 차이에 금속의 밀도가 8 g/cm3으로 가정하여 나타내었다. 도금된 Co/ Ni/P/Mn 박막의 전자파 차폐성능을 확인하기 위해 표면전기 저항을 CMT-100MP 를 사용하였다. 도금막의 성분분석에 사용한 검출기는 SDD Apollo XL 타입을 사용하였고, 해상도는 130.68 이다. 도금막의 용액안정성을 평가하기 위해 3.5 wt% 의 NaCl 전해질 용액과 5.0 wt% H2SO4용액에서 부식저항을 측정하였다. 사용된 기준전극은 Ag/AgCl 이었다. 측정방법은 3.5 wt% 의 NaCl 과 5.0 wt% 의 황산 용액속에서 각각 폴리프로필렌 위에 도금된 금속 Co/Ni/P/Mn 을 1 cm2의 크기로 하여 도선을 연결하고 부식저항을 측정하였다. 이 때 사용한 전기화학 측정 장치는 Solartron 1287 Potentio/Galvanostat 를 사용하였다.
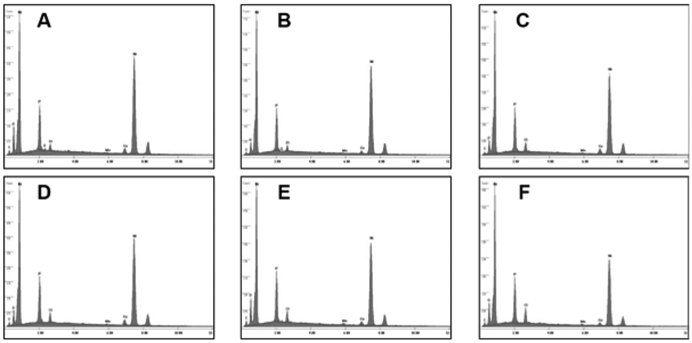
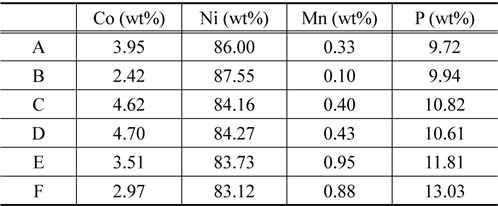
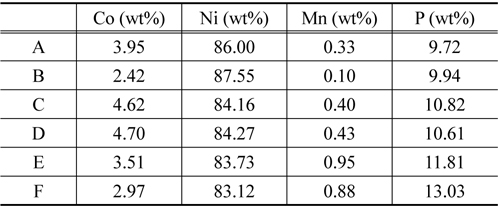
Figure 1은 도금된 샘플 A부터 샘플 F까지의 성분을 분석 하기 위해 측정된 EDS 결과이고, Table 2는 이를 정리한 것이다. Figure 1에서 x 축은 X-ray의 에너지 항을 나타내고, y 축은 counts 수가 나타나는데 이것으로 분석하는 시료의 조성을 알 수있다. 모든 샘플은 Co, Ni, Mn, P를 함유하고 있으며 함유비는 Table 2에서 볼 수 있다. 샘플의 종류에 따라 각 금속의 조성은 다른 것을 나타낸다. Ni 금속의 조성은 83% 이상으로 매우 높고, Co 금속의 조성은 2~5% 로 상대적으로 낮다. 그리고 Mn 금속의 조성은 앞의 두 금속에 비하여 매우 낮은데 0.1~1.0% 정도이다. 그리고 P의 조성은 9% 에서 13% 정도이다. 이러한 조성의 변화가 나타나는 것은 다음과 같은 이유에서이다. Mn의 금속은 표준 산화환원 전위가 매우 낮기 때문에 금속으로 존재하는 것보다 이온으로 존재하려는 경향이 높기 때문에 Mn 금속의 조성이 다른 금속의 조성과 비교하여 매우 적다. Ni, Co, Mn 금속의 표준 산화환원 전위 (V) 는 다음과 같다.
[Table 2.] Energy dispersive spectroscopy analysis of various Co/Ni/ P/Mn coatings
Energy dispersive spectroscopy analysis of various Co/Ni/ P/Mn coatings
위와 같은 표준 전위의 차이는 Ni와 Co는 평형상태에서 금속으로 존재할 수 있는 양이 많다는 것을 의미하고, Mn 금속은 환원될 확률이 낮아진다는 것으로 해석된다. 실제적으로 무전해 도금된 Mn 금속은 니켈이나 코발트에 비하면 조성이 낮은 것을 Table 2에서 볼 수 있다. 또 Table 2에서 Ni의 양은 매우 많고 Co의 양이 상대적으로 적은 것으로 나타난다. 이 것은 Onho[22]에 따르면 활성화 에너지의 차이 때문이다 . 코발트 의 경우는 활성화 에너지가 Ni에 비하여 두 배 정도 높은 것 으로 알려져 있다. 이러한 활성화 에너지의 차이는 반응속도에 영향을 미치고 반응속도의 영향은 Ni의 조성이 높고 Co의 조성이 낮은 이유가 된다. 그리고 P의 조성은 보통 환원제로 사용하기 때문에 항상 8~14%를 유지하는 것으로 나타난다 .
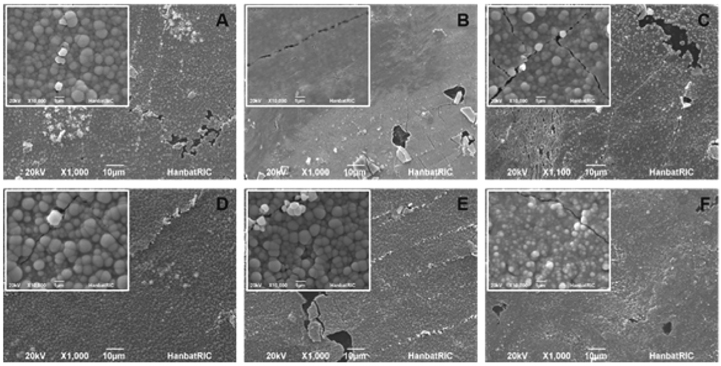
Figure 2는 6 가지 도금표면의 특성을 주사전자현미경(SEM) 으로 분석한 결과이다. 사진에서 보이는 것과 같이 샘플 A, C, D, E의 경우는 표면에 금속의 응집현상으로 인한 방울구조가 나타난 것을 확인할 수 있었고, 샘플 B와 F에서는 방울 구조가 두드러지지 않은 결과를 얻었다. 이와 같은 방울구조를 가지는 박막은 구조의 경계부분에서 도금이 일어나지 않고, 기판의 변형에 따라 파괴가 발생하는 문제를 야기한다. 이러한 이유로 샘플 B의 경우와 같은 표면이 균일한 도금이 형성되는 것이 물리적으로 우수한 특성을 가진다. 그리고 도금된 박막의 많은 파손이 관찰되었다. 이는 박막의 처리 후 이동 중에 발생한 휨과 같은 박막의 변형에 의한 파손으로써 도금 중에 발생한 것은 아닌 것으로 판단된다.
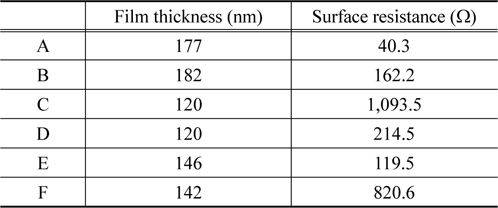
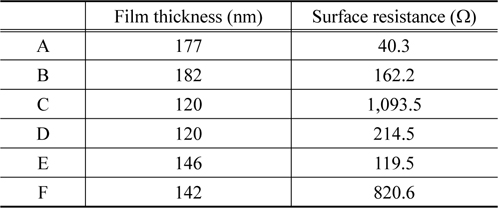
Table 3은 도금된 박막의 두께와 표면저항 값을 측정한 결과이다. 샘플 B의 박막두께가 가장 큰 값을 가지는 것을 확인 하였고, 샘플 C와 샘플 D는 120 nm 로서 가장 얇은 도금막이 형성되었다. 이러한 결과는 중요한 의미를 포함하고 있다. Figure 2에서 보인 SEM 데이터는 샘플 B를 제외하고 방울구조의 표면을 지니고 있었다. 방울구조 표면은 높이의 차이가 존재하는 구조로써 샘플 D의 경우 가장 높은 두께는 147 nm, 그리고 가장 얇은 부분은 63 nm 로 그 박막의 두께차이가 ± 84 nm 로서 큰 것을 확인하였다. 반면에 샘플 B 는 박막의 두께가 ±10 nm 의 오차를 지니는 균일한 표면구조를 지니고 있다. 폴리프로필렌 표면도금의 가장 중요한 활용분야인 전자 파 차폐효과를 확인하기 위해 표면저항을 각 샘플별로 측정하였다. 측정결과를 살펴보면 샘플 C와 샘플 F가 1,093.5 Ω과 820.5 Ω으로 가장 높은 값이 관찰되었고, 샘플 A에서 40.25 Ω 으로써 낮은 값을 보였다.
[Table 3.] Film thickness and surface resistance of quaternary coating films on polypropylene
Film thickness and surface resistance of quaternary coating films on polypropylene
또한 도금막의 표면균일도가 가장 우수한 샘플 B의 경우는 162.2 Ω 의 상대적으로 낮은 저항값을 확인하였다. 일반적으로 저항값이 낮은 경우 전기전도도가 높고, 이로 인해 전자파 차폐효과가 우수한 특성을 보인다. 즉 샘플 A의 경우가 가장 우수한 전자파 차폐효과를 지닐 것으로 보이며, 박막표면구조가 우수한 샘플 B도 상대적으로 우수한 차폐효과가 있을 것으로 예상된다. 그리고 내식성이 우수한 샘플 F는 전기저항도 높은 것으로 나타나있다. Table 3에서 샘플 C와 F의 표면 저항이 높은데 이것은 다른 샘플에 비하여 P의 함량 이 높은 것으로 내식성과 함께 전도성도 낮아지는 것을 알 수 있었다.
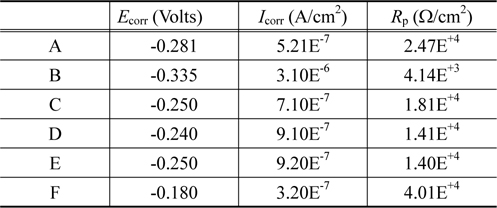
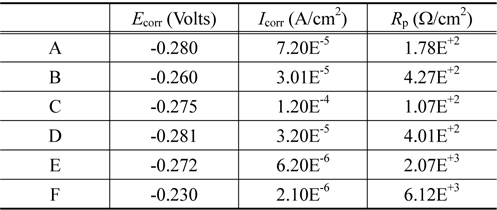
Figure 3에서(a)는 3.5 wt% NaCl 용액속에서 각각의 샘플의 Tafel plot 을 나타낸 것이고 (b)는 5.0 wt% 황산용액 속에 서의 결과를 나타낸 것이다. 그리고 Table 4는 Figure 3(a)를 이용하여 3.5 wt% NaCl 용액속에서 부식전류 (
여기서
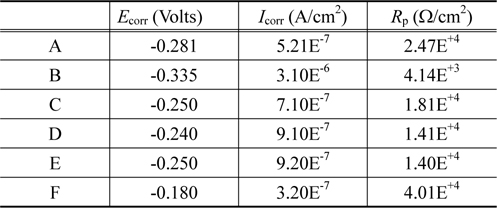
Corrosion potential Ecorr , corrosion current densityIcorr and polarization resistance Rp for samples in 3.5 wt% NaCl solution
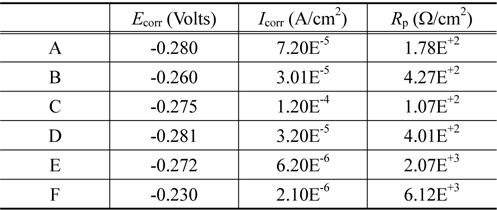
Corrosion potential Ecorr , corrosion current density Icorr and polarization resistance Rp for samples in 5.0 wt% H2SO4
무전해 도금방법으로 폴리프로필렌 위에 4가지 조성의 금속 Co/Ni/P/Mn 도금이 가능하였다. 도금욕조의 변화에 따라 도금조성이 달라지는 것도 확인할 수 있었다. 욕조에 들어가는 성분의 양에 따라 도금되는 금속의 조성이 비례하는 것은 아니었으나 Ni 은 전체적으로 높은 조성을 유지하였다. 투입 되는 화학 조성이 비슷할 때 도금되는 조성은 Ni이 가장 많고, P, Co, Mn 의 순서로 감소되었다. P의 함량이 높은 샘플은 분극곡선을 이용하여 용액에서 저항을 측정한 결과 소금과 황산용액에 대하여 부식저항이 가장 높았다. 도금의 조성은 복잡한 화학 반응으로 표준 산화환원 전위가 비슷함에도 불구하고 초기에 용액속의 조성이 비슷하지만 도금된 금속의 조성은 차이가 나는 것을 확인하였다.