In this study, PVC-LMO beads were prepared by immobilizing lithium manganese oxide (LMO) with poly vinyl chloride (PVC) diluted in dimethyl sulfoxide (DMSO) solvent on behalf of N-methyl-2-pyrrolidone (NMP). XRD analysis confirmed that LMO was immobilized well in PVC-LMO beads. The diameter of PVC-LMO beads synthesized by DMSO was about 4 mm. The adsorption experiments of lithium ions by PVC-LMO beads were conducted batchwise. The maximum adsorption capacity obtained from Langmuir model was 21.31 mg/g. The adsorption characteristics of lithium ions by PVC-LMO beads was well described by the pseudo-second-order kinetic model. It was considered that the internal diffusion was the rate controlling step.
최근 리튬은 배터리용 원료로써 뿐만 아니라 핵융합 발전용 연료로도 이용되면서 리튬에 대한 수요가 크게 증가할 것으로 예상되고 있다. 리튬의 육상 매장량은 약 1,400 만톤에 불 과하지만 해수에는 약 2.5 × 1014 kg 의 많은 양의 리튬이 존재하기 때문에 해수로부터 리튬을 회수하고자 하는 연구가 많이 이루어지고 있다[1].
액상으로부터 유용 금속을 회수 및 분리하기 위해서 주로 용매추출공정[2,3]과 흡착공정[4,5]이 사용되고 있다. 그러나 용매추출공정의 경우에는 많은 양의 유기 용매를 필요로 할뿐만 아니라, 유기 용매가 손실하게 되면 환경오염, 불쾌한 악취 및 화재의 원인이 된다[6]. 이에 비하여 흡착공정은 비교적 공정이 간편하고, 운전이 용이하기 때문에 유용금속의 회수 및 분리에 많이 사용되고 있으며[7], 활성탄[8], 제올라이트[9], 무기화합물[10,11] 등의 흡착제들이 많이 사용되고 있다. 이 중에서 무기화합물들은 큰 계면적과 미세다공성구조를 가지고 있기 때문에 금속이온에 대하여 흡착량이 높은 것으로 알려져 있다[12]. Pan et al.[10]은 인산 지르코튬 (zirconium phosphate, ZrP) 을 사용하여 Pb2+ , Zn2+ , Cd2+ 및 Ca2+ 를 제거하는 연구를 수행하였으며, Pena et al.[11] 는 이산화티타튬 (titanium dioxide, TiO2 ) 을 사용하여 As5+와 As3+를 제거하는 연구를 하였다. 본 연구자들은 선행연구[13]에서 리튬망간산화물 (lithium manganese oxide, LMO)을 합성하여 리튬이온을 흡착하는 연구를 수행하였으며 합성한 LMO는 리튬이온에 대하여 높은 선택성과 흡착능을 가지는 결과를 얻었다. 그러나 무기물 화합물중의 하나인 LMO는 일반적으로 미세한 분말 형태이기 때문에 공정에서 쉽게 유출될 수 있으며, 컬럼에 충전하여 연속식으로 운전하는 경우에는 압력강하가 생길 수 있다[14].
이러한 단점을 보완하기 위하여 최근에는 LMO를 한천[14], 키틴[15], 폴리염화비닐(poly vinyl chloride, PVC)[16,17] 등의 고분자를 사용하여 고정화하여 사용하고 있다. 이 중에서 PVC는 가격이 저렴하며, 높은 기계적 강도를 가지고 있을 뿐 아니라 산 / 알칼리나 용매에 대하여 내구성이 높고 투과플럭스가 높아, 멤브레인 등에 사용되고 있다[18]. Umeno et al.[16] 은 PVC를 디메틸 포름아미드 (dimethyl formamide, DMF)에 녹여 LMO를 멤브레인 형태로 고정화하여 사용한 경우에 리 튬이온 흡착량이 16 mg/g 이었다고 하였으며, Xiao et al.[17] 은 PVC를 노말 메틸 피로리돈 (N-methyl-2-pyrrolidone, NMP)에 용해시켜 LMO를 비드 형태로 고정화하여 사용한 경우에는 흡착량이 20.02 mg/g 이라고 하였다. 그러나 이들 연구에서 사용하고 있는 용매인 DMF와 NMP의 경우 반수치사량 (LD50)이 각각 2.8g [Rat] 및 7 g/Kg [Rat] 으로 독성이 높으며, 인체에 노출시에 시각장애, 발진, 중독 현상 등을 일으키는 것으로 알려져 있다[19,20].
따라서 본 연구에서는 LD50의 수치가 17 g/kg 으로 DMF나 NMP에 비해 독성이 낮은 다이메틸설폭시화물(dimethyl sul- foxide, DMSO)을 용매로 사용하여 PVC-LMO 비드를 합성하고, SEM과 XRD를 통하여 합성된 PVC-LMO 비드의 특성을 분석하였다. 또한 PVC-LMO 비드에 의한 리튬이온의 흡착 실험을 수행하고 , 등온 실험결과를 랭뮤어 (Langmuir) 등온식에 적용하여 고찰하였다. 아울러, 유사 2 차 속도식과 내부입자 확산식을 사용하여 흡착속도 해석을 하였다.
PVC 는 한화케미칼( 주 )의 KCM-12 를 사용하였으며, PVC를 녹이는 용매로 DMSO (Samchun, EP) 를 사용하였다. 실험에 사용한 리튬 이온 용액은 염화리튬(LiCl, Shinyo, EP)을 사용하여 1,000 mg/L 의 모액 (stock solution) 을 제조한 후 이를 희석하여 사용하였다 .
본 연구에서 사용한 LMO 는 선행연구[13]에서와 같은 방법으로 합성하였다. 탄산망간 (MnCO3, Samchun, EP) 1.67 mol 과 탄산리튬 (Li2CO3, Samchun, EP) 1.33 mol 을 20 mL 에탄올에 넣고 12 h 동안 혼합하였다. 70 °C 건조기에서 12 h 건조한 뒤 500 °C 전기로 (Thermolyne, F-62700)에서 4 h 동안 소성하여 LMO를 합성하였다.
PVC 1.22 g 을 DMSO 17 mL에 용해시킨 후 LMO 분말 5.0 g 을 넣고 균일한 슬러리가 되도록 충분히 혼합한 후 직경이 1 mm 인 실린지를 이용하여 증류수에 떨어뜨려 PVC-LMO 비드를 형성시켰다. 합성한 PVC-LMO 비드는 증류수로 수차례 세척한 후 0.5 M HCl 용액으로 24 h 동안 처리한 후 이를 세척하여 흡착제로 사용하였다. 합성한 PVC-LMO 비드의 특성분석 은 X 선 회절 분석기 (X-ray diffractionometer, XRD, D/MAX-2100H, Rigaku)를 사용하여 XRD 분석을 하였으며, 주사전자 현미경(scanning electron microscopy, SEM, XL20, Philips)을 이용하여 SEM 촬영을 하였다. 또한 BET (Brunauer-emmett- teller) 비표면 측정장치(Micromeritics, ASAP 2010) 를 사용하여 PVC-LMO 비드의 비표면적과 기공부피를 측정하였다.
리튬이온 흡착실험은 회분식으로 진행하였다. 500 mL 삼각플라스크에 일정농도의 리튬이온 용액 200 mL 와 흡착제를 투입하고 수평진탕기 (Johnsae co. Js-Fs-2,500) 를 사용하여 교반하면서 일정시간 간격으로 시료를 채취하였다. 채취한 시료를 원심분리기(Eppendorf, centrifuge 5415c)로 10,000 rpm 에서 5 분간 원심 분리한 후 상등액을 취하여 이온크로마토그래피 (ion chromatography, IC, Dionex, DX-120) 를 사용하여 리튬이온의 농도를 분석하였다. 선행연구[13]에서 LMO로 리튬이온을 흡착시키는 경우에 적정 pH 는 10 으로 나타나 용액의 pH 를 10으로 조절하여 실험을 행하였다.
흡착제에 흡착된 리튬이온의 흡착량은 아래 식을 이용하여 계산하였다 . 여기서 qt는 t에서의 리튬이온의 흡착량 (mg/g), C0는 초기 리튬이온의 농도 (mg/L), Ct는 t시간 후의 리튬이온의 농도 (mg/L)이며, V는 리튬이온 용액의 부피(L), W는 사용한 흡착제의 양(g)이다.
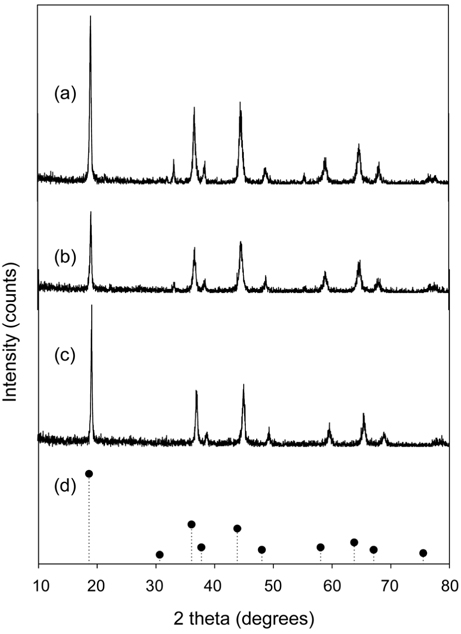
합성한 LMO, PVC-LMO 비드와 산 처리한 PVC-LMO 비드의 XRD 분석 결과를 Figure 1에 나타내었다. Figure 1(a)는 LMO의 XRD 측정결과를 나타낸 것으로 , 2 θ 값이 18.78, 36.52 및 44.48에서 회절 피크가 관측되었다. 관측된 각각의 회절 피크는 리튬이 4면체 위치하고, 망간이 8면체 위치에 존재하여 형성된 (111), (311) 및 (400)의 LMO의 스피넬 결정면을 나타낸다[21]. Figure 1(b) 의 PVC-LMO 비드의 경우에도 이와 유사한 피크가 관측되었으며, 이로부터 LMO를 PVC를 이용하여 고정화한 후에도 LMO의 특성을 유지하는 것을 확인할 수 있었다. 이와 마찬가지의 결과가 Figure 1(c) 의 산 처리한 PVC-LMO 비드에서도 관측되었으며, PVC-LMO를 산 처리한 경우에도 스피넬 구조가 유지되는 것이 확인되었다.
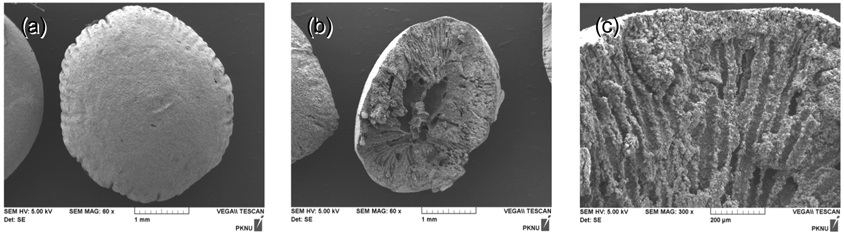
Figure 2는 합성한 PVC-LMO 비드의 SEM 찰영한 결과이다. Figure 2(a)에서 보는 것과 같이 PVC-LMO 비드는 직경이 약 4 mm 인 구형으로 형성되었다. Xiao et al.[16] 이 NMP 를 용매로 사용하여 제조한 PVC-LMO 비드의 직경이 3.1 mm 인 것과 비교해보면 본 연구에서 용매를 DMSO로 사용한 경우의 입자의 크기가 다소 크게 형성되었다 . Figure 2(b)는 PVC- LMO 비드의 절단면을 60배 배율로 SEM 찰영한 것이며, Figure 2(c) 는 이를 300배율로 확대한 것이다. SEM 사진에서 보듯이 내부에는 LMO가 잘 고정화되어 있으며 , 다공성구조 를 가지는 것으로 나타났다. 이는 PVC-LMO 비드 제조시에 LMO 가 분산된 고분자 용액을 물에 떨어뜨리면 물과 접촉한 면이 먼저 경화되고, 경화된 외벽을 통해 물이 유입되어 내부의 DMSO 가 물에 용해되어 나감에 따라 PVC-LMO 비드의 내부는 용액의 유통이 원활한 다공성 구조가 형성된 것으로 생각되었다.
PVC-LMO 비드의 BET 측정을 통해 얻어진 비표면적은 30.43 m2/g, 기공부피는 0.7724 cm3/g이었다. Xiao et al.[17]이 NMP를 용매로 사용한 경우에 PVC-LMO 의 비표면적은 33.65 m2/g으로 본 연구의 결과와 유사하였다.
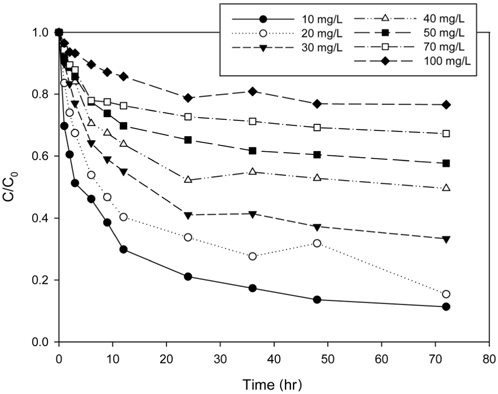
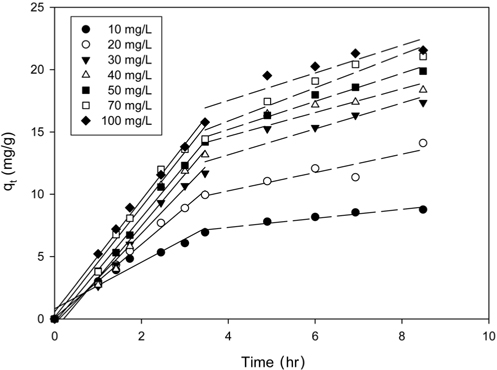
Figure 3은 리튬 이온의 초기농도를 10~100 mg/L 로 달리한 경우에 PVC-LMO 비드에 의한 리튬이온의 시간에 따른 리튬이온 농도변화를 나타낸 것이다. 그림에서 보는 바와 같이 흡착이 시작된 후 초기 12 h까지는 급격한 농도 변화를 보이다가 차츰 완만해져 72 h에 평형에 도달하였다. 이러한 현상은 일반적으로 흡착의 초기단계에서는 흡착제에 비어 있는 활성점들이 많아 쉽게 흡착이 일어나지만, 시간이 경과함에 따라 비어있는 활성점들이 점차 감소하면서 흡착의 후반부 단계에서는 흡착이 느리게 이루어지기 때문인 것으로 사료된다[21]. Xiao et al.[17] 이 NMP (N-methyl pyrolidone)를 용매로 사용하여 합성한 PVC-LMO 비드의 리튬 이온의 흡착 평형 시간도 72 h으로 본 연구에서 DMSO를 용매로 사용하여 합성한 경우와 유사하였다.
등온흡착실험 결과로 얻어진 실험자료를 Freundlich 흡착 등온식과 Langmuir 흡착 등온식에 적용하여 검토하였다.
Fruendlich 흡착 등온식은 아래와 같이 표현된다. 여기서 kF는 Freundlich 상수 (L/mg)이며, Ce는 평형 흡착농도 (mg/L), qe은 평형 흡착량 (mg/g) 그리고 1mg/n 은 흡착강도를 나타내는 상수이다.
Langmuir 흡착 등온식은 아래와 같다. 여기서 kL은 Langmuir 상수(L/mg) 그리고 qm은 최대 흡착량 (mg/g)이다.
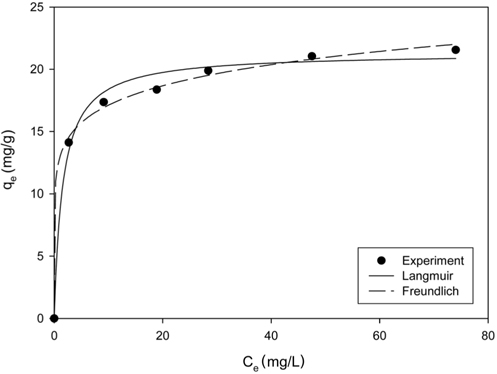
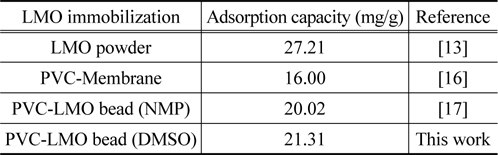
Figure 4는 평형흡착 실험에서 얻은 결과와 식 (2)및 (3)에 적용하여 구한 결과를 비교하여 나타낸 것이다. Freundlich 흡착 등온식에 적용한 경우에 결정계수 (r2) 값은 0.9719이었으며, Langmuir 흡착 등온식의 경우에는 0.9868로 Langmuir 흡착 등온식에 더 잘 만족하는 것으로 나타났으며, Langmuir 흡착 등온식부터 구한 최대 흡착량은 21.31 mg/g 이었다. 또한, Table 1에서 LMO 분말을 PVC로 고정화한 다른 연구들과 비교해 볼 때, 본 연구에서 DMSO를 용매로 사용하여 합성한 PVC-LMO 비드의 경우에 리튬이온의 흡착량이 LMO 분말을 사용한 경우보다는 낮지만 LMO 분말을 PVC로 고정화하여 멤브레인으로 만든 경우나 NMP 를 용매로 사용하여 제조한 비드의 경우에 비해서는 다소 높은 결과를 보였다.
[Table 1.] Comparison of adsorption capacity by different adsorbents
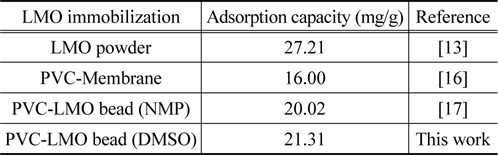
Comparison of adsorption capacity by different adsorbents
흡착 속도론적 연구는 고 - 액경계면에서 흡착제에 대한 흡착질의 제거 속도를 설명하며, 흡착반응의 반응 경로와 메커니즘을 예측할 수 있어 흡착 공정설계에 있어서 중요한 요소이다.
유사 2차 속도모델식은 다음과 같이 정의된다[21].
여기서 k2는 유사 2차 속도식의 속도상수 (g/mg·h)이다.
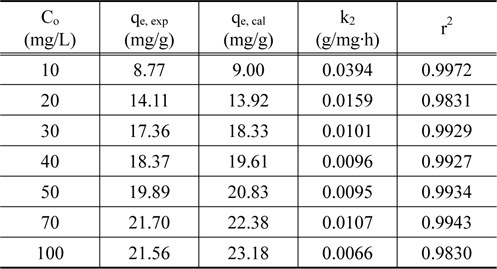
Figure 3의 흡착 실험 자료를 식 (4)에 적용하여 구한 파라미터값들을 Table 2에 나타내었다. Table 2에서 보면 유사 2차 속도식의 r2 값은 0.9830~0.9972로 나타나 유사 2차 속도식에 잘 만족하였다.
[Table 2.] The pseudo-second-order parameters
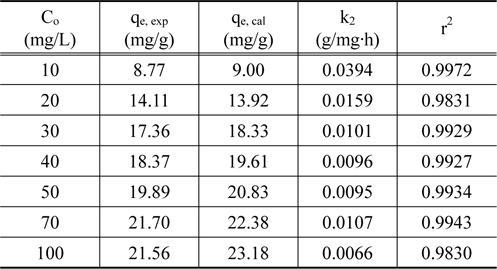
The pseudo-second-order parameters
내부입자확산 모델식은 다음과 같다[22]. 여기서 , Kid는 세공 내 확산속도상수이다.
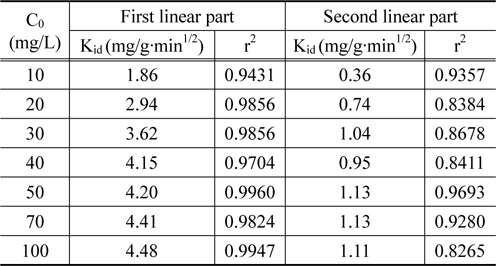
Figure 5는 Figure 3의 실험데이터를 식 (5)에 적용한 결과를 나타낸 것이며, 이로부터 얻어진 파라미터 값들을 Table 3에 나타내었다 . 그림에서 보는 바와 같이 3.5 min1/2를 전후로 하여 직선의 형태가 이원화되어 나타났다. Hamdaoui et al.[23]의 연구에 의하면 첫 번째 직선은 액체의 외부물질전달에 의한 것이고, 두번째 직선은 내부입자확산에 의해 흡착이 일어났다고 하였다. Table 3에서 보는 바와 같이 첫 번째 직선으로부터 얻은 속도상수는 1.86~4.48 mg/g·min1/2인데 비해 두번째 직선 구간에서의 속도상수는 0.36~1.13 mg/g·min1/2로 두 번째 구간의 속도상수가 약 4~6 배 정도 낮은 값을 나타내었다. 이는 PVC-LMO 비드에 의한 리튬이온의 흡착시에 외부물질전달단계는 매우 빠르게 이루어지며, 내부입자확산에 의한 흡착반응은 느리게 진행되는 내부입자확산 단계가 흡착속도 결정단계인 것으로 사료된다.
[Table 3.] Parameters of internal diffusion model
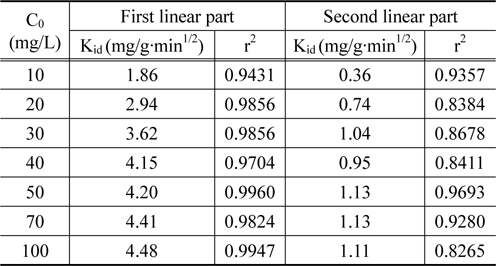
Parameters of internal diffusion model
NMP를 대신하여 독성이 낮은 DMSO을 용매로 사용하여 PVC-LMO 비드를 합성하였으며, XRD 분석을 통해 LMO가 잘 고정화된 것을 확인하였다. 합성한 PVC-LMO 비드의 크기는 4 mm 로 NMP로 합성한 PVC-LMO 비드직경에 비해 다소 크게 형성되었으며, 비표면적은 30.43 m2/g 로 NMP로 합성한 PVC-LMO 비드와 유사하였다. 흡착 평형 실험 자료는 Langmuir 흡착 등온식에 잘 적용되었으며 , 흡착속도는 유사 2차 속도모델식에 가장 잘 부합하였다. 또한 내부입자확산 모델식을 적용한 결과 내부입자확산 단계가 흡착속도 결정단계인 것으로 나타났다. 리튬이온 흡착량은 21.31 mg/g 으로 NMP로 합성한 PVC-LMO와 흡착량이 유사하였으며, PVC- LMO 비드 제조시 독성이 높은 NMP를 대신하여 DMSO를 사용하여도 흡착량의 차이는 거의 없는 것으로 나타났다.