In this study, the effect of alkanolamine additives, 2-amino-2-methyl-1-propanol (AMP) and 2-amino-2-methyl-1,3- propanediol (AMPD) on CO2 absorption rate of K2CO3 solution and the formation of KHCO3 crystals was investigated. The normalized CO2 flux and the equilibrium CO2 partial pressure were measured for 5 wt% additives and 30 wt% K2CO3 mixtures using a wetted-wall column unit at 40 °C and 60 °C . Both additives showed the increased CO2 absorption rate and lowered the equilibrium CO2 partial pressure acting as promoters. Besides, AMPD which has two hydroxyl groups enhanced the formation of KHCO3 solid product separated from the CO2-rich solution from the results of batch cooling crystallization experiments.
이산화탄소는 기후변화를 일으키는 주요 온실가스로 알려져 있으며 , 화력발전소가 주된 대량 배출원이다 . 화력발전소에서 연소후 배출되는 이산화탄소를 포집하기 위해 , 습식흡수 , 흡착 , 막분리등 여러기술에 대한 연구가 활발히 진행되고 있다 [1,2]. 습식 흡수법은 아민 , 암모니아수 , 탄산칼륨 (K2CO3 ) 수용액등 알칼리성 흡수액을 이용하여 산성가스인 이산화탄소를 화학반응에 의해 포집하는 기술로써 , 대량의 이산화탄소를 포집하는데 유리하여 기초 및 공정연구가 활발히 진행 중에 있다 [3,4]. 이 중 K2CO3 흡수액은 흡수제의 가격이 아민에 비해 저렴하고 , 증발에 의한 흡수제 손실이 없으며 열화학적 안정성이 우수한 장점이 있다 . 또한 , 이산화탄소와 아민에 의한 카바메이트(carbamate) 생성반응이 아닌 , 탄산(bicarbonate, HCO3-) 의 생성반응이 주반응이므로 재생에너지가 낮다 . 이러한 이유로 K2CO3 흡수액을 연소후 이산화탄소 포집공정에 사용하는 것에 대한 많은 연구가 보고되고 있다 [5,6].
이와 같이 K2CO3 흡수액등을 이용하는 습식흡수법은 이산화탄소를 흡수한 흡수액을 재사용하기 위해 고온 탈거공정이 필수적이다 . 그러나 대량의 수용액을 고온의 탈거탑에서 재생하여야 하므로 , 현열 및 물의 잠열등에 소요되는 에너지가 높은 단점이 있다 [7,8]. 따라서 이산화탄소 포집공정 비용을 저감하기 위해 대량의 흡수액을 재생하는 대신 , 이산화탄소를 많이 포함하는 일부 흡수제만을 선택적으로 분리하여 재생하는 연구들이 최근 제안되고 있다 . Hu[9] 는 아민과 알콜 계 용매의 혼합 흡수제를 이용하여 이산화탄소를 많이 포함하는 용액을 분리하여 재생한 결과에 대해 보고한 바 있다 . Lu[10] 와 Kohe et al.[11] 은 K 2 CO 3 흡수액을 이용하여 이산화탄소를 많이 포함하는 고체염을 수용액으로부터 분리하여 재생하는 방법에 대해 보고한 바 있다 . 이들 방법은 이산화탄소를 포함하는 고체염의 결정화공정과 고체-액체 분리공정 개발을 통해 , 재생탑으로 유입되는 물의 양을 낮춤으로써 흡수액의 현열과 증발잠열이 저감된 저비용 포집공정을 구현할 수 있을 것으로 예상되고 있다 .
암모니아수와 K2CO3 흡수액은 고농도로 사용할 경우 흡수 온도 미만에서 탄산염이 석출되는 특징이 있다 . 예를 들어 , K2CO3 는 이산화탄소를 흡수하면 용액 중의 탄산 (carbonate, CO32-) 이 중탄산으로 전환되면서 중탄산칼륨 (KHCO3 ) 의 형태로 존재하는데 , 온도가 낮아지면 용해도 감소에 의해 KHCO3 결정이 석출된다 .
KHCO3는 K+ 1몰당 1 몰의 이산화탄소를 포함하고 있으므로 , K2CO3에 비해 2배의 이산화탄소 로딩값을 갖는다 . 중탄산 고체염을 액상 흡수액으로부터 선택적으로 분리하면 , 물의 양이 적고 이산화탄소 로딩이 높은 고농도 슬러리를 얻을 수 있다 [11,12]. 따라서 다량의 물을 포함하는 흡수액 대신 이산화탄소를 많이 함유한 소량의 슬러리만을 탈거탑에서 재생함으로써 , 물의 증발잠열과 흡수액 가열에 따른 현열을 낮출 수 있어 유리하다 . 탈거탑에서 다량의 이산화탄소를 회수하기 위해서는 흡수액으로부터 중탄산염을 다량으로 생성시켜야 하며 , 이를 위해 30~40 wt% 이상의 고농도 K2CO3 흡수액을 사용하여 과포화도를 높이는 것이 필요하다 . 한편, 중탄산염의 용 해도는 냉각시 크게 감소하는 특징이 있다 [13]. 따라서 60~70 °C 에서 운전되는 흡수탑에서는 흡수액이 액상으로 존재하지만 , 흡수탑에서 배출되는 흡수액을 상온 -35 °C 로 냉각시키면 중탄산염 고체를 포함하는 슬러리 용액을 만들 수 있다 . 즉 , 냉각결정화를 이용하여 이산화탄소를 많이 포함하는 고체염과, 이산화탄소를 적게 포함하고 물을 많이 포함하는 액체로 상분리가 가능하다 [10,12]. 이 중 물을 많이 포함하는 흡수액은 흡수탑으로 재순환되고 , 생성된 고체염은 탈거탑에서 이산화탄소를 분리하고 흡수전의 이산화탄소가 적게 포함된 상태로 재생시켜 흡수액으로 재사용된다 .
KHCO3는 냉각에 따른 용해도가 크게 감소하여 온도에 따라 염석출량을 제어할 수 있는 장점이 있으나 , K2CO3 흡수액의 이산화탄소 흡수속도가 흡수공정으로 적용하기에 느린 단점이 있다 [13,14]. 이를 극복하기 위해 15~35 wt% K2CO3 수용액에 10 wt% 이하의 다양한 아민 또는 무기물 첨가제를 혼합하여 흡수속도를 향상시키는 방법에 대해 보고되어 왔다 . Mahajani and Danckwerts[15] 는 교반셀 흡수장치를 이용하여 30 wt% K2CO3에 대해 1 wt% 디에탄올아민 (diethanolamine, DEA), 모노에탄올아민 (monoethanolamine, MEA) 등의 첨가제 혼합에 의해 흡수속도가 향상됨을 실험적으로 제시하였다 . Cullinane and Rochelle[16] 은 wetted-wall column 을 이용하여 20 wt% K2CO3에 대해 0.6 m piperazine 의 혼합으로 흡수속도 향상을 확인하였다 . Thee et al.[17] 은 0.2~1.5 M 붕산을 이용하여 30 wt% K2CO3의 흡수속도 향상 가능성에 대해 보고하였다 . Yoon et al.[18] 은 교반셀 장치에서 15~20 wt% K2CO3에 대해 피페 라진 (piperazine) 과 2- 메틸 피페라진 (2-methylpiperazine) 에 의한 흡수속도 증가에 대해 발표하였다 . 또한 , Shen et al.[19] 은 아미노산과 실리케이트 등의 무기물에 의한 흡수속도 촉진 결과 에 대해 보고한 바 있다 . 그러나 대부분의 연구가 30 wt% 이하 K2CO3에서 1차 또는 2차 아민의 혼합에 대한 것이며 , 고농도 K2CO3 흡수액에서 입체장애 알카놀아민에 의한 흡수속도 향상에 대해서는 연구된 바가 적다 . 또한 , 흡수액으로부터 중탄산 고체염을 분리시킬 목적으로 알카놀아민계 첨가제들이 고체염 생성에 미치는 영향에 대한 연구는 보고된 바가 없다.
따라서 본 연구에서는 대표적인 입체장애 알카놀아민계 첨 가 제인 AMP 와 AMPD 가 K2CO3 흡수액의 이산화탄소 흡수속도 와 중탄산칼륨 고체염의 석출에 미치는 영향에 대해 고찰하 였 다 . 이를 위해 wetted-wall column 을 이용하여 고농도 (30 wt%) K2CO3 흡수액의 이산화탄소 흡수속도와 평형분압을 측정하였 고, 첨가제, 흡수온도 및 흡수액의 로딩 ( 또는 CO32-가 HCO3-로 전환된 정도, CTB 전환율 ) 등의 조건에 대해 비교하였다 . 또한, 회분식 결정화기를 이용하여 첨가제를 포함하는 흡수액을 냉각 결정화시켜 중탄산칼륨 고체염의 생성량을 측정함으로 써, AMP와 AMPD가 중탄산염 결정화에 미치는 영향에 대해서도 검토하였다 .
첨가제가 포함된 흡수액에 대해 wetted-wall column을 이용하여 , 온도 및 CTB 전환율 (CO32-가 HCO3-로 전환된 정도) 조건에 대한 물질전달계수를 구함으로써 이산화탄소 흡수속도를 비교하였다 . 일반적으로 이산화탄소 플럭스 (NCO2) 는 단위 면적 및 단위시간당 이산화탄소가 흡수 또는 탈거된 몰 수를 의미한다 . 플럭스는 아래의 식과 같이 평형분압 (PCO2*) 및 흡수 전후 이산화탄소 분압의 로그평균 (PCO2,lm )의 차이와, 총괄 물질전달계수의 곱으로 나타낼 수 있다 [20].
위 식에서 이산화탄소 분압이 평형분압에 가까울 때 플럭스가 0 이 되는 흡수액의 PCO2* 를 구할 수 있다 . 한편, 플럭스가 크면, 총괄물질전달계수 (KG)를 보다 정밀하게 계산할 수 있다 . 따라서 평형분압 보다 높은 이산화탄소 분압 범위에서, 식 (3) 과 같이 유입 또는 유출되는 이산화탄소 분압과 평형분압의 차에 대한 로그평균인 (PCO2-PCO2*)lm 과 플럭스의 관계로 부터 KG를 얻을 수 있다 [16].
한편, 기상 격막의 물질전달계수 (kg) 는 Bishnoi[21] 가 0.1 M NaOH 에 대한 SO2의 흡수에 대해 wetted-wall column 실험에서 도출된 아래의 상관관계로부터 구할 수 있다 . 여기서 d와 h는 각각 컬럼의 수력학적 지름과 높이이다 . 그리고 Reynolds 수, Schmidt 수, Sherwood 수는 다음과 같이 표현될 수 있다. 여기서 , kg , DCO2,
일반적으로 이산화탄소가 흡수액으로 흡수되는 과정은 액상의 물질전달이 중요한 영향을 미친다 . 따라서 본 연구에서는 각 첨가제가 혼합된 흡수액에 대해 kg' 를 구함으로써 첨가제 혼합 흡수액의 흡수속도에 대해 비교하고자 하였다 .
이산화탄소 흡수액은 K2CO3 (Samchun, 99%) 와 KHCO3(Samchun, 99%) 을 증류수 (18 M Ω) 에 혼합하여 제조하였다. 혼합 용액의 탄산 이온의 중탄산 이온으로의 전환정도를 나타내기 위해 탄산-중탄산(carbonate to bicarbonate, CTB) 전환율([HCO3-]/{[CO32-]+[HCO3-]} × 100%)을 이용하였다. 여기서 전환율은 이산화탄소 로딩과 비례하며, K2CO3만 혼합되었을 때 CTB 전환율은 0% 이고, KHCO3만으로 존재할 때 CTB 전환율은 100%에 해당된다 . 실험에 사용된 흡수액의 전환율은 10, 20, 30, 40%이며 , 이산화탄소가 희박한 흡수탑으로 유입되는 흡수액의 로딩 범위에 해당된다. K2CO3 흡수액의 농도는 용액 중의 KHCO3가 모두 K2CO3로 존재할 경우로 가정되는 30 wt% 상당 (equivalent)의 농도로 선택하였다. K2CO3 상당 wt% 를 이용함으로써 , CTB 전환율에 따라 물과 CO32-의 양이 변화하여도 , 용액 중의 K+ 양은 일정하게 유지시켰다 . 한편 , 흡수속도 향상을 위해 도입한 입체장애 알카놀아민 첨가제를 K2CO3 흡수액에 혼합하여 준비하였다 . 사용된 첨가제는 AMPD (TCI, 98%, 105.14 g/mol), AMPD (TCI, 98%, 105.14 g/mol) 등 입체장애 알카놀아민을 선택하였다. 첨가제는 5 wt% 로 첨가하였고, 혼합한 첨가제의 양 만큼 흡수액에서 물을 미리 제거하여 준비하였다.
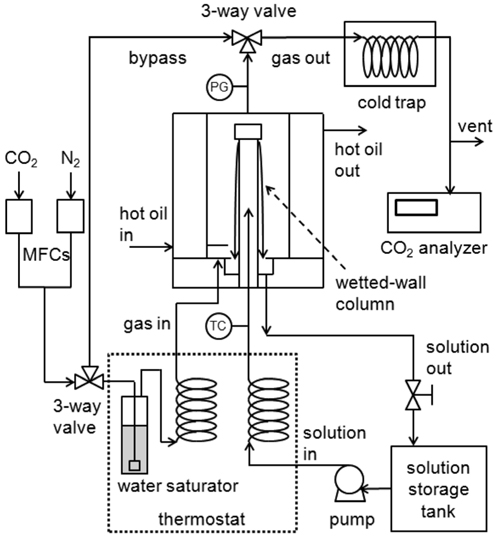
Figure 1 에 이산화탄소 흡수속도를 측정하기 위한 wetted- wall column 장치의 개략도를 나타내었다. 스테인레스 재질의 원통형 컬럼 상부는 덮개로 덮혀 있으며, 지름은 1.27 cm 이고 , 높이는 11 cm 이므로 흡수액이 기체와 접촉하는 면적은 43.9 cm2 으로 계산된다. 컬럼은 외부 항온순환조에 의해 온도가 일정하게 유지되는 이중유리관 내에 위치하며, 이중유리 관의 내경은 6 cm 이다. 혼합된 흡수액은 실험온도로 유지된 저장용기 내에 보관하였고, 정량펌프를 이용하여 150 mL/min 의 유속으로 컬럼 내부로 이송시켰다. 이때 컬럼으로 주입하기 전 항온조를 거침으로써 온도를 실험온도 (40, 60 °C) 로 유지시켰고, 용액의 온도는 컬럼 내부의 열전쌍 (T-type)으로 확 인하였다 . 컬럼을 통과하여 컬럼 벽에서 격막을 이룬 뒤 컬럼 외부로 배출되는 용액은 저장용기로 순환시켰다.
이산화탄소(99.9%) 와 질소(99.9%)를 질량유량계(mass flow controller, MFC, Brooks, 5850E) 로 혼합하여, 총유량 2,000 mL/min 의 혼합가스 (0~15% CO2/N2) 를 만들었다. 실험 범위의 온도에서는 시간에 따라 흡수액의 수분이 증발하여 손실될 수 있으므로, 이를 억제하기 위해 실험온도의 증류수와 기포기를 이용하여 혼합가스에 수분을 포화시켜 공급하도록 하였다. 준비된 혼합가스는 실험온도 이상으로 가열시켜 수분의 응축이 일어나지 않도록 하였고, 이중반응관 하부를 거쳐 기체 분산판을 이용하여 균일하게 주입시켜 컬럼의 흡수액과 접촉 시키도록 하였다. 이때 이중유리관 내의 압력은 상압으로 유지하였다. 흡수반응 후 이중유리관을 거쳐 배출되는 혼합가스는 약 -15 °C 로 유지되는 콜드트랩을 거치도록 하였다. 혼합가스의 농도는 적외선 분광방식의 이산화탄소 분석기 (CO2 analyzer, CA, Fuji Electric, ZRJ, 0~2 및 0~20% CO 2 범위)를 이용하여 실시간으로 측정 및 기록하였다. 이때 이산화탄소 분석기는 1.8 및 18% 의 이산화탄소/질소 혼합가스를 이용하여 교정 후 사용하였다 .
CTB 전환율과 첨가제 종류별로 준비된 혼합 흡수액을 실험온도 (40, 60 °C)로 유지된 흡수컬럼에 주입시켜 안정한 격막이 형성되도록 하였다. 이산화탄소/질소 혼합가스는 흡수컬럼에서 우회시켜 먼저 이산화탄소 농도 (P CO2,in)를 확인하였다. 다음으로 3-way 밸브를 조작하여 흡수컬럼으로 혼합가스를 주입시켜 격막과 접촉하도록 하였다. 이때 배출되는 기체의 이산화탄소 농도를 확인하면서 안정화될 때의 농도 (PCO2,out)를 기록하였다. 다른 이산화탄소 농도에 대해서도 흡수 전후의 이산화탄소 분압을 측정하였다[16].
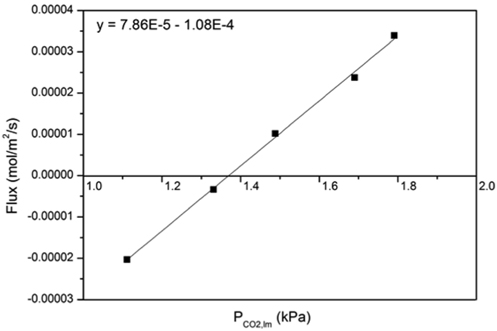
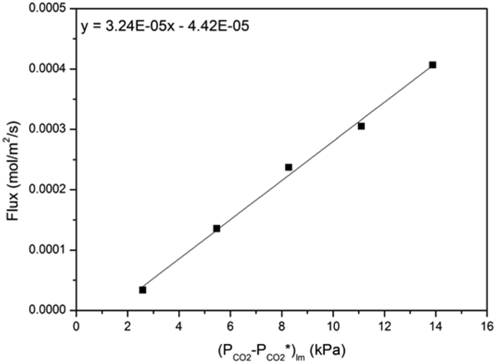
먼저 평형에 가까운 약 0.3~3% 의 저농도 이산화탄소 범위에서 각 온도 및 CTB 전환율에 대한 흡수제의 이산화탄소 평형분압 (PCO2*)을 구하였다. 이를 위해 기상 이산화탄소가 액상으로 유입되거나 유출된 플럭스 (NCO2) 를 구한 뒤, 식 (2) 을 통해 선형 회귀분석으로 계산된 절편에서 이산화탄소 평형분압을 구하였다. Figure 2 에 40% 의 CTB 전환율과 30 wt% K2CO3 흡수액에 대해 40 °C 에서의 평형분압을 구하는 방법을 나타내었다. 여 기서 평형분압은 x 축 절편에 해당되며, 1.37 kPa 로 계산된다 . 한편 , 총괄물질전달계수 (KG) 는 평형분압 보다 큰 고농도 이산화탄소 범위 ( 약 1~9%) 에서 플럭스를 구하여 식 (3) 과 같이 선형회귀분석을 하여 기울기로부터 구하였다. Figure 3 에 나타낸 예시에서 KG는 3.24 × 10-5 mol/kPa/m2/s 으로 나타났다. 이와 같이 선형 회귀분석으로 계산된 KG와 식 (4)~(7) 로부터 계산되는 kg를 이용하여, 정규화된 플럭스 (kg') 는 식 (9)에 의 해 3.32 × 10-5 mol/kPa/m2/s 으로 계산되었다.
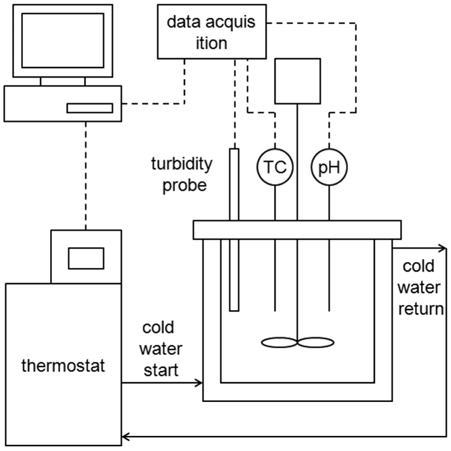
이산화탄소를 다량 포함하는 흡수액의 냉각시 석출되는 중 탄산염의 석출량을 측정하기 위해 회분식 냉각결정화기를 사용하였다. Figure 4 에 나타난 것과 같이, 결정화기는 이중자켓의 유리재질로서 내경은 7.7, 높이 6.5 cm 이고 , 오링과 클램프를 이용하여 밀폐시켰다. 직경 6 cm 인 테플론 재질의 교반기 를 바닥에서 1.5 cm 떨어진 곳에 설치하여 200 rpm으로 회전시켜 용액을 균일하게 혼합하였다. 이중자켓 반응기는 외부의 항온순환조를 이용하여 -0.5 °C/min 의 속도로 60 °C 에서 25 °C로 냉각시켰다. 실험에 사용된 흡수액은 이산화탄소가 풍 부한 (rich) 조건인 50% 의 CTB 전환율을 가지고, 5, 10 wt% AMP, AMPD 첨가제를 혼합한 30 wt% 의 K2CO3 수용액을 사용하였다. 냉각이 완료되면 감압여과 (5 μm) 를 통해 용액으로 부터 결정을 분리하였다. 회수된 결정은 60 °C 의 오븐에서 건조시킨 뒤 무게를 측정하여 첨가제 유무에 따른 결정의 생성 수율을 비교하였다 .
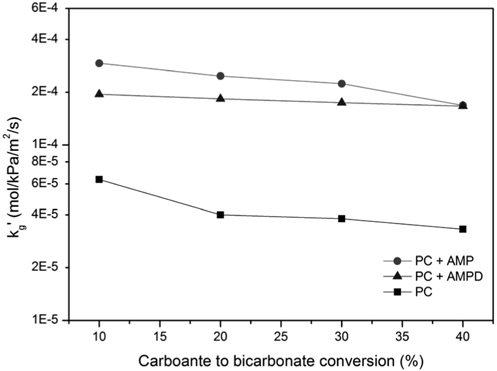
5 wt% 의 AMP, AMPD가 혼합된 고농도 (30 wt%) K2CO3 흡수액에 대해, wetted-wall column 을 이용하여 40 °C 에서의 정규화된 플럭스 (kg')를 측정한 결과를 Figure 5 에 나타내었다. 용액 중에 존재하는 탄산 중 CO32-가 HCO3-로 전환된 양(CTB 전환율) 이 많을수록, 이산화탄소가 포함된 정도를 나타내는 로딩 (loading) 값이 증가한다. 30 wt% K2CO3 흡수액의 CTB 전환율이 10 에서 40%로 상승함에 따라 , kg'가 6.37 × 10-5에서 3.32 × 10-5 mol/kPa/m2/s으로 낮아져 흡수속도가 감소하는 것으로 나타났다. 5 wt% AMP, AMPD 첨가제가 존재할 때, 흡수 속도는 10% 전환율에 대해 각각 2.92 × 10-4, 1.95 × 10-4 mol/kPa/ m2/s으로 4.6 배, 3.1배 상승하였다. CTB 전환율이 상승하여도 kg'는 5% 첨가제 혼합에 의해 상승하였으며, 40% 전환율에 대해 각각 1.68 × 10-4, 1.66 × 10-4 mol/kPa/m2/s으로 나타났다. 10~ 20% 의 CTB 전환율에서 10 wt% AMP 또는 AMPD의 혼합으로 흡수속도가 약 3~7 배 증가한 결과는, 15% CTB 전환율을 나타내는 30 wt% K2CO3 용액에 9 wt% 붕산을 첨가했을 때, 60 °C 에서의 흡수속도가 약 1.3 배 이하로 향상된 것과 비교된다[17]. 또한, 1 M K2CO3에 대해 10% 의 아민 또는 피페라진을 첨가시, 30 °C 에서의 흡수속도가 약 5~8 배 향상되는 결과와 유사하다 [22].
AMP와 AMPD는 이산화탄소 흡수제로서 널리 알려져 있으며, 느린 흡수속도의 흡수제에 혼합하여 사용될 수 있다. 고농도의 K2CO3 흡수액을 대상으로 하는 본 연구에서도 이들 아민 첨가제의 흡수 촉진효과가 확인되었다. 특히, AMP가 AMPD에 비해 중량 기준으로 우수한 것으로 나타났다. 첨가제의 몰 수 기준 1.18 배의 아민 분자 몰 수 차이를 고려하더라도, 전환율 10~30% 에서 AMP가 AMPD에 비해 우수하였다. 이는 AMPD 보다 작은 크기의 AMP가 이산화탄소와의 반응에 대한 입체장애 효과가 작기 때문이다. 또한, 아민과 이산화탄소 화학반응에 영향을 미치는 염기도와 관련하여, 염기도가 큰 AMP (pKa 9.82)가 AMPD (pKa 8.84) 보다 반응에 유리하기 때문이기도 하다[23,24]. 한편, AMP, AMPD 모두 CTB 전환 율이 상승함에 따라 kg'가 감소하는 경향을 나타내었고, AMPD 의 kg'가 감소 정도가 AMP 대비 작은 것으로 나타났으나 그 이유에 대해서는 추가분석이 필요하다.
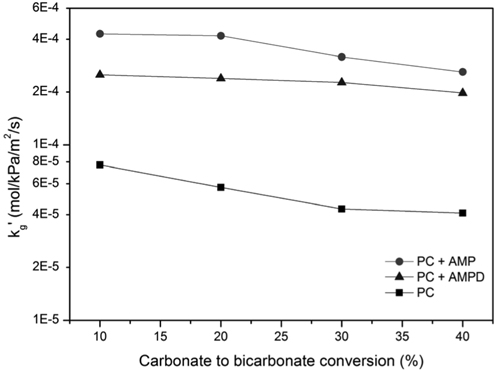
흡수온도가 40 °C에서 석탄화력발전소에서 배출되는 연소 배가스 온도 수준인 60 °C로 상승함에 따라 kg'가 상승하였다. 첨가제가 존재하지 않는 10% CTB 전환율에 대해, kg'는 6.37 ×10-5에서 7.69 × 10-5 mol/kPa/m2/s로 상승하였다 (Figure 6). 40 °C에서 나타난 것과 같이, 5 wt% AMP, AMPD 첨가제 혼합에 의해 kg'가 상승하므로, 소량의 상기 첨가제 혼합에 의해서도 고농도 K2CO3 흡수액의 흡수성능이 개선될 수 있을 것으로 예상된다. 마찬가지로 CTB 전환율 상승에 의해 kg'가 감소하는 것으로 확인되었다. 따라서 흡수탑으로 유입되는 이산화탄소가 희박한 (lean) 용액의 CTB 전환율을 20% 이하로 낮게 유지 할수록 이산화탄소 제거에 유리하다.
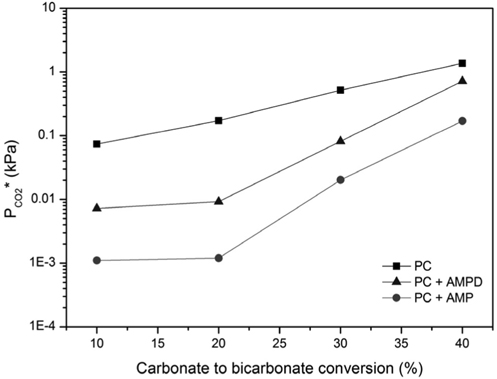
5 wt% AMP, AMPD 첨가제가 혼합된 30 wt% K2CO3 흡수액에 대해, 40 °C 및 저농도 이산화탄소 농도 범위에서 수행된 wetted-wall column 실험을 통해 이산화탄소 평형분압 (PCO2*) 을 측정한 결과를 Figure 7 에 나타내었다. PCO2* 는 CTB 전환율이 증가할수록 증가하였다. 이것은 흡수액 중 이산화탄소의 로딩이 높기 때문에 평형을 이루기 위해 기상으로 탈거 되는 이산화탄소가 많기 때문이다. CTB 전환율이 10% 일 때 0.0735 kPa 인 PCO2* 가 20, 30, 40%로 증가하면서 0.1715, 0.5183, 1.3701 kPa로 급격히 증가하였다. 한편, 5 wt% AMP 가 첨가될 때 PCO2* 는 1/10 이하로 감소된 낮은 값을 나타내었다. 5 wt% AMPD에 대해서도 유사한 결과가 나타났으나, AMP 대비 그 효과는 작았다. 이와 같이 소량의 AMP, AMPD 첨가제 혼합에 의해 평형분압이 감소됨은, 이산화탄소 흡수에 상기 첨가제 혼합 흡수제가 유리하게 사용될 수 있음을 의미한다. 고농도 이산화탄소 농도에서 구해진 kg'와 저농도 이산화탄소 농도에서 측정된 PCO2* 를 비교하면, 무첨가제 조건, AMP, AMPD 첨가제 조건의 영향력 순서가 서로 일치하였다.
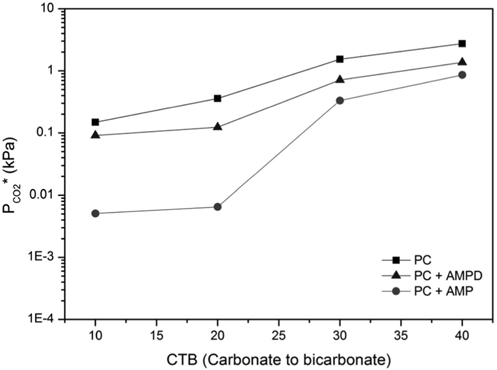
흡수온도가 60 °C로 상승하면 모든 흡수액에 대해 이산화탄소 평형분압이 상승하게 되며 (Figure 8), 이것은 높은 온도에서 기상에 보다 많은 이산화탄소가 존재하기 때문이다. 그러나 흡수속도가 흡수공정 설계에 평형분압 보다 중요한 영 향을 주므로, 약 60 °C 의 흡수조건이 흡수탑 장치비 저감 및 운전에 유리하다. 각 첨가제 혼합 용액에 대해 동일 CTB 전 환율 및 온도에서 kg'와 PCO2* 의 관계를 정리하면, PCO2* 가 증가함에 따라 kg'가 감소하는 것으로 나타났다. 따라서 kg'를 상승시키고 PCO2* 를 감소시킬 수 있는 AMP, AMPD 첨가제를 사용함으로써, 흡수제의 흡수성능을 향상시킬 수 있을 것으로 예상된다.
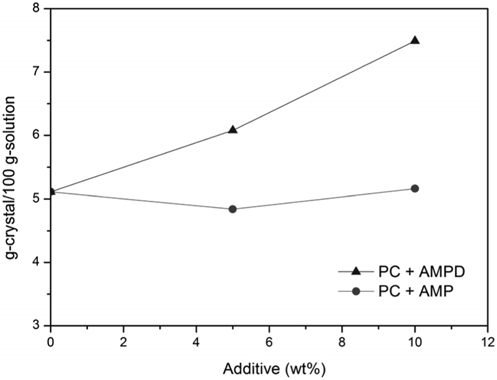
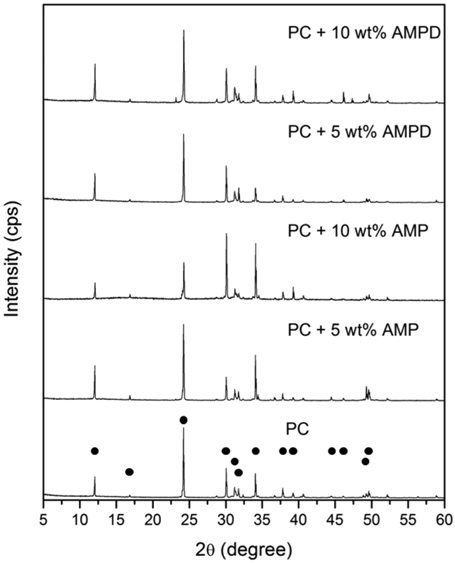
첨가제가 존재하지 않고 CTB 전환율이 50% 로 이산화탄소가 풍부한 (rich) 조건에 해당되는 30 wt% K2CO3 수용액을 60 에서 25 °C로 냉각시켰을 때, 생성된 결정의 양을 Figure 9 에 나타내었다. 첨가제가 존재하지 않을 때 흡수액 100 g 당 5.11 g의 고체염이 석출되었으나, 5 wt% 의 AMPD가 첨가되면 6.08 g의 고체염이 회수되었다. 혼합된 AMPD의 양이 10 wt% 로 증가하면, 100 g 흡수액 당 석출된 고체염의 양은 7.49 g으로 보다 증가하였다. 이를 통해 AMPD가 고체염의 석출량을 증가시킴을 확인할 수 있었다. 그러나 AMP는 5, 10 wt% 의 첨가에도 각각 4.84, 5.16 g의 고체염이 석출되어 실험범위 내에서는 큰 효과가 없었다. 한편, 생성된 흰색의 고체염의 성분은 첨가제 유무와 관계없이 분말 X-선 회절분석기 (powder X-ray diffraction, XRD) 관찰로부터 중탄산칼륨 (KHCO3) 결정인 것으로 확인되었다 (Figure 10).
MEA, DEA 등 1차, 2차 아민류는 이산화탄소와 반응하여 안정한 카바메이트를 형성시키므로, 이를 원래의 아민으로 회복하여 재사용하기 위해서는 고온의 재생공정이 필요하다. 이에 따라 아민의 재생 비용이 발생하고 고온에서 아민의 열분해에 따라 손실이 발생하여 지속적인 보충이 필요하다[25]. 이 와 달리 입체장애아민인 AMP와 AMPD는 이산화탄소와 반응시 불안정한 카바메이트를 형성시키는 것으로 알려져 있다[26]. 따라서 카바메이트가 형성되더라도 쉽게 분해되어 아민으로 회복되고 용액 중 HCO3-의 형성을 유발하게 된다. HCO3-의 형성이 활발해지므로 KHCO3의 농도가 보다 높아져 염석출 가능성이 높아질 수 있다 . 그러나 AMP를 첨가할 경우 50% CTB 전환율 및 30 wt% K2CO3 조건에서는 고체염의 석출량이 크게 증가하지 않았으므로, KHCO3의 농도 상승 효과만으로 설명하기 어렵다. 특히, AMPD가 AMP 보다 많은 고체염을 석출시킨 것은 AMPD 분자내의 히드록실기의 숫자와 관 련이 있다. 즉, 분자내에 히드록실기가 1개인 AMP에 비해 히드록실기가 2 개인 AMPD가 결정화에 유리하게 작용할 수 있다. 따라서 히드록실기를 많이 포함하는 알카놀아민은 반용매로써 용해도를 낮추어 결정 생성 수율을 향상시킬 수 있는 것으로 풀이된다[27].
흡수탑에서 배출되는 흡수액에서 이산화탄소를 분리하기 위해서는 다량의 흡수액을 가열하여야 하므로 많은 에너지가 필요하다. 그러나 고농도 K2CO3 흡수액을 사용할 경우 이산화탄소를 다량으로 포함하는 KHCO3 고체염을 석출시킬 수 있다. 따라서 이산화탄소를 고농도로 함유한 중탄산염의 석출을 활성화시켜 이를 용액에서 선택적으로 분리후 재생하면, 재생할 흡수액의 양을 감소시켜 잠열, 현열을 포함하는 재생에너지를 낮출 수 있다. AMPD와 같은 첨가제를 고농도 K2CO3 흡수액에 사용하면, 이산화탄소의 흡수속도를 촉진시키는 동시에 중탄산염 결정 생성수율을 향상시킬 수 있다. 또한, AMPD와 같은 입체장애 알카놀아민은 안정한 카바메이트를 형성시키지 않고 중탄산염 결정에 내포되지 않으므로, 열분해에 의한 재생이 필요하지 않고 흡수액으로 재사용이 가능한 장점이 있다.
본 연구에서는 AMP, AMPD 등 입체장애 알카놀아민 첨가제가 30 wt% 의 고농도 K2CO3 흡수액의 이산화탄소 흡수속도 및 고체염 석출량에 미치는 영향에 대해 고찰하였다. 흡수온 도 40, 60 °C 에서 wetted-wall column 을 이용하여 정규화된 플럭스 (kg') 와 평형분압 (PCO2*) 을 측정한 결과로부터, 5 wt% AMP, AMPD의 첨가제는 흡수속도를 향상시키는 한편, 평형 분압을 낮추어 이산화탄소 흡수에 유리하게 작용하였다. 또한, 알카놀아민 첨가제인 AMPD는 복수의 히드록실기를 포 함하고 있어, 반용매와 같은 작용을 통해 중탄산염 결정의 생성을 유발시켰다. 이러한 입체장애 알카놀아민 첨가제는 고농도 K2CO3 흡수액에서도 흡수촉진제로 사용될 수 있는 동시에, 이산화탄소를 많이 포함하는 중탄산칼륨염의 생성율을 높여 다량의 흡수액에서 소량의 슬러리를 선택적으로 분리하여 재생시킬 수 있다. 또한, 입체장애 알카놀아민 첨가제들의 종류와 조성을 최적화함으로써, 흡수속도와 고체염 생성수율을 개선 및 최적화할 수 있을 것으로 예상된다. 이를 통해 연소후 이산화탄소 포집공정에서 흡수탑의 장치비용을 저감할 수 있고, 다량의 흡수액 재생에 필요한 에너지를 낮추어 이산화탄소 포집비용 저감에 기여할 수 있을 것으로 기대된다.