A green procedure is described for the preparation of a series of ionic liquids where two 3-methylimidazolium cations were bridged with ethylene glycol chain as linkers. Diethylene glycol-bis(3-methylimidazolium) ditosylate, triethylene glycolbis(3-methylimidazolium) ditosylate, and tetraethylene glycol-bis(3-methylimidazolium) ditosylate were heated with 3-methylimidazole under solvent-free condition to give the corresponding bis(3-methylimidazolium) ditosylate ionic liquids efficiently in a short time.
청정 반응에 대한 세계적 관심이 집중되고 있는 가운데 이온성 액체의 활용은 다양한 유기화학적 과정에서 기존의 유기 성분을 대체하는 환경친화적 용매와 효율적 반응 매질 또는 촉매로서의 이용 등으로 크게 증가하고 있다 . 현재 많이 이용되고 있는 이온성 액체의 종류는 이미다졸 양이온과 피리딘 염과 같은 질소를 포함하는 방향족 헤테로고리 화합물의 염으로서 이들은 극히 작은 증기압 , 높은 열안정성 , 우수한 용해력 (solvation property), 높은 이온전도성 (ionic conductivity) 등 물리적 특성을 나타내어 다양한 유기화학적 과정에서 고반응성 맞춤형 용매와 재료 및 촉매로서의 이용이 크게 증가하고 있다 [1-4]. 두 개의 헤테로고리 양이온을 포함하는 구조의 이온성 액체의 합성과 이들에 대한 독특한 활용이 보고되고 있다 . 금속 양이온과의 배위 결합에 의한 중합체 형성[5,6], 이미다 졸리움 작용기를 포함하는 다양이온 사슬 구조[7,8], 교차 결합을 해내는 이온성 액체 단량체의 합성 [9,10], 이중 구조의 액정 및 표면활성제 [11-13] 등이 그 예이다 . 이들 화합물이 한층 넓은 온도 영역에서도 높은 열적 안정성과 용해성을 나타내는 것 [14,15] 이외에 양이온 및 그의 음이온의 종류와 이들간에 도입되는 알킬 , 플로오로 알킬 , 아릴 , 알콕시 등 사슬의 구조 변화를 주게 되면 이 화합물의 열적 성질 , 증기압 조절을 가져옴으로써 극지 조건에서의 사용될 수 있는 매질 등에의 활용 등 그의 활용 범위가 크게 증가되고 있다 [16,17].
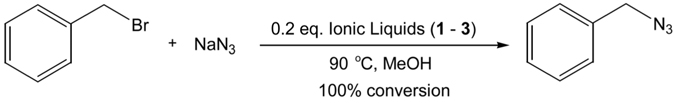
한편 , 2~4 개의 에틸렌 글리콜 사슬을 포함하는 비스 3- 메틸 이미다졸리움 (bis (3-methylimidazolium) 양이온 이온성 액체는 촉매 또는 용매로서의 흥미로운 활용 예가 최근 보고되고 있다 . 예를 들어, Figure 1 에서와 같이 아지드화 반응[18]의 효율적 촉매 (100% convertsion) 로서의 활용이 그 한 예이다.
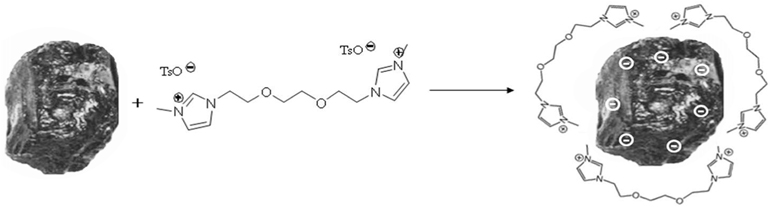
본 연구자들은 이러한 이온성 액체를 이용하면 고효율로 석탄 분해가 이루어짐을 보고한 바 있다 . 고효율의 분해과정은 Figure 2 에 보인 바와 같이 두 개의 3- 메틸이미다졸리움 고리 사이에 치환된 알킬 사슬의 길이와 입체적 스트레인이 석탄 표면과 이온성 액체간의 상호작용에 영향을 미치기 때문 으로 설명하였다[21].
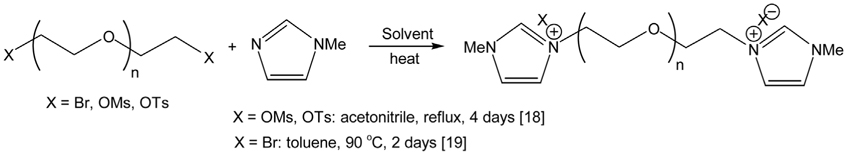
두 개의 헤테로고리 양이온을 포함하는 이온성 액체에 대한 기존의 제법은 대개 반응물질을 휘발성의 유해한 유기 용매에서 가열하여 얻는다 [17]. 예를 들어 본 연구에서 목표로 하는 두 개의 알킬 이미다졸리움 이온에 2~4 개의 에틸렌 글 리콜 사슬을 포함하는 이온성 액체를 합성해내는 기존 방법은 Figure 3 에 나타낸 바와 같이 해당하는 길이의 에틸렌글리콜 사슬의 두 말단 부위에 브롬 (Br), 메탄솔포닐 (CH 3SO3), p- 톨루엔술포닐 (p-C6H5SO3 ) 를 도입한 화합물을 N- 알킬이미다 졸과 아세토니트릴 [18] 또는 톨루엔[19]등의 비청정 유기용매에서 2~4 일간 가열교반하는 과정을 거치게 된다 . 또한 , 이후에도 얻어진 이온성 액체에 포함된 불순물을 제거하기 위해 다량의 용매를 이용하는 까다로운 정제과정이 필요하다는 점에서 충분히 환경친화적이지 못했다 . 위 석탄 분해 연구를 위해 다량의 두 개의 3- 메틸이미다졸리움 고리를 가지는 이온성 액체를 대량 합성할 필요에서 기존의 제법을 포함하는 용매를 사용하는 여러 방법을 시도하였지만 반응 속도가 느리고 생성물의 수율도 적합하지 않았다 .
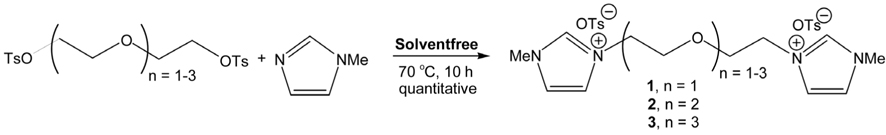
본 연구에서는 Figure 4 에서 보인 바와 같이 2~4 개의 에틸렌 글리콜 사슬을 포함하는 비스 (3-메틸이미다졸리움 ) p-톨루엔솔폰네이트 (bis(3-methylimidazolium)ditosylate) 이온성 액체 (1-3) 를 유해한 휘발성의 용매를 사용하지 않는 무용매 조건에서 효율적으로 얻어낼 수 있음을 보고하고 그에 대한 논의를 덧붙이고 한다 .
소듐 하이드라이드 (sodium hydride, NaH) 는 Aldrich 사의 미네랄 오일 60% 분산 제품 , p-톨루엔술포닐 클로라이드 (p-tolu-enesulfonyl chloride), 이미다졸 , 3- 메틸이미다졸 , 다이에틸렌글리콜 , 트리에틸렌글리콜 , 테트라에틸렌글리콜은 Aldrich 사의 순도 99%의 시약을 사용하였다 . Bruker 사의 300 MHz 분광기를 사용하여 수소 핵자기공명분광기 (proton nuclear mag- netic Resonance, 1 H-NMR) 및 탄소 핵자기공명분광기 (carbon nuclear magnetic Resonance, 13 C-NMR) 스펙트럼을 얻었고 , 이 때 테트라메틸실란 (tetramethylsilane, TMS) 을 표준물질로 사용하여 화학적 이동 (δ) 을 ppm 단위로 기록하였다 .
Diethylene glycol ditosylate (1a), triethylene glycol ditosylate (2a), tetraethylene glycol ditosylate (3a) 의 토실레이트 화합물 은 알려진 방법 [18] 과 같이 트리에틸아민 존재 하의 다이에틸렌글리콜 , 트리에틸렌글리콜 , 테트라에틸렌글리콜 용액에 p-톨루엔술포닐 클로라이드를 가하면 높은 수율 (1a, 89% ; 2a, 93%, 3a, 90%) 로 세 ditosylate 전구체를 쉽게 합성할 수 있다 . 이 때 발생하는 환경위해적 부산물은 염산 가스는 트리 에틸 에틸 아민에 의해 제거된다 ( 이 과정에 대한 환경위해적 부산 물인 염산의 발생에 대한 우려와 함께 토실클로라이드 (tosyl chloride) 대신 p-toluenesulfonic anhydride 등의 대체 사용에 대한 referee 의 권고가 있었음 ).
2.3. Bis (3-methylimidaz olium) ditosylate (1-3) 의 무용매 합성 제법
>
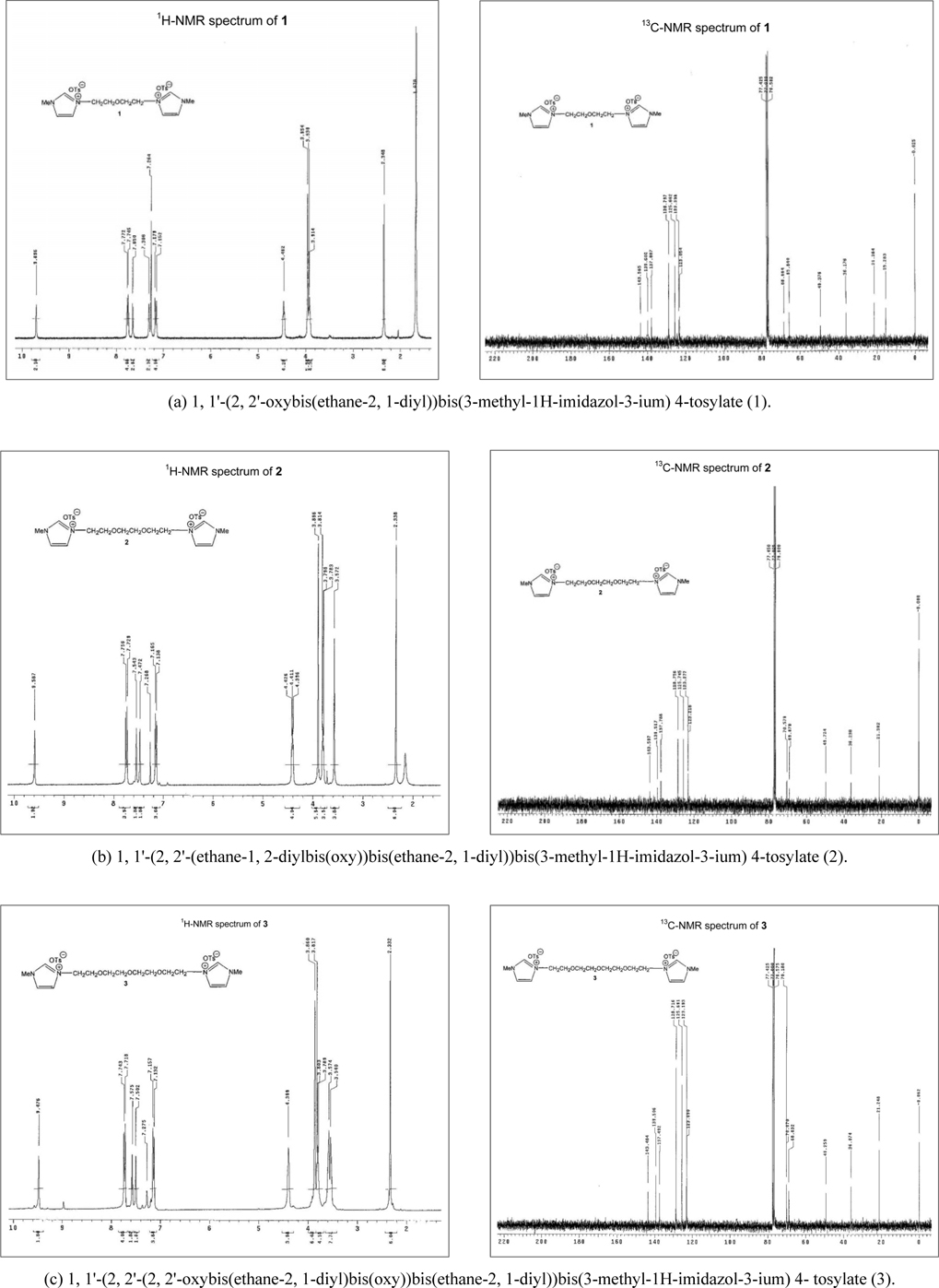
(1) 1, 1'-(2, 2'-oxybis(ethane-2, 1-diyl))bis(3-methyl- 1H-imidazol-3-ium) 4-tosylate (1)
Diethylene glycol-bis(3-methylim idazolium) ditosylate (1.00 g, 2.41 mmol) 와 2.5 당량의 3-메틸이미다졸 (495 mg, 6.03 mmol) 을 70 °C 에서 10시간 교반하면 이온성 액체가 노란색 오일이 얻어진다 . 과량의 3- 메틸이미다졸은 무수 ether 로 씻어 내면 고순도 이온성 액체 (1) (1.35g, 97%) 을 얻을 수 있다 . 1: 1H-NMR (CDCl 3 , 300 MHz) δ 9.69 (2H, s), 7.75 (4H, d, J = 7.8 Hz), 7.68 (2H, s), 7.31 (2H, s), 7.16 (4H, d, J = 8.1 Hz), 4.45 (4H, t, J = 4.5 Hz), 3.94 (6H, s), 3.88 (4H, t, J = 4.5 Hz), 2.35 (6H, s); 13 C-NMR (CDCl3 , 75 MHz) ppm 143.57, 139.60, 137.89, 128.80, 125.66, 123.40, 123.05, 68.66, 65.84, 49.38, 36.18, 21.28, 15.26.
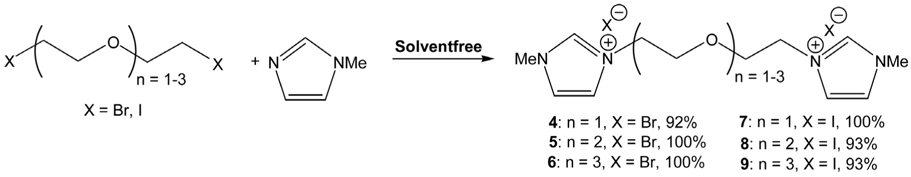
Triethylene glycol-bis(3-methylimidazolium) ditosylate (1.00 g, 2.18 mmol) 에 2.5 당량의 3- 메틸이미다졸 (448 mg, 5.45 mmol) 을 첨가한 후 70 °C 에서 10 시간 교반하여 얻은 노란색 오일 이온성 액체가 생성된다 . 이온성 액체에 남은 3- 메틸이 미다졸을 무수 ether 로 씻어 내면 고순도의 이온성 액체 (2) (1.36 g, 100%) 를 고순도 상태로 얻을 수 있다 . 2:1 H-NMR (CDCl3 , 300 MHz) δ 9.59 (2H, s), 7.74 (4H, d, J = 8.1 Hz), 7.54 (2H, s), 7.47 (2H, s), 7.15 (4H, d, J = 8.1 Hz), 4.41 (4H, t, J = 4.5 Hz), 3.90 (6H, s), 3.80 (4H, t, J = 4.5 Hz), 3.57 (4H, s), 2.34 (6H, s); 13 C-NMR (CDCl3 , 75 MHz) ppm 143.60, 139.51, 137.79, 128.76, 125.75, 123.28, 123.22, 70.58, 69.07, 49.72, 36.24, 21.30.
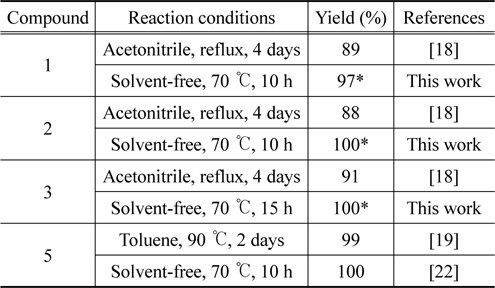
위와 마찬가지 방법으로 액체상의 tetraethylene glycol-bis(3- methylimidazolium) ditosylate (1.00 g, 1.99 mmol) 에 10 시간 교반하여 얻은 노란색 오일 이온성 3- 메틸이미다졸 (409 mg, 4.98 mmol) 을 넣고 70 °C 에서 15 시간 동안 교반하여 액체가 생성된다 . 이온성 액체에 남은 3- 메틸이미다졸을 무수 ether 로 씻어 내면 고순도의 이온성 액체 (3) (1.33 g, 100%) 을 얻었 다 . 3:1 H-NMR (CDCl 3 , 300 MHz) δ 9.48 (2H, s), 7.73 (4H, d, J = 7.5 Hz), 7.58 (2H, s), 7.50 (2H, s), 7.14 (4H, d, J = 7.5 Hz), 4.40 (4H, t, J = 4.5 Hz), 3.86 (6H, s), 3.80 (4H, t, J = 4.2 Hz), 3.56 (8H, d, J = 10.2 Hz), 2.33 (6H , s); 13 C-NMR (CDCl 3 , 75 MHz) ppm 143.48, 139.51, 137.49, 128.72, 125.69, 123.19, 123.09, 70.18, 70.07, 68.83, 49.26, 36.07, 21.25.
이온성 액체의 1H-NMR 및 13 C-NMR 스펙트럼은 Figure 5 와 같았다 . 얻은1 H-NMR 스펙트럼은 이미 보고된 데이터[18] 와 일치함을 알 수 있었고 , 1 H-NMR 스펙트럼을 고려할 때 순도는 매우 높을 것으로 판단되었다 . 이온성 액체의 순도는 역상 고성능 액체크로마토그래피 (high-performance liquid chro- matography, HPLC) 를 이용하여 확인하였을 때 세 경우 모두 100% 의 area 의 단일 피크를 보여 고순도로 판단할 수 있었다 . 사용한 장비와 조건은 아래와 같았다 .
HPLC : JASCO 사의 PU-2089 Plus (quaternary gradient pump), reversed phase column : CNW Technologies 사의 Athena C18 (120 Å , 4.6 mm × 250 mm), 용리액 : 아세토니트릴 / 톨 루엔 = 3 / 97, UV-VIS detector : JASCO UV-2075 Plus.
Ethylene glycol 사슬을 가지는 tosylate 를 3- 메틸이미다졸 과 다른 용매없이 반응시켜 비스 3- 메틸이미다졸리움 이온성 액체를 합성하는 방법은 아직 보고된 바 없다 . Mueller 등은 약 7 g (30 mmol) 의 비스 2- 브로모에틸이써 (bis(2-bromoethyl) ether)) 와 3- 메틸이미다졸과의 치환반응으로 비스 3- 메틸이미다졸리움 브로마이드 (5) 를 얻기 위하여 30 mL 의 톨루엔 용매에서 90 °C 로 48 시간 가열하여 99% 수율로 이온성 액체를 얻었음을 보고한 바 있다 [18]. 또한 에틸렌 글리콜 사슬을 포함하는 비스 3- 메틸이미다졸리움 솔포네이트 이온성 액체를 얻기 위한 최근의 연구에서는 세 종류의 에틸렌글리콜 토실레이트 (ethylene glycol tosylate) 를 3- 메틸이미다졸과 반응시키기 위해 아세토니트릴 용매 하에서 4일 동안 환류시켰으며 이때 생성물의 수율은 88-91% 였다 (1 : 89%, 2 : 88%, 3 : 91%)[18]. 본 연구들이 위 화합물 (1-3) 을 얻기 위해 용매를 사용하는 반응을 시도했을 때 2일 동안 가열하여도 반응 종결이 되지 않았고 얻어진 생성물에 미반응한 출발물질이 섞여 있어서 실제적으로 이를 제거하기 쉽지 않았다 .
이에 다음 시도한 것은 세 종류의 에틸렌글리콜 토실레이트를 휘발성 용매를 첨가하지 않고 대신 3- 메틸이미다졸을 과량 , 즉 10 당량의 3-메틸이미다졸과 함께 가열하였는데 두가지 면에서 만족스러운 결과를 얻을 수 있었다 . 첫째 , 앞서의 조건보다 훨씬 짧은 반응 시간 10-15 시간 (1 과 2: 10 시간 , 3: 15 시간 ) 에서 반응이 종결되었다 . 한편 , 반응의 전환은 원하는 생성물과 남겨진 3-메틸이미다졸만 남아있어 정량적임을 알 수 있었다 ( 생성물의 스펙트럼은Figure 5 참조 ). 그러나 , 과량 남아있는 3- 메틸이미다졸을 추출해내기 위해서는 ether 용매를 반복적으로 사용해야 하는 문제가 아직 남아 있었다 . 최소량의 3- 메틸이미다졸 , 즉 2 당량 만의 3-메틸이미다졸 (3- methylimidazole) 을 사용했을 때에는 반응용액의 점도가 높아 반응이 원활하지 못하였다 . 2.5 당량 사용한 결과 ,Table 1 에 나타낸 바와 같이 짧은 시간에 고순도의 생성물을 높은 수율로 얻어 낼 수 있는 만족스러운 결과를 얻었다 (Figure 5 참조 ). 단 , 남아있는 3-메틸이미다졸는 ether 용매를 사용하여 제거하였다 .
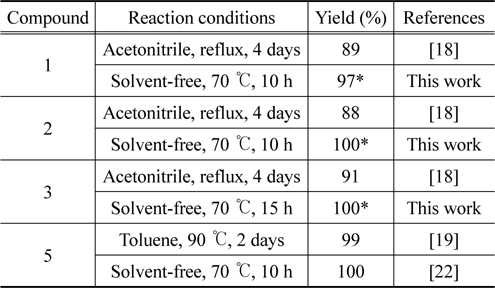
Comparison of experimental c onditions and yields for pre- paring bis(3-methylimidazolium) cation-based ionic liquids (1-3, 5).
앞에 논의한 바와 같이 정량적 무용매 조건에서의 반응 시간은 상당히 단축됨을 관찰하였다 . 그 원인은 무엇일까? 반응물질인 3-메틸이미다졸의 유효농도의 증가로 반응속도의 증가로 나타난 외에 다른 이유는 없을까 ? 아마도 반응이 진행 되면서 생성되는 이온성 액체가 유기 용매의 간섭 없는 상태에서 용매 또는 촉매로서 작용하여 치환반응을 가속화시킨결과가 아닐까 추측된다 . 이러한 효과는 비스 3- 메틸이미다졸 리움 이온성 액체의 솔포네이트염이 아닌 다른 염 , 즉 할로젠 염의 합성에도 효율적으로 작용할 것으로 생각된다 . 다이브로마이드 화합물과 3- 메틸이미다졸의 반응으로 이온성 액체 5 (Figure 6 참조 ) 를 합성할 경우 무용매의 이온성 액체 생성조건에서는 70 °C 에서 10 시간 가열 시 반응이 종결되었다 (Table 1). 또한 다른 할로겐 화합물의 3- 메틸이미다졸과의 무용매반 응으로 비스 3-메틸이미다졸리움의 브롬 및 요오드 할로젠염 (4-9) 을 높은 수율로 얻을 수 있었다 [21]. 유사한 방법은 메탄 솔폰네이트 등 다른 다양한 음이온 염의 합성에도 일반적으로 적용할 수 있을 것으로 기대하며 이는 앞으로 밝혀야 할 부분이다 .
이온성 액체의 순도는 화학반응의 사용에 있어 매우 중요한 요소이다 . 이온성 액체의 활용은 최근 매우 큰 관심이 집중되고 있다 . 이온성 액체 화합물의 순도는 실제적 활용에 극히 중요한 요소이다 . 잔류 할로젠 화합물 , 반응물질 , 용매 등 은 화학반응에서 역효과를 나타낼 수 있다 . 예를 들어 액체상 수소화 반응 또는 스즈키 반응을 방해하기에 이온성 액체의 고순도는 매우 중요한 것으로 알려져 있다[20]. 한편 , 높은 수율은 반응 종결 후 생성물의 정제 과정이 크게 용이하게 하는 장점도 가진다 . 이 때 생성되는 이온성 액체의 순도도 매우 높아 알려진 바와 같이 할로젠 불순물을 제거하기 위한 여러 조작을 거칠 필요를 줄여줄 것으로 생각한다 .
본 연구에 따르면 과량의 3- 메틸이미다졸 존재 하에서 반응을 시도했을 때 짧은 시간에 효과적으로 이온성 액체를 얻어낼 수 있었으나 , 종결 후 생성된 이온성 액체에 3- 메틸이미다졸이 남아있었다 . ether 용매를 사용하여 추출해내면 수율에 영향을 미치지 않으면서 순도를 높일 수 있었다[21]. 앞서의 논의에서와 같이 반응의 효율과 정제의 용이성을 고려하여 3-메틸이미다졸을 2.5 당량 사용한 결과 ,Table 1 에 나타낸바와 같이 각 경우 짧은 시간에 고순도의 생성물을 높은 수율로 얻어 낼 수 있는 만족스러운 결과를 얻었다 . 얻어진 화합물의 순도는 이들의 1 H-NMR 스펙트럼 (Figure 2) 을 토대로 볼 때 95% 이상일 것으로 추측하였으며 , 이를 다시 역상 HPLC 로 분석한 결과 , 세 화합물은 모두 매우 높은 순도 (100%) 인 것으로 나타났다 .
이온성 액체는 작은 증기압 , 높은 열안정성 , 우수한 용매화 (solvation property), 높은 이온전도성 (ionic conductivity) 등 우수한 물리적 특성으로 인해 여러 화학 반응 매질로 활용이 커지고 있다 . 최근에는 다양한 특성의 재료 , 고반응성을 가진 촉매로서의 활용에 대한 연구가 증가하는 가운데 두 개의 3- 메틸이미다졸리움 고리 사이에 여러 길이의 에틸렌글리콜 사슬을 포함하는 비스 3- 메틸이미다졸리움 이온성 액체는 한층 넓은 온도 영역에서의 높은 안정성과 액체성을 나타내는 것으로 알려져 그 합성이 관심을 끌고 있다 . 본 연구는 이러한 새로운 이온성 액체의 기존 합성 방법의 단점을 극복하기 위해 휘발성 용매의 비사용 , 반응시간의 감소로 에너지 소모를 극소화함과 동시에 높은 수율로 이온성 액체를 얻어내는 방법에 관한 내용이다 . 비스 3- 메틸이미다졸리움 토실레이트와 3- 메틸이미다졸의 두 반응물질을 무용매 조건에서 가열함으로써 기존 방법보다 짧은 시간 동안 반응시켜 원하는 이온성 액체를 합성해내는 친환경적이고 에너지 효율적 제법에 대해 기술하였다 .