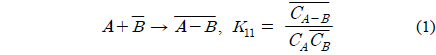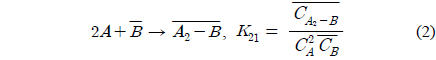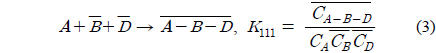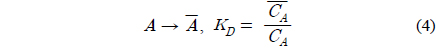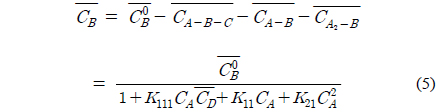각종 고분자 화합물과 섬유산업에 응용되어왔던 아크릴산은 지금까지 화석원료를 이용하여 생산되어 왔다. 그러나 최근 화석원료의 가격 불안정성과 화석연료 유래 제품의 전주기에 걸친 온실가스 배출로 인해 재생 가능한 바이오매스로부터 아크릴산을 생산하는 공정에 관심이 높아지고 있다. 재생 가능한 탄소원으로부터 경제적으로 아크릴산을 생산하기 위해서는 효율적인 분리공정 개발이 필수적이다. 본 연구에서는 수용액 내의 아크릴산을 추출하기 위해 3차 아민추출제인 TOA를 사용하여 반응추출을 실시하였다. 각종 변수들이 추출능에 미치는 영향을 알아보고자 희석제의 극성과 TOA의 농도, 수용상에서 아크릴산의 농도에 변화를 주며 실험을 진행하였다. 아크릴산의 추출능은 TOA의 농도와, 알콜의 극성에 비례하였으며 최대 추출능은 95% 이상인 것으로 나타났다. 추출 후 산과 아민의 복합체의 형성을 확인하기 위해 적외선분광법을 실시하였고, 적외선분광법을 바탕으로 평형모델 식을 세워 추출평형 데이터를 해석하였다. 적외선분광법을 통하여 TOA의 농도가 높아질수록 (1, 1) 복합체의 비율이 증가하는 반면 아크릴산 이합체의 비율이 감소하는 것을 확인하였으며 이를 바탕으로 수립된 평형모델은 평형데이터를 잘 모사하였다.
Acrylic acid is a commodity chemical which is applicable for various industries such as polymer and textile industry. Currently, it has been produced by chemical synthesis from petroleum. However, due to the high price of petroleum and global CO2 emission, renewable materials such as sugar are interesting alternative carbon sources for the biological production of acrylic acid. For an economic production of acrylic acid from renewable carbon sources, a cost effective separation process for acrylic acid should be needed. In this study, reactive extraction by TOA (tri-n-octylamine) was used for the recovery of acrylic acid from its aqueous solutions. The effects of polarity of diluents and concentration of TOA on extraction equilibrium were investigated. The extraction efficiency was proportional to concentration of TOA and polarity of diluents and its value was more than 95% in the case of sufficient concentration of TOA. From IR spectroscopy, it was concluded that the ratio of (1,1) acid-amine complex was increased and the ratio of acid dimer was decreased with concentration of TOA. Equilibrium model based on IR spectroscopy was well fitted with experimental data.
아크릴산은 α-탄소 위치에 비닐기와 말단에 카르복실기를 갖는 가장 단단한 구조의 불포화 카르복실산이다. 아크릴산의 연간 생산량은 연간 420만 톤으로 추정하고 있으며 주된 용도는 고분자 응집제, 분산제, 코팅, 도료, 접착제와 피혁 및 제지산업의 바인더 등이다[1,2].
지금까지 대부분의 아크릴산은 화석원료를 원료로 한 프로펜의 산화공정을 통해 생산되어 왔다. 단일단계 공정에서는 수율도 낮을 뿐 아니라 과량의 폐기물을 발생시키는 단점이 있다. 그러나 아크롤레인을 중간체로 하는 2단계 공정에서는 약 90%에 달하는 수율을 나타내는 것으로 알려져 있다. 그럼에도 불구하고 화석원료를 통한 아크릴산의 생산 공정은 화석원료 자체가 재생이 불가능한 한계와 더불어 여전히 공정 중에 과량의 유해 폐기물을 발생시킨다는 단점을 갖고 있다[2].
재생 가능한 탄소원으로부터 아크릴산을 생산하는데 있어 발효공정을 포함한 생물학적 공정은 유력한 대안이 될 수 있다. 당으로부터 아크릴산을 생물학적으로 생산하기 위한 방법은 포도당에서 아크릴산에 이르는 전체 경로에 대해 단일한 효소가 포함되게 하는 직접 경로와 중간체를 거치는 간접적인 경로로 나눌 수 있다. 그러나 경제적인 생산을 위해서는 당으로부터의 아크릴산 직접 전환이 더 적합하며 이 과정에서는 한 분자의 포도당에서 2 분자의 아크릴산이 생성되고 질량으로 환산하면 포도당 1 kg당 0.8 kg 아크릴산의 비율이 얻어진다[3].
아크릴산을 포함한 카르복시산의 발효생산은 수용액상에서 저농도로 존재하게 되어 이를 선택적으로 분리하기 어렵다는 공통적인 문제점을 갖고 있다. 원심분리를 통해 균주가 제거된 발효액에서 아크릴산을 분리하기 위해서는 모사이동층(Simulated Moving Bed, SMB)에 의한 이온교환 크로마토그래피, 반응에 의한 액-액 추출 그리고 암모니아에 의한 탈거과정이 결합된 물리적 용해도 차이에 의한 액-액 추출법 등이 적용될 수 있다. 암모니아는 발효조의 pH를 7.0 근처로 유지 하는데에 동시에 사용될 수 있다는 장점이 있으나 암모니아 를 회수하는 공정이 복잡하다는 단점이 있다. 또한 용해도 차이에 의한 액-액 추출법은 상대적으로 낮은 추출능에 따른 다량의 유기 용매가 소비된다는 단점이 있다. 모사이동층은 아크릴산을 염의 형태로 분리하는데 사용될 수 있는 가능성을 갖고 있으나 적용된 사례에 대한 보고는 없다.
반응추출이란 추출제와 분리 대상물질을 반응시켜 유기용매에 대한 용해도가 높은 염으로 변환시켜 추출하는 방법이다. 반응추출의 장점은 적은 양의 유기용매로도 높은 추출능을 얻을 수 있으며, 적절한 추출제와 희석제를 선정할 경우 유기용매의 회수 및 재사용이 용이하다는 점이다. 아크릴산을 포함한 카르복실산의 반응추출에는 여러 추출제가 사용될 수 있으나 젖산, 숙신산 등에서 3차 아민계 추출제가 효과적인 것으로 보고된 바 있다[4-6]. 아민계 추출제는 일반적으로 반응추출 시의 발열, 추출제의 부식성, 높은 점성으로 인해 유기용매에 희석하여 사용한다. 희석제는 활성희석제와 비활성희석제로 나뉘는데. 활성희석제는 추출 대상물질과 결합할 수 있는 작용기를 갖고 있거나 극성이 강한 유기용매이며, 비활성희석제는 추출 대상물질과 결합할 수 있는 작용기를 갖고 있지 않거나, 비극성인 유기용매를 말한다[7].
본 연구는 아크릴산 모사 수용액에 대하여 긴사슬 3차 아민추출제인 트리옥틸아민(tri-n-octylamine, TOA)을 다양한 알콜 용매에 희석한 유기상을 이용하여 반응추출 평형특성을 살펴 보고, 적외선분광법 분석 결과 얻어진 산-아민 복합체의 반응비 를 기초로 수립된 평형모델을 통해 평형데이터를 해석하였다.
본 연구에서 사용한 아민 추출제는 98% 순도를 가진 Junsei사의 TOA이며, 0.1 mol/L부터 0.7 mol/L까지 이르는 농도 범위로 활성희석제에 희석시켜 사용하였다.
반응추출에 사용된 활성 희석제는 98% 이상의 순도를 가진 Sigma-aldrich사의 1-부탄올, 1-헥산올과 Junsei사의 1-옥탄올, 대정화금의 1-데칸올을 사용하였다.
아크릴산은 99% 순도를 가진 Sigma-aldrich사의 제품을 사용하였으며, 0.14 mol/L (10 g/L)부터 2.08 mol/L (150 g/L)까지 이르는 농도 범위로 증류수와 함께 혼합액으로 사용하였다.
준비된 아크릴산 수용액 10 mL와 추출제가 희석된 활성희석제 10 mL를 30 mL 바이알에 넣고, 25 ℃의 온도를 유지하며 1,000 rpm으로 1시간 동안 교반하여 추출하였다. 추출 후 상분리를 위해 3,000 rpm으로 5분간 원심분리를 실시하였다.
잔류 아크릴산의 농도 측정은 0.02 N, 0.2 N NaOH를 이용한 적정법을 통해 이루어졌으며 이때 지시약으로는 페놀프탈레인을 사용하였다. 유기상 내 아크릴산과 추출제 결합 형태는 적외선분광기(infrared spectrometry, IR, FT-IR-4000, Jasco, Japan)를 통해 분석하였으며 700-3,700 cm-1 파장범위에서의 피크를 확인하였다.
3.1. 추출제의 농도와 희석제의 변화에 따른 추출평형
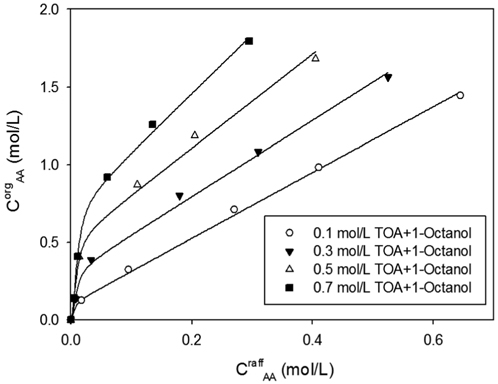
Figure 1은 TOA/1-옥탄올에서 TOA의 농도 변화에 따른 아크릴산의 추출평형으로, 평형 모델에 의해 계산된 실선과 함께 보여주고 있다. TOA의 농도가 증가할수록 아크릴산-아민 복합체의 양은 증가하게 되며 아크릴산-아민 복합체에 대한 1-옥탄올의 용해도가 충분히 크다면 유기상으로 이동되는 아크릴산의 양은 증가하게 된다. 그림에서 보듯이 TOA의 농도가 증가할수록 유기상으로 추출되는 아크릴산의 양이 증가할 뿐 아니라 기울기가 급격히 커지므로 산-아민간의 반응속도 역시 증가함을 알 수 있다.
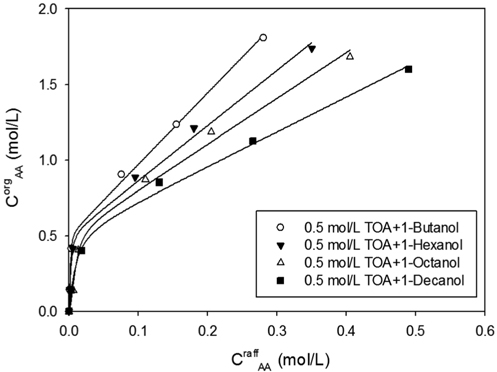
Figure 2는 일정한 TOA농도에서 희석제의 극성에 따른 추출 평형을 나타내고 있다. 유기상으로의 아크릴산의 이동은 같은 농도의 TOA에 대해서 1-데칸올 <1-옥탄올 <1-헥산올< 1-부탄올의 순으로 증가하는 것으로 나타났다. 이는 알콜의 사슬길이가 짧아짐에 따라 알콜의 극성이 증가하는 경향과 일치하게 된다. 아크릴산-아민 복합체에 대한 용해도는 희석제의 극성에 따라 증가하게 된다. 그러므로 아크릴산의 반응추출에 있어서 아민의 농도 뿐 아니라 희석제의 극성이 중요한 변수임을 알 수 있다.
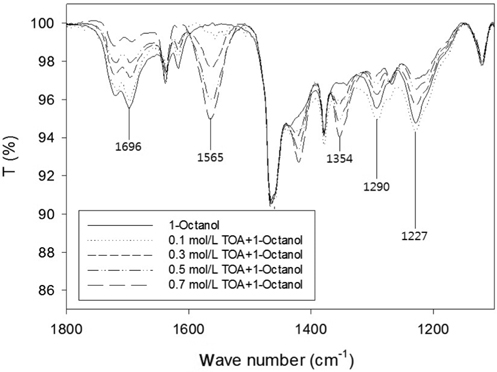
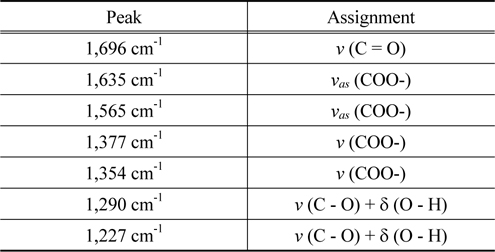
추출 후 아크릴산과 TOA의 복합체 형성을 확인하기 위하여 적외선분광법 분석을 실시하였으며 기존에 보고된 다른 카르복실산의 반응추출에 대한 IR 피크 해석결과를 이용한 해석결과는 Table 1과 같다[8,9].
[Table 1.] Peak assignments[8]
Peak assignments[8]
아민을 이용한 아크릴산의 반응추출에서는 유기상으로 추출되는 아크릴산이 산이 아닌 암모늄염의 형태가 된다. 따라서 알킬암모늄 양이온과 아크릴산 라디칼 간의 이온-pairing 정도가 추출능의 척도가 된다.
Figure 3은 TOA의 농도 변화에 따른 IR 스펙트럼이다. TOA의 농도가 증가하면서 1,227 cm-1과 1,290 cm-1피크가 감소하였는데 이는 아크릴산 이합체 형성이 감소하는 것으로 해석할 수 있다. 즉, 아민농도가 증가하게 되면 아크릴산의 카르복실기 농도에 비해 아민기의 농도가 높아지므로 산-아민 복합체의 결합비가 (1, 1)이 되게 한다. 또한 희석제로 사용된 1-옥탄올의 극성은 (1, 1) 결합형태를 보이는 산-아민 복합체에 추가 적인 아크릴산이 결합할 수 없도록 한다. 한편 1,635 cm-1 및 1,696 cm-1 피크는 카르복실레이트 또는 카르보닐 형태의 작용기를 가지는 아크릴산과 TOA가 (1, 1)의 비율로 결합함을 의미한다. 단, 아민의 농도가 증가할수록 공액 -C-O- 형태를 가진 (1, 1) 결합 비율이 증가하고 C = O형태를 가진 (1, 1) 결합비율이 줄어듦을 알 수 있다.
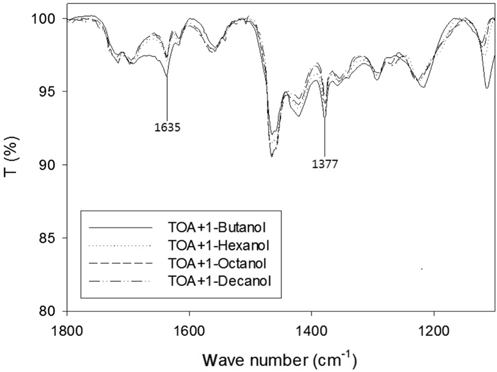
Figure 4는 희석제 극성 변화에 따른 IR 스펙트럼이다. 알콜의 사슬 길이가 길어질수록
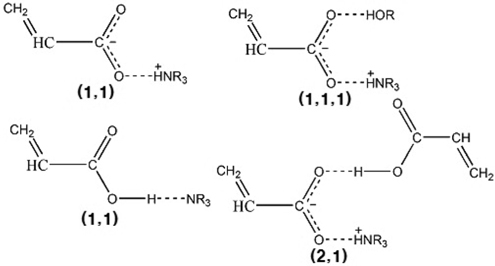
TOA에 의한 아크릴산 반응추출에 대한 평형모델식을 수 립하기 위해서는 적외선분광법 분석 결과에 의해 얻어진 산- 아민-알콜간의 (1, 1), (2, 1), 그리고 (1, 1, 1)복합체 형성과 알콜에 대한 아크릴산 일부의 물리적 추출을 가정한다.
위 식에서 A, B, D는 각각 아크릴산, 아민, 희석제를 나타내며 overbar는 유기상을 의미한다. 식 (1)과 식 (2), 식 (3)은 본 연구에서 사용한 아크릴산과 아민추출제, 희석제간의 추출평형을 나타낸 식이며, 식 (4)는 희석제를 통한 아크릴산의 물리적인 추출을 나타낸다. 이상의 식들을 앞서 보고하였던 TOA에 의한 숙신산의 반응추출 평형모델 수립 과정과 동일한 방법[10]을 적용하여 풀면 미반응 아민 농도는 식 (5)와 같다.
또한 이를 추출 후 유기상에 존재하는 아크릴산의 농도를 수용상에 존재하는 아크릴산 농도의 식으로 나타내면 식 (6)과 같아진다.
화석원료를 통해 생산되는 아크릴산을 생물학적 공정을 통해 생산하기 위해서는 효과적인 분리공정 개발을 통한 생산비용 절감이 필요하다. 본 연구에서는 3차 아민인 TOA를 알콜계 희석제에 용해시킨 유기상을 이용한 반응추출이 추출용매의 물리적 용해도 차이에 의한 추출법에 비해 아크릴산의 분리에 효과적임을 알 수 있었다. 반응추출 과정에서의 산-아민 복합체 형성은 적외선 분광법을 통해 확인할 수 있었으며 이를 바탕으로 수립된 평형모델은 아크릴산의 반응추출 평형데이터를 잘 만족하였다.
![Peak assignments[8]](http://oak.go.kr/repository/journal/13247/CJGSB2_2014_v20n2_103_t001.jpg)