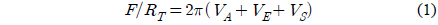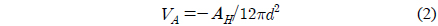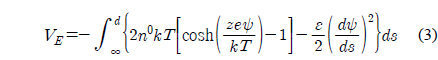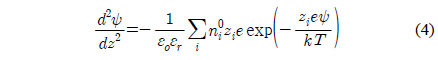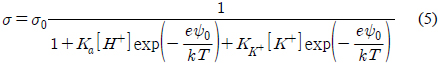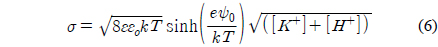지르코니아 표면에 흡착되는 금 입자의 분포 또는 그 반대 경우의 분포에 영향을 끼칠 수도 있는 정전기적 상호작용과 금 입자를 코팅한 메르캡토파이러빅산(mercaptopyruvic-acid)층의 표면물성을 규명하였다. 이를 위하여, 원자힘현미경(atomic force microscope)으로 메르캡토파이러빅산층 표면과 지르코니아표면 사이의 표면힘을 염농도와 pH값에 따라 측정하였다. 측정된 힘은 derjaguin-landau-verwey-overbeek (DLVO) 이론으로 해석되어 표면의 포텐셜과 전하밀도들이 정량적으로 산출되었다. 이 특성들이 염농도와 pH에 대하여 나타내는 의존성을 질량보존의 법칙으로 기술하였다. pH 8 조건에서 실험으로 산출된 표면 특성의 염농도 의존성은 이론적으로 예측했던 결과와 일치하는 것으로 관찰되었다. 메르캡토파이러빅산층의 표면이 지르코니아 표면보다 높은 포텐셜과 전하밀도를 갖는 것이 발견되었는데, 이는 메르캡토파이러빅산 층의 이온화-기능-그룹에 기인한 것으로 생각된다.
It is investigated that the surface properties of mercaptopyruvic-acid layer formed on gold surfaces may make an effect on the distribution of either gold particle adsorbed to the zirconia surface or vice versa. For the investigation, the atomic force microscope was used to measure the surface forces between the surfaces as a function of the salt concentration and pH value. The forces were quantitatively analyzed with the derjaguin-landau-verwey-overbeek (DLVO) theory to estimate the electrostatic properties, potential and charge density, of the surfaces for each condition of salt concentration and pH value. The estimatedvalue dependence on the salt concentration was explained with the law of mass action, and the pH dependence was interpreted with the ionizable groups on the surface. The salt concentration dependence of the surface properties, found from the measurement at pH 4 and 8, was predictable from the law. It was found that the mercaptopyruvic-acid layer had higher values for the surface charge densities and potentials than the zirconia surfaces at pH 4 and 8, which may be attributed to the ionizedfunctional-groups of the mercaptopyruvic-acid layer.
금과 지르코니아로 구성된 물질들은 표면패턴화 , 촉매 , 그리고 태양광 전지 등의 여러 가지 분야들에 응용 가능성을 가지고 있다[1-4]. 이 물질들은 빛에 의하여 태양에너지 전환에 중요한 전자전송과정을 유도하는 여기상태로 전환되는데 , 이 과정에서 물질의 활성도와 선택도는 구성물들의 분포에 따라 달라진다[5,6].
금 - 금속산화 물질을 제조하기 위하여 , 증착 및 석출 그리고 금속 이온 주입 및 소성의 방법들이 이용되었다[7-9]. 이 접근법들은 금 입자들이 지르코니아표면에 직접 증착을 가능하도록 하나 , 몇 가지 문제점들을 야기한다 . 전구체의 불균일성에 기인한 생성물의 다분산성 , 열처리로 발생되는 불균일한 뭉침 , 그리고 이온성 확산으로 나타나는 화학적 변화가 관찰되었다[6]. 이에 따라 , 금 - 지르코니아의 균일한 제조를 위하여 대안이 제시되었다[10]. 제시된 대안은 용액에서 용액상에서 균일한 크기의 금 나노입자들을 제조하고 이 나노입자들을 지르코니아 표면에 증착하는 것이다[11,12]. 이 접근법은 포스핀과 싸이올과 같은 피복리간드의 활용을 전제로 한 것이며 , 피복리간드들은 나노입자들이 표면에 응집없이 흡착된 후에 하소로 제거된다[13-15].
원자힘현미경의 출현은 표면힘 측정에 새로운 전환점이 되었다 . 원자힘현미경의 출현으로 , 콜로이드 입자와 평평한 표면 사이에 작용하는 힘을 거리에 따라 직접적으로 측정하는 것이 가능하게 되었다[16]. 거리에 대하여 측정된 힘을 derjaguin- landau-verwey-overbeek (DLVO) 이론으로 해석하여 , 관심이 있는 입자나 평평한 표면의 포텐셜과 전하밀도들이 산출될 수 있다[17]. 이 특성들은 입자들 사이에 존재하는 정전기적 작용을 나타내는 지표이며 , 금 - 지르코니아 물질의 활성도와 선택도를 좌우하는 입자분포에 영향을 끼칠 수 있다 . 지르코 니아와 상호작용하는 , 금의 표면에 피복리간드로 형성된 메르캡토파이러빅산 층 표면의 포텐셜과 전하밀도를 본 연구에서 정량적으로 규명하고자 한다 .
금 표면은 고진공 전자 빔 증발기를 이용하여 실리콘 기판에 5 nm 크롬 접착층과 100 nm 금 층을 순차적으로 증착함으로써 제조되었다 . 금 표면은 사용하기 직전에 96% 황산과 30% 과산화수소의 4:1 용액으로 5 분 동안 60~80 °C 에서 세척되었다 . 금 표면에서 메르캡토파이러빅산 층은 금 표면을 상온에서 10 mM 메르캡토파이러빅산 용액 (100 mM 질산칼륨 , pH 4) 속에 3~4 시간 동안 넣어두는 것으로 형성된다 . 용액 속에 넣어둔 후에 , 풍부한 버퍼용액으로 금 표면을 씻는다 . 메르캡토파이러빅산 층 형성은 pH 8 의 100 mM 질산칼륨 용액의 조건에서 정성적인 표면힘 측정으로 확인되었다 . 정량적인 표면 힘의 측정을 위하여 , 용액은 목적 버퍼 용액으로 대체되었다 ( 본 실험에서는 6 개의 목적 버퍼 용액들이 있다 . -pH 4 와 8 에서 각각 100, 10, 그리고 1 mM 질산칼륨 용액 ). 지르코니아 표면은 실리콘기판 위에 RF 전자관 스퍼터링을 2 kW 에서 41 분간 아르곤 - 산소 환경에서 지르코늄을 증착함으로써 형성되었다 . 스퍼터링 직전에 , 실리콘기판을 불산에 담궈 산화층을 제거하였다 . 사용 하는 총 압력은 5×10-6bar 이고 , 아르곤과 산소의 유속은 각각 6 및 1.2 dm3/min 이었다 . 기판과 지르코늄 소스의 거리는 7 cm 이며 지르코늄소스의 직경은 20 cm 이다 . 지르코니아층 표면의 형태는 금 표면의 형태와 동일했다 .
형태의 시각화와 표면힘의 측정은 닫힌 되먹임 압전소자로 구성된 3-D Molecular Force Probe 원자힘현미경 (Asylum Research, Santa Barbara, CA) 으로 수행되었다 . 곡률반경이 20 nm 인 미세제조된 질화실리콘 외팔보 (Olympus, Shinjuku-ku, Tokyo, Japan) 가 형태의 시각화와 정성적인 표면힘 측정에 이 용되었다 . 정량적인 표면힘 측정은 3 μm 직경의 지르코니아 구 (Microspheres-Nanospheres, Cold Spring, NY) 가 부착된 외팔보로 수행되었다 (Figure 1). 지르코니아 구는 UV- 경화 접착제 (Norland Products, New Brunswick, NJ) 를 통해 외팔보 끝의 중앙에 부착되었다 . UV 오존 세척기 (Jelight, Irvine, CA) 가 이용되어 , 접착제의 경화와 외팔보의 세정이 동시에 수행되었다 . 세척기의 처리가 외팔보의 반응에 변화를 일으키지 않는 것으로 관찰되었다 . 외팔보의 탄성계수는 열진동수 스펙트럼을 측정하여 결정되었다[18]. 외팔보의 탄성계수는 외팔보의 열진동수 스펙트럼으로부터 결정되었으며 , 0.02 N/m 인 것으로 밝혀졌다 .
이론적으로 정전기적 이중층의 상호작용을 기술한 DLVO 이론이 발전한 이후로 , 많은 연구자들에 의하여 표면힘들이 이 이론으로 분석되었다[19]. 이론에 따르면 , 두 개의 편평한 판들 사이의 상호작용 에너지는 반데르발스 에너지 (
반데르발스 에너지는 억제되지 않는 조건에서 다음의 식으로 나타낸다[25]
여기에서
여기에서
식 (4) 와 같은 비선형식의 해는 수치해석기법으로 구하며 , 식 (3) 의 적분은 간단한 심슨의 3/8 법칙과 같은 방법으로 쉽 게 수행된다[31]. 식 (1) 에서의
원자힘현미경으로 금 표면 위에 형성된 메르캡토파이러빅산 층의 표면구조가 파악되었다 . 일정한 힘이 외팔보에 유지 되도록 닫힌 되먹임이 주어진 조건에서 금표면 , 메르캡토파 이러빅산 층의 표면 , 그리고 지르코니아 표면이 시각화되었다 . 이 세 가지 표면의 형태는 다결정구조이며 거친 정도는 1.5 nm 로 동일하게 나타났으므로 , 이 세 가지 표면은 본질적으로 구분이 되지 않았다 . 표면에서 특정한 영역이 존재하면 , 인지 질층의 표면에서처럼 원자힘현미경에 의하여 초미세크기의 범위에서 그 영역이 관찰된다[33]. 금표면 위에 형성된 메르캡토파이러빅산 층의 표면에서는 특정한 영역이 관찰되지 않았으므로 , 형성된 층이 균일함을 알 수 있다 .
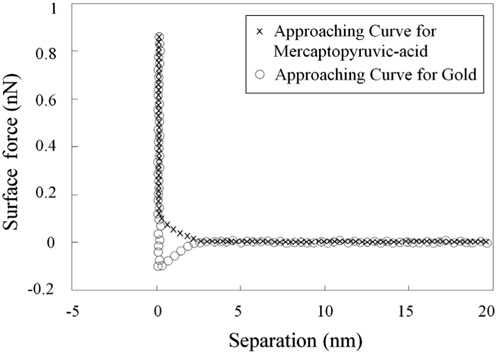
메르캡토파이러빅산 층의 형성은 20 nm 곡률반경의 외팔보로 금표면과 금표면 위에 형성된 메르캡토파이러빅산 층 표면에서 표면힘을 측정함으로써 확인할 수 있다 (Figure 2). 메르캡토파이러빅산 층에서 측정된 표면힘은 표면과 2.0 nm 떨어진 지점으로부터 대략 0.2 nN 의 척력이 특징적으로 존재 하고 있다 . 그와 반면에 , 금표면에서 측정된 힘은 순수하게 인력인 것으로 확인되었다 . 금표면에서 관찰되지 않았던 짧은 거리의 척력은 이온화 그룹이 더 많은 메르캡토파이러빅 산 층 표면에서 더 많은 수화의 존재가 원인인 것으로 판단된다[26]. 측정된 표면힘의 명확한 차이점은 메르캡토파이러빅산 층의 형성을 나타내고 있다 .
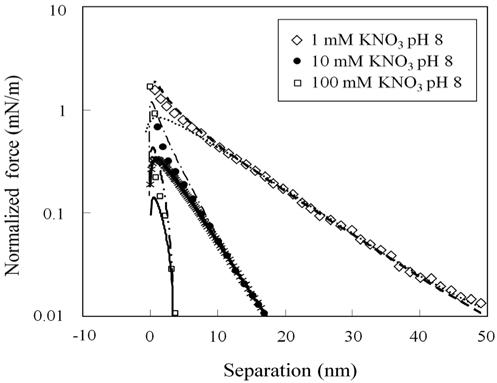
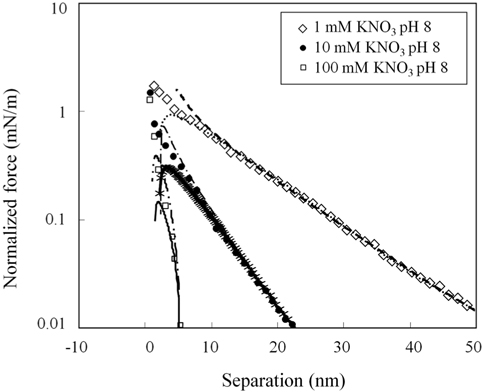
메르캡토파이러빅산 층 표면의 포텐셜과 전하밀도에 대한 정량적인 해석을 위하여 , 3 μm 직경의 지르코니아 구와 편평한 지르코니아 사이의 표면힘을 측정하고 해석하여 지르코니아 표면의 전하밀도와 포텐셜을 먼저 산출한다 .Figure 3은 pH 8 에서의 표면힘 측정결과를 제시하고 있다 . 원거리 영역 표면힘은 순수하게 척력성이고 , 힘이 미치는 범위는 용액의 이온농도에 의존성을 보이고 있다 . 척력의 거리에 대한 의존성은 수용액에서 전하성 표면들 사이에 존재하는 이중층 힘과 같이 지수함수의 경향을 나타내고 있다 . 2 nm 보다 작은 거리에서 명확하게 관찰되는 근거리 척력은 표면의 입체척력과 표면 고유의 거친 형상에 의해 나타나는 것으로 판단된다[34,35]. 이와 같은 거동은 다른 pH 값들에서도 동일하게 나타나고 있다 .
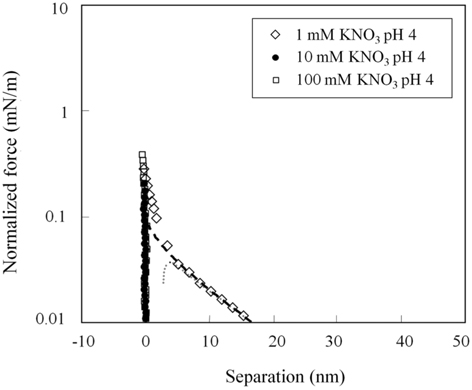
그러나 , 원거리 척력은 pH 4 에서 pH 8 에서와는 크게 다른 양상을 보이고 있다 .Figure 4에서 보이는 것처럼 , 1 mM 질산 칼륨 pH 4 용액에서는 원거리 척력이 존재하였으나 다른 두가지 pH 에서보다 매우 작은 값으로 관찰되었다 . 또한 , 다른 두 가지 질산칼륨농도에서는 원거리 척력이 관찰되지 않고 있다 . 즉 , pH 4 의 10 과 100 mM 질산칼륨 용액에서 원거리 영역의 정전기적 힘은 더 이상 표면힘의 주된 성분으로 작용하지 않는 것으로 보인다 . 이 결과는 아마도 지르코니아의 등전점에 기인한 것으로 판단된다 . pH 4 의 10 과 100 mM 질산칼륨 용액에서는 원거리 척력이 관찰되지 않았으므로 , 표면힘이 DLVO 이론으로 해석되지 않았으며 표면포텐셜과 표면전하밀도가 산출되지 않았다 .
원거리 척력의 해석을 위한 경계조건으로 , 두 가지 극한 - 표면의 포텐셜 혹은 전하밀도가 고정된 조건 - 이 이용된다 .
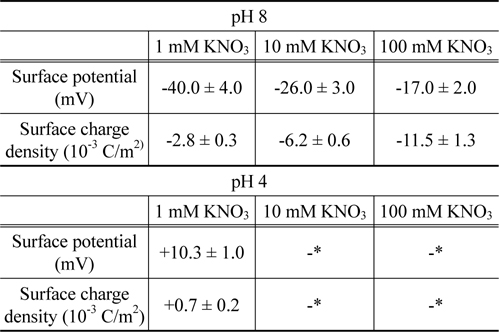
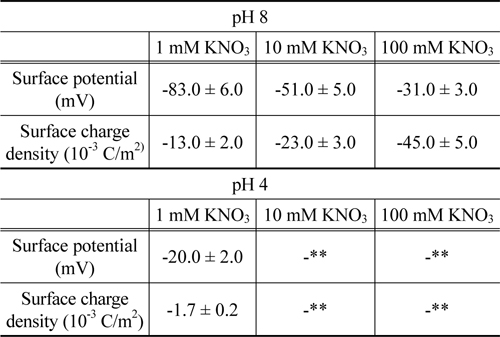
경계조건으로부터 , 이들 표면물성들이 결정되었으며 그 결과는Table 1에 요약되어 있다 . pH 8 에서 지르코니아의 표면 포텐셜은 -10~-100 mV 의 범위에서 나타나고 있다 . 이 결과는 예전에 발표했던 연구결과와 일치함을 보이고 있다[36]. pH 8 에서 pH 4 로 변경됨에 따라 , 음의 값에서 양의 값으로 전환되는 것은 pH 5.5 의 등전점에 따라 나타나는 결과이다[37].
[Table 1.] Electrostatic properties of the zirconia surfaces
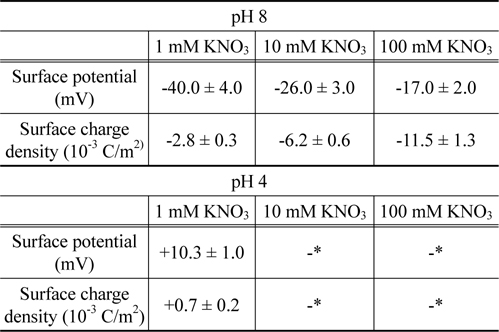
Electrostatic properties of the zirconia surfaces
Table 1에서 볼 수 있는 것처럼 , pH 8 에서 용액의 이온농도 감소에 따라 , 지르코니아 표면의 포텐셜은 단조롭게 증가하나 표면의 전하밀도는 단조롭게 감소하였다 . 이 특성은 Pashley가 제안한 모형으로 설명될 수 있다[38]. 이 모형은 질량보존의 법칙을 도출되었으며 , 표면 전하밀도 ( σ ), 표면 포텐셜 (
여기에서 σ
메르캡토파이러빅산 층이 형성된 후에 , 지르코니아 구가 부착된 외팔보로 표면힘이 측정되었고 측정된 힘의 원거리 영역은 DLVO 이론으로 해석되었다 . pH 8 에서 측정된 표면힘의 결과가 Figure 5에 나타나 있다 . 원거리 영역의 표면힘은 순수하게 척력성이며 이온농도에 따라 이중층 힘의 경향과 일치하게 변화되고 있다 . pH 의 값에 따라 척력의 크기가 다르게 나타나는 원인은 메르캡토파이러빅산의 이온화 그룹에 기인한다 . pH 8 에서 아민그룹이 수소양이온을 방출하게 되나 , 카르복시그룹은 여전히 음이온성이기 때문이다 .Table 2는 pH 값과 이온농도에 따라 메르캡토파이러빅산 층 표면의 포텐셜과 전하밀도를 제시하고 있다 . 이 특성들도 또한 Pashley 가 제시한 모형에 일치하는 경향을 나타내고 있다 . pH 4 의 1 mM 질산칼륨용액에서 원거리 영역의 힘은 관찰되지 않았다 . 이는 메르캡토파이러빅산의 pKa값과 지르코니아의 등전점을 고려하여 이미 예측되었다 . 그리고 , pH 4 의 10 과 100 mM 질산칼륨 용액에서 또한 원거리 영역의 힘이 보이지 않았다.
[Table 2.] Electrostatic properties of the Mercaptopyruvic-acid layer
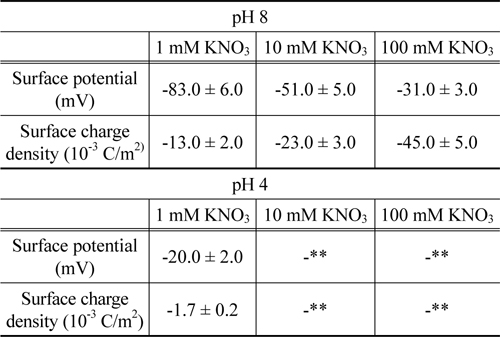
Electrostatic properties of the Mercaptopyruvic-acid layer
위에 제시된 결과들은 금표면 위에 형성된 메르캡토파이러빅산 층과 지르코니아 표면 사이에 정전기적인 힘을 이온농도와 pH 값을 통하여 제어할 수 있음을 시사하고 있다 . 그러므로 , 메르캡토파이러빅산으로 코팅된 금표면 위에 지르코니아 입자들이 흡착되거나 혹 그 반대의 경우에 , 흡착되는 입자 속도의 조절이 가능할 수 있다 . 더 나아가 , 입자들이 표면에 흡착되는 분포를 조절할 수도 있다 . 그러므로 , 이온농도와 pH 값에 따른 표면힘은 표면에 존재하는 입자들의 분포를 설계함에 있어서 중요한 것으로 여겨진다 . 그리고 , 이 분포는 지르코니아 - 금 복합물질의 활성에 영향을 끼치므로 , 두 물질 표면 각각의 특성과 복합물질의 활성 사이에 밀접한 관련성이 있음을 유추할 수 있다 .
금 표면 위에 형성된 메르캡토파이러빅산 층과 지르코니아 표면 사이의 표면힘들이 이온농도와 pH 값에 따라서 측정되었고 , DLVO 이론으로 해석하여 표면의 포텐셜과 전하밀도를 정량적으로 산출하였다 . 그리고 , 각 조건에 따른 이 특성들이 질량보존의 법칙과 일치하는지 확인하였다 . 본 연구에서 파악된 정량적인 포텐셜과 전하밀도는 지르코니아 입자들과 금 표면 위에 형성된 메르캡토파이러빅산 층 사이의 상호작용에 대한 지표로서 입자들이 층 위에 균등한 배열에 영향을 끼치게 된다 . 입자들의 배열 후 , 하소를 통해 지르코니아 - 금 복합체가 제조될 수 있다 . 따라서 , 궁극적으로 본 연구의 결과는 지르코니아 - 금 복합체 형성을 제어하는 지표로 응용될 수 있다 .