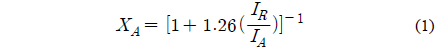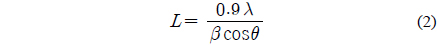본 연구에서는 나노 크기의 결정 구조를 가진 타이타니아 담체를 용매열합성법(solvothermal method)을 활용하여 합성한 후 팔라듐과 구리를 담지한 촉매를 제조하였다. 제조된 촉매를 수중 질산성 질소 저감 반응에 적용한 결과, 타이타니아 담체의 결정 크기가 반응 활성에 영향을 미치는 것이 확인되었다. 결정 크기가 작은 담체를 활용한 촉매가 더 빠른 속도로 질산성 질소를 저감하였지만, 반응 중 pH가 높게 형성되어 질소 선택도가 매우 낮은 현상을 보였다. 이를 해결하기 위해 pH 완충제인 이산화탄소를 공급하여 질소 선택도를 약 60% 증가시켰다. 상기에 언급한 촉매를 대상으로 질소 흡-탈착, X-ray diffraction (XRD), H2-temperature programmed reduction (TPR), X-ray photoelectron spectroscopy (XPS) 등의 다양한 특성화 분석을 수행하여 촉매의 반응활성과 물성간의 상관관계에 대해 조사하였다.
In this study, we synthesized TiO2 supports with nanosized crystalline structure by solvothermal method and prepared TiO2 supported Pd-Cu catalysts. It was shown that the crystalline size of TiO2 support in the catalyst influenced on the catalytic activity of nitrate reduction in water. The catalyst with the smaller crystalline size of TiO2 support presented faster nitrate reduction rate, but had low nitrogen selectivity due to high pH environment of reaction medium during the reaction. Through injection of carbon dioxide as a pH buffer, the nitrogen selectivity increased by about 60%. Furthermore, we investigated that the relationships between the catalytic performance and the physicochemical properties of the prepared catalysts characterized by N2 adsoprtion-desorption, X-ray diffraction (XRD), H2-temperature programmed reduction (TPR), X-ray photoelectron spectroscopy (XPS).
최근 토양 내 농업 비료의 침출, 산업 폐수의 과도한 방류 등으로 인해 수계 내 질산성 질소의 농도가 점차 높아지고 있는 실정이다[1,2]. 수중 질산성 질소는 적조 현상, 부영영화 등 다양한 수중 오염의 원인이 되고 있다. 특히 질산성 질소가 유아의 체내에 흡수될 경우 아질산성 질소로 환원이 발생하며, 생성된 아질산성 질소가 인체 내 헤모글로빈의 작용을 방해하여, 결국 질식에 이르게 하는 청색증을 발병시키는 것으로 알려져 있다[3,4]. 질산성 질소의 유해성에 대한 보고가 점차 증가함에 따라, 세계보건기구(world health organization, WHO), 유럽공동체(european community, EU)에서 음용수 내 질산성 질소 규제치를 각각 25, 50 ppm으로 설정하였다[5,6].
질산성 질소를 저감하기 위하여 다양한 방법들이 적용되어왔고, 이온교환, 전기영동, 역삼투압법 등과 같은 물리화학적공정 및 미생물을 이용한 생물학적 방법 등이 개발되어 왔다[7]. 하지만 물리화학적 방법은 처리 후 잔류한 고농도의 담수를 추가 처리해야 하고, 생물학적 방법 또한 처리수 내 공생해있는 미생물을 재처리해야 하는 등 공정의 효율성에 대한 단점이 부각되고 있다[8,9]. 이에 Tacke[10]는 촉매를 적용한 질산성 질소 제거 공법을 제시하였다. 상기 공정은 상온, 상압에서 효과적으로 질산성 질소를 저감할 수 있는 장점을 가지고 있어 최근 큰 주목을 받고 있다[11].
촉매를 활용한 질산성 질소 저감 반응 경로는 다음과 같다. 적합한 촉매와 환원제의 적용을 통해 질산성 질소는 우선 아질산성 질소로 환원되고, 아질산성 질소가 질소 혹은 암모늄으로 전환되는 반응 경로를 나타낸다[12]. 촉매의 활성 금속은 대체로 귀금속-비귀금속 계로 구성된 이중 금속이 사용되고 있다. 이는 촉매 상 질산성 질소 저감 반응의 메커니즘과 관련이 있다. 질산성 질소는 비귀금속 상에서 귀금속에 화학흡착된 수소와 반응하여 아질산성 질소로 전환된 후, 귀금속 상에서 최종 생성물로 환원되는 반응 과정을 보인다[13]. 귀금속으로 팔라듐 혹은 백금, 비귀금속으로 구리, 주석, 인듐 등이 활용되는데[14-16], 이 중 팔라듐-구리 조합이 가장 우수한 성능을 나타내는 것으로 보고되었다[17,18]. 촉매의 담체는 알루미나[19], 지크로니아[20], 활성 탄소[21], 세리아[22], 실리카[10], 하이드로탈사이트[23], 타이타니아[24] 등 다양한 물질들이 적용되었고, 이 중 타이타니아 담체가 질산성 질소를 빠른 속도로 저감하는데 효과적으로 활용되었다.
본 연구진은 질산성 질소 저감에 효과적인 물질로 보고된 활성 금속과 담체를 조합하여 Pd-Cu/TiO2 촉매를 제조한 바있다[25]. Pd-Cu/TiO2 촉매를 질산성 질소 저감 반응에 적용한 결과, 촉매 내에서 금속-담체 간의 상호 작용이 강할수록 우수한 촉매 활성을 나타냈다. 따라서 촉매 내 물성 제어를 통하여 강한 금속-담체간의 상호 작용을 유도하는 것은 활성 증진의 요인이 될 것으로 판단되었다.
Weerachawanasak et al.[26]은 다양한 결정 크기를 가진 타이타니아 담체를 합성하여 Pd/TiO2 촉매를 제조하였고, 담체의 결정 크기에 따라 금속-담체간의 상호 작용이 다른 경향을 가지는 현상을 보고하였다. 따라서 타이타니아 담체의 결정크기를 달리한 Pd-Cu/TiO2 촉매를 질산성 질소 저감 반응에 적용하여, 활성에 적합한 타이타니아 담체의 물성을 탐색하는 것은 중요하다고 할 수 있다. 본 연구에서는 용매열합성법을 적용하여 타이타니아 담체의 결정 크기를 제어하였고, 이에 팔라듐 및 구리를 담지한 촉매의 물성과 수중 질산성 질소저감 반응의 활성간의 상관 관계에 대해 조사하였다.
타이타니아 담체는 용매열합성법(solvothermal method)을 적용하여 제조하였다[27,28]. 25 g의 타이타늄 부톡사이드(titanium butoxide)를 반응용매인 1,4-부탄다이올(1,4-butanediol) 100 mL에 혼합한 후 테플론으로 내부 코팅된 고압반응기에 주입하였다. 내부 공기를 제거하기 위하여 초고순도 질소를 이용하여 퍼지하였으며, 그 후 250 ℃로 가열하였다. 목표 온도에 도달한 후 결정 크기가 다른 담체를 제조하기 위해, 타이타늄 출발물질과 반응용매의 교반 시간을 1, 3시간으로 차이를 두었다. 교반이 끝난 후 상온으로 냉각한 다음, 생성물을 메탄올로 세척하고 90 ℃에서 24시간 동안 건조하였다. 건조된 물질을 600 ℃에서 2시간 동안 소성한 후 담체 제조를 완료하였다.
제조된 담체에 증착 담지법(deposition-precipitation method)을 사용하여 팔라듐 및 구리를 담지하였다[29,30]. 금속 출발물질로 팔라듐 클로라이드(PdCl2), 구리 클로라이드(CuCl2)를 활용하였고, 목표 담지량에 해당하는 금속 전구체를 500 mL의 0.01 M 염산 수용액에 타이타니아 담체와 같이 혼합하였다. 반응물을 75 ℃로 승온하는 동시에 침전제인 1 M의 소듐 카보네이트(Na2CO3)를 일정한 속도로 주입하여 pH 10으로 제어하였다. 3시간 동안 교반한 후, 3차 증류수로 금속 출발 물질의 클로라이드기가 제거될 때까지 세척하였다. 90 ℃에서 24시간 동안 건조하고, 공기 분위기에서 300 ℃ 소성을 4시간 동안 수행한 후, 200 ℃에서 10% H2/N2 가스를 활용하여 환원 처리를 하여 촉매 제조를 완료하였다.
촉매 상 활성금속의 정량 측정을 위하여 Inductively coupled plasma atomic emission spectroscopy (ICP-AES) 분석(Jobin Yvon 사, 138 Ultrace)을 수행하였다. 또한 질소 흡-탈착 분석(Micromeritics사, ASAP 2010)을 통해 촉매의 비표면적을 측정하였다. 분석 전, 3 mmHg 이하에서 24시간 동안 150 ℃로 가열하는 전처리 과정을 통해 촉매 기공 내 수분 및 불순물을 제거하였다. 타이타늄 및 팔라듐, 구리의 결정 구조와 담체의 결정 크기를 확인하기 위해 X-ray diffraction (Rigaku사, Rotaflex)분석을 수행하였다. 40 kV, 150 mA의 X선을 사용하였고, 스캔 범위는 20~80°, 스캔 간격은 0.01°, 스캔 속도는 2°/분으로 적용하였다. 제조된 촉매의 환원성을 관찰하기 위해 BELCAT-M-77 (BEL JAPAN Inc.)을 이용하여 H2-temperature programmed re-duction (TPR)분석을 수행하였다. 0.15 g의 샘플을 헬륨을 이용하여 200 ℃에서 30분 동안 전처리하였고 50 ℃로 냉각시켰다. 그 후 5% H2/N2 혼합기체를 활용하여 750 ℃까지 10 ℃/분의 속도로 승온하며 TPR 분석을 수행하였다. 또한 X-ray photoelectron spectroscopy (XPS)분석을 통해 촉매 내 구성 원소의 화학적 상태를 관찰하였고, C1s의 결합에너지(284.6 eV)를 이용하여 보정하였다.
제조된 촉매의 반응 활성을 평가하기 위하여, 반회분식 반응기를 활용하였다. 상온, 상압의 반응 조건에서 실험을 수행하였으며, 환원제로써 수소를 사용하였다. 초기에 295 mL의 증류수와 0.15 g의 촉매가 혼합된 용액을 반응기에 주입하였고, 700의 분당 회전수로 교반하였다. 초고순도 질소를 이용하여 잔류해 있는 공기를 퍼징한 후, 2 mM의 농도를 목표로 5 mL의 반응물을 주입하여 반응을 시작하였다. 동시에 90 mL/min 유량으로 수소를 공급하였다. 반응 중 pH의 변화를 관찰하기 위하여, 반응기 내에 pH 전극을 설치하였고, 이산화탄소를 pH 완충제로 사용하여 질소의 선택도 향상을 도모하였다. 반응 후 미전환된 질산성 질소 및 생성된 아질산성 질소의 농도는 액체 크로마토그래피(Zorbax Eclipse C18 컬럼)를 이용하여 측정하였고, 암모늄은 이온 크로마토그래피(Ionpac CS12A 컬럼)로 분석하였다.
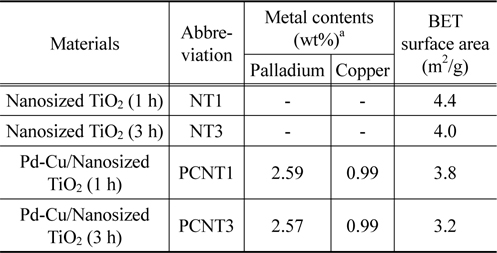
촉매 제조 중에 적용된 교반 시간에 따라 각 담체 및 촉매를 분류하였고, 표 1에 제조된 담체 및 촉매의 약어가 기재되었다. ICP-AES 결과에 따르면, 팔라듐 및 구리의 담지량은 각각 2.6, 1 wt% 로써 일정하게 담지된 것으로 확인되었다. 비표면적은 NT1이 NT3에 비해 높은 것으로 나타났고, 금속 담지 후에는 약 0.6~0.8 m2/g이 줄어들었다.

ICP-AES results and BET properties of the synthesized TiO2 supports and prepared catalysts Materials Abbreviation Metal contents
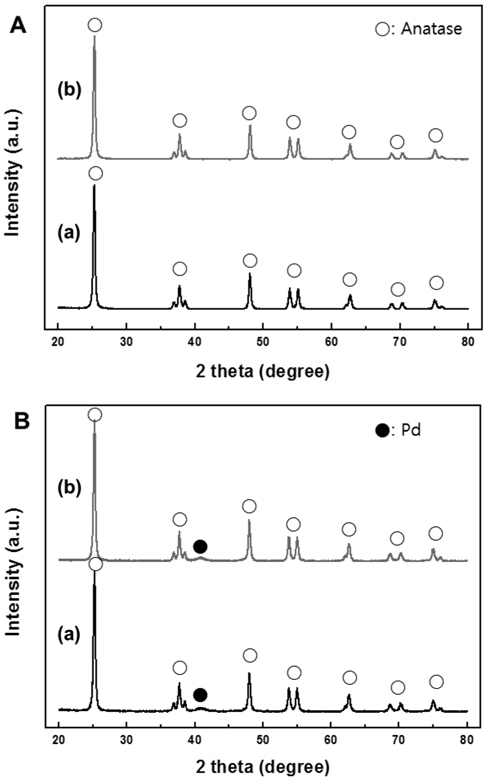
Figure 1에 NT1, NT3, PCNT1, PCNT3의 X-ray diffraction (XRD)분석 결과를 도시하였다. 담체의 경우, 2
PCNT1과 PCNT3 또한 담체와 동일한 위치에서 아나타제상의 회절 피크가 보였고, 같은 아나타제 상 비율을 가지는 것으로 나타났다. 구리의 특성 피크는 관찰되지 않았고, 이는 1 wt%의 담지량이 XRD 분석의 검출 한계보다 낮은 것이 원인인 것으로 파악되었다. 반면에 금속 상태의 팔라듐 특성 회절 피크(JCPDS 번호: 87-0639)가 약 41°에서 나타났다.
NT1, NT3, PCNT1, PCNT3에서의 TiO2 담체의 결정 크기는 Scherrer 방정식으로 계산하였다. Scherrer 방정식은 하기 식 (2)와 같으며, 식 내의 L은 TiO2 담체의 결정 크기, λ는 분석에 적용된 X-선의 파장, β는 특성 피크의 반가폭, 그리고 θ는 피크의 세기가 가장 큰 지점에서의 회절각을 나타낸다[32]. 계산 결과, NT1, NT3, PCNT1, PCNT3의 평균 결정 크기는 각각 20.8, 22.6, 21.4, 23.3 nm으로 나타났다. 촉매 제조 중, 교반시간이 길수록 담체의 결정 크기가 커졌고, 팔라듐 및 구리의 담지 후 담체에 비해 0.6~0.7 nm 가량 크기가 증가하였다.
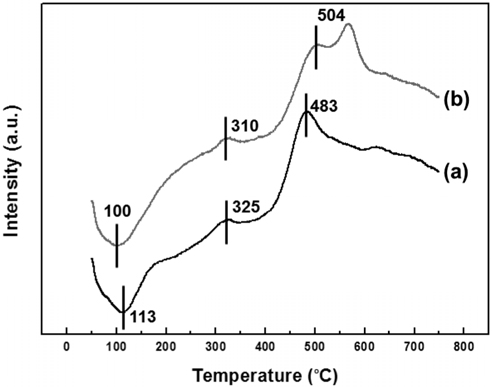
Figure 2는 타이타니아 담체의 결정 크기에 따른 촉매의 환원성 변화를 관찰하기 위하여 H2-temperature programmed reduction (TPR)분석을 수행한 결과이다. 두 촉매 모두 50~150 ℃에서 음 피크가 나타났고, 이는 팔라듐 하이드라이드가 분해되는 것이다[33]. 구리의 환원 피크는 300 ℃ 부근에서 관찰되었고[34], 450 ℃ 이상에서 타이타니아 담체의 환원 피크가 나타났다. 두 촉매의 환원 피크는 차이를 보이는데, PCNT1은 PCNT3보다 높은 온도에서 금속 환원 피크가 형성되었고, 낮은 온도에서 담체 환원 피크가 관찰되었다. 이는 금속과 담체간의 상호 작용이 강한 경우 발생하는 현상으로써[25], 타이타니아 담체의 결정 크기가 작은 PCNT1에서 더 강한 상호작용이 발생한 것으로 판단되었다.
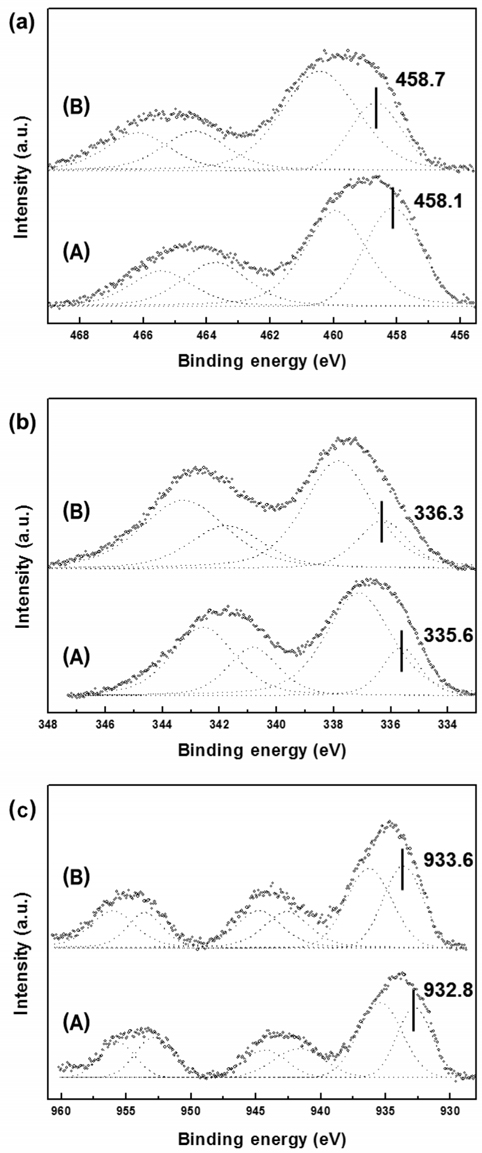
PCNT1 및 PCNT3 촉매 내 각 원소의 화학적 상태를 파악하기 위하여 X-ray photoelectron spectroscopy (XPS)분석을 수행하였다(Figure 3). Figure 3(a)의 타이타늄 2p3/2 스펙트럼은 두 개의 피크로 디컨볼루션 되는데, 결합에너지의 값이 낮은 피크에서 타이타늄 3가의 생성 여부를 확인할 수 있다. PCNT1 및 PCNT3의 결합에너지는 각각 458.1, 458.7 eV로 관찰되었다. 4가의 타이타늄(IV) 산화물(TiO2)은 458.6 eV, 3가의 타이타늄(III) 산화물(Ti2O3)은 457.8 eV의 결합에너지를 가지는 것으로 알려져 있다. PCNT1이 PCNT3에 비해 타이타늄 3가에 가까운 상태를 보였다. 이는 PCNT1 상에서 담체와 금속간의 상호작용이 강하여, 타이타늄 담체의 부분적인 환원 정도가 PCNT3보다 큰 것이 원인으로 파악되었다. 또한 PCNT1이 PCNT3에 비해 담체 표면에 산소 공공(oxygen vacancy)이 많이 생성된 것을 의미한다[35].
상기 현상은 두 촉매의 팔라듐 및 구리 XPS 분석 결과에서도 관찰되었다. PCNT1과 PCNT3의 팔라듐 3d5/2 XPS 스펙트럼의 결합에너지는 각각 335.6, 336.3 eV에 위치하였다. PCNT1 피크는 금속 팔라듐(Pd0)의 결합에너지(335.2 eV)와 2가의 팔라듐 산화물(Pd2+O)의 결합에너지(336.2 eV) 사이에 위치하는 데, PCNT3에 비해 금속 상태에 근접하였다. PCNT1의 구리피크는 932.8 eV에 위치하였고, 금속 구리(Cu0)의 결합에너지에 정확히 일치하였다. 반면 PCNT3은 933.6 eV의 결합에너지를 가졌고, 2가의 구리 산화물(Cu2+O)의 결합에너지(934.1 eV)에 가까웠다. PCNT1 내 금속의 화학적 상태가 PCNT3에 비해 0가에 근접한 이유는, 타이타니아 담체가 환원(Ti4+ → Ti3+)되는 과정 중 발생한 전자가 금속에 영향을 미치는 현상에서 원인을 찾을 수 있다[36]. 타이타니아 담체의 환원 정도가 큰 PCNT1에서, 담체에서 금속으로의 전자의 이동이 PCNT3에 비해 활발하여 0가에 가까운 상태를 보인 것으로 파악되었다. 상기 XPS 결과는 PCNT1에서 더 강한 담체-금속간 상호작용이 존재한다는 H2-TPR 결과를 명확하게 하는 것으로 판단된다.
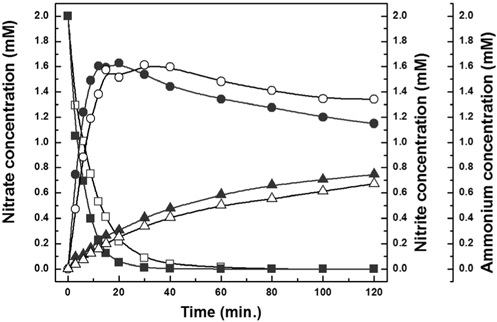
촉매 상에 존재하는 금속-담체 간의 상호 작용이 수중 질산성 질소 저감 반응에 미치는 영향을 파악하기 위하여, 제조된 촉매를 대상으로 실험을 수행하였다. Figure 4에 반응 시간에 따른 반응물(질산성 질소) 및 생성물(아질산성 질소, 암모늄)의 농도 변화를 도시하였다. PCNT1과 PCNT3의 초기 반응속도(정의: 초기 3분 동안 촉매의 질량 별 저감된 질산성 질소 농도)는 각각 2.11, 1.56 mmol/min/gcat으로 계산되었고, 두촉매 모두 선행 문헌에서 개발된 촉매의 초기 반응 속도인 0.41 mmol/min/gcat 보다 매우 높은 값을 가졌다. PCNT1 및 PCNT3 상에서 질산성 질소를 완전히 저감하는데 소요되는 시간은 각각 30, 40분으로 관찰되었다. PCNT1이 PCNT3에 비해 빠른 반응 속도를 보였는데, 이에 따라 생성물인 아질산성질소 및 암모늄의 농도는 PCNT1에서 높은 것으로 관찰되었다. 반응 시간 120분 경과 후, 반응 중 발생하는 아질산성 질소 및 암모늄의 농도가 생성물 중 높은 비중을 차지함에 따라, PCNT1과 PCNT3은 각각 5, 1%의 낮은 질소 선택도를 보였다. 이는 반응 후 높게 형성된 pH (13.5 이상)가 원인으로 파악되었다. 반응 중 pH는 질산성 질소가 저감됨에 따라 발생하는 수산화기에 의하여 증가하게 되는데, 높은 pH가 형성된 환경에서 아질산성 질소의 전환 속도가 감소되는 것으로 알려져 있다[16,20]. 이러한 문제점을 해결하기 위해, 최근 이산화탄소를 pH 완충제로 활용하여 환원제인 수소와 같이 공급하는 방법이 적용되었다[37].
Figure 5는 우수한 활성을 보였던 PCNT1에 일정한 유량의 수소와 다양한 유량의 이산화탄소를 주입한 조건에서의 반응결과이다. 질산성 질소는 이산화탄소의 유량이 증가함에 따라 점차 느린 속도로 전환되었다. 반면 아질산성 질소와 암모늄은 이산화탄소 유량이 클수록 생성량이 저감되었다. 이는 pH 완충제인 이산화탄소의 공급으로 인해 반응물의 pH가 6 이하로 낮아짐에 따라, 아질산성 질소가 축적되지 않고 빨리 전환되는 것이 원인인 것으로 파악되었다. 다양한 이산화탄소 공급 유량 중, 수소와 이산화탄소를 90 : 30 mL/min의 비율로 공급한 조건이 우수한 결과를 보였고, PCNT1의 최종 질소 선택도는 63%로 약 60% 증가한 결과가 관찰되었다.
앞서 언급한 바와 같이 질산성 질소 저감에 이중 금속 촉매 성분 중 비귀금속이 중요한 역할을 하므로, 반응에 적합한 비 귀금속의 특성에 관한 연구가 지속적으로 수행되어왔다. Pd-Cu 계 촉매의 경우, 금속 상태의 구리에서 질산성 질소가 효과적 으로 저감되는 결과가 보고된 바 있다[38]. 본 연구진의 선행 연구에 의하면, 아나타제 상을 가진 타이타니아 담체가 활용된 촉매에서 강한 금속-담체 간의 상호 작용이 관찰되었다[25]. 이로 인해 타이타니아 담체에서 금속으로의 전자 이동이 발생하여, 구리의 화학적 상태가 금속에 가까운 것으로 나타났다. 반면 루타일 상을 가진 타이타니아 담체가 포함된 촉매는 구리 산화물이 생성되었다. 두 촉매 중 상기에 언급한 바와 같이, 금속 상태에 가까운 구리를 가진 촉매에서 매우 우수한 활성이 관찰되었다. 따라서 강한 금속-담체간의 상호 작용을 유도하여 금속 상태의 구리를 생성하는 것이 활성 증진에 중요한 요인인 것으로 판단되었다. 활성 금속 외에 질산성 질소저감 반응 활성에 영향을 미치는 다른 요인으로 담체 표면에 생성되는 산소 공공(oxygen vacancy)이 알려져 있다[39,40]. 문헌에 의하면 산소 공공에 질산성 질소가 약하게 결합되어, 질산성 질소의 전환이 보다 용이하게 되는 현상이 발생하였다. 따라서 H2-TPR 및 XPS 분석 결과에서 확인된 바와 같이, 강한 금속-담체 간의 상호 작용이 존재하는 PCNT1이 PCNT3보다 금속 상태의 구리와 타이타니아 담체에 산소 공공을 가지고 있으므로 더 우수한 활성을 가지는 것으로 파악되었다.
본 연구에서는 나노 크기의 결정을 가진 타이타니아 담체에 일정한 양의 팔라듐과 구리를 담지한 촉매를 대상으로 실험을 수행하여, 타이타니아 담체의 결정 크기가 수중 질산성질소 저감 반응에 미치는 영향을 조사하였다. XRD 분석 결과에 따르면, 담체 제조 시 적용한 타이타늄 출발 물질과 반응 용매의 교반 시간에 따라 담체의 결정 크기가 달라졌다. 1, 3시간 동안 교반한 결과, 각각 20.8, 22.6 nm의 결정 크기를 가진 타이타니아 담체가 제조되었고, 활성 금속의 담지 후에 0.6~0.7 nm 가량 그 크기가 증가하였다. H2-TPR 및 XPS 결과를 통해 담체의 결정 크기가 작은 PCNT1이 PCNT3에 비해 강한 금속-담체 간의 상호 작용을 가지는 것으로 확인되었다. 순수 수소공급 조건에서, PCNT1이 PCNT3보다 질산성 질소가 빨리 저감되었지만, 반응 중 급격히 생성된 수산화기로 인해 반응물의 pH가 증가하였다. 이로 인해 아질산성 질소가 느리게 전환되고, 암모늄의 생성이 많아지는 현상을 보여 질소로의 선택적인 반응이 이루어지지 않았다. pH의 완충 작용을 위해 이산화탄소를 수소와 함께 공급하였고, PCNT1에서 100%의 질산성 질소전환율, 63%의 질소 선택도를 확보하였다. 이러한 PCNT1에서의 우수한 반응 활성은 강한 금속-담체간의 상호 작용으로 인하여 본 반응의 활성종인 금속 상태의 구리 및 타이타늄 담체 상 산소 공공이 생성되었기 때문인 것으로 파악되었다.