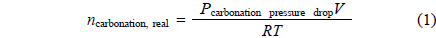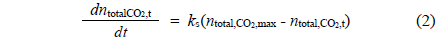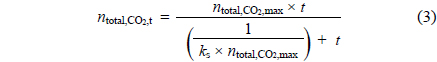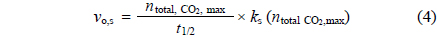In this study, the Mg(OH)2 slurry was made form ferro-nickel slag and then used for CO2 sequestration. The experiments were in the order as leaching step, precipitation, carbonation experiments. According to the leaching results, the optimal leaching conditions were H2SO4 concentration of 1 M and the temperature of 333 K. In the Mg(OH)2 manufacturing step, NaOH was added to increase the pH upto 8, the first precipitation was confirmed as Fe2O3. After removal the first precipitation, the pH was upto 11, the Mg(OH)2 was generated by XRD analysis. The Mg(OH)2 slurry was used for CO2 sequestration. The pseudo-second-order carbonation model was used to apply for CO2 sequestration. The CO2 sequestration rate was increased by the CO2 partial pressure and temperature. However, CO2 sequestration rate was decreased when temperature upto 323 K. After CO2 sequestrated by Mg(OH)2, the CO2 can be sequestrated stable as MgCO3. This study also presented optimal sequestration condition was the pH upto 8.38, the maximum MgCO3 can be generated. This study can be used as the basic material for CO2 sequestration by ferro-nickel slag at pilot scale in the future.
화석연료의 사용에 기인한 CO2의 배출량은 급격히 증가하고 있다. 특히 제철사업에서는 전 세계 CO2 배출량의 3~5%를 차지하고 있고 한국 제철산업에서 발생되는 CO2는 한국 전체의 12.4%를 차지하고 있다[1]. 기후변화협약에 적극적으로 대응하기 위한 CO2 저감기술은 CO2 포집 및 저장(CO2 capture and storage, CCS)기술이 가장 효율적으로 CO2를 처리할 수 있는 것으로 알려져 있다. 이 기술은 1) 배가스 중 CO2의 분리 및 포집, 2) 포집된 CO2의 수송, 3) 지중저장, 4) 해양저장, 5) 탄산염 광물로의 전환(광물탄산화: mineral carbonation), 6) CO2 전환 등 기술로 구성되어 있다[2]. 특히 광물탄산화기술은 열역학적으로 CO2를 안정시켜 장기적으로 처리가 가능하고 대기로 CO2가 누출되지 않는 기술로서 지속적으로 연구가 진행되어 왔다[3]. 이러한 탄산화 광물기술은 크게 직접탄산화기술, 간접 탄산화기술로 분류할 수 있다. 간접 탄산화기술 중 indirect aqueous carbonation 방법은 다양한 무기산을 사용하여 원료로부터 탄산화 유효성분을 용출하고 NaOH 등 알칼리물질을 사용하여 pH를 높여 CO2와 반응시켜 탄산염광물을 생성하는 방법이며[4], 이 방법은 CO2의 고정화속도를 높일 수 있는 장점을 갖고 있다. 그러나, 현재의 기술 수준이 초기 단계로서 상대적으로 중․소규모의 CO2 처리에 적합하고 처리비용이 높은 단점을 갖고 있다[3]. 1 ton의 CO2를 탄산 화 시키기 위해서 지출되는 비용은 약 50~100 $로서, 지중 저장비용의 약 10배, 해양저장의 3배이기 때문에 경제성을 높이기 위해서는 향후 부가가치를 갖고 있는 부산물을 생산함으로써 처리비용을 절약해야만 한다[2]. 특히, 건축폐기물 및 산업부산물(slag, fly ash, red mud, cement kiln dust와 waste cement)은 풍부한 Ca성분과 Mg 등이 함유되어 있기 때문에 CO2를 고정화시키기 위한 원료로 충분히 활용될 수 있다[5-7]. 철강산업에서 발생되는 제철 슬래그는 전 세계적으로 배출량이 매우 많은 산업 부산물로서 제철 슬래그를 이용하여 약 171 Mt의 CO2를 고정화 할 수 있으며, 전 세계의 CO2 배출량의 약 0.6%를 저장할 수 있는 잠재성을 갖고 있는 것으로 알려져 있다[8]. Doucet et al.[9]은 제철슬래그를 이용한 간접탄산화실험을 통해 CO2를 고정화시키는 연구를 진행하였으며, 다양한 산 추출액(HNO3, H2SO4, NaOH)을 이용하여 상온에서 제철슬래그 중의 칼슘을 효율적으로 추출하고 HNO3를 이용하여 0.26~0.38 kg CO2/kg slag를 고정하였다. 또한 초산을 이용하여 31~86%의 칼슘을 추출하여 99.5~99.8%의 침강성 탄산칼슘(CaCO3)을 제조하는 연구도 진행되었다[10]. 이 연구에서는 탄산칼슘 제조를 통해 CO2의 처리비용을 감소시켰으나, 탄산칼슘 외에 더 경제적인 가치가 있는 생성물을 제조함으로서 경제성을 확보할 수 있는 CO2 탄산화 기술에 대한 지속적인 연구가 필요한 실정이다.
한편, 산화마그네슘(MgO)은 산화칼슘(CaO)에 비해 단위질량당 CO2를 고정화할 수 있는 양이 많고 또한 생성된 탄산화마그네슘은 건축자료 및 단열제 등으로 활용할 수 있는 장점이 있다. 선행 연구에 따라 천연광물인 감람석(Mg2SiO4), 사문석(Mg3Si2O5(OH)4)과 폐석면 등은 마그네슘(Mg)을 함유하고 있어 CO2를 고정화 할 수 있는 원료 물질로 활용되고 있다[3,4]. 하지만 석면의 경우, 사용 규제에 따라 향후 석면제품은 CO2고정화 원료로 공급하기 어려운 단점이 있다. 따라서 CO2를 고정화 할 수 있는 원료 중 공급량이 충분하고 Mg 성분이 함유된 산업부산물을 이용한 CO2의 고정화에 관한 연구가 필요성한 실정이다. 이러한 연구의 일환으로 제련산업 중 페로니켈을 생산하기 위한 원 재료인 니켈광은 철과 니켈을 함유한 리테라이트 광석으로서 Mg의 함량이 높고 철분의 함량이 낮은 것이 특징이다. 폐로니켈 슬래그는 현재 일부 소결용 원료로 재사용하거나 시멘트 원료, 도로용 골재 및 성토용과 같은 토목용으로 사용되기도 하지만 대부분 해안에 매립하여 처리하고 있다[11]. 특히 폐로니켈 슬래그는 산화마그네슘(MgO)(약 33.5%), 이산화규소(SiO2)(약 55.6%), 철(Fe) (약 5.5%) 등의 유용한 자원이 함유되어 있으며, 연간 약 100만 톤을 배출하는 것으로 알려져 있어 CO2를 고정화시키기 위한 폐자원로 활용될 수 있다[12].
따라서 본 연구에서는 기존에 매립 처리하고 있는 페로니켈 슬래그를 활용하여 간접탄산화기술을 통해 CO2의 고정화 연구를 진행하였다. 실험은 페로니켈 슬래그로 부터 Mg의 침출, 수산화마그네슘(Mg(OH)2)의 침전, CO2의 고정화 순서 로 진행하였다. 첫 번째로, 추출실험을 통해 추출액의 농도 및 반응온도 조건에 따라 Mg의 용출효율을 분석하여 최적 조건을 도출 하였으며, 둘째, 침전반응을 통해 침전생성물의 성분을 조사하여 불순물의 제거 여부를 확인하고 Mg(OH)2 제조 시최적의 pH 조건을 제시하고자 하였다. 또한 수산화마그네슘 slurry를 이용한 CO2의 고정화 실험을 통해 온도, CO2 분압 조건이 CO2의 고정화에게 미치는 영향을 평가하였다. 셋째, 동력학적 모델을 이용하여 CO2 고정화양 및 반응속도를 분석하고 CO2 고정화를 향상시킬 수 있는 최적조건을 도출하였으며, X-선 회절분석(X-ray diffraction, XRD) 및 X-선 분광분석(energy dispersive X-ray spectrometer, SEM-EDS)을 통해 생성된 탄산화물의 성분과 종류를 분석하였다.
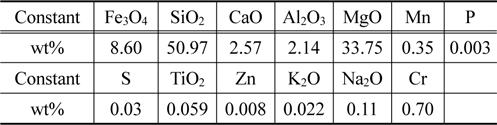
본 연구에서 사용한 페로니켈 슬래그의 화학성분을 Table 1에 나타내었으며, 주성분은 실리카(SiO2), 마그네슘(Mg) 및 철(Fe)성분이었다.
[Table 1.] Comparative chemical compositions of Fe-Ni slag (wt%)
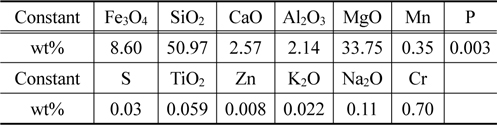
Comparative chemical compositions of Fe-Ni slag (wt%)
용출실험단계에서 선행 연구의 최적조건을 고찰하여 변수 범위를 설정하였다. Kim et al.[13]는 입자크기 200 µm 이하의 페로니켈 슬래그를 HCl로 처리하였을 때 6 M의 조건에서 마그네슘의 침출 효율이 가장 우수한 결과를 내었다. 또한 Maroto et al.[14]은 Mg의 용출을 위하여 아세트산, 염산, 인산, 황산, 수산화나트륨을 사용하였으며, 실험결과 가장 효과적인 추출용액은 황산임을 확인하였다. 이에 본 연구에서는 페로니켈 슬래그의 용출 조건을 다음과 같이 진행하였다. 건조한 페로니켈 슬래그를 볼밀(ball mill)을 이용해 53~106 µm 크기로 분쇄하였으며, 용출온도 범위는 303~353 K로 설정하였다[13]. 또한 각 금속의 용출 효율을 정량적으로 알아보기 위해 유도결합플라즈마 발광분광계(inductively coupled plasmaoptical emission spectrometers, ICP-OES) (Shimadzu Corporation, ICPS-5000 ver.2)를 이용하여 분석하였다.
용출실험단계에서 용출액 중 철 등의 금속이온이 추출되어 수산화마그네슘을 제조하는 단계에서는 불순물이 포함될 수 있다. 이에 본 연구에는 Nduagu et al.[15]의 수산화마그네슘 제조법을 참고하여 실험을 실시하였다. 먼저 용출액에 NaOH를 주입하여 pH를 8~10까지 조절하여 1차 침전물을 생성시킨 후 여과하였다. 여과액에 NaOH를 계속 주입하여 그 용액의 pH를 11~12까지 상승시키고, 2차 침전반응을 진행한 후 침전물을 세척, 건조한 후, SEM-EDS분석을 통해 Mg(OH)2의 생성여부를 확인하였다.
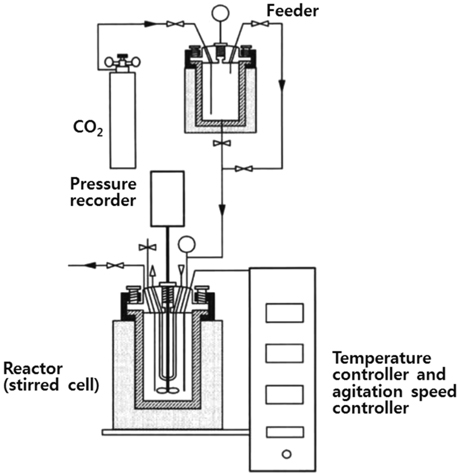
제조된 Mg(OH)2 slurry를 이용하여 CO2를 고정화하는 실험 을 실시하였으며, 그 반응장치를 Figure 1에 나타내었다. 먼저 반응부는 주입가스의 온도를 유지시켜 주기 위한 공급조와 CO2 와 Mg(OH)2 slurry가 반응하는 반응조, 그리고 압력을 확인하 는 압력 반응계로 구성된다. 반응조는 electric band heater를 이용하여 온도를 조절하고, 온도는 K-type 열전대(thermocouple) (오차: ±0.1 K)에 의해 측정하였으며, 직류모터를 통해 교반할 수 있도록 일체형으로 제작하였다. 먼저 electric band heater를 이용하여 반응조를 목표 온도로 조정하고 반응조에 Mg(OH)2 slurry를 주입한 후, 설정된 온도로 가열시켰다. 이후 공급조로 CO2의 온도를 조절하여 반응조로 주입시키고, 가스분압이 평형압력에 도달한 후, 반응조와 연결된 밸브를 닫아 가스 공급조와 반응기의 가스흐름 차단하였다. 마지막으로 반응조 내부 압력 변화를 압력 기록계로 기록하여 데이터를 컴퓨터에 저장하고, 반응 후 일정한 교반속도(500 rpm)를 유지시켰다. 또한 반응시간에 따라 CO2의 이온변화를 모니터링하기 위해 10 min 간격으로 샘플을 채취하여 이온농도를 분석하였다. 액상 CO2와 CO32−이온의 양은 페놀프탈레인 지시약을 사용하여 NaOH로 중화적정 하였으며, HCO3−농도는 메틸레드 지시약으로 염산으로 적정하였다[16].
시간에 따른 CO2의 고정양(sequestered quantity of CO2) 알아보기 위해 다음 식 (1)과 같은 이상기체법칙을 통해 계산 할 수 있다.
여기서, V는 반응부피, T는 반응온도(K), R는 이상기체상수(8.32 L•kPa/K•mol)이며, 위 식 (1)을 통해 CO2의 고정양을 시간에 따른 다음 식
고-액 반응계면에서 동력학적 모델은 1차, 준1차, 2차, 준2차 등의 모델식을 통해 제시하였다[17-19]. 본 연구에서는 선 행 계산을 통해 모델계산 결과 및 실험 결과와 가장 접합한 준2차 모델식을 이용하였다[19]. 준 2차 동력학 모델을 통해 CO2를 고정화하기 위해 반응속도(reaction kinetics)를 분석하였으며, 사용된 준2차 탄산화반응모델은 다음 식 (2)와 같다.
여기서, ks는 CO2의 고정화 반응속도 상수이고,
모델식을 간략화 하여 변수 t1/2는 t1/2 = 1/ks ×
여기서
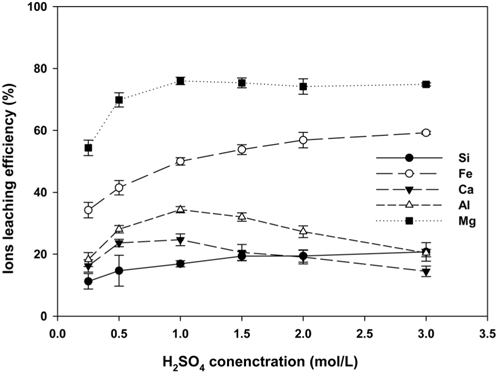
페로니켈 슬래그를 0.25~3.0 M H2SO4용액에서 4시간 동안 용출시킨 후, 용출 용액 내에 존재하는 이온의 종류 및 함량을 ICP로 분석하였다. Figure 2에서와 같이 용출액 농도에 따른 각 이온의 용출효율을 비교한 결과 Mg 이온이 가장 높았으며, 그 다음에 Fe의 용출효율이 높게 나타났다. H2SO4 용액의 농도가 증가함에 따라 Mg 와 Fe 이온의 용출효율은 증가하였으며, 특히 1 M의 조건에서 Mg의 용출율은 75.97%로 최대로 나타나 H2SO4용액은 Mg를 선택적으로 용출하는데 적합한 것으로 판단되며, Si는 함량은 높으나 용출효율은 20%의 낮은 값을 보여주고 있다. 이는 마그네슘 팔면체에 의해 실리카 사면체가 연결되어 있는 화합물의 경우, 산성용액에서 Si-O 결합에 비해 Mg-O결합이 좀 더 쉽게 해제되어[20], Mg의 용출효율이 더 높게 나온 것으로 판단된다. 또한 페로니켈 슬래그는 MgO•SiO2 결정으로 구성되어 있어 산에 의해 용해된 후 비정질(amorphous) 형태로 변화됨을 이전 연구에서 보고하였으며[10], 이를 통해 Mg와 Si가 동시에 용출되는 것은 간접적으로 폐로니켈 슬래그가 H2SO4의 용해로 인해 비정질 형태로 변화 된 것으로 사료된다.
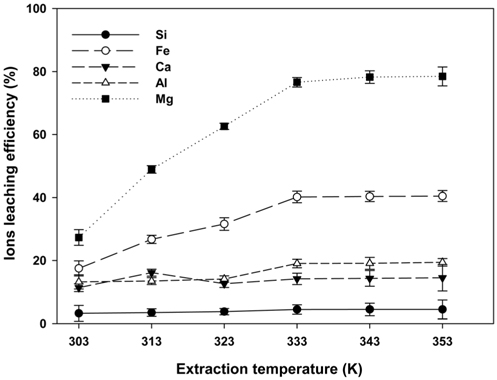
Figure 3은 용출온도에 따른 각 이온의 용출효율에 미치는 영향을 나타낸 것이다. 용출온도가 증가함에 따라 Mg, Fe이온의 용출 효율은 급격히 증가하나, Al, Ca, Si의 용출효율은 일정하게 유지되는 것으로 나타났으며, 이는 페로니켈 슬래그 중 SiO2의 함량이 높아 황산에 의해 용출되지만 SiO2는 겔상태로 존재하기 때문에 여과된 후 남은 용액 중 Si의 잔류량은 낮은 것으로 판단된다[21]. Mg의 용출효율은 303~333 K일때, 27.31~76.60%로 증가되지만 온도 333 K부터 일정하게 유지되었으며, 이러한 결과를 통해 Mg이온의 용출은 산의 농도보다는 온도의 영향을 더 크게 받은 것으로 판단된다. Lacin et al.[22]의 연구에 의하면 Mg 함유된 광물의 용해 속도는 온도증가에 따라 증가되었지만 높은 산 농도를 사용할 경우 고체입자표면에 난용해성고체막(difficult soluble solid film layer) 생성되어 Mg의 용출이 억제될 수 있음을 분석하였으며, Kose et al.[23]은 Mg가 함유된 광물은 반응온도 60 ℃일때 Mg의 용출율이 최대 90%로 나타나, 반응온도는 광물의 용해도와 용출속도를 촉진한다고 보고하였으며, 본 연구에서 도 유사한 경향을 보이고 있다. 이러한 연구결과를 통해 Mg의 용출량을 향상시키기 위해서는 산의 농도를 높이는 방법보다는 온도의 조건을 변화시키는 것이 유리하다는 것을 간접적으로 확인할 수 있다.
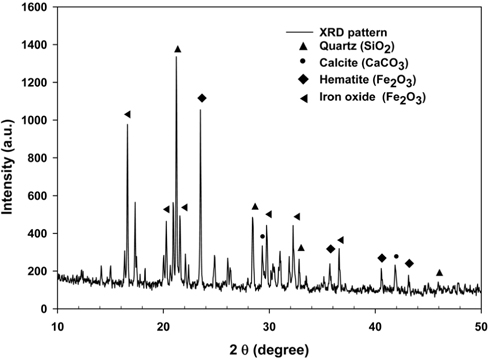
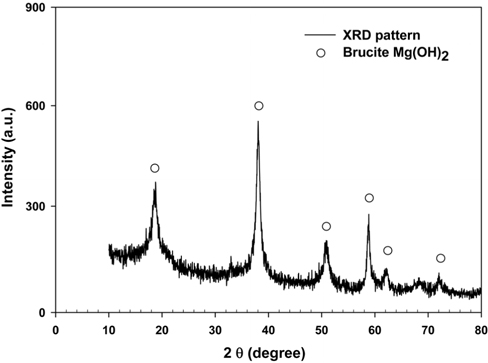
Mg(OH)2 제조단계에서 용출된 Mg2+ 이온을 Mg(OH)2로 전환시키기 위해 OH− 이온이 필요하다. 특히 NaOH는 강 알칼리성 으로 탄산화반응을 촉진시킬 수 있는 촉매의 역할을 갖고 있기 때문에 본 연구에서는 NaOH를 용출액에 주입하여 용액의 pH을 증가시켰다[24]. 앞에서 제시한 용출액의 성분을 분석한 결과, Mg2+이온 및 Fe3+이온을 함유하는 것으로 나타났다. 특히 Fe3+이온의 경우, Mg(OH)2 slurry의 순도에 영향을 줄 수 있기 때문에, 사전에 제거할 필요가 있으며, 또한 용액의 pH 수치가 높을 경우, Fe3+와 Mg2+ 이온이 동시에 침전되기 때문에 선택적으로 Mg(OH)2을 침전시키기 위해서는 적정 pH 범위를 평가해야한다. 이에 본 연구에서는 NaOH를 이용하여 침전반응 시 변화하는 pH의 적정범위를 분석하고자 하였다. 먼저 NaOH를 첨가하여 용액의 pH를 8~10까지 올린 후 생성된 1차 침전물을 여과하고 세척하여 105 ℃에서 건조시켰다. Figure 4는 XRD분석을 통해 1차로 건조된 침전물을 분석한 것으로 quartz (SiO2), calcite (CaCO3), hematite (Fe2O3), iron oxide (Fe2O3) 등의 성분이 존재하는 것으로 나타났다. 1차 침전 반응 중 Fe(OH)2의 빠른 산화반응으로 인해 Fe(OH)3가 생성되어 건조 시 탈수되어 Fe2O3로 전환된다. Figure 5는 2차 침전물을 XRD로 분석한 결과로서 Mg(OH)2만 생성된다는 것이 확인되었다. 이에 pH 8~10의 조건에서 불순물은 1차 침전을 통해 모두 제거될 수 있으며, 이러한 결과는 이전 연구에서 나타난 결과와 유사한 것으로 나타났다[15,25-27].
3.3. Mg(OH)2 slurry를 이용한 CO2의 고정화 반응
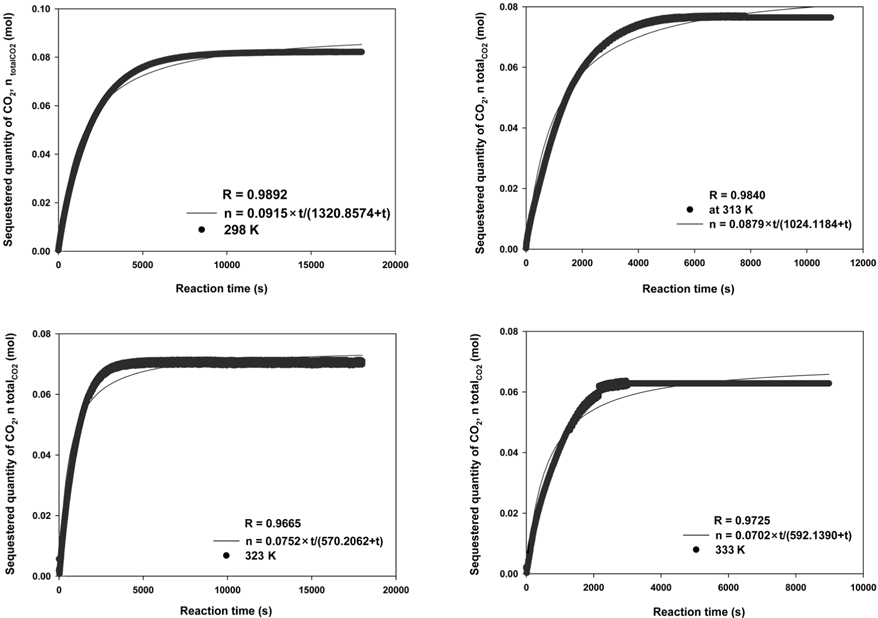
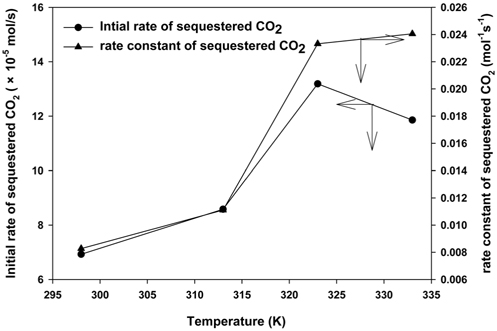
Mg(OH)2 slurry를 이용한 CO2의 고정화 영향을 살펴보기 위해 반응온도에 따른 식 (1)~(5)을 사용하여 시간에 따른 CO2의 고정양을 계산하였다. Figure 6에 나타낸 바와 같이 모델의 regression (R) 값은 0.97~0.99로 높은 수준으로 나타나 Mg(OH)2의 탄산화반응을 잘 모사한 것으로 판단된다. Figure 7에는 모델 계산을 통해 293~333 K 온도 조건에서 CO2의 고정화 속도 및 고정화 반응 상수를 제시하였다. 낮은 온도범위에서 초기 CO2 고정화 속도는 온도가 증가함에 따라 급격히 상승하며, 323 K 조건에서 최대치를 나타내었으나, 이후 감소하는 것으로 나타났다. 선행 연구에서는 Mg(OH)2 결정체는 온도가 증가함에 따라 용액에서 분해되어 OH−이온 및 Mg2+이온화 되는 것으로 나타났다[28]. 이러한 결과로 온도변화에 따라 Mg(OH)2 침전은 용액에서 이온화 되어 MgCO3의 침전반응을 가속화 시키는 것으로 나타났다. 그러나 높은 온도에서 는 CO2가 탄산화반응에게 부정적인 영향을 줄 수 있으며[29], 그 이유로는 CO2 총괄물질전달계수가 22~60 ℃의 조건에서 지속적으로 감소하고 높은 온도에서는 CO2를 고정화시키는 데 부정적인 영향을 주는 것으로 알려져 있기 때문이다[30]. 이러한 연구 결과를 통해 반응속도를 향상시키기 위한 최적의 반응온도는 323 K로 판단되었다.
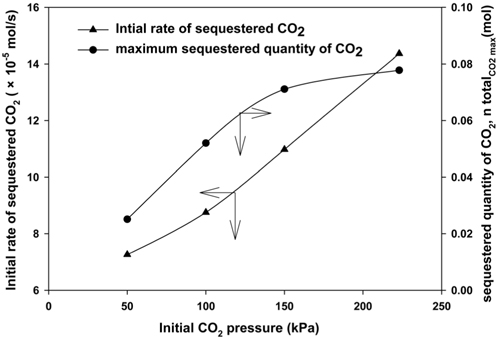
낮은 CO2 압력 조건(50~223 kPa)에서 CO2 고정화에 미치는 영향을 분석하기 위해 CO2 고정화실험을 실시하였으며, Figure 8은 CO2 압력에 따른 CO2의 고정화 속도를 나타낸 것이다. CO2 압력이 증가함에 따라 고정화 속도는 1.26~8.36 × 10−5 mol/s로 급격히 증가하여 높은 압력에서 CO2의 고정화 시간을 감소시킬 수 있다.
Mg(OH)2-CO2-H2O 반응 시스템은 고체상, 액체상, 기체상에서 같이 진행된다. 따라서 CO2 압력의 증가에 의해 액상에 서의 물질전달이 진행되며, CO2의 수화반응을 향상될 수 있다 [31]. 또한, CO2의 최대 고정양은 압력 50~150 kPa에서 0.025~0.071 mol까지 증가되나 150~223 kPa일 때 CO2 최대 고정양이 약 0.006 mol 가량 증가되는 결과가 나타나 이는 반응이 평형에 도달한 것으로 판단된다. 최종적으로 압력증가에 의해 CO2의 용해도가 증가하고 CO2가 이온화됨에 따라 MgCO3 의 생성이 촉진되고 CO2 고정량을 향상시킨 것으로 판단된다. 이러한 결과를 통해 압력증가에 따라 장치의 초기설치비용이 높아질 수 있기 때문에 적당한 압력을 선정할 필요가 있다. 따라서 본 연구에서는 고정화 속도 및 CO2의 최대 고정량을 종합적으로 고려하여 최적의 압력조건으로 150 kPa을 선정하였다.
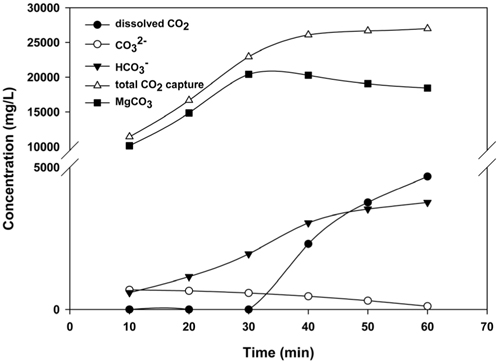
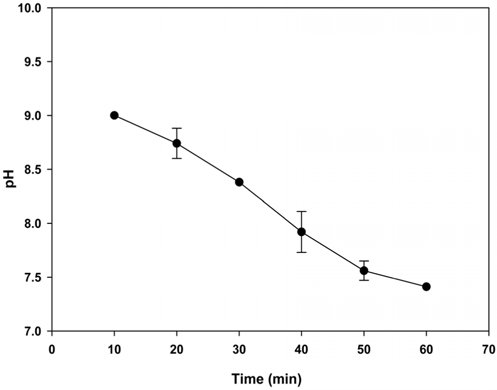
Mg(OH)2를 이용한 CO2의 고정화반응 시 발생되는 이온별 농도변화를 분석하기 위해 10분 간격으로 Mg(OH)2와 CO2를 반응시켜 각 이온의 농도 변화를 Figure 9에 나타내었으며, 이때 pH의 변화를 Figure 10에 나타내었다. 탄산화반응 메카니즘을 살펴보면, CO2 가스가 물속으로 용해되어 액상CO2가 OH− 이온의 농도에 따라 HCO3−, CO32− 이온으로 이온화되며, CO32−이온과 Mg2+의 빠른 반응에 의해 MgCO3로 침전되고 혹은 Mg(OH)2와 액상CO2가 직접반응 하여 MgCO3를 생성한다[32]. Figure 9에 나타낸바와 같이 MgCO3 침전물은 30 min까지 지속적으로 증가하나, 이 후, 약간씩 감소하는 경향이 나타났으며, CO2의 지속적인 주입으로 인해 HCO3−의 농도는 계속 증가하나, pH가 감소됨에 따라 CO32−의 함량은 감소하는 것으로 분석되었다. 반면 액상 CO2는 반응 후, 30 min부터 지속적으로 증가하는 것으로 나타났으며, 이는 30 min부터 CO2는 주로 HCO3− 및 액상 CO2의 형태로 존재하기 때문이다. 또한 CO2 고정화 반응 시 용액의 pH 값은 9.00~7.41까지 감소하였으며, 이를 통해 MgCO3의 최대 생성조건은 30 min이 경과한 이후, pH가 8.38을 보였을 때, 최대로 생성되는 것이 확인되었다. 본 연구에서 제시한 최적의 반응 시간(30 min) 및 pH 조건 (8.38 이상)을 통해 향후 페로니켈 슬래그를 이용한 CO2 고정화 Pilot 설비의 기초설계 및 운영 시, 본 연구 결과를 활용할 수 있을 것으로 판단된다.
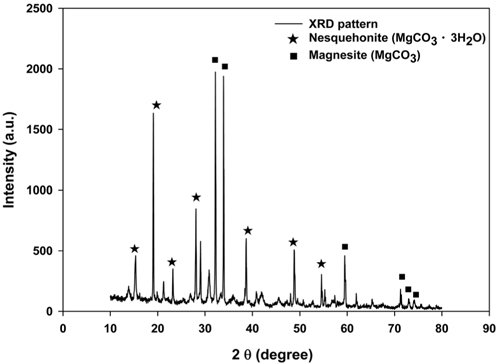
페로니켈 슬래그를 이용한 CO2 고정화 반응에 따른 최종생성물을 XRD 및 SEM-EDS 분석을 통해 성분을 조사하였다. Figure 11은 XRD 분석을 통해 Mg(OH)2의 성분을 분석한 결과로 CO2 고정화를 통해 탄산화 된 생성물은 nesquehonite (MgCO3•3H2O)과 magnesite (MgCO3)로 나타났다. 또한 SEMEDS 분석(Figure 12)을 통해 탄산화생성물의 Mg 함량은 27.91 wt%, C 함량은 13.18 wt%, O 함량은 56.85 wt%, S 함량은 2.07 wt%으로 나타났으며, MgCO3의 순도는 92.25%로 나타났다. 이전 연구에서는 MgO-CO2-H2O반응시스템에서 CO2 분압 및 반응온도에 따라 nesquehonite (MgCO3•3H2O), lansfordite (MgCO3•5H2O), aritnite (MgCO3•Mg(OH)2•3H2O), hydromagnesite ((MgCO3)4•Mg(OH)2•4H2O) 등이 생성될 수 있다고 제시하였다[33]. 또한 Jarosinski and Madejska[34] 연구에서는 Mg(OH)2와 CO2가 반응할 경우, 25 ℃, PCO2 = 1 bar조건에서 MgCO3•3H2O가 생성됨을 확인하였으며, 이러한 선행 연구결과는 본 연구결과와 유사한 것으로 나타났다. 특히 본 실험에서 생성된 MgCO3의 순도를 높이기 위해서는 MgCO3•3H2O은 100 ℃ 이상 가열할 경우, 탈수반응을 통해 MgCO3로 전환될 수 있으며[35], 이러한 MgCO3는 단열제, 연마제 등으로 활용할 수 있을 것으로 판단된다.
본 연구에서는 페로니켈 제련소에서 배출된 산업부산물 중 하나인 페로니켈 슬래그를 사용하여 간접탄산화 방법으로 CO2를 고정화하는 연구를 진행하였다. 먼저 페로니켈 슬래그에 있는 Mg성분을 추출한 후 이를 활용하여 CO2와 탄산화반응을 통해 CO2를 고정화하는 실험을 진행하였다. CO2를 고정화하기 위해 H2SO4을 이용하여 페로니켈 슬래그를 활성화시켰으며, 실험결과, Mg를 용출하기 위한 최적조건은 1 M의 H2SO4를 333 K 조건에서 용출할 때, 최적의 용출효율(76%)이 나타났으며, MgO 제조 시 1차 침전반응에서 불순물이 제거된 것을 XRD 분석을 통해 확인하였다. 또한 CO2 고정화 실험결과, 반응온도 및 초기 CO2 분압 조건에 따라 초기 CO2의 고정화 속도를 향상시킬 수 있는 반면 323 K 이상 높은 온도에서는 고정화속도가 감소되는 것으로 나타났다. CO2 고정화 반응과정 시 이온성분을 분석한 결과, CO2를 안정적으로 고정화 시킬 수 있고 MgCO3의 생성양을 최대로 높일 수 있는 pH 조건은 8.38로 나타났다. 종합적으로 본 연구결과를 활용하여 향후 페로니켈 슬래그를 이용하여 CO2를 고정화하기 위한 기초자료로 활용할 수 있을 것으로 판단되며, 최종적으로 CO2 고정화 반응을 통해 생성된 MgCO3는 단열제 및 연마제 등의 화합물로서 활용이 가능할 것으로 판단된다.