Ethanol steam reforming reaction considered as a clean hydrogen production method is introduced in this paper. Reactivity and reaction rate equation of ethanol steam reforming reaction using various catalysts, reaction temperature, and molar ratio of ethanol and water will be discussed. In addition to introducing a membrane reactor combining a reactor and a separator, the effect of the use of a membrane reactor on an ethanol conversion and hydrogen yield will be compared to those from a conventional packed-bed reactor.
본 총설에서는 최근 청정수소생산방법으로 큰 관심을 받고 있는 에탄올 수증기개질반응(ethanol steam reforming reaction)에 대해 소개하고자 한다. 다양한 촉매, 반응온도, 에탄올과 물의 몰비에 따른 에탄올 수증기개질반응의 반응특성 및 반응속도식(reaction rate equation)을 검토해 보고자 한다. 또한, 반응기와 분리기를 동시에 장착한 새로운 개념의 막반응기(membrane reactor)를 소개하며, 막반응기의 사용이 일반적인 충전층반응기(packed-bed reactor)에 비해 에탄올 전환율과 수소 수율에 어떠한 영향을 주는지에 대하여 고찰해 보고자 한다.
최근 지구온난화 및 환경오염에 대한 문제의식이 커지면서 석탄 및 석유와 같은 화석연료가 아닌 청정에너지로서의 수소에 대한 관심이 커지고 있으며, 석유화학, 화학소재, 연료전 지 등의 다양한 산업분야에서 요구되는 수소의 수요 또한 매우 급격하게 증가하고 있는 실정이다[1]. 하지만, 현재 수소생산을 위해 상업적으로 광범위하게 사용되고 있는 천연가스개질반응과 석탄가스화공정들은 궁극적으로 환경문제를 야기 하고 있기 때문에, 기존의 수소생산공정들과는 다른 새로운 청정수소생산공정에 대한 시대적인 요구가 커지고 있다. 이러한 시점에서 에탄올 수증기개질반응은 기존의 수소생산방법의 문제점을 보완하고, 좀 더 환경 친화적인 청정수소생산공정으로서 매우 큰 관심을 받고 있다. 에탄올 수증기개질반응은 아래의 반응식 (1)처럼 에탄올과 수증기가 반응하여 수소와 이산화탄소를 생산하는 반응이다.
이 반응에서 생산된 이산화탄소는 에탄올의 원료인 바이오 매스로 재 흡수될 수 있기 때문에 에탄올 수증기개질반응은 이산화탄소중성공정(CO2 neutral process)으로 불리기도 한다[2]. 에탄올 수증기개질반응은 위의 주반응외에 탈수소화반응 (2), 탈분리반응(3), 탈수반응(4)과 같은 부반응들을 수반하기도 한다.
지금까지 많은 연구자들에 의해 다양한 방법으로 제조된 여러 촉매들이 에탄올 수증기개질반응을 위해 사용되었지만, 촉매의 반응성, 안정성 및 가격 등 여러 제약들로 말미암아 아직까지는 에탄올 수증기개질반응을 위한 상업용촉매가 개발되지 못한 실정이다. 이러한 시점에서 지금까지 발표된 에탄올 수증기개질반응에 대하여 포괄적으로 논의해 보는 것은 의미가 있다고 판단된다. 본 총설에서는 우선 대표적인 촉매들이 다양한 반응조건에서 보여준 반응특성에 대해 고찰한 후, 기존에 발표되었던 에탄올 수증기개질반응에 대한 반응속도식을 검토해 보고자 한다. 또한, 향상된 에탄올 전환율과 수소수율을 목표로 새롭게 시도된 막반응기(membrane reactor) 에서의 에탄올 수증기개질반응의 반응특성을 기존의 충전층 반응기(packed-bed reactor)와 비교하여 그 실효성에 대해 검토하고자 한다.
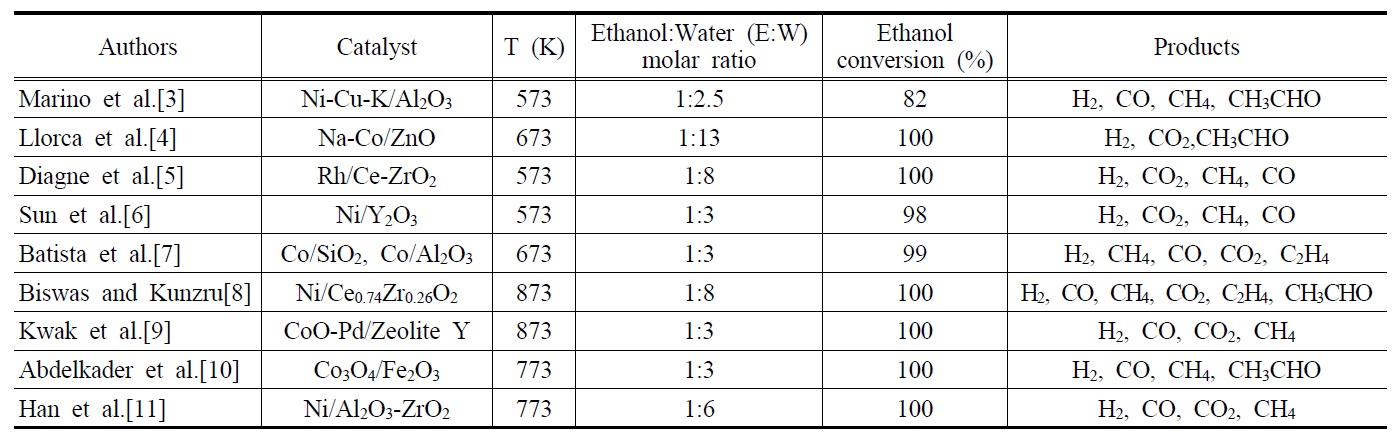
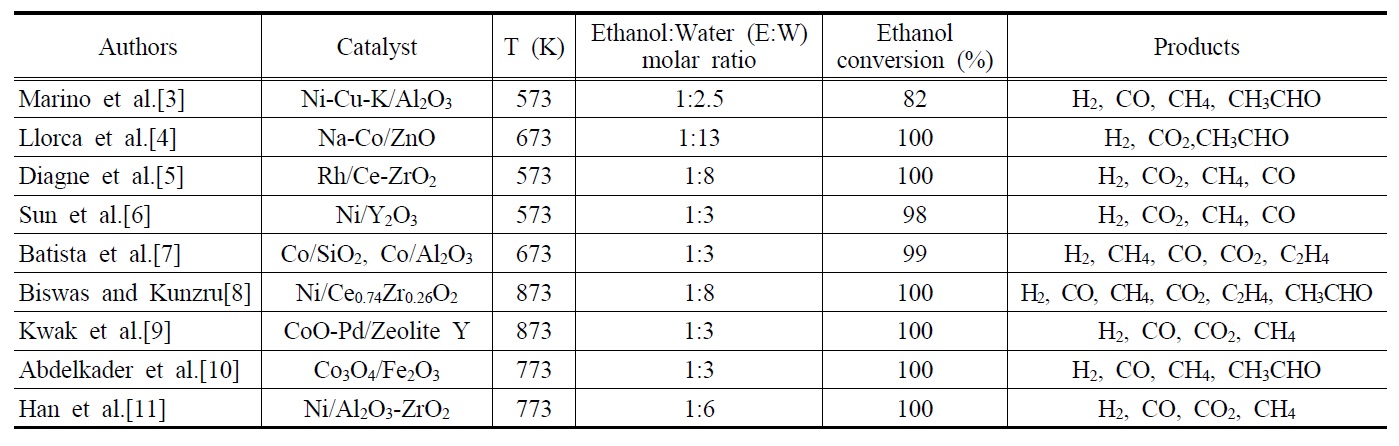
에탄올 수증기개질반응에 사용된 대표적인 촉매로는 Ni, Co, Rh 계열의 촉매가 있다. Table 1은 지금까지 발표된 대표적인 에탄올 수증기개질반응에 대한 연구결과에서 얻어진 촉매, 반응온도, 에탄올과 물의 몰비, 에탄올전환율 및 주요생성물들을 나타내고 있다. Marino et al.[3] 은 공함침법(co-impregnation method)을 통해 제조된 Ni-Cu-K/Al2O3촉매를 이용하여 573 K에서 에탄올 수증기개질반응의 반응특성을 연구하였고, 1,500 h-1의 기체공간속도와 에탄올 : 물 = 1 : 2.5의 조건하에서 82%의 에탄올 전환율(ethanol conversion)이 얻어졌으며, 주요 생성물로는 H2,CO, CH4, CH3CHO가 확인되었다. 또한, Ni성분이 에탄올의 가스화반응을 증가시켜 가스수율을 높임으로서 부생성물인
[Table 1.] Representative reaction characteristics of ethanol steam reforming
Representative reaction characteristics of ethanol steam reforming
아세트알데이드(acetaldehyde)와 초산의 생산량을 감소시켰다고 보고하였고, 5 h의 반응시간 동안 촉매의 안정성을 확인 하였다. Llorca et al.[4]은 공침법(co-precipitation method)을 통해 제조된 Na-Co/ZnO 촉매를 이용하여 673 K에서 반응을 진행한 결과, 5,000 h-1의 기체공간속도와 에탄올: 물=1: 13의 조건하 에서 100%의 에탄올 전환율과 주요 생성물로 H2, CO2, CH3CHO 가 관찰되었다. 또한, 이때 사용된 촉매는 Na성분의 도움으로 240 h 동안 불활성화 없이 촉매의 초기성질이 유지됨을 확인함 으로써 상업용 촉매 개발에 초석을 다진 중요한 실험결과라 할 수 있다. Diagne et al.[5]은 공침법으로 제조된 Rh/Ce-ZrO2촉매를 사용하여 573 K에서 반응을 진행한 결과, 15400 h-1의 기체공간속도와 에탄올 : 물= 1 : 8의 조건하에서 반응을 진행시켜 100%의 에탄올 전환율을 확인하였으며, 화학양론비에 근거 한 이론적인 H2수율(생성된 H2/주입된 에탄올 = 6)의 값인 6 에 근접한 5.0~5.7의 수율을 관찰하였다. 또한, 이 반응의 주요 생성물로는 H2, CO2, CH4, CO 등이 보고되었다. Sun et al.[6]은 공침법으로 제조된 Ni/Y2O3촉매를 이용하여 1400 h-1의 기체공간속도와 573 K에서 반응을 진행시킨 결과, 에탄올 : 물= 1 : 3의 조건에서 98%의 에탄올 전환율과 주요 생성물로 H2, CO2, CH4, CO가 검출되었다. 또한, 촉매의 안정성을 실험하기 위해 823 K에서 66 h 동안 반응을 진행시킨 결과 100%의 에탄올 전환율이 유지되었으며, H2 수율은 초기 시간에는 증가하다가 최고점(61.4%)을 도달한 뒤 점점 감소함을 보였다. Batista et al.[7]은 초기습식함침법(incipient wetness impregnation) 방식으로 제조된 Co/SiO2 및 Co/Al2O3 촉매를 이용하여 673 K에서 17400 h-1의 기체공간속도로 반응을 수행한 결과 에탄올 : 물 = 1 : 3의 조건에서 99%의 에탄올 전환율이 관찰되었으며, 주요 생성물로는 H2, CH4, CO, CO2, C2H4 등이 검출되었다고 보고하였다. 또한, 생성된 가스혼합물중 H2의 분율 60% 이상을 가졌으며, 특히, 산성지지체(acidic support)인 Al2O3과 8 wt%의 코발트를 함유한 Co(8)/Al2O3 촉매는 코킹의 원인이 되는 C2H4를 생성하였지만, Co/SiO2 촉매 및 18 wt%의 코발트를 함유한 Co(18)/Al2O3촉매는 C2H4를 거의 생성하지 않았다.
Biswas and Kunzru[8]은 공침법으로 제조된 다양한 조성을 지닌 Ni/CexZr
지금까지 살펴본바와 같이 에탄올 수증기개질반응에 사용 되었던 다양한 촉매들은 여러 반응조건에서 높은 에탄올 전환율을 보여주고 있지만, 이 촉매들에 대한 안정성에 대한 연구결과는 매우 미흡한 실정이다. 메탄수증기개질반응에 대한 연구에 비해 그 역사가 매우 짧은 점을 비추어 보면 당연한 결과이긴 하지만, 에탄올 수증기개질반응이 상업적인 수소생산공정이 되기 위해선 반드시 오랜 시간동안 활성을 유지할 수 있는 촉매의 개발이 선행되어야 할 것이다. 다른 한편으로, 메탄수증기개질반응이 보통 973 K 이상의 온도에서 반응이 진행되는 것과는 대조적으로, 에탄올 수증기개질반응은 상대적으로 낮은 온도에서 진행될 수 있기 때문에 앞으로 발전 가능성이 매우 크다고 볼 수 있다.
반응속도식은 주어진 반응을 수행하기 위해 필요한 반응기
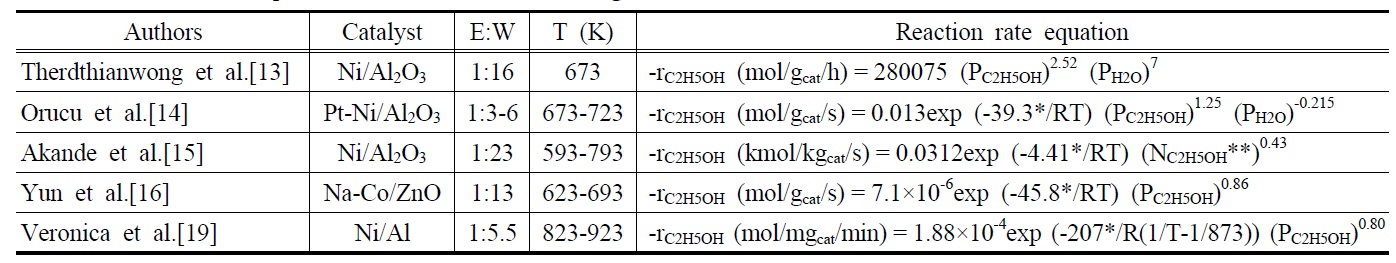
[Table 2.] Reaction rate equations of ethanol steam reforming
Reaction rate equations of ethanol steam reforming
의 크기를 설계함에 있어 필요한 매우 중요한 요소이다. 현재 상업적인 수소생산방법으로 널리 상용되고 있는 메탄수증기 개질반응에 대해선 Xu and Froment [12]가 제안한 반응속도식이 광범위하게 사용되고 있지만, 현 시점에서는 에탄올 수증기개질반응에 대한 대표적인 반응속도식이 없는 실정이다. 이러한 시점에서, 현재까지 발표된 에탄올 수증기개질반응에 대한 대표적인 반응속도식들을 살펴보고 여러 특징적인 점들에 대해 논의해 보고자 한다.
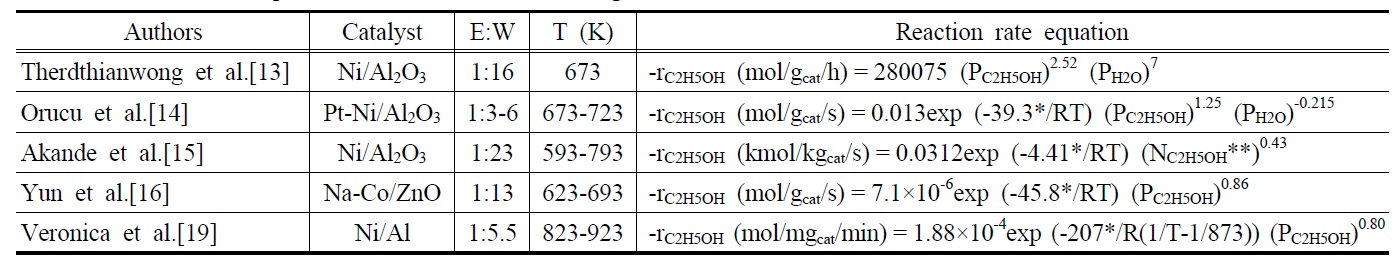
Table 2는 에탄올 수증기개질반응에 사용된 촉매의 종류, 에탄올과 물의 몰비, 반응온도 및 실험을 통해서 얻어진 반응속도식을 나타내고 있다. Therdthianwong et al.[13]은 상업용 Ni/Al2O3촉매를 이용하여 673 K의 조건에서 실험한 결과를 토대로 반응속도식을 구한 결과 에탄올은 2.52의 반응차수를 물은 7의 반응차수를 갖는다고 보고하였다. 또한, Orucu et al.[14] 은 Pt-Ni/Al2O3촉매를 이용하여 673-723 K의 반응온도 조건하에서 실험한 결과 39.3 kJ/mol의 활성화 에너지가 관찰되었으며, 에탄올은 1.25의 반응차수를 물은 -0.215의 반응차수를 갖는다고 보고하였다. 에탄올과 물의 반응차수를 동시에 구하였던 위의 두 가지 경우와는 반대로, Akande et al.[15]은 일반적 으로 얻어지는 에탄올 수용액이 대략 12vol%의 에탄올을 함유 하고 있는 점에 착안하여, 반응물로 이미 충분한 물이 공급되기 때문에 물을 제외한 에탄올만의 반응차수를 구하는 방법을 시도하였다. Ni/Al2O3촉매를 이용하여 593-793 K의 반응조건 하에서 실험을 수행한 결과 4.41 kJ/mol의 활성화 에너지 값과 에탄올에 대한 0.43의 반응차수를 얻었다고 보고하였다. 같은 방식으로, Yun et al.[16]은 1:13이라는 에탄올과 물의 몰비의 조건하에서 충분한 물이 공급된다는 가정 하에 623-693 K 조건에서 반응속도식을 구한 결과 45.8 kJ/mol의 활성화 에너지 값과 에탄올에 대한 0.86의 반응차수를 얻게 되었다. 그 외에, Sun et al.[17]과 Vaidya and Rodrigues[18]는 에탄올에 대한 1의 반응차수를 갖게 된다고 보고했으며, Veronica et al.[19] 에탄올에 대한 반응차수가 0.75~0.8의 값을 갖는다고 보고 하였다.
최근 바이오매스로부터 직접 구해지는 바이오에탄올 생산 방식의 비약적인 발전을 고려하면, 추가적인 증류공정을 거치지 않고 바이오에탄올을 직접 개질반응에 도입할 경우 많은 장점을 갖게 될 것이다. 특히, 바이오에탄올이 이미 충분 한 양의 물을 함유하고 있다는 사실을 고려하면, 앞서 언급한 반응속도식들은 매우 유용한 실험값들이라고 할 수 있다.
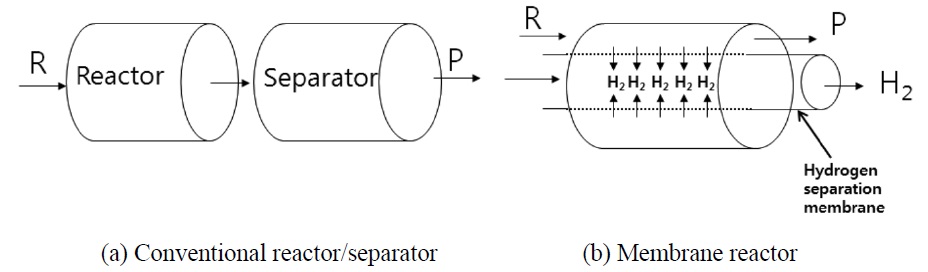
Figure 1(a)는 전통적인 화학공장에서 볼 수 있는 공정으로서 반응기와 분리기가 독립적인 단위공정을 구성하고 있는데 반하여, Figure 1(b)는 반응기와 분리기가 하나의 단위공정으 로 구성된 새로운 개념의 막반응기를 보여주고 있다. 막반응기는 반응기와 분리기를 함께 장착함으로써 화학공정의 비용을 절감함과 동시에 생성물 중에서 특정한 한 성분을 반응과 동시에 선택적으로 분리시킴으로써 평형이동(shift of equili brium)에 의해 그 특정성분의 생산량을 증가시킬 수 있으며 순수하게 특정성분만을 분리할 수 있는 매우 효율적이며 새로운 화학공정이라 할 수 있다[20]. 특히, 개질반응에서는 수소만을 선택적으로 분리할 수 있는 수소분리막(hydrogen separation membrane)을 이용하여 반응과 동시에 수소를 연속적으로 분리해 줌으로써 향상된 수소수율을 기대할 수 있게 된다. 개질 반응은 일반적으로 고온고압의 조건하에서 실행되기 때문에 사용가능한 막의 제한성으로 인해 막반응기의 활용도가 매우 낮았다. 하지만, 최근 막반응기에 쓰일 막을 제조하는 기술의 발전으로 말미암아 고온고압에서 주로 이루어지는 개질반응에 대해서도 막반응기를 적용하는 수많은 연구가 가능하게 되었다. 개질반응들은 보통 이산화탄소 혹은 물과 결합하여 메탄건조개질반응(methane dry reforming reaction, 5), 메탄수증기개질반응(methane steam reforming reaction, 6), 메탄올수증기개질반응(methanol steam reforming reaction, 7) 및 에탄올 수증기개질반응(ethanol steam reforming reaction, 8) 공정을 거쳐 수소를 생산하는데, 이때 수소만을 선택적으로 분리할 수 있는 막을 반응기에 장착하여 반응과 동시에 시에 수소를 연속적으로 분리함으로써 보다 향상된 수소의 수율을 기대하는 것이 막반응기의 기본개념이다.
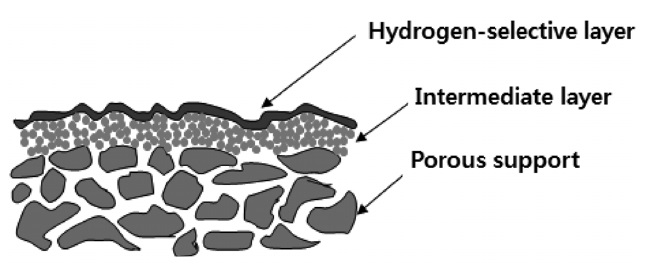
공정비용의 절감 및 수소수율의 향상을 기대할 수 있는 막 반응기의 핵심은 수소만을 선택적으로 분리할 수 있는 수소 분리막을 제조하는 기술이다. 개질반응은 일반적으로 고온고압의 조건에서 수행되기 때문에 막반응기에 쓰일 수소분리막 도 이러한 조건을 견딜 수 있는 세라믹 혹은 금속계열의 막의 개발이 중요시 되고 있다. 특히, 상업화할 수 있는 수소분리막을 제조하기 위해선 막의 안정성, 수소투과량(hydrogen permeation rate) 및 수소선택도(hydrogen selectivity)가 어느 정도 보장되어야 한다. 수소분리막을 제조하는 방법은 매우 다양하지만, Figure 2에서 보이는 것처럼 지지체에 표면개질을 통하여 수소분리용 막을 만드는 방법이 일반적이다.
지지체로는 보통 수 nm에서 500 μm의 평균기공크기를 가지는 알루미나 혹은 스테인레스강을 사용한다. 기체 분자들이 이러한 평균기공크기를 가진 지지체를 통과할 경우에는 보통 Knudsen 확산 메카니즘을 따르며, 이 경우 기체 분자들의 투과량은 다른 조건들이 일정할 경우 기체 분자들의 분자량의 제곱근에 반비례하게 된다. 투과량에 근거하여 예측할 수 있는 수소선택도는 H2/CH4 = 2.8, H2/N2 = 3.7, H2/ CO2 = 4.7의 값을 가지게 되며, 이러한 수소선택도로는 수소만을 선택적으로 분리할 수 있는 고성능의 수소분리막을 기대할 수 없게 된다. 따라서 중간체층을 이용하여 평균기공크기를 줄인 후, 마지막으로 수소선택층을 화학증착(chemical vapor deposition), 무전해도금(electroless plating), 솔-겔법 등을 이용하여 수소만을 선택적으로 분리할 수 있는 수 μm 두께의 수소분리막을 만들게 된다.
일반적으로 개질반응은 고온 고압의 반응조건에서 수행되기 때문에 고분자 수소분리막보다는 세라믹 혹은 금속계열의 수소분리막을 쓰게 된다. 개질반응용 수소분리막으로는 크게 세라믹 계열의 실리카 수소분리막과 금속 계열의 Pd 수소분리막을 예로 들 수 있다. 실리카 수소분리막은 다양한 방법으로 제조되는데, 대표적인 제조 방법으로는 솔-겔 법[21-24]과 화학증착법[25-28]을 들 수 있다. 실리카 수소분리막은 실리카 전구체(precursor)를 이용하며 제조비용이 매우 저렴하다는 장점이 있으나 물과 결합하면 수소분리막 자체가 밀도화되어 수소투 과량이 급격하게 감소되는 단점을 가지고 있다. 최근에는 순수한 실리카 수소분리막이 가진 여러 단점들을 극복하기 위한 실리카 복합막에 대한 연구도 활발히 진행되고 있으며, 이러한 노력으로 말미암아 물에 대한 저항성을 향상시키고 보다 높은 수소투과량과 수소선택도를 유지할 수 있는 실리카 복합막을 소개하는 다양한 연구논문들이 발표되고 있다[29-32].
수소에 대한 높은 선택도를 보여주는 Pd 수소분리막을 제조 하는 방법으로는 화학증착법[33-36]과 무전해도금법[37-39]을 들 수 있으며, 특히 무전해도금법은 고가의 장비가 필요 없는 간단하면서도 저렴한 공정으로서 고가의 Pd 재료비를 상쇄할 수 있는 공정으로서 큰 관심을 받고 있다. Pd 수소분리막의 장점으로는 높은 수소투과량과 수소선택도를 들 수 있다. 하지만, 가격이 비싼 점과 황(sulfur)에 의한 피독현상(poisoning) 이 큰 문제점으로 지적되고 있다. 최근에는, 황에 대한 저항력을 높이고 제조비용을 줄이면서 향상된 수소투과량을 얻기 위한 방법으로 Pd-Ag[40-42], Pd-Cu[43-47], Pd-Au[48-51], Pd-Ru[52,53]과 같은 합금막에 대한 연구가 매우 활발히 진행되고 있다.
개질반응용 수소분리막을 제조함에 있어서 높은 수소투과량을 얻기 위해선 두께가 매우 얇은 수소선택층을 제조하는 것이 유리하지만, 두께가 너무 얇게 되면 결점이 생길 수 있는 확률이 높아지므로 오히려 수소선택도가 낮아질 수 있다. 이처럼 일반적으로 수소투과량과 수소선택도는 반비례의 관계를 가지게 되므로, 관심을 가지고 있는 막반응기에 가장
[Table 3.] Membrane reactor studies for methane, methanol, and ethanol reforming reactions
Membrane reactor studies for methane, methanol, and ethanol reforming reactions
적합한 최적화된 수소투과량과 수소선택도를 가진 수소분리막을 개발하는 것이 매우 중요한 과제라 할 수 있다.
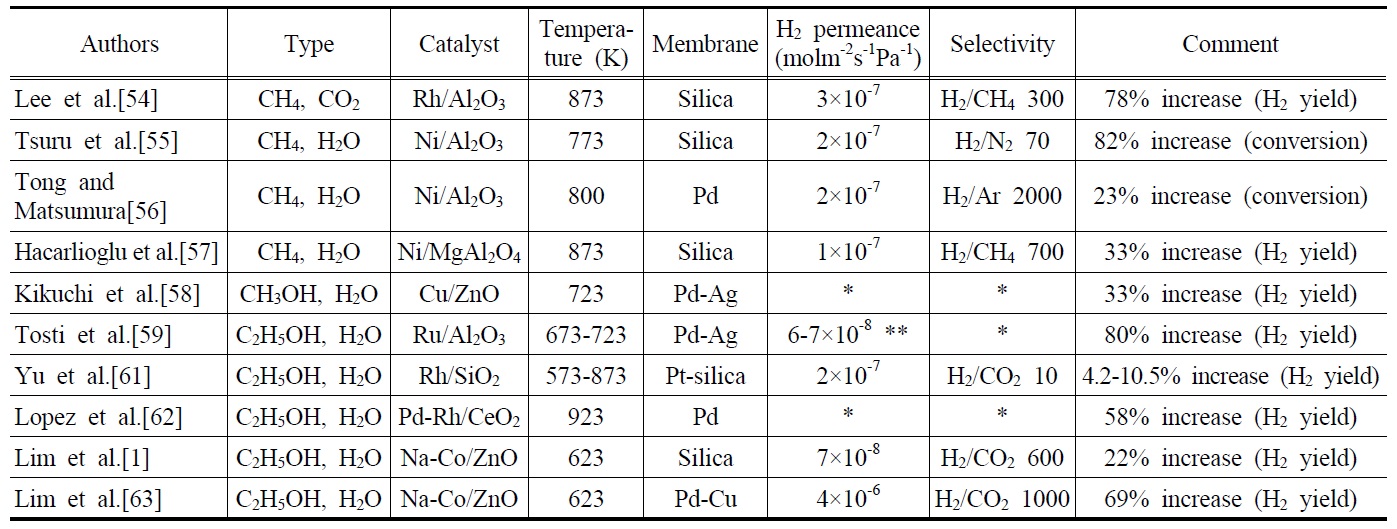
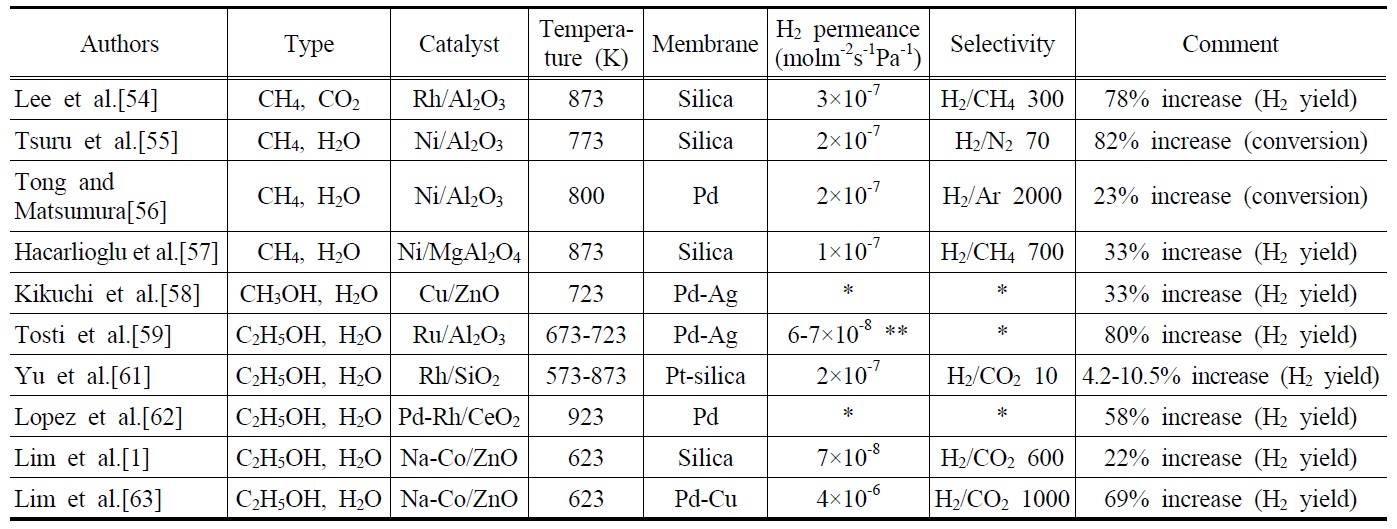
현재 산업계에서 사용되는 대부분의 수소는 Ni계열의 촉매를 이용한 메탄수증기개질반응에 의해 생산된다. 최근에는 개질반응에 수소분리막을 장착하여 평형이동으로 인한 수소수율의 향상을 구현할 수 있는 막반응기의 사용에 대한 관심 이 크게 높아졌다. 또한, 많은 연구자들이 막반응기에서 메탄 수증기개질반응을 수행하여 향상된 메탄 전환율과 수소수율 을 얻게 되었다고 보고하였다. Table 3은 메탄, 메탄올 및 에탄올 개질반응을 막반응기에서 수행한 대표적인 연구결과를 보여주고 있다. Lee et al. [54] 은 메탄건조개질반응을 Rh/Al2O3촉매와 실리카막이 장착된 막반응기에서 수행한 결과 873 K에서 일반충전층반응기에 비해 약 78%의 수소수율의 증가를 보고하였다. 하지만, 고압에서는 오히려 막반응기에서 수소수율이 감소함을 보여주었고, 메탄건조개질반응이 상업적인 수소생산방식으로는 적합하지 않다고 주장하였다. Tsuru et al. [55]은 메탄수증기개질반응을 Ni/Al2O3 촉매를 이용하여 실리카막을 장착한 막반응기에서 실행한 결과 82%의 메탄 전환율의 증가를 얻었으며, Tong and Matsumura [56]는 Ni/Al2O3촉매를 이용하여 메탄수증기개질반응을 금속계열의 Pd막을 장착한 막반응기를 실험한 결과 23%의 메탄 전환율의 증가를 관찰하였다. Hacarlioglu et al. [57]은 상업용 촉매인 Ni/MgAl2O4 촉매를 사용하여 실리카막이 장착된 막반응기에서 메탄수증기개질반응을 수행한 결과 33%의 수소수율의 향상을 관찰하였으며, 반응기 압력의 증가가 막을 통과하는 수소투과량의 상승과 더불어 수소수율의 향상을 가져왔다고 주장하였다. Kikuchi et al. [58]은 Cu/ZnO촉매와 Pd-Ag막을 장착한 막반응기를 이용하여 메탄올수증기개질반응을 수행한 결과 33%의 수소수율의 향상을 보고하였다. 이와 같은 막반응기의 장점들을 바탕으로 최근에는 바이오매스로부터 얻어질 수 있는 에탄올을 이용하여 개질반응을 진행시킴과 동시에 수소를 선택적으로 분리하여 증가된 수소수율을 얻으려는 노력이 광범위 하게 진행되고 있다. 앞서 기술한바와 같이 에탄올 수증기개질반응은 재생 가능한 바이오매스로부터 얻어질 수 있다는 장점뿐만 아니라, 반응을 통해 생성된 이산화탄소는 바이오매스에 의해 재흡수 될 수 있기 때문에 매우 환경 친화적인 청정수소 생산방법이라고 할 수 있다. 또한, 생성물에서 고압의 이산화탄소를 수소생성과 동시에 포집할 수 있기 때문에 물리적인 이산화탄소 포집방법 으로도 고려되고 있다.
Tosti et al. [59,60]은 Ru/Al2O3, Pt/Al2O3, Ni/SiO2 촉매와 Pd-Ag 막을 장착한 막 반응기를 이용하여 에탄올 수증기개질반응을 수행한 결과 특히 Ru/Al2O3 촉매를 사용한 막반응기에서 80% 이상의 수소수율이 관찰되었다고 보고하였다. Yu et al. [61]은 Rh/SiO2 촉매와 platinum이 함침된 실리카계열의 막을 사용하여 7.4-14.4%의 에탄올 전환율의 증가와 4.2-10.5%의 수소수율의 증가를 보고하였고, 반응과정시 수소투과로 인한 수성가스전이반응의 도움으로 상당히 감소된 CO의 농도를 관찰할 수 있었다. Lopez et al.[62]은 Pd-Rh/CeO2촉매와 Pd막을 사용한 막반응 기를 실험한 결과 58%의 수소수율의 향상을 보고하였고, 수소의 생산과 분리를 동시에 수행하는 막반응기가 상업적으로 가능성이 있음을 보여주었다. Lim et al.[1,63]은 Na-Co/ZnO 촉매와 실리카 혹은 Pd-Cu막을 장착한 막반응기에 대해 연구한 결과 수소투과량이 높은 금속막인 Pd-Cu막을 장착한 막반응기에서 보다 높은 수소수율의 향상이 관찰되었다고 보고하였다. 또한, Oyama and Lim[64]은 다양한 개질반응에 대한 수치 시뮬레이션을 수행한 결과 수소선택도가 에탄올 전환율과 수소수율에 상당한 영향을 미치고 있음을 보였으며, 막반응기가 높은 성능을 보여주기 위해선 수소선택도가 적어도 100 이상의 값을 가져야 한다고 주장하였다. 더 나아가 Lim et al.[63]은 막반응기가 상업적으로 실현 가능하기 위한 척도로서 수소투과량에 대해 연구한 결과, 직경 1 cm의 막을 장착한 막반응기는 적어도 2.5 × 10-7 mol m-2 s-1Pa-1의 수소투과량을 가져야 한다고 보고하였다.
최근 청정수소생산방법으로서 많은 관심을 받고 있는 에탄올 수증기개질반응에 대해 소개하였다. 에탄올 수증기개질반응에 사용된 대표적인 촉매로는 Ni, Co, Rh 계열의 촉매를 들 수 있으며, 여러 연구결과에서 높은 에탄올 전환율과 수소수율을 확인할 수 있었다. 하지만, 촉매의 상용화를 위해 반드시 검증되어야 할 촉매의 안정성에 대한 연구는 매우 미흡한 실정이다. 따라서 앞으로는 촉매의 안정성을 높일 수 있는 방법에 대한 연구가 수반되어야 할 것이다.
에탄올과 물이 반응속도에 미치는 영향에 대한 다양한 연구결과가 보고되었으며, 특히 재생 가능한 에너지원인 바이오매스로부터 얻어질 수 있는 바이오에탄올은 다량의 물을 함유하고 있기 때문에 이 바이오에탄올을 직접 개질반응에 사용할 경우 에탄올에만 의존하는 반응속도식을 제안한 경우도 확인되었다.
반응기와 분리기를 하나로 묶은 막반응기는 화학공정상의 비용절감 및 향상된 수소수율을 기대할 수 있는 새로운 개념의 화학공정이며, 기존의 메탄, 메탄올 개질반응에서 확인된 것과 마찬가지로, 에탄올 수증기개질반응을 막반응기에서 수행한 결과 증가된 에탄올 전환율 및 수소수율이 확인되었다. 또한, 개질반응용 막반응기에 적합한 대표적인 수소분리막인 실리카 계열 및 Pd 계열의 수소분리막의 제조방법중 대표적인 솔-겔 법, 화학증착법, 무전해도금법에 대해 살펴보았으며, 현재 순수한 실리카 혹은 Pd 수소분리막의 한계를 극복하기 위한 복합 혹은 합금 수소분리막에 대한 연구가 한창 진행되고 있다. 마지막으로, 기존의 대부분의 연구결과들은 단일막을 장착한 막반응기에 대한 연구가 주류였기 때문에, 이 기술의 상업화를 위해선 보다 증가된 수소수율을 기대할 수 있는 다관막(multi-tube membrane)을 장착한 막반응기에 대한 연구가 더 진행되어야 할 것이다.